Что заливать в щелочной аккумулятор
Что заливать в щелочной аккумулятор
Щелочные аккумуляторы широко распространены и довольно востребованы в настоящее время. Их применяют в различных производственных сферах: на железной дороге, в горнодобывающей отрасли, а также в бытовых целях. Такие АКБ зарекомендовали себя, как надежные и долговечные устройства. При правильной эксплуатации срок их службы составляет от пяти до десяти лет. Для этого следует своевременно проводить техобслуживание аккумуляторов: предупреждать возможность возникновения короткого замыкания внутри банок, вовремя замерять плотность электролита и доливать его при необходимости. И здесь возникает вопрос: что заливать в щелочной аккумулятор? В данной статье рассмотрим, каким электролитом заправляют такие устройства, какие его виды существуют, а также как правильно самостоятельно приготовить раствор для щелочных аккумуляторов.
Виды раствора для щелочных АКБ
 Для таких батарей применяют электролиты, имеющие натриевый или калиевый состав. По сути, электролит для щелочных батарей представляет собой водный раствор гидроксида калия или гидроксида натрия. Зачастую к раствору добавляют еще и однопроцентный гидроксид лития, что в значительной степени повышает емкость аккумуляторов и увеличивает их срок службы.
Для таких батарей применяют электролиты, имеющие натриевый или калиевый состав. По сути, электролит для щелочных батарей представляет собой водный раствор гидроксида калия или гидроксида натрия. Зачастую к раствору добавляют еще и однопроцентный гидроксид лития, что в значительной степени повышает емкость аккумуляторов и увеличивает их срок службы.| Готовый электролит | Диапазон рабочей температуры, градусы Цельсия | Плотность, г/см3 |
|---|---|---|
| Калиевый | от -20 до +35 | от 1,19 до 1,21 |
| Калиево-литиевый | от -20 и ниже | от 1,26 до 1,28 |
| Натриево-литиевый | от +5 до +40 | от 1,18 до 1,20 |
Для заливки можно купить уже готовый жидкий электролит тем более, что на потребительском рынке имеется не малое предложение. А можно и приготовить собственными силами в домашних условиях.
Самостоятельное приготовление электролита
При самостоятельном приготовлении электролита для щелочных АКБ важно помнить о том, что калиево-литиевые и натриево-литиевые растворы взаимозаменяемы, но совмещать их ни в коем случае нельзя. Далее детально рассмотрим весь процесс приготовления калиево-литиевого электролита.
Далее детально рассмотрим весь процесс приготовления калиево-литиевого электролита.
Что понадобиться для раствора
Для приготовления щелочного электролита понадобится:
- дистиллированная вода, имеющая ГОСТ 6709-72;
- гидроксид калия (едкий калий) марки А (твердый) или В (жидкий), имеющий ГОСТ 9285-69;
- гидроксид лития, имеющий ГОСТ 8595-75;
- чистая железная, чугунная или пластмассовая посуда.
Процесс приготовления
При приготовлении электролита необходимо строго соблюдать технологию и последовательность действий:
- Налить нужное количество дистиллированной воды в термостойкую посуду из расчета 3 л.
 на 1 кг твердого гидроксида калия и гидроксида лития.
на 1 кг твердого гидроксида калия и гидроксида лития. - Опускаем щелочь (KOH и LiOH в соотношении 0,04/0,045) в воду маленькими частями, используя для этого стальные щипцы.
- Растворить щелочь в воде, помешивая раствор стеклянной, эбонитовой или стальной мешалкой, что существенно ускорит время реакции.
- Остудить полученный раствор и настоять его в течение трех-шести часов, плотно закрыв крышкой, до полного оседания примесей.
- По прошествии вышеуказанного времени, аккуратно слить получившуюся прозрачную жидкость и замерить ареометром плотность.
Правильно приготовленный щелочной раствор должен быть прозрачным или чуть желтоватым, не иметь запаха. На дне возможно образование небольшого осадка. Такой электролит можно залить в аккумулятор.
Проверка плотности
Для полной готовности электролита нужно добиться требуемой его плотности. В ее измерении поможет ареометр. Необходимо понимать, что плотность раствора выбирается в зависимости от температуры окружающей среды. Летом, к примеру, ее нужно снижать, а зимой – наоборот, повышать, ведь чем выше плотность, тем больше срок службы устройства. Оптимальной плотностью для жаркого времени считается – от 1,21 до 1,23 г/см3, в зимний период она должна составлять от 1,27 до 1,29 г/см3. Чтобы изменить плотность полученного раствора необходимо добавлять в него либо щелочь, что сделает его более плотным, либо дистиллированную воду, что уменьшит первоначальный результат.
Летом, к примеру, ее нужно снижать, а зимой – наоборот, повышать, ведь чем выше плотность, тем больше срок службы устройства. Оптимальной плотностью для жаркого времени считается – от 1,21 до 1,23 г/см3, в зимний период она должна составлять от 1,27 до 1,29 г/см3. Чтобы изменить плотность полученного раствора необходимо добавлять в него либо щелочь, что сделает его более плотным, либо дистиллированную воду, что уменьшит первоначальный результат.
- Производить замеры во всех емкостях аккумулятора.
- Не измерять плотность сразу после залива жидкости в АКБ.
- Более точные показания можно получить при температуре электролита не выше комнатной.
- В обязательном порядке промыть измерительный прибор после использования.
Хранение
Хранить приготовленный электролит необходимо в стеклянных емкостях, герметично закрытых резиновыми пробками и залитых парафином.
Меры предосторожности
При изготовлении раствора для заливки в щелочные АКБ следует соблюдать меры предосторожности при работе с едкими химическими веществами, так как щелочь – довольно опасный элемент и, попав на кожу или слизистые оболочки, может вызвать сильные химические ожоги. Поэтому при работе с ней нужно использовать средства индивидуальной защиты: перчатки, очки. Необходимо также следить за тем, чтобы раствор не попал на одежду или незащищенные участки тела.
Популярные сообщения из этого блога
Почему кипит аккумулятор при зарядке
Зачастую при зарядке АКБ можно услышать булькающий звук, похожий на кипение. Причем бывает, что бурлит абсолютно новый, только что купленный аккумулятор. Многие начинающие автолюбители впервые сталкивающиеся с этим сразу же думают о наличии каких-то проблем или неполадок. Однако, переживать по этому поводу не стоит, ведь кипение электролита в аккумуляторе – вполне нормальное явление, возникающее в процессе заряда устройства. Что же происходит с АКБ во время зарядки и всегда ли является нормой его кипение? Попробуем разобраться с этим в данной статье. Химические процессы в АКБ при зарядке Как во время работы аккумулятора, так и на протяжении его зарядки, в устройстве протекают некоторые физико-химические процессы. Поэтому наличие различных шумов и звуков при этом – явление вполне нормальное и логичное. Аккумуляторная батарея представляет собой емкость, накапливающую электрический ток, который питает всю электронную начинку автомобиля. Процесс аккумулирования энергии обеспечивают кис
Причем бывает, что бурлит абсолютно новый, только что купленный аккумулятор. Многие начинающие автолюбители впервые сталкивающиеся с этим сразу же думают о наличии каких-то проблем или неполадок. Однако, переживать по этому поводу не стоит, ведь кипение электролита в аккумуляторе – вполне нормальное явление, возникающее в процессе заряда устройства. Что же происходит с АКБ во время зарядки и всегда ли является нормой его кипение? Попробуем разобраться с этим в данной статье. Химические процессы в АКБ при зарядке Как во время работы аккумулятора, так и на протяжении его зарядки, в устройстве протекают некоторые физико-химические процессы. Поэтому наличие различных шумов и звуков при этом – явление вполне нормальное и логичное. Аккумуляторная батарея представляет собой емкость, накапливающую электрический ток, который питает всю электронную начинку автомобиля. Процесс аккумулирования энергии обеспечивают кис
Какой аккумулятор выбрать для дизельного двигателя
Дизельные автомобили уже давно обрели популярность среди автолюбителей.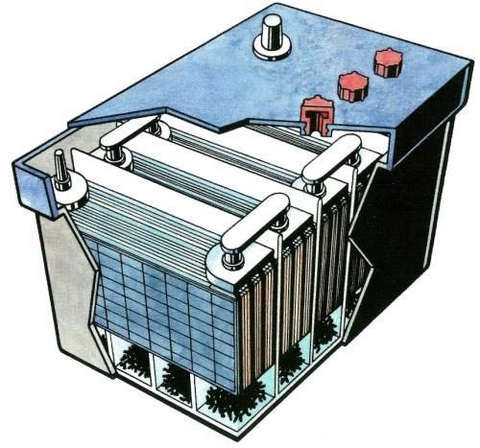 И этому есть множество разных причин: их КПД выше бензиновых, режим их движения более эластичен. Однако такие автомобили существенно дороже в обслуживании, ведь дизельное топливо обладает большей вязкостью и на холоде сильно густеет. К тому же, дизельные моторы более восприимчивы к качеству топлива, чем бензиновые двигатели, и требуют на стартер пусковой ток большей мощности. Поэтому к выбору аккумулятора на дизельное авто следует подходить с особой тщательностью. Как это правильно сделать и на что обратить внимание при покупке АКБ для дизельного двигателя рассмотрим в данной статье. Что влияет на выбор АКБ для дизельного мотора Покупая аккумулятор для дизельного двигателя, следует обращать внимание на некоторые факторы, которые могут повлиять на срок его службы и качество работы. Остановимся на них немного подробнее. Объем двигателя От объема двигателя дизельного автомобиля зависит правильное определение по
И этому есть множество разных причин: их КПД выше бензиновых, режим их движения более эластичен. Однако такие автомобили существенно дороже в обслуживании, ведь дизельное топливо обладает большей вязкостью и на холоде сильно густеет. К тому же, дизельные моторы более восприимчивы к качеству топлива, чем бензиновые двигатели, и требуют на стартер пусковой ток большей мощности. Поэтому к выбору аккумулятора на дизельное авто следует подходить с особой тщательностью. Как это правильно сделать и на что обратить внимание при покупке АКБ для дизельного двигателя рассмотрим в данной статье. Что влияет на выбор АКБ для дизельного мотора Покупая аккумулятор для дизельного двигателя, следует обращать внимание на некоторые факторы, которые могут повлиять на срок его службы и качество работы. Остановимся на них немного подробнее. Объем двигателя От объема двигателя дизельного автомобиля зависит правильное определение по
Восстановление аккумулятора бесперебойника — как восстановить аккумулятор ИБП
Многие владельцы источников бесперебойного питания были в ситуации, когда при малейшем скачке напряжения компьютер выключался, хоть и был подключен к ИБП. Причиной тому служит выход из строя батарей, а цена их такова, что иногда дешевле купить новый источник. У многих сразу возникают вопросы: «Как реанимировать бесперебойник? Можно ли починить батарею ИБП?». Предлагаем вам узнать, как восстановить аккумулятор от бесперебойника, в данной статье.
Причиной тому служит выход из строя батарей, а цена их такова, что иногда дешевле купить новый источник. У многих сразу возникают вопросы: «Как реанимировать бесперебойник? Можно ли починить батарею ИБП?». Предлагаем вам узнать, как восстановить аккумулятор от бесперебойника, в данной статье.
Причины выхода из строя аккумуляторов
Для начала рассмотрим основные виды неисправностей и причины, по который аккумулятор может прийти в негодность. Причин поломки АКБ источника может быть множество:- систематический недозаряд аккумуляторных батарей ИБП – это наиболее часта причина, так как бюджетные источники оснащаются не очень качественными зарядными устройствами. Также причина может быть в качестве входного сетевого напряжения, из-за которого ИБП приходится часто включать режим работы от батарей;
- глубокий разряд – также возможен при плохом качестве входного напряжения;
- продолжительное нахождения батарей в разряженном состоянии – после долгой работы от аккумуляторов старайтесь оставлять ИБП включенным для того, чтобы он смог полностью зарядить свои батареи, также бывают ситуации, что сам ИБП разряжает аккумулятор, но эта проблема связана с физическими неполадками в схеме;
- снижение уровня электролита, что приводит к высыханию батареи и потере ее первоначальных качеств – это происходит из-за повышенного напряжения при зарядах;
- работа аккумулятора в повышенном температурном режиме и его хранение при температурах ниже 0.

Все вышеперечисленное отрицательно сказывается на работоспособности аккумуляторных батарей в ИБП, и они работают некачественно или совсем выходят из строя. Вышеперечисленные причины приводят к следующим поломкам АКБ:
- осыпание и оползание активной массы положительно заряженных электродов, которое связано с нарушением однородности и разрыхлением;
- слабое сцепление активной массы или плохая механическая прочность токоотводов является причиной опадания активной массы;
- коррозия электродов, которая заключается в образовании электрохимических процессов растворения и окисления в электролите, в результате чего материал токоотводов осыпается;
- сульфатация пластин, которая заключается в невозможности протекания обратимых токообразующих процессов в результате образования крупных кристаллов сульфата свинца.
Перечисленных проблем можно избежать установкой в ИБП качественного зарядного устройства, но, к сожалению, обычный человек этого сделать не может, так же, как и повлиять на производителей ИБП. Остается только покупать более качественные, но вместе с тем, и дорогие модели бесперебойников.
Остается только покупать более качественные, но вместе с тем, и дорогие модели бесперебойников.
Как восстановить аккумулятор ИБП?
Теперь перейдем к сути статьи – оживление аккумулятора бесперебойника в домашних условиях. Стопроцентных результатов ожидать не стоит, да и методы оживления подходят лишь для некоторых видов поломок, но попробовать произвести восстановление аккумулятора бесперебойника все же стоит, так как цены на новые аккумуляторы достаточно высоки. Ниже рассмотрим несколько способов восстановления аккумуляторных батарей.
1. Оживляем бесперебойник дистиллированной водой.
Сначала нужно купить необходимые инструменты: шприц и дистиллированную воду. Дистиллированная вода продается в любом автомобильном магазине. Для восстановления аккумуляторных батарей данным способом придется сорвать верхнюю крышку батареи, которая прикрывает колпачки банок. Затем снимите колпачки, которые являются еще и клапанами для сброса избыточного давления, которое создается при нагревании батарей.
Наберите в шприц дистиллированную воду, не более 2 мл, и выдавите в банку. Проделайте так с каждой банкой. Дайте время воде впитаться (понадобится около получаса), если потребуется, то залейте еще. Пластины должны быть слегка покрыты водой, если получился избыток, то шприцом можно его удалить.
2. Длительное заряжание
Восстановление аккумуляторов ИБП данный способом позволяет восстановить его первоначальные свойства после высыхания. Изначально можно попробовать его, чтобы не разбирать аккумулятор. Если длительное заряжание не помогло, то тогда придется выполнить первый пункт. Высохший аккумулятор изначально не будет потреблять ток от зарядного устройства, поэтому на амперметр внимания не обращайте.
Перед подключением накройте аккумулятор крышкой и поставьте на нее груз, иначе колпачки разлетятся по всей комнате, так как через них будет сбрасываться избыточное давление.
Заряжать нужно напряжением не менее 15 Вольт. Причем придется долго ждать, прежде чем аккумулятор начнет оживать и брать ток. Если в течение 15 часов зарядки батарея так и не стала брать ток, то следует повысить напряжение до 20 В. В этом случае нельзя АКБ оставлять без присмотра, иначе можно испортить и батарею, и зарядное устройство.
Если в течение 15 часов зарядки батарея так и не стала брать ток, то следует повысить напряжение до 20 В. В этом случае нельзя АКБ оставлять без присмотра, иначе можно испортить и батарею, и зарядное устройство.
3. Циклический заряд
Если аккумулятор не хочет оживать, то можно попробовать «раскачать» его. Следует поочередно выполнять циклы заряда/разрядки, что позволит восстановить первоначальные свойства АКБ.
Первый цикл заряда следует проводить высоким напряжением около 30 В. При последующих циклах потребуется ступенчатое снижение напряжения до 14 В, например, 30-25-20-14 В. Если циклов будет больше, то показатели напряжения будут другие. Разряжать батарею следует небольшой лампочкой на 5-10 Вт. При разряде следует следить за напряжением батареи и не допускать его просадки ниже 10,5 В.
Приведенные методы описывают, как восстановить работу ИБП, но если они не помогли, то придется идти в магазин за новым аккумулятором. Если вы решите выбросить старые батареи, то не забывайте, что в аккумуляторах содержится свинец, который относится к тяжелым металлам, и кислота. Поинтересуйтесь в Интернете или в любом сервисном центре, куда сдать батареи от ИБП в вашем городе, чтобы не нанести урон окружающей среде.
Поинтересуйтесь в Интернете или в любом сервисном центре, куда сдать батареи от ИБП в вашем городе, чтобы не нанести урон окружающей среде.
Написать письмо
По любому вопросу вы можете воспользоваться данной формой:
Кислотные аккумуляторы; чтобы больше не было отвратительно читать то что люди о них пишут / Хабр
Случайно узрел статью с комментариями к ней, и так злость во мне закипела по поводу безграмотности людей в области кислотных (свинцовых в простонародье) аккумуляторов, что не выдержал и решил написать «гикам» (чтобы быть гиком, как оказывается, мало купить дорогой телефон) краткую статью об аккумуляторах. С рассмотрением тех ошибок, которые мне постоянно мусолят глаза и вызывают праведное желание их исправить.
Начнем с названия. Я очень часто вижу что тремя буквами А-К-Б называют все что можно зарядить, абсолютно любой аккумулятор. Особенно тремя буквами люди любят называть аккумуляторы типа Li-ion. На самом-же деле АКБ аббревиатура от Аккумуляторная Кислотная Батарея. Под ними подразумевается лишь один тип аккумулятора — свинцовый кислотный. С современной точки зрения это название вызывает некоторый когнитивный диссонанс т.к. на данный момент значение слова «батарейка» т.е. гальванического элемента который зарядить нельзя перешло на слово «батарея». И получается как будто бы из-за слова «аккумуляторная» это аккумулятор который зарядить можно, а из-за слова «батарея» это как будто батарейка которую зарядить нельзя. В реальности-же батарея — просто цепь гальванических элементов и со словом «батарейка» имеет общий лишь корень.
На самом-же деле АКБ аббревиатура от Аккумуляторная Кислотная Батарея. Под ними подразумевается лишь один тип аккумулятора — свинцовый кислотный. С современной точки зрения это название вызывает некоторый когнитивный диссонанс т.к. на данный момент значение слова «батарейка» т.е. гальванического элемента который зарядить нельзя перешло на слово «батарея». И получается как будто бы из-за слова «аккумуляторная» это аккумулятор который зарядить можно, а из-за слова «батарея» это как будто батарейка которую зарядить нельзя. В реальности-же батарея — просто цепь гальванических элементов и со словом «батарейка» имеет общий лишь корень.
Далее перейдем к некоторым мифам, а именно главный миф — АКБ для автомобиля имеет некие существенные отличия от АКБ для ИБП. И вот нельзя их применять и там и там.
С химической точки зрения любые АКБ абсолютно одинаковы. Как-же они устроены? Очень кратко — если аккумулятор заряжен, то один электрод представляет собой свинцовую решетку с нанесенной на нее пастой из PbO2, второй -такую-же решетку с пастой губчатого свинца. Электролитом служит раствор серной кислоты. В процессе разряда PbO2 восстанавливается и взаимодействуя с серной кислотой образует PbSO4. Свинец на другом электроде окисляется и опять-же образует PbSO4. В конце разрядки мы имеем обе решетчатые пластины заполненные (более или менее) сульфатом свинца. При зарядке аккумулятора происходит электролиз и из сульфата свинца вновь образуется диоксид и металлический свинец. Конечно-же, тут нужно подчеркнуть, что электроды при этом не равны и путать их полярность не стоит т.к. еще на стадии производства в намазку электродов вводятся соответствующие добавки, улучшающие их эксплуатационные свойства. При этом добавки полезные для одного электрода вредны для другого. В очень старые времена, где-то в начале прошлого века, в условиях простых аккумуляторов, вероятно, была допустима переполюсовка аккумулятора по ошибке или с какими-то целями и он какое-то время после этого работал. В том что она допустима сейчас я сомневаюсь.
Электролитом служит раствор серной кислоты. В процессе разряда PbO2 восстанавливается и взаимодействуя с серной кислотой образует PbSO4. Свинец на другом электроде окисляется и опять-же образует PbSO4. В конце разрядки мы имеем обе решетчатые пластины заполненные (более или менее) сульфатом свинца. При зарядке аккумулятора происходит электролиз и из сульфата свинца вновь образуется диоксид и металлический свинец. Конечно-же, тут нужно подчеркнуть, что электроды при этом не равны и путать их полярность не стоит т.к. еще на стадии производства в намазку электродов вводятся соответствующие добавки, улучшающие их эксплуатационные свойства. При этом добавки полезные для одного электрода вредны для другого. В очень старые времена, где-то в начале прошлого века, в условиях простых аккумуляторов, вероятно, была допустима переполюсовка аккумулятора по ошибке или с какими-то целями и он какое-то время после этого работал. В том что она допустима сейчас я сомневаюсь.
Таких ячеек в 12В аккумуляторе 6 шт, в 6В — 3 шт. и т.д. Многих вводит в заблуждение значение напряжения на аккумуляторах. Причем значений напряжения номинального, заряда, разряда. С одной стороны, аккумуляторы называются 12В (и 6В, 24В тоже есть, по-моему, даже 4В изредка встречаются) но на корпусе тех-же аккумуляторов для ИБП производитель указывает напряжение выше 13.5В.
Например:
Тут мы видим, что в форсированном режиме напряжение заряда может быть аж 15В.
Все разъяснит кривая напряжения на АКБ:
Слева мы видим напряжение для аккумулятора из 12 ячеек (24В номинальных), 6 (12В номинальных) и, самое полезное, для одной ячейки. Там-же отмечены области нежелательных напряжений при разряде/ заряде. Из кривой можно сделать выводы:
1 Напряжение 12В, 24В и т.д. являются номинальными и показывают лишь число гальванических ячеек (путем деления на два) в батарее. Это просто название для удобства.
2 Напряжение при заряде могут достигать 2. 5 В/ ячейку что для 12В аккумулятора соответствует 15В.
5 В/ ячейку что для 12В аккумулятора соответствует 15В.
3 Напряжение заряженной батареи считается допустимым при значении 2.1-2.2 В/ячейку, что для 12В аккумулятора соответствует 12.6-13.2В.
Теоретически, батарею можно зарядить и до значений 2.4 В/ячейку или даже немного выше, однако, такая зарядка будет негативно сказываться как на состоянии электродов, так и на концентрации электролита. Однажды, перед сдачей в утиль, я легко зарядил 12В батарею до напряжения ок. 14.5В (уже не помню точное значение).
Итак, автор статьи с которой я начал, решил, что напряжение заряда автомобильной АКБ и АКБ от ИБП отличаются. Это неверно, у них одинаковый тип электродов и одинаковая концентрация серной кислоты в электролите (подобранная давным-давно экспериментальным путем, чтобы предоставлять максимальное напряжение и минимальном саморазряде). Однако, что-же происходит в батарее, почему ее нельзя заряжать при слишком высоком значении напряжения?
Почему в автомобильную АКБ нужно подливать воду, а в АКБ от ИБП не нужно? Эти вопросы позволяют нам плавно перейти в область напряжения разложения воды. Как я написал выше, при зарядке аккумулятора происходит электролиз. Однако, не весь ток расходуется на превращение PbSO4 в PbO2 и Pb. Часть тока будет неизбежно расходоваться и на разложение воды, составляющей значительную часть электролита:
Как я написал выше, при зарядке аккумулятора происходит электролиз. Однако, не весь ток расходуется на превращение PbSO4 в PbO2 и Pb. Часть тока будет неизбежно расходоваться и на разложение воды, составляющей значительную часть электролита:
2H2O = 2H2 + O2
Теоретический расчет дает значение напряжения для этой реакции ок. 1.2В. Напоминаю, что напряжение на ячейке при заряде заведомо более 2В. К счастью, активно вода начинает разлагаться только выше 2В, а в промышленности для получения водорода и кислорода из нее процесс ведут и вовсе при 2.1-2.6В (при повышенной температуре). Как бы то ни было, тут мы приходим к выводу, что в конце процесса заряда АКБ будет неизбежно происходить процесс разложения воды в электролите на элементы. Образующиеся кислород и водород попросту улетучиваются из сферы реакции. Про них бытуют следующие мифы:
1. Водород крайне взрывоопасен! Перезарядишь аккумулятор и как минимум лишишься комнаты где тот был!
На самом деле, водорода в процессе электролиза выделяется ничтожно мало по сравнению с объемом комнаты. Водород взрывается при концентрации от 4% в воздухе. Если мы допустим, что электролиз ведется в комнате размером 3*3*3 метра или 27 метров куб., то нам понадобится наполнить помещение 27*0.04=1.1 метров куб. водорода. Для получения такого количества h3 нужно было бы полностью разложить ок. 49 моль воды или 884 грамма ее. Если кто-то наблюдал электролиз, то поймет насколько это много. Или попробуем перейти ко времени. При силе тока в стандартной зарядке для крупногабаритных АКБ в 6А, уравнение Фарадея дает время, необходимое для получения этого количества водорода, аж 437 часов или 18.2 дня. Чтобы наполнить комнату водородом до взрывоопасной концентрации нужно забыть про зарядку на 2 с половиной недели! Но даже если это случится, концентрация серной кислоты просто будет расти пока ее раствор не приобретет слишком высокое сопротивление для жалких 12В зарядки и сила тока не станет ничтожной. Да и водород попросту улетучится.
Водород взрывается при концентрации от 4% в воздухе. Если мы допустим, что электролиз ведется в комнате размером 3*3*3 метра или 27 метров куб., то нам понадобится наполнить помещение 27*0.04=1.1 метров куб. водорода. Для получения такого количества h3 нужно было бы полностью разложить ок. 49 моль воды или 884 грамма ее. Если кто-то наблюдал электролиз, то поймет насколько это много. Или попробуем перейти ко времени. При силе тока в стандартной зарядке для крупногабаритных АКБ в 6А, уравнение Фарадея дает время, необходимое для получения этого количества водорода, аж 437 часов или 18.2 дня. Чтобы наполнить комнату водородом до взрывоопасной концентрации нужно забыть про зарядку на 2 с половиной недели! Но даже если это случится, концентрация серной кислоты просто будет расти пока ее раствор не приобретет слишком высокое сопротивление для жалких 12В зарядки и сила тока не станет ничтожной. Да и водород попросту улетучится.
Очень редко случаются взрывы непосредственно в корпусах крупногабаритных АКБ из-за того, что выделяющийся водород по какой-то причине не может покинуть замкнутого пространства. Но и в этом случае нечего страшного не бывает — чаще всего взрыва хватает только на небольшую деформацию верхней части корпуса, но не на разрыв свинцовых соединений. И АКБ еще может работать дальше даже после таких повреждений.
Но и в этом случае нечего страшного не бывает — чаще всего взрыва хватает только на небольшую деформацию верхней части корпуса, но не на разрыв свинцовых соединений. И АКБ еще может работать дальше даже после таких повреждений.
2. При электролизе может образоваться смертельно ядовитый и, не менее взрывоопасный чем водород, сероводород!
Не наш, периодически попадался миф в англоязычных постах. Теоретически конечно возможно подать такое большое напряжение и создать т.о. такую большую силу тока, что на катоде начнется процесс восстановления сульфат-иона. Напряжение для этого будет достаточным, а продукты восстановления не будут успевать диффундировать подальше от электрода и восстановление будет идти дальше. Но зарядка в пределах десятка-трех вольт и с ограничением силы тока в 6А на такое едва ли способна. Однажды, я наблюдал процесс восстановления сульфата до SO2, да, это возможно; однокурсницы по ошибке что-то сделали не то во время опыта. Но это большая редкость т. к. там концентрация серной кислоты была заметно выше той, что используется в АКБ, была иная конструкция электрода и иной его материал и, естественно, напряжения и сила тока были были непомерными. И SO2 не H2S.
к. там концентрация серной кислоты была заметно выше той, что используется в АКБ, была иная конструкция электрода и иной его материал и, естественно, напряжения и сила тока были были непомерными. И SO2 не H2S.
3. При электролизе мышьяк и сурьма из материала решеток будут восстанавливаться до ядовитых арсина и стибина!
Действительно, решетки содержат относительно много сурьмы, мышьяка в современных решетках, вероятно, нет вообще. При работе АКБ та решетка на которой происходит восстановление, т.е. катод, разрушению не может подвергаться. Выделяйся даже каким-то образом стибин, он бы тут-же взаимодействовал с PbSO4, восстанавливая его до металла.
Однако, некоторая практическая неприятность тут есть. Газообразные водород и кислород могут увлекать за собой капельки электролита, создавая аэрозоль серной кислоты. Аэрозоль серной кислоты, даже концентрированной, для человека не опасен и просто вызывает кашель. Однако, серная кислота — кошмар для тканей и бумаги. Стоит даже небольшому количеству серной кислоты попасть на одежду и там обязательно появятся дырки или ткань разорвется по этому месту. Через недели, если кислоты много, через месяц, но одежда истлеет.
Стоит даже небольшому количеству серной кислоты попасть на одежду и там обязательно появятся дырки или ткань разорвется по этому месту. Через недели, если кислоты много, через месяц, но одежда истлеет.
Так что газовыделения опасаться не стоит с бытовой точки зрения или стоит, но нужно ориентироваться именно на аэрозоль серной кислоты.
Итак, вода начала разлагаться на водород кислород, ее в электролите становится все меньше, что-же дальше? Если это АКБ в котором электролит просто налит в виде слоя жидкости, то начнется повышение саморазряда из-за повышения концентрации серной кислоты. Занятно, что это будет сопровождаться небольшим повышением напряжения (концентрация кислоты растет) на ячейке. Именно поэтому автовладельцы должны постоянно контролировать концентрацию серной кислоты в своих АКБ (при помощи ареометра) и доливать туда воду. Процедура доливания воды — необходимая часть процесса обслуживания любой АКБ. Кроме одного их типа, и мы сейчас об этом поговорим.
Иметь аккумулятор в котором болтается слой едкой, по отношению к металлам, жидкости конечно-же неудобно, а потому попытки избавиться непосредственно от жидкости предпринимались давно, начались чуть ли не в первой половине 20-го века. К слову сказать, не то чтобы слой серной кислоты прямо плескался вокруг электродов. В реальности она неплохо распределена между электродами и окружающими их сепараторами даже в дешевых моделях. Итак, первым вариантом было использование стекловолокна. Достаточно просто окружить электроды стекловолокном которое пропитано серной кислотой и большинство проблем решится. Этот тип АКБ носит название AGM (absorbent glass mat) и таких АКБ для ИБП подавляющее большинство. Хотя такие АКБ малого форм-фактора и зачастую позиционируются как те, которые можно эксплуатировать в любом положении, с этим нельзя вполне согласиться. Вскрытие крышки стандартного дешевого AGM аккумулятора показывает, что никаких особых крышек там нет, а следовательно, электролит от вытекания удерживают лишь капиллярные силы. Я почти уверен, что если погонять AGM аккумулятор перевернутым вверх дном, то уже после одной зарядки из него польется серная кислота под давление газов.
К слову сказать, не то чтобы слой серной кислоты прямо плескался вокруг электродов. В реальности она неплохо распределена между электродами и окружающими их сепараторами даже в дешевых моделях. Итак, первым вариантом было использование стекловолокна. Достаточно просто окружить электроды стекловолокном которое пропитано серной кислотой и большинство проблем решится. Этот тип АКБ носит название AGM (absorbent glass mat) и таких АКБ для ИБП подавляющее большинство. Хотя такие АКБ малого форм-фактора и зачастую позиционируются как те, которые можно эксплуатировать в любом положении, с этим нельзя вполне согласиться. Вскрытие крышки стандартного дешевого AGM аккумулятора показывает, что никаких особых крышек там нет, а следовательно, электролит от вытекания удерживают лишь капиллярные силы. Я почти уверен, что если погонять AGM аккумулятор перевернутым вверх дном, то уже после одной зарядки из него польется серная кислота под давление газов.
Второй распространенный тип интереснее, это т. н. гелевые АКБ. А получаются они благодаря следующему. Если подкислять растворимые силикаты, то будет происходить выделение кремневой кислоты:
н. гелевые АКБ. А получаются они благодаря следующему. Если подкислять растворимые силикаты, то будет происходить выделение кремневой кислоты:
Na2SiO3 + H2SO4 = Na2SO4 + SiO2 + H2O
Если исходный раствор силиката не отличается качеством, то кремневая кислота будет выделяться в виде стекловидной массы, но если он достаточно чист, то кремневая кислота осадится в виде красивого куска однородного полупрозрачного геля. На этом и основан способ получения гелевых АКБ — простое добавление силикатов к электролиту вызывает его затвердение в гелеобразную массу. Соответственно, вытекать оттуда уже нечему и АКБ действительно можно эксплуатировать в любом положении. Сам по себе процесс образования геля не повышает емкости АКБ и не улучшает его качеств, однако, производители его используют при производстве наиболее качественных моделей, а потому эти АКБ отличаются высоким качеством и большей емкостью. Занятно, что в обоих случаях носителем электролита является SiO2 в той или иной форме.
Занятно, что в обоих случаях носителем электролита является SiO2 в той или иной форме.
Оба типа АКБ объединяются в славный тип VRLA — valve-regulated lead-acid battery который и применяется в ИБП. Формально они считаются необслуживаемыми и терпящими эксплуатацию в любом положении, но это не совсем так. Более того, многие уже встречались с эффектом, когда буквально несколько мл воды возвращают к жизни, казалось бы, дохлую АКБ от ИБП. Так получается, потому что и эти аккумуляторы не капли не застрахованы от электролиза воды в электролите, а следовательно, и пересыхания. Все происходит точно так-же, как в крупногабаритных АКБ. А вот самые дорогие и крутые необслуживаемые АКБ содержат катализатор для рекомбинации выделяющихся газов обратно в воду и вот уже у них корпус действительно выполнен абсолютно герметичным. Обращаю внимание, что по-настоящему герметичным и необслуживаемым может быть и аккумулятор типа AGM и GEL, но они-же могут ими и не быть и не содержать катализатора рекомбинации кислорода и водорода. Тогда, несмотря на казалось бы продвинутую конструкцию, пользователю придется либо чаще покупать новые аккумуляторы, либо доливать воду при помощи шприца.
Тогда, несмотря на казалось бы продвинутую конструкцию, пользователю придется либо чаще покупать новые аккумуляторы, либо доливать воду при помощи шприца.
Хотелось бы добавить несколько слов о режимах разряда. Производители АКБ указывают какой ток максимально допустим для той или иной модели, но нужно понимать, что аккумулятор — просто смесь химических веществ и ЭДС генерируется исключительно химическим путем. Это не конденсатор который, по электрогидравлической аналогии, можно сравнить с неким механическим сосудом (с гибкой мембраной). Хотя АКБ могут выдавать очень большие значения силы тока, в реальности они лучше всего эксплуатируются как раз при небольших токах, что в разряде, что в заряде. Поэтому ИБП, рассчитанные на заряды небольших АКБ, при работе с крупногабаритными будут заряжать их в наиболее щадящем режиме. Впрочем, в течении далеко не одних суток. Интересно обратить внимание на то, что чем выше мощность ИБП, тем больше аккумуляторов последовательно предпочитает собирать производитель. Тут все логично — большие токи разряда маленькие АКБ выдерживают очень плохо.
Тут все логично — большие токи разряда маленькие АКБ выдерживают очень плохо.
Подводя итоги:
1. Малогабаритные и крупногабаритные АКБ идентичны по устройству.
2. Для подавляющего большинства АКБ любого размера доливание воды является необходимой частью текущего обслуживания.
3. Лишь немногие из дорогих моделей АКБ содержат механизм рекомбинации газов и могут быть названы действительно необслуживаемыми.
4. Сам по себе водород, который выделяется при заряде (а это равно постоянной работе в ИБП) АКБ, не является существенной угрозой или проблемой.
5. Нужно очень внимательно работать с АКБ, тщательно избегая пролива даже малейших капель электролита, или лишитесь одежды.
6. Разряд и заряд малыми токами являются наиболее предпочтительными режимами эксплуатации АКБ.
Как эксплуатировать и заряжать гелевый аккумулятор
Для того чтобы начать разговор о преимуществах гелевого аккумулятора, нужно вначале разобраться что такое сам аккумулятор. По определению это источник тока, который многократно преобразовывает химическую энергию в электрическую и накапливает ее на продолжительный срок.
Разновидности аккумуляторов
Для бесперебойного питания используются четыре разновидности накопителей:
1. Стартерные автомобильные батареи, требующие проверки уровня электролита единожды в год и добавления дистиллированной воды по необходимости.
2. Стартерные автомобильные аккумуляторы необслуживаемые герметичные.
3. Стационарные батареи типа AGM.
4. Стационарные аккумуляторы типа GEL.
Последних две разновидности аккумуляторов можно устанавливать в жилых помещениях, а срок эксплуатации достигает 12 лет.
Absorptive Glass Mat (AGM) – распространенная технология, в которой применяется пористый заполнитель-сепаратор из стекловолокна, пропитанный электролитом, что позволяет добиться его состояния без жидкости.
Gelled Electrolite (GEL) – технология изготовления аккумуляторов, в которых состояние электролита напоминает гель. Данная субстанция получается путем добавления в него кремния. Это и есть т. н. гелевые аккумуляторы. Гелеобразный электролит в них позволяет достичь полной непроницаемости, а выделение газов осуществляется внутри разветвленной пористой системы геля. Такая технология позволяет свести обслуживание гелевого аккумулятора к нулю.
гелевые аккумуляторы. Гелеобразный электролит в них позволяет достичь полной непроницаемости, а выделение газов осуществляется внутри разветвленной пористой системы геля. Такая технология позволяет свести обслуживание гелевого аккумулятора к нулю.
Преимущества и недостатки гелевых аккумуляторов
Плюсы
Во-первых, гелеобразный электролит не вытекает, что делает аккумулятор более безопасным и устойчивым к вибрациям. Данное качество позволяет устанавливать батарею вертикально.
Во-вторых, в отличие от кислотного электролита гелевый не разлагается, не кристаллизуется и коррозия не касается анодных пластин.
В-третьих, гелевый аккумулятор позволяет использовать его в нестандартных погодных условиях, к примеру, при –35 или при +50 градусах, а также во влажной среде.
В-четвертых, отлично держит кратковременный глубокий разряд.
В-пятых, активный материал, который используется в GEL аккумуляторах, увеличивает их емкость и сохраняет ее на стабильном уровне, что увеличивает срок эксплуатации батареи.
В-шестых, гелевый аккумулятор не выделяет газы, что в свою очередь снижает потерю массы электролита, а производительность аккумулятора возрастает.
Минусы
Эффективность рекомбинации газов в аккумуляторах со сгущенным электролитом несколько меньше (около 97%), чем в аккумуляторах типа AGM, в которых она превышает 99%.
Подвижность ионов из-за более плотной среды имеет более низкий показатель, что в свою очередь сказывается характеристике заряда-разряда гелевых аккумуляторов. Более того, при набросе нагрузки может прослеживаться частичный провал в напряжении, что приводит к активизации автоматики, защиты и неадекватному поведению всего оборудования.
Любой гелевый аккумулятор не переносит даже непродолжительного короткого замыкания. К примеру, при секундном замыкании двух полюсов обычным гаечным ключом, автомобильный гелевый аккумулятор моментально выйдет из строя.
При заряде гелевого аккумулятора током более 0,2 С10 возникает угроза «вспучивания» геля, так как эффективность рекомбинации меньше, а теплопроводность ограничена.
Высокое внутреннее сопротивление не позволяет снимать с гелевых аккумуляторов большие токи.
О некоторых особенностях автомобильных гелевых аккумуляторов можно узнать из видеоролика:
Зарядка гелевого аккумулятора
Сфера использования гелевых аккумуляторов простирается от автомобиля, сельхоз и мотто техники и солнечной батареи до многочисленных бытовых приборов. В правила эксплуатации гелевого аккумулятора входит и правильный заряд.
Когда устройство длительное время находится в простое, номинальная емкость медленно теряется и так же постепенно испаряется электролит. А так как гелевые аккумуляторы относятся к разряду необслуживаемых, то чаще всего их отправляют на свалку.
Однако, если гелевые аккумуляторы «умерли» не до конца, есть способ их «оживить». Вначале нужно провести тест, который покажет, есть ли шансы на выживание. Примечательно, что все это можно сделать своими руками.
Тест
Снять аккумулятор с устройства и замерить вольтметром остаточное напряжение. Если показатели не упали ниже 9 В, значит реанимировать батарею возможно. Нормальное напряжение колеблется в диапазоне 12,6-13,4 В.
Ремонт и восстановление
Инструментом с острым концом снять пластину или заглушки на верхней панели (зависит от типа АКБ).
Снять пробки с отверстий для залива.
Двухкубовым одноразовым шприцом набрать дистиллированную воду и при помощи иглы маленькими порциями заливать в отверстия, пока жидкость не покажется на поверхности. Дать отстояться около 3-х часов. Если вода полностью впиталась, добавить еще.
Затем, не закрывая заливные отверстия, подключить гелевую батарею к зарядному устройству, следя чтобы напряжение держалось на уровне 14-14,4 В, а величина тока не превышать 1/10 от емкости батареи. К примеру, при емкости 7 А/ч заряд тока должен быть не более 0,7 А. Превысив величину тока можно испортить гелевый аккумулятор, раздув его окончательно.
После заряда и периода отстоя должно получиться напряжение в пределах 12,6-12,8 В, тогда восстановление можно считать состоявшимся.
Отключить гелевый аккумулятор от зарядки, вытереть насухо «ловушки», закрыть резиновыми пробками и зафиксировать крышку верхней панели при помощи клея или скотча.
Для наглядности можно посмотреть видеоролик как восстановить гелевый аккумулятор:
Советы
Нужно обязательно контролировать вытекающий у заливных отверстий электролит: собирать шприцом и не допускать его выливания на борта корпуса аккумулятора.
При отсутствии прибора для зарядки, гелевая батарея присоединяется к клеммам прибора, на котором она был установлена. Остается включить прибор в электросеть.
После процедуры восстановления гелевого аккумулятора не рекомендуется класть его на бок или опрокидывать вверх тормашками.
Советы по эксплуатации
Прежде всего, нужно придерживаться правил указанных в эксплуатационном листке.
Также рекомендуется тренировать гелевый аккумулятор каждые 10 дней.
Каждые 2-3 года проводить ревизию, т.е. разбирать батарею и заправлять дистиллированной водой.
Все эти действия могут значительно увеличить срок эксплуатации гелевого аккумулятора.
Запчасти на renault 12
Прокладка впускного коллектора
Запчасти на renault 10
Сальник рулевой рейки/механизма (см. типоразмеры)
Как устроены аккумуляторы в UPS
Приветствую, друзья!
Все мы слышали об аккумуляторах, которые способны накапливать (аккумулировать) электрическую энергию, не так ли?
Что такое аккумулятор?
Аккумулятор – это первичный источник электропитания. К первичным источникам относятся, например, и литиевые элементы 2032, которые есть в каждом компьютере. Эти элементы питают микросхему CMOS, которая хранит настройки BIOS Setup компьютера. В отличие от аккумулятора, возобновить запас энергии в таких элементах невозможно.
Существуют и вторичные источники электропитания, к которым относится, в частности, блок питания компьютера. Вторичным источником компьютерный блок питания является потому, что выполняет преобразование первичного источника — сетевого переменного напряжения 220 В.
Энергия в аккумуляторе образуется в результате обратимого химического взаимодействия материала электродов и электролита. Восполнить израсходованный запас энергии в аккумуляторе можно, пропусти через него зарядный ток. Отметим, что существует несколько типов аккумуляторов. Например, в ноутбуках применяются литий-ионные, которые обладают лучшим соотношением энергия/вес.
Свинцово-кислотные аккумуляторы
В источниках бесперебойного питания (UPS или ИБП) применяются свинцовые кислотные аккумуляторы.
Свинцовый кислотный аккумулятор представляет собой две пластины, содержащие в себе свинец и погруженные в электролит – раствор на основе серной кислоты.
Вся эта конструкция заключена в пластиковый корпус.
Она содержит несколько «банок», соединенных последовательно. Каждая «банка» после заряда имеет напряжение около 2,2 В, которое постепенно понижается в процессе эксплуатации.
В аккумуляторах для ИБП последовательно соединены обычно 6 элементов.
В течение некоторого времени можно наслаждаться жизнью. Напряжение в сети скачет или пропадает, ИБП периодически переключается на питание от аккумулятора. И мы, поплевывая с высокой башни, не видим для себя никаких неудобств.
Однако любая кислотная аккумуляторная батарея имеет ограниченное число циклов «заряд-разряд». Она постепенно стареет, и в ней со временем происходят необратимые изменения, в частности, сульфатация пластин электродов.
Технологические тонкости
При заряде на положительном электроде выделяется кислород и происходит электролиз (разложение) воды, содержащейся в электролите. Поэтому в «обычных» аккумуляторах (которые применяются, в частности, в автомобилях) приходится открывать специальную пробку для отвода газов. Это, прямо скажем, неудобно – каждый раз проверять плотность электролита, доливать воду, закрывать пробку…
Это, прямо скажем, неудобно – каждый раз проверять плотность электролита, доливать воду, закрывать пробку…
Поэтому были придуманы специальные технологии утилизации выделяющегося при заряде кислорода. Чтобы утилизировать кислород, надо доставить его пузырьки к отрицательному электроду, где он ступит в реакцию со свинцом. Это достигается двумя способами:
- использованием сепаратора с мелкими ячейками из специального синтетического материала,
- загущением электролита специальными добавками.
В последнем случае электролит принимает гелеобразное состояние и не вытекает, даже если перевернуть аккумулятор «вверх ногами». Сепаратор и гель удерживают воздух, и пузырьки кислорода благополучно достигают отрицательного электрода, так как диффузия в газе происходит намного быстрее, чем в жидкости.
Если выделившийся при заряде кислород утилизирован, потери воды в электролите не происходит и доливать ее не надо. Удобство обслуживания повышается, но количество циклов «заряд-разряд» все равно остается ограниченным.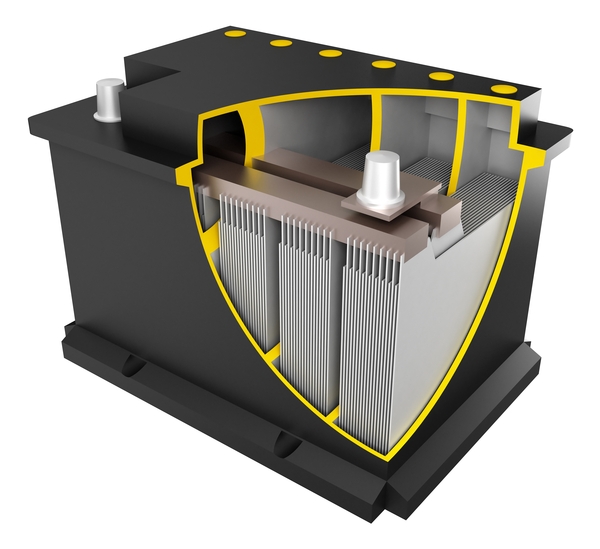
Главный параметр аккумуляторной батареи — емкость
Аккумуляторы характеризуются таким параметром, как емкость.
Емкость аккумулятора – это способность накапливать электрический заряд. Она измеряется в ампер-часах (A*h). В ИБП наиболее широко применяются аккумуляторы с напряжением 12 В и емкостью 5, 7 и 12 A*h.
Значение емкости чаще всего приводится для времени разряда 10 или 20 часов. Так, батарея емкостью 7 A*h может обеспечить в течение 10 часов разрядный ток в 0,7 А. При этом аккумуляторная батарея разрядится до на напряжения примерно 1,7 В на элемент (или до напряжения около 10,4 В для всего устройства).
После этого в аккумуляторе остается еще энергия, и он может ее отдать. Но это будет уже режим глубокого разряда, что сильно сокращает срок жизни источника.
Фирма-производитель обычно оговаривает число циклов «заряд-разряд» при 100% разряде, т.е. до того времени, пока батарея не отдаст всю свою емкость (в данном случае – 7 A*h). При частичном разряде (т.е. когда он отдает не всю свою емкость, а меньшую величину) в каждом цикле — число циклов увеличивается. И это отрадный факт!
При частичном разряде (т.е. когда он отдает не всю свою емкость, а меньшую величину) в каждом цикле — число циклов увеличивается. И это отрадный факт!
Следует отметить, что цифра емкости приводится именно для 10 или 20 часов разряда. При меньших временах разряда и, соответственно, бОльших разрядных токах он отдаст только часть своей емкости. И зависимость эта нелинейная.
Например, батарея GP1272 фирмы CSB емкостью 7,2 A*h при 10-ти часовом разряде (при температуре 25 С) способна отдавать ток 0,74 А.
Таким образом, ее емкость даже чуть больше заявленной – 7,4 А*h.
При часовом разряде батарея сможет отдавать ток 5,3 А, что соответствует емкости 5,3 А*h. При 15-ти минутном разряде батарея отдаст 15,1 А, что соответствует емкости 3,8 А*h, а при 5-ти минутном разряде – 29,6 А, что соответствует емкости 2,5 А*h.
Получается, что при малых временах разряда, когда аккумулятор должен отдавать большой ток (случай, наиболее интересный для нас), он может отдать меньше половины своей емкости. Это прискорбный факт!
Это прискорбный факт!
Заканчивая первую часть статьи, отметим, что, когда в сети исчезает напряжение, ИБП работает от аккумулятора, потребляя (при наличии нагрузки более 100 Вт) более 10 А. При мощной нагрузке может потребляться ток в десятки ампер! Уж лучше было бы наоборот – при больших токах разрядки аккумулятор отдавал бы всю свою емкость, а при малых – часть…
Во второй части статьи мы завершим предварительное знакомство с аккумуляторами. А пока еще раз перечитайте первую часть, чтобы цифры отложились в голове.
До встречи на блоге!
Окончание следует…
Типы аккумуляторов холода и правила их использования ― 130.com.ua
С приходом лета такой предмет, как сумка-холодильник, приобретает особую актуальность. В них можно хранить продукты и держать напитки охлажденными долгое время, даже в очень жаркую погоду. Для того, чтобы сумка могла охлаждать содержимое используются специальные аккумуляторы холода. Так что же это такое аккумулятор холода, и каких типов они бывают?
Разновидности аккумуляторов холода
Аккумуляторы холода — это специальные контейнеры, заполненные особым веществом с высокой теплоемкостью. Их можно разделить на три группы по типу используемого вещества. Каждая группа имеет определенные достоинства и недостатки.
Их можно разделить на три группы по типу используемого вещества. Каждая группа имеет определенные достоинства и недостатки.
Гелевые
Это, пожалуй, самый распространенный и популярный тип. Их делают из прочной пленки и заполняют специальным гелеобразным составом. Обычно в его основу входит карбоксиметилцеллюлоза. Это вещество полностью безопасно, даже если произойдет утечка, поэтому разрешено для применения при транспортировке лекарственных препаратов. Причем стоит сказать, что аккумуляторы этого типа могут выступать в роли не только охлаждающих, но и нагревательных элементов. Они обладают свойством хорошо держать любую температуру как низкую, так и высокую.
Силиконовые
Внешне их можно перепутать с гелевыми, так как они имеют форму таких же плотным пакетов, только внутри них находится особый силиконовый наполнитель. Их особенность в том, что такие аккумуляторы имеют небольшой диапазон температур — от 0 до +2°, однако могут ее держать в течение нескольких дней — до 7 суток.
Солевые
Это небольшие пластиковые контейнеры, которые заполняются водно-солевым раствором. Они могут держать температуру не так долго — около суток. Но этот тип отличается более широким диапазоном температур — от -20° до +8° C.
Принцип работы аккумуляторов холода
Вне зависимости от типа, каждый аккумулятор холода для переносных холодильников и термобоксов работает по общей схеме. Чтобы он охладился и набрал нужную температуру сначала контейнер надо поместить на некоторое время в морозилку. Обычно это занимает пару часов. После этого его можно помещать в сумку-холодильник, где он будет помогать поддерживать нужную температуру, увеличивая время охлаждения продуктов. В зависимости от объема сумки может потребоваться как один, так и несколько аккумуляторов холода.
Стоит отметить, что гелевые варианты могут использоваться в качестве нагревательных элементов. Для этого контейнер требуется пометить на несколько минут в микроволновую печь, после чего также следует положить в сумку. Только в этом случае аккумулятор будет поддерживать внутри изотермической конструкции бокса или сумки тепло, согревая еду или напитки, что особенно актуально в холодную погоду, осенью или зимой.
Только в этом случае аккумулятор будет поддерживать внутри изотермической конструкции бокса или сумки тепло, согревая еду или напитки, что особенно актуально в холодную погоду, осенью или зимой.
Особенности выбора и эксплуатации аккумуляторов холода разных видов
Очевидно, что различные типы аккумуляторов холода имеют определенные плюсы и минусы, которые определяются, в первую очередь, диапазоном поддерживаемой температуры и временем работы. Поэтому при выборе подходящего варианта, сначала надо четко для себя решить, для каких целей вы планируете его использовать:
- Для длительной автономной работы идеально подойдет силиконовый тип.
- Для использования одновременно и летом, и зимой — подойдет гелевый. Так вы сможете получить и прохладные напитки, и горячие бутерброды.
- Если надо обеспечить возможность поддержания очень низкой температуры, то лучше всего использовать солевые контейнеры.
Что касается оптимального объема, то его надо рассчитывать с учетом пропорции: 1 литр на 10 литров объема термосумки.
Аккумулятор холода может быть полезен и для домашнего холодильника, но мало кто об этом знает. Например, если положить несколько таких контейнеров в морозилку, это поможет сгладить температурные колебание при частом открытии дверцы или при большом объеме загруженных продуктов. Это продлевает срок эксплуатации холодильника, так как компрессору реже приходится включаться. Кроме того, при отключении электричества аккумулятор холода будет в течение долгого времени поддерживать нужную температуру в холодильной камере.
Использование аккумуляторов холода актуально при перевозке лекарственных средств. Многие препараты можно хранить исключительно при низкой температуре, иначе они утрачивают свои лечебные свойства. Именно поэтому для транспортировки многих препаратов часто применяются термохолодильники с аккумуляторами холода. Это очень удобно, так как при перевозке небольшого количества лекарств нет необходимости использовать громоздкие холодильные установки, и препарат можно доставить больному в любую точку назначения в охлажденном виде. Для этих целей подходят любые типы аккумуляторов холода.
Для этих целей подходят любые типы аккумуляторов холода.
Их важная особенность в очень длительном сроке эксплуатации — при бережном отношении срок годности подобных элементов практически неограничен. Их можно многократно замораживать и размораживать.
Выбрать подходящий вариант всегда можно в нашем интернет-магазине. У нас в каталоге представлены самые разные варианты, которые подойдут для термосумок любого объема. Купить аккумулятор холода можно с доставкой в Киев, Одессу, Харьков и по всей Украине на 130.com.ua.
Купить аккумулятор холода
Материалы по теме
Как работают батареи? | Полное руководство по хранению энергии
Батареи являются неотъемлемой частью современного мира. Они позволяют нам носить с собой энергию и питать наши устройства без необходимости привязываться к розетке или шнуру. Однако существует такой растущий спрос на накопители энергии и аккумуляторы, которые служат дольше и питают более энергоемкие устройства, что могут возникнуть проблемы с их будущим.
Присоединяйтесь к нам, чтобы узнать, как работают батареи, из чего они сделаны, а также о потенциальных проблемах безопасности и производительности.
Как работают батареи?Батареи — это устройства, используемые для хранения химической энергии, которая может быть преобразована в полезную и портативную электрическую энергию. Они допускают свободный поток электронов в виде электрического тока, который можно использовать для питания устройств, подключенных к аккумуляторному источнику питания. Батареи уравновешивают этот поток электронов, используя раствор электролита, который находится в контакте с электродами на положительном и отрицательном концах — маленькие знаки «плюс» и «отрицательный», которые вы видите на всех батареях.
Хотя это общий метод работы батарей, существует несколько различных способов их работы. К ним относятся электрохимические, которые производят электричество с использованием электролита и двух разных металлов, взвешенных внутри, что позволяет электронам течь от отрицательного конца к положительному концу, создавая ток.
Стандартная батарея состоит из стального корпуса и смеси цинка с марганцем и калием или графита. Кроме того, остальные компоненты выполнены из пластика и бумаги снаружи. Это относится к средним бытовым батареям, таким как щелочные AA, AAA, C, D и 9.-вольтовые версии, а также аккумуляторы в корпусе, например, в вашем телефоне или автомобиле.
Как изготавливаются батареи?Стальной контейнер образует корпус батареи, в котором находятся электроды, анод (отрицательная клемма) и катод (положительная клемма). Положительная сторона батареи сделана из колец диоксида марганца и графита. Отрицательная сторона изготовлена из цинковой пасты, находящейся внутри сепаратора, который не позволяет электродам соприкасаться друг с другом. Это единственное, что предотвращает короткое замыкание внутри аккумулятора.
Когда были изобретены батареи? Первый экземпляр «настоящей» батареи создал итальянский физик Алессандро Вольта в 1800 году. Вольта использовал медь и цинк, укладывая их столбиками, разделенными кусками ткани, пропитанными рассолом (соленой водой). Затем к обоим концам столбов были подключены провода, которые давали стабильный и непрерывный ток.
Вольта использовал медь и цинк, укладывая их столбиками, разделенными кусками ткани, пропитанными рассолом (соленой водой). Затем к обоим концам столбов были подключены провода, которые давали стабильный и непрерывный ток.
Что касается современных батарей, то первая свинцово-кислотная батарея была создана в 1859 году. Эти батареи до сих пор используются почти во всех транспортных средствах с двигателями внутреннего сгорания. Они также были началом тенденции к перезаряжаемым батареям.
Сегодня аккумуляторы невероятно разнообразны. Они варьируются по размеру от достаточно больших, чтобы хранить энергию солнечных ферм, до достаточно маленьких, чтобы поместиться в электронных часах, и многие батареи теперь перезаряжаемые.
Какие существуют типы батарей?источник
Существуют две основные категории батарей: перезаряжаемые, такие как в телефонах и ноутбуках, и неперезаряжаемые, такие как обычные батареи в пультах дистанционного управления телевизора. Однако в каждой из этих категорий есть несколько типов батарей, изготовленных из разных материалов и обладающих разными свойствами.
Однако в каждой из этих категорий есть несколько типов батарей, изготовленных из разных материалов и обладающих разными свойствами.
Существует три основных типа неперезаряжаемых батарей: угольно-цинковые, щелочные и литиевые. Щелочные батареи являются наиболее популярным типом, в то время как литиевые батареи также распространены, хотя обычно предпочтительны близкородственные литий-ионные батареи из-за их перезаряжаемой природы. Цинк-угольные батареи проще всего сконструировать, но они наименее применимы к современным устройствам.
Цинк-угольные батареиЭто были первые коммерческие «сухие» батареи, в которых все было заключено в корпус и не было никаких влажных частей, о которых можно было бы беспокоиться. Они используются в фонариках и других устройствах уже почти 150 лет.
Щелочные батарейки Это обычные батарейки, которые вы найдете в своем доме, например, в пульте дистанционного управления телевизора или настенных часах. Они бывают стандартных AA, AAA, C, D и 9-вольтовых.
Они бывают стандартных AA, AAA, C, D и 9-вольтовых.
Аккумуляторы раньше были похожи на неперезаряжаемые аккумуляторы и обычно извлекались для помещения в зарядное устройство. Сегодня почти все перезаряжаемые батареи остаются подключенными к электронным устройствам, пока они заряжаются через кабель, как и любой телефон, ноутбук или беспроводные наушники.
Ионно-литиевые аккумуляторы — популярный выбор для устройств, которым необходимо удерживать заряд в течение длительного времени, но они также подвержены взрыву, поскольку их содержимое легко воспламеняется. Таким образом, никелевые батареи являются более безопасным выбором, даже если они не обеспечивают такой же мощности. Свинцово-кислотные батареи также очень полезны для более крупных устройств или машин, таких как транспортные средства или портативные устройства для хранения электроэнергии.
Никель-кадмиевые батареи Никель-кадмиевые (NiCd) батареи в заряженном состоянии содержат гидроксид никеля в положительном электроде и кадмий в отрицательном электроде. Эти батареи обеспечивают очень высокие токи и могут быстро перезаряжаться.
Эти батареи обеспечивают очень высокие токи и могут быстро перезаряжаться.
Никель-металлогидридные (NiMH) батареи в заряженном состоянии содержат гидроксид никеля в положительном электроде и металлический сплав в отрицательном электроде. Это довольно стабильный и надежный тип аккумуляторной батареи.
Ионно-литиевые батареиИонно-литиевые батареи содержат анод (отрицательный электрод) и катод (положительный электрод), каждый из которых служит в качестве носителя для ионов лития, которые обеспечивают длительную энергию.
Свинцово-кислотные батареиСвинцово-кислотные батареи являются самой старой формой перезаряжаемых батарей. Чаще всего они используются в автомобильных двигателях и больших портативных зарядных устройствах.
Аккумуляторы переменного или постоянного тока? Батареи используют электричество постоянного тока, как и все электронные устройства, которые они питают. Даже если подается переменный ток, он преобразуется в постоянный, как только поступает в устройство. Типичные бытовые батареи подают на устройства около 1,5 вольт постоянного тока.
Даже если подается переменный ток, он преобразуется в постоянный, как только поступает в устройство. Типичные бытовые батареи подают на устройства около 1,5 вольт постоянного тока.
Батареи и конденсаторы различаются по одному основному признаку: батареи хранят заряд химически, а конденсаторы накапливают заряд электрически. Это хранение является важным отличием, поскольку химические реакции способны накапливать больше энергии, что делает батареи более полезными в повседневных ситуациях.
Конденсаторы являются пассивными компонентами цепи, а не активными, и они имеют более низкую плотность энергии, чем батареи. Из-за этого скорость зарядки и разрядки конденсаторов выше — они мгновенно разряжаются при снижении напряжения, а батареи могут работать в течение длительного периода времени при постоянном напряжении.
Могут ли батарейки промокнуть?источник
Батареи не должны намокать или даже подвергаться воздействию воды. Как только вода попадает в батарею, ее чрезвычайно трудно удалить из-за предохранительного клапана, который есть в типичных батареях. Это сделано для того, чтобы предотвратить утечку жидких химикатов, составляющих внутреннюю часть батареи.
Как только вода попадает в батарею, ее чрезвычайно трудно удалить из-за предохранительного клапана, который есть в типичных батареях. Это сделано для того, чтобы предотвратить утечку жидких химикатов, составляющих внутреннюю часть батареи.
Автомобильные аккумуляторы, с другой стороны, обычно без проблем промокают. Это потому, что они специально разработаны, чтобы вода не попадала внутрь — они защищены прочным водонепроницаемым корпусом.
Можно ли перерабатывать батареи?Вообще говоря, большинство типов батарей можно легко переработать. Тем не менее, некоторые батареи перерабатываются легче, чем другие. Сюда входят свинцово-кислотные автомобильные аккумуляторы, которые перерабатываются почти в 90% случаев. Существует несколько способов утилизации аккумуляторов — обязательно зайдите на сайт Earth 911, чтобы найти одобренные пункты утилизации рядом с вами, и на веб-сайте EPA, чтобы узнать, как утилизировать бытовые аккумуляторы.
Какие проблемы с батареями? Помимо потенциального воздействия на окружающую среду свинца и других химических веществ, содержащихся в батареях, эти же материалы могут вызывать ожоги и иные повреждения кожи и глаз. Кроме того, токсичные металлы, содержащиеся во многих батареях, например, содержащие никель и кадмий, являются известными канцерогенами для человека. Кроме того, некоторые из наихудших воздействий на окружающую среду, связанные с батареями, происходят на стадии производства во время добычи и переработки.
Кроме того, токсичные металлы, содержащиеся во многих батареях, например, содержащие никель и кадмий, являются известными канцерогенами для человека. Кроме того, некоторые из наихудших воздействий на окружающую среду, связанные с батареями, происходят на стадии производства во время добычи и переработки.
Да, если батареи оставить рядом с постоянным источником тепла, они потенциально могут взорваться. Это справедливо в основном для щелочных батарей и свинцово-кислотных батарей. Это может произойти даже с ионно-литиевыми батареями в сотовых телефонах, которые взрываются во время зарядки и перегреваются.
Могут ли батареи замерзнуть? Батареи могут замерзнуть, но их температура замерзания намного ниже, чем у воды. Полностью заряженный аккумулятор не замерзнет примерно до -92°F (-69°C). Однако, когда батареи заряжены всего на 40%, они замерзнут примерно при -16°F (-27°C). Важно держать батареи в сильно заряженном состоянии, чтобы предотвратить нежелательное замерзание.
Батареи разрешены к перевозке в самолетах, но это зависит от того, как вы их упаковываете, а также от типа батареи. Обычные сухие батареи, такие как типичные бытовые батареи (AA, AAA, C, D или 9-вольтовые), можно упаковывать как в ручной клади, так и в зарегистрированных сумках. Однако, по данным TSA, запасные неустановленные литиевые батареи не допускаются в самолетах. Они разрешены только в том случае, если они установлены на рабочих устройствах, таких как ноутбуки или телефоны.
Какая батарея самая опасная? По большому счету, литий-ионные аккумуляторы являются наиболее опасными типами аккумуляторов. Во многом это связано с тем, что единственное, что предотвращает короткое замыкание, — это тонкая пластинка из полипропилена (разновидность пластика). Это скольжение не позволяет каждому электроду соприкасаться с другим, а если оно нарушено, электроды соприкасаются, что создает много тепла. Объедините это с тем фактом, что эти батареи заполнены легковоспламеняющимся раствором электролита, и это рецепт опасности. Это может привести к взрывам, которые повредят ваши устройства или, что еще хуже, вашу кожу.
Объедините это с тем фактом, что эти батареи заполнены легковоспламеняющимся раствором электролита, и это рецепт опасности. Это может привести к взрывам, которые повредят ваши устройства или, что еще хуже, вашу кожу.
источник
Аккумуляторы имеют сложные отношения с окружающей средой. По мере того, как мы движемся к замене ископаемого топлива чистой энергией, аккумуляторы являются неотъемлемой частью этого процесса. Однако воздействие добычи лития на окружающую среду само по себе становится серьезной проблемой.
Крайне важно уменьшить воздействие на окружающую среду, которое в конечном итоге вызвано потребностью во все большем и большем количестве энергии. Тот факт, что мы отказываемся от ископаемых видов топлива, не решает проблему сразу — нам нужно убедиться, что мы не создаем те же проблемы с растущим кризисом полезных ископаемых, связанным с производством аккумуляторов.
Такие компании, как Tara Energy, находятся в авангарде обеспечения ответственной энергетики, которая уравновешивает воздействие на окружающую среду на всех фронтах. Энергию ветра можно хранить в батареях, но если батареи сводят на нет положительное воздействие ветра на окружающую среду, это не настоящий прогресс. Помня об этом, мы должны продолжать удовлетворять потребность в батареях.
Энергию ветра можно хранить в батареях, но если батареи сводят на нет положительное воздействие ветра на окружающую среду, это не настоящий прогресс. Помня об этом, мы должны продолжать удовлетворять потребность в батареях.
Предоставлено вам taranergy.com
Все изображения лицензированы из Adobe Stock.
Избранное изображение
Как работают батареи? | Ваше подробное руководство
Алессандро Вольта случайно создал первую батарею в 1800 году. Он пытался доказать коллеге-ученому, что нет необходимости использовать ткани животных для производства электрического тока. Вольта успешно выиграл свои дебаты, а затем и некоторые другие. Непредвиденное изобретение электрохимического элемента принесло Вольте много почестей. При этом он оставался очень скромным человеком.
После его смерти лицо Вольты появилось на марках, а также на банкноте в 10 000 итальянских лир, вышедшей из обращения в 2002 году. Имя Вольта живет, поскольку другие отмечают его работу, называя в его честь вольт — единицу, которую мы используем для измерения силы. электрических токов.
электрических токов.
Но что открыл Вольта, что заставило батарею работать? В этой статье мы углубимся в ответы на часто задаваемые вопросы, в том числе: как работают батареи, из чего они сделаны, какие типы батарей существуют сегодня и какие проблемы у нас возникают с батареями?
Как работают батареи?Батарейки — это одна из тех вещей, которые большинство из нас считает само собой разумеющимися. Они просто обычная часть повседневной жизни, которые по большей части остаются незамеченными, пока накапливают энергию и выполняют свою магию. Подумайте о фонариках, сотовых телефонах, пультах дистанционного управления, слуховых аппаратах, автомобильных аккумуляторах и даже электромобилях.
Но вы когда-нибудь останавливались, чтобы действительно попытаться понять, как на самом деле работают эти незаменимые продукты, которые обеспечивают нас портативной, мгновенной энергией? Батареи — это автономные блоки питания, которые накапливают химическую энергию и преобразуют ее в электрическую энергию. Этот процесс известен как электрохимия. Чтобы более подробно объяснить процесс работы батарей, давайте подробно рассмотрим, из чего сделаны батареи.
Этот процесс известен как электрохимия. Чтобы более подробно объяснить процесс работы батарей, давайте подробно рассмотрим, из чего сделаны батареи.
источник
Батарея обычно состоит из группы гальванических элементов. Есть два разных типа: гальванические (также называемые гальваническими) и электролитические.
- Гальванические или гальванические элементы: Они получают энергию в результате спонтанных окислительно-восстановительных реакций. В этих клетках химическая энергия превращается в электрическую энергию.
- Электролитические элементы: Они получают энергию от внешнего источника электронов, такого как источник переменного тока (AC) или источник постоянного тока (DC).
 В этих клетках электрическая энергия превращается в химическую энергию.
В этих клетках электрическая энергия превращается в химическую энергию.
Давайте рассмотрим пример двух типов ячеек. Когда что-то с перезаряжаемой батареей — например, ваш мобильный телефон или планшет — находится в зарядном устройстве, батарея работает как электролитическая ячейка. Однако, пока вы используете свое электронное устройство, батарея работает как гальванический элемент.
Для производства электроэнергии стандартному аккумуляторному элементу требуются следующие три элемента:
- Анод : это отрицательный электрод или отрицательная клемма батареи и место окисления. Это также положительный электрод в электролитической ячейке. Мы обычно используем такие металлы, как литий и цинк, в качестве анода в виде пасты, находящейся внутри детали, называемой сепаратором. Мы используем сепаратор для предотвращения коротких замыканий, разделяя отрицательный и положительный электроды.

- Катод : Это положительный электрод или положительная клемма аккумулятора. Это также отрицательный электрод в электролитической ячейке. Катод состоит из серебристых матовых колец из оксидов металлов, таких как графит и диоксид марганца.
- Электролит : Это химическое вещество, разделяющее анод и катод. Это химический катализатор в виде липкой пасты или жидкости, который используется между электродами, чтобы сделать батарею проводящей. Это достигается за счет обеспечения механизма переноса ионов между анодом и катодом ячейки. Здесь химическая энергия батареи превращается в электрическую энергию. Гидроксид калия, натрий и хлорид являются основными электролитами.
Два разных металла (анод и катод) прикреплены к батарее на противоположных концах друг от друга.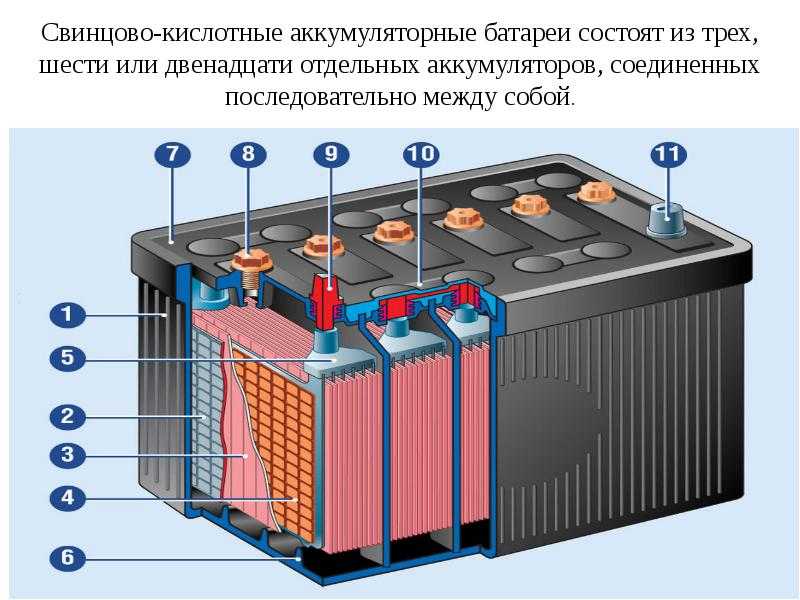 Это позволяет протекать химической реакции между электролитом и металлами, позволяя большему количеству электронов высвобождаться через один металл, чем через другой.
Это позволяет протекать химической реакции между электролитом и металлами, позволяя большему количеству электронов высвобождаться через один металл, чем через другой.
Положительный заряд возникает в металле, который получает большее количество электронов. Затем на противоположной стороне образуется отрицательный заряд. Затем, когда провод или внешняя цепь соединяет два конца батареи друг с другом, поток электронов движется по проводу, уравновешивая электрический заряд и создавая электрический ток.
Последним шагом является введение того, что мы называем электрической нагрузкой. Это все, что требует электричества для работы. Возьмем в качестве примера фонарик. Когда вы вставляете батарейки в фонарик и включаете его, вы создаете электрическую цепь. Эта схема соединяет лампочку с проводом, позволяя электрической энергии течь через провод и лампочку, когда электроны проходят через отрицательный конец батареи, через провод, лампочку и обратно к положительному концу батареи.
источник
За прошедшие годы накопители энергии прошли долгий путь. Сегодня два основных места, где мы храним энергию, — это батареи и конденсаторы. И хотя они очень похожи, они не одинаковы. Давайте посмотрим на сходства и различия между ними.
В чем сходство между батареями и конденсаторами?Вот основные сходства между батареями и конденсаторами:
- Накопленная энергия создает электрический потенциал, известный как напряжение.
- Электрический потенциал генерирует поток электронов, называемый электрическим током.

- Электрический ток может создавать электрическую энергию для питания компонентов в цепи.
Инженеры будут выбирать, использовать ли батарею или конденсатор для своего продукта, исходя из конструкции схемы и ее функции. Иногда они идут с комбинацией двух. Однако это не означает, что они полностью взаимозаменяемы.
Почтовый индекс
В чем разница между батареями и конденсаторами?Вот основные различия между батареями и конденсаторами:
- При сравнении батареи и конденсатора одинакового объема батарея имеет в тысячи раз большую емкость для хранения энергии, чем конденсатор. Аккумуляторы
- надежны и обеспечивают бесперебойную подачу энергии.
- Конденсаторы часто могут обеспечить всплески энергии быстрее, чем батареи.
- Конденсаторы накапливают энергию электрического поля, что делает их перезаряжаемыми.
 Напротив, батареи хранят свою энергию в химическом поле, которое часто не может перезаряжаться.
Напротив, батареи хранят свою энергию в химическом поле, которое часто не может перезаряжаться. - Аккумуляторы имеют тенденцию терять способность удерживать заряд, чего не происходит с конденсаторами.
- Простые конденсаторы обычно изготавливаются из нетоксичных материалов, поэтому их безопасно выбрасывать.
Переменный ток (AC) представляет собой поток электронов, который регулярно, много раз в секунду меняет направление. Большинство наших бытовых приборов работают от сети переменного тока. Например, большинство наших микроволновых печей, кофейников, посудомоечных машин, телевизоров и даже наших систем отопления, вентиляции и кондиционирования работают на переменном токе. Однако, поскольку электроны батареи текут только в одном направлении, батареи генерируют постоянный ток (DC). Многие портативные устройства, такие как фонарики, сотовые телефоны и mp3-плееры, работают от постоянного тока, обеспечиваемого батареями.
источник
Не все батареи одинаковы. Различные типы батарей изготавливаются из других химических веществ и работают с различными химическими реакциями. Давайте рассмотрим семь наиболее распространенных типов батарей.
1. Щелочная батареяDuracell® и Energizer® — две популярные марки щелочных батарей. Это наши стандартные батареи AA, AAA, C, D и 9-вольтовые. Электроды в этих батареях — оксид марганца и цинк. Электролит представляет собой щелочную пасту из гидроксида калия или натрия.
2. Свинцово-кислотный аккумуляторСвинцово-кислотные аккумуляторы — это то, что мы используем для автомобильных аккумуляторов и фотогальванических солнечных энергосистем. Электроды в этих батареях — свинец и оксид свинца, а электролит — сильная кислота.
3. Литиевая батарея В камерах с лампами-вспышками используются литиевые батареи, но в остальном большинство литиевых батарей, с которыми вы сталкиваетесь, имеют форму монеты или кнопки для таких вещей, как часы и другие небольшие устройства с низким энергопотреблением. Хотя они не дают большой мощности, вы можете сложить литиевые батареи, чтобы получить более высокое напряжение. Все литиевые батареи используют металлический литий в качестве анода и не подлежат перезарядке. По этой причине их также называют первичными литий-металлическими батареями. Катод может быть разным, но в наиболее распространенных литий-металлических батареях обычно используется диоксид марганца.
Хотя они не дают большой мощности, вы можете сложить литиевые батареи, чтобы получить более высокое напряжение. Все литиевые батареи используют металлический литий в качестве анода и не подлежат перезарядке. По этой причине их также называют первичными литий-металлическими батареями. Катод может быть разным, но в наиболее распространенных литий-металлических батареях обычно используется диоксид марганца.
Сотовые телефоны и другое портативное электронное оборудование обычно питаются от литий-ионного аккумулятора, который можно перезаряжать. Кроме того, литий-ионные батареи стали популярными для использования в электромобилях и крупных интеллектуальных сетях. В качестве анода в литий-ионных батареях используются литий-углеродные соединения. В качестве катода используются оксиды лития-металла.
5. Никель-кадмиевый или никель-кадмиевый аккумулятор Мы находим никель-кадмиевые аккумуляторы в электроинструментах, а также во многих небольших бытовых приборах. Электроды в этих батареях — гидроксид никеля и кадмия, а электролит — гидроксид калия.
Электроды в этих батареях — гидроксид никеля и кадмия, а электролит — гидроксид калия.
Никель-металлогидридные батареи также являются перезаряжаемыми и используются в устройствах с высоким коэффициентом разрядки, таких как цифровые камеры и игровые контроллеры. В этих батареях используются положительные электроды из оксигидроксида никеля, а в отрицательных электродах используется сплав, поглощающий водород.
7. Сухая угольно-цинковая батарея или стандартная угольная батареяЕсли вы покупаете продукт, в который «батарейки включены», велика вероятность того, что в нем есть угольно-цинковые батареи из-за их низкой стоимости. Как правило, в электродах используется металлический цинк и углеродный стержень, окруженный диоксидом марганца. Электролит изготовлен из пасты хлорида аммония.
Какие проблемы с батареями?источник
Нет идеальных продуктов. Всегда будет случайный бракованный кусок. Тем не менее, некоторые продукты имеют больше проблем, чем другие. Вот некоторые из основных проблем, с которыми обычно сталкиваются потребители при использовании батарей:
Всегда будет случайный бракованный кусок. Тем не менее, некоторые продукты имеют больше проблем, чем другие. Вот некоторые из основных проблем, с которыми обычно сталкиваются потребители при использовании батарей:
- Батареи могут загореться или даже взорваться : Хотя это происходит нечасто, если батарея неисправна и ее электроды соприкасаются друг с другом, батарея может произойти короткое замыкание, что приведет к сильному нагреву, возгоранию или взрыву.
- Аккумуляторы нельзя мочить : После того, как вода попала в аккумулятор, удалить ее практически невозможно, так как предохранительный клапан предотвращает утечку жидкости из аккумуляторов. Вода в аккумуляторе может привести к его неисправности. Быстро и правильно утилизируйте намокшие батареи.

- Батареи могут замерзнуть : На улице должно быть чертовски холодно, но если вы живете в районе с суровыми и холодными зимами, будьте осторожны. Батарея может замерзнуть примерно на 10 градусов ниже Фаренгейта, если она заряжена только наполовину.
- Аккумуляторы вредны для окружающей среды : Аккумуляторы, которые не утилизируются должным образом, могут в конечном итоге накапливаться и коррозировать, что позволяет их химическим веществам загрязнять нашу землю и воду. Эти химические вещества аккумуляторов не только вредны для наших экосистем, но и попадают в нашу питьевую воду и воздух, которым мы дышим. Не говоря уже о том, что литиевые батареи потенциально могут вызывать пожары на свалках и способствовать глобальному потеплению.
 Хорошей новостью является то, что батареи подлежат вторичной переработке. И это очень просто. У Energizer® есть сайт, который поможет вам найти места рядом с вами для переработки батарей. Вы также можете попробовать один из этих веб-сайтов:
Хорошей новостью является то, что батареи подлежат вторичной переработке. И это очень просто. У Energizer® есть сайт, который поможет вам найти места рядом с вами для переработки батарей. Вы также можете попробовать один из этих веб-сайтов:
- https://earth911.com
- https://www.call2recycle.org
Теперь, когда мы ответили на важный вопрос «как работают батареи», пришло время немного поразвлечься с вашими новыми знаниями. Попробуйте прогуляться по дому и посмотреть, сколько различных типов батарей вы используете. Затем, чтобы получить больше полезной информации о часто используемых бытовых товарах, ознакомьтесь с нашей статьей о лампочках, чтобы узнать, как вы можете сэкономить большие деньги.
Предоставлено вам justenergy.com
Все изображения предоставлены по лицензии Adobe Stock.
Рекомендуемое изображение:
Как работают батарейки?
Батарейки! Они не являются единственным решением климатического и энергетического кризиса, но они, безусловно, сыграют большую роль. Наряду с насосными гидроэлектростанциями они, вероятно, обеспечат большую часть накопления энергии, необходимой для устойчивого развития возобновляемых источников энергии в следующем десятилетии. И они постоянно становятся дешевле и эффективнее.
Кажется, почти каждую неделю анонсируется новый тип батареи — за последние 12 месяцев Cosmos охватывает квантовые батареи, бумажные батареи, батареи из целлюлозы и батареи из графена.
Самое время вернуться к основам: как работают батареи и какую роль они играют в энергосистеме?
Как работают батареи?
Если коротко, то в батареях происходит химическая реакция, в результате которой выделяется энергия. Энергия высвобождается в виде электричества, и подключение батареи к цепи позволяет произойти реакции.
Энергия высвобождается в виде электричества, и подключение батареи к цепи позволяет произойти реакции.
Чтобы понять немного более длинный ответ, стоит взглянуть на структуру атомов. Атомы имеют ядро, состоящее из положительно заряженных протонов и незаряженных нейтронов, окруженное облаком отрицательно заряженных электронов.
Рисунок атома лития: протоны (красные) и нейтроны (синие) в ядре, электроны (серые) со свистом носятся снаружи. Предоставлено: Ричи Бендалл — собственная работа, CC BY-SA 4.0, https://commons.wikimedia.org/w/index.php?curid=102688272Электроны могут легко перемещаться от одного атома к другому. Если вы можете перемещать электроны в постоянном потоке, вы можете создавать тепло, свет и множество других полезных вещей — с помощью электричества.
Батарея состоит из одного вещества или реагента, который поставляет электроны (называется анод ) и другой реагент, который их принимает (называемый катод ). Электроны передаются между реагентами через цепь в устройстве, которое вы пытаетесь запитать, позволяя электричеству течь.
Чтобы эта реакция работала, что-то положительно заряженное также должно двигаться от анода к катоду, чтобы уравновесить отрицательно заряженные электроны. Атомы с меньшим количеством электронов, чем протоны, называемые положительными ионами или катионами, выполняют эту работу.
Простой электрохимический элемент. Авторы и права: Эмануэле Оддо — собственная работа, CC BY-SA 4.0, https://commons.wikimedia.org/w/index.php?curid=80156641Положительные ионы движутся не по цепи, а по отдельной перемычке, соединяющей анод и катод. Это электролит – это может быть жидкий раствор или твердое вещество.
Весь этот процесс называется электрохимической ячейкой. Батареи могут использовать только одну ячейку или иметь несколько электрохимических ячеек, соединенных друг с другом.
Большинство коммерческих аккумуляторов на самом деле основаны на химических реакциях, которые являются более сложными, чем просто шунтирование электронов и положительного иона одного типа (включая ион лития). Могут быть задействованы несколько различных типов металлов, солей и других реагентов.
Могут быть задействованы несколько различных типов металлов, солей и других реагентов.
Но в конечном счете всем батареям нужны катод, анод и электролит.
В чем разница между незаряжаемой и перезаряжаемой батареей?
Из чего он сделан. В неперезаряжаемой батарее реакция, создающая электроны, работает только в одном направлении: как только вещество на катоде приняло электроны, оно уже не может вернуться в прежнее, безэлектронное состояние.
В перезаряжаемой батарее есть возможность обратить эту реакцию вспять. Внешний источник питания может удалять электроны с катода и добавлять их к аноду, оставляя их свежими и готовыми к повторной реакции.
Вещества, входящие в состав анода, катода и электролита, определяют, является ли реакция обратимой.
Вас интересует энергетика, технологии и научные разработки, на которых она основана? Тогда наш новый информационный бюллетень по электронной почте Energize , который скоро будет запущен, для вас. Нажмите здесь, чтобы стать первым подписчиком.
Нажмите здесь, чтобы стать первым подписчиком.
Почему аккумуляторы разряжаются?
Поскольку в батарее есть куча различных веществ, реагирующих друг с другом, чтобы заставить эти электроны течь, есть несколько возможностей, что что-то пойдет не так.
В результате химических реакций редко получаются именно те продукты, которые вам нужны — обычно есть небольшое количество побочных продуктов.
«Когда происходит эта химическая реакция, иногда она не полностью меняется, когда вы ее перезаряжаете. Это может привести к таким вещам, как рост дендритов, которые представляют собой своего рода рост крошечных кристаллов», — говорит профессор Лахлан Блэкхолл, руководитель программы по хранению аккумуляторов и интеграции сетей в Австралийском национальном университете.
«Со временем это эффективно снижает способность этой химической реакции продолжать происходить обратимым образом».
Получайте новости о научных новостях прямо на свой почтовый ящик.
Исследователи и производители все лучше находят химические составы батарей с полностью обратимыми реакциями, которые практически не прекращаются с течением времени.
Гарантия на батарею Tesla в Hornsdale Power Reserve в Южной Австралии, например, составляет 15 лет, но оператор Neoen уверен, что батареи по-прежнему сохранят большую часть своей емкости в это время и смогут работать дольше в зависимости от этого. от конъюнктуры рынка и других факторов.
Аккумуляторы Tesla Powerpack в сентябре 2017 года перед их установкой в Хорнсдейле. Предоставлено: Марк Брейк / Стрингер. В чем разница между батареей телефона и батареей сетевого масштаба?
«Во многих случаях они на самом деле идентичны по химическому составу, — говорит Блэкхолл.
«Аккумулятор масштаба сети, он просто состоит из сотен или тысяч маленьких литий-ионных элементов, но упакован и управляется в аккумуляторном модуле».
Большие батареи не являются отдельными гальваническими элементами. На самом деле они представляют собой серию более мелких единиц, выстроенных в линию в одном месте.
Тем не менее, это не гарантирует, что ваш телефон идентичен сетевому аккумулятору. Все требования к батарее сообщают, из чего она может быть сделана. Например, вес является абсолютно важной характеристикой автомобильного аккумулятора, но он менее важен для статической домашней батареи. Там вы можете использовать более дешевые, но более тяжелые материалы.
Все требования к батарее сообщают, из чего она может быть сделана. Например, вес является абсолютно важной характеристикой автомобильного аккумулятора, но он менее важен для статической домашней батареи. Там вы можете использовать более дешевые, но более тяжелые материалы.
Возникает другой вопрос:
Зачем батареям нужен литий?
Будут ли литий-ионные аккумуляторы всегда оставаться золотым стандартом? Можем ли мы сделать их из более дешевого вещества?
Причина, по которой литий называют «королевой аккумуляторов», заключается в его основном химическом составе. Как самый легкий металл, содержащий всего три протона, литий, по сути, гарантированно является наиболее энергоемким способом изготовления батареи. (Чтобы узнать больше о важности и распространенности лития, смотрите наш брифинг Cosmos.)
Таким образом, там, где необходимо минимизировать вес или размер (читай: во всем, что должно двигаться), маловероятно, что литиевые батареи будут вытеснены.
Но сетевые батареи и домашние батареи могут быть намного больше и тяжелее, чем автомобильные или телефонные батареи. Например, натрий экономически выгоднее лития в этом диапазоне.
Проточные батареи также начинают использоваться в качестве больших батарей. Проточные батареи имеют совершенно другую структуру, чем традиционные батареи — они никогда не разрядятся и могут очень эффективно работать без лития. Ванадий является здесь особенно популярным кандидатом.
С другой стороны, небольшая электроника не обязательно нуждается в мощных батареях. Здесь мы можем подойти к химии еще более творчески — например, используя биоразлагаемые материалы, такие как бумага и полимеры на основе углерода.
Как они работают в сети?
Гидронасосы — более дешевый способ хранения энергии, чем батареи. Но у аккумуляторов есть особенность, которая дает им ключевое преимущество при передаче энергии: они могут почти мгновенно передавать энергию в сеть.
Но у аккумуляторов есть особенность, которая дает им ключевое преимущество при передаче энергии: они могут почти мгновенно передавать энергию в сеть.
«Химические реакции могут протекать достаточно быстро, поэтому вы можете очень быстро получать ток от элемента», — говорит Блэкхолл.
«Ваш результат может быть почти мгновенным».
Даже самые быстрые формы генераторов на ископаемом топливе не могут сравниться с этим, например, газовые электростанции, используемые для получения пиковой энергии.
«Газовые пики, им может потребоваться 15 минут, чтобы перейти от нулевой мощности к выходной мощности, просто потому, что вам нужно раскрутить турбину», — говорит Блэкхолл.
В настоящее время электросеть спроектирована с учетом такого времени. Но по мере дальнейшего преобразования наших энергетических систем мы, возможно, сможем стать более гибкими.
«Поскольку вы можете так быстро управлять батареями, мы можем даже получить новую парадигму работы для нашей системы электроснабжения, как только мы полностью отключим все синхронные генераторы», — говорит Блэкхолл.
Как устроена батарея. Инженерное мышление
Батареи, мы используем их каждый день по всему миру, но как они работают? Об этом мы расскажем в этой статье, спонсируемой Squarespace. Перейдите на сайт sqarespace.com, чтобы начать бесплатную пробную версию, или используйте инженерное мышление, чтобы сэкономить 10 % на веб-сайтах и доменах.
АккумуляторыПрокрутите вниз, чтобы посмотреть видео на YouTube.
Что такое батарея?
Аккумулятор — это устройство, используемое для хранения энергии, когда она нам нужна. Мы используем их для питания небольших электрических устройств, таких как фонарики. Энергия хранится в виде химической энергии, и ее можно превратить в электрическую энергию, когда она нам понадобится. Мы увидим, как это работает чуть позже в статье.
Цепь батареи и лампы Если мы посмотрим на простую цепь батареи и лампы. Чтобы зажечь лампу, нам нужно, чтобы через нее протекали электроны. Батарея будет обеспечивать толкающую силу, позволяющую электронам течь через лампу. Нам просто нужно подключить лампу к положительной и отрицательной клеммам батареи, чтобы замкнуть цепь. Батарея может выталкивать электроны только в течение определенного периода времени, это время зависит от того, сколько энергии хранится внутри батареи и сколько требуется нагрузке.
Нам просто нужно подключить лампу к положительной и отрицательной клеммам батареи, чтобы замкнуть цепь. Батарея может выталкивать электроны только в течение определенного периода времени, это время зависит от того, сколько энергии хранится внутри батареи и сколько требуется нагрузке.
Когда мы говорим о нагрузке в электрической цепи, мы имеем в виду любые компоненты, для работы которых требуется электричество, например резисторы, светодиоды, двигатели постоянного тока или даже целые печатные платы. Некоторые батареи можно перезаряжать, и это будет четко указано сбоку, но типичная бытовая щелочная батарея не может, поэтому ее просто утилизируют, когда в ней заканчивается энергия. Они могут быть переработаны, поэтому убедитесь, что вы утилизируете их ответственно.
Между прочим, если вы хотите узнать, как работает двигатель постоянного тока, мы уже подробно рассказывали об этом ранее — посмотрите ЗДЕСЬ.
Что внутри батареи?
Типичная щелочная батарея на 1,5 В выглядит примерно так, но цвета зависят от производителя. Когда мы смотрим на батарею, у нас обычно есть пластиковая обертка, плотно прикрепленная к внешней стороне, она изолирует батарею, но также сообщает нам важную информацию, такую как емкость и напряжение, а также то, какой конец является положительным, а какой отрицательным.
Когда мы смотрим на батарею, у нас обычно есть пластиковая обертка, плотно прикрепленная к внешней стороне, она изолирует батарею, но также сообщает нам важную информацию, такую как емкость и напряжение, а также то, какой конец является положительным, а какой отрицательным.
Положительный конец известен как катод и имеет расширенную поверхность, выступающую наружу.
Положительный конецОтрицательный конец будет плоским, отрицательный конец известен как анод. Эти две клеммы электрически изолированы друг от друга.
Negative EndПод оберткой находится основной кожух, который обычно изготавливается из стали с никелированием. Это удерживает все внутренние компоненты на месте и предотвращает их взаимодействие с элементами атмосферы, такими как воздух и вода.
Under Wrapper Внутри корпуса у нас есть несколько слоев различных материалов, эти материалы специально отобраны, потому что их химические реакции создают определенные уровни напряжения и тока. Первый слой — это катод, представляющий собой смесь оксида марганца (MnO2) и графита. Этот материал находится в контакте с металлом положительной клеммы. Графит добавляется для улучшения проводимости смеси и увеличения плотности энергии.
Первый слой — это катод, представляющий собой смесь оксида марганца (MnO2) и графита. Этот материал находится в контакте с металлом положительной клеммы. Графит добавляется для улучшения проводимости смеси и увеличения плотности энергии.
Затем мы находим слой пористого материала, обычно волокнистой бумаги, который образует барьер. Барьер предотвращает прямой контакт материалов анода и катода друг с другом, что помогает батарее дольше работать, когда она не используется. Если бы барьера не было, то произошло бы короткое замыкание батареи. Микроскопические отверстия внутри материала позволяют атомам ионов проходить сквозь него. Мы рассмотрим это более подробно позже в этой статье.
БарьерЖидкий электролит из гидроксида калия затем распыляется на сепаратор во время производственного процесса, который пропитывает его и впитывается в материал анода. Используемый электролит является щелочным, поэтому мы называем этот тип батареи щелочной батареей.
Electrolyte Liquid Spray На другой стороне барьера у нас есть анод, который представляет собой пасту, изготовленную из порошка цинка (Zn), а также гелеобразователя. Желирующий агент просто удерживает цинк во взвешенном состоянии, поэтому он не скапливается в одном месте. Цинк находится в форме порошка для увеличения площади поверхности материала, что снижает внутреннее сопротивление и, таким образом, улучшает перенос электронов.
Желирующий агент просто удерживает цинк во взвешенном состоянии, поэтому он не скапливается в одном месте. Цинк находится в форме порошка для увеличения площади поверхности материала, что снижает внутреннее сопротивление и, таким образом, улучшает перенос электронов.
Стальная капсула закрыта нейлоновой пластиковой крышкой. Затем в цинк вставляется латунный штифт, на который надевается стальной колпачок. Это дает нам отрицательную клемму. Обратите внимание, что положительные и отрицательные клеммы разделены пластиковой крышкой. Это гарантирует, что они электрически изолированы друг от друга, в противном случае электроны могут пройти через корпус и достичь положительной клеммы, что приведет к короткому замыканию батареи.
Разделение положительного и отрицательногоОсновы электричества
Нам нужно понять некоторые основы того, как работает электричество, прежде чем мы сможем понять аккумулятор.
Во-первых, электричество — это поток электронов в цепи. Батареи могут обеспечить толкающую силу, которая перемещает электроны по цепи. Электроны хотят вернуться к своему источнику, и они немедленно пойдут по любому пути, чтобы достичь этого. Помещая такие вещи, как лампы, на пути электронов, мы можем заставить их выполнять работу за нас, например, освещать лампу.
Батареи могут обеспечить толкающую силу, которая перемещает электроны по цепи. Электроны хотят вернуться к своему источнику, и они немедленно пойдут по любому пути, чтобы достичь этого. Помещая такие вещи, как лампы, на пути электронов, мы можем заставить их выполнять работу за нас, например, освещать лампу.
Батареи производят электричество постоянного или постоянного тока. Это означает, что электроны текут только в одном направлении от отрицательного к положительному. Осциллограф покажет постоянный ток в виде плоской линии в положительной области. Вы можете думать об электричестве постоянного тока как о реке, которая течет только в одном направлении.
Постоянный ток В этих анимациях мы показываем поток электронов, который идет от отрицательного к положительному, но вы, возможно, привыкли видеть обычный ток, который идет от положительного к отрицательному. Электронный поток — это то, что происходит на самом деле, но обычный ток был исходной теорией, которая до сих пор широко используется и преподается по сей день. Просто знайте о двух и о том, какой из них мы используем.
Просто знайте о двух и о том, какой из них мы используем.
Электричество, которое вы получаете от электрических розеток в своих домах, представляет собой электричество переменного или переменного тока, это отличается от электричества, обеспечиваемого аккумулятором. При переменном токе электроны непрерывно текут вперед и назад, подобно морскому приливу, который течет между приливом и отливом. Осциллограф покажет переменный ток как волну, проходящую как через положительную, так и через отрицательную области, потому что она течет вперед, это положительно, и назад, это отрицательно.
Переменный токЕсли мы посмотрим на отрезок медного провода, внутри него мы обнаружим атомы меди. В центре атома у нас есть протоны и нейтроны, протоны заряжены положительно, а нейтроны считаются нейтральными, поэтому они не имеют заряда. Вокруг них вращаются электроны, электроны заряжены отрицательно.
Медная проволока Некоторые из этих электронов могут свободно перемещаться к другим атомам. Они будут естественным образом перемещаться между другими атомами, но в случайных направлениях, что для нас бесполезно. Нам нужно, чтобы много электронов текло в одном направлении, и мы можем сделать это, обеспечив разность напряжений от источника питания, такого как батарея.
Они будут естественным образом перемещаться между другими атомами, но в случайных направлениях, что для нас бесполезно. Нам нужно, чтобы много электронов текло в одном направлении, и мы можем сделать это, обеспечив разность напряжений от источника питания, такого как батарея.
Когда мы говорим об атомах, вы часто будете слышать термин «ион». Ион — это просто атом, который имеет неравное количество электронов или протонов. Атом имеет нейтральный заряд, когда в нем одинаковое количество протонов и электронов, потому что протоны заряжены положительно, а электроны отрицательно заряжены, поэтому они уравновешиваются. Если в атоме больше электронов, чем протонов, то это отрицательный ион. Если в атоме больше протонов, чем электронов, то это положительный ион.
Ион Напряжение похоже на давление в резервуаре с водой. Чтобы узнать, какое у нас давление, мы должны сравнить давление внутри трубы с давлением снаружи, и для этого мы используем манометр. Когда дело доходит до напряжения, мы используем вольтметр для измерения разницы напряжения между двумя разными точками. Если мы измерим разницу между батареями, мы получим 1,5 В, но если мы измерим тот же конец, мы получим 0 В, потому что это тот же конец, поэтому разницы нет.
Если мы измерим разницу между батареями, мы получим 1,5 В, но если мы измерим тот же конец, мы получим 0 В, потому что это тот же конец, поэтому разницы нет.
Некоторые материалы позволяют электронам легко проходить через них, они известны как проводники. Примерами этого являются медь и большинство металлов. Другие материалы не пропускают электроны, они известны как изоляторы. Примерами этого являются резина и большинство пластмасс. Поэтому мы используем медные провода с резиновой изоляцией. Медь переносит электричество туда, где оно нам нужно, а резина защищает нас.
Смешивая определенные материалы, мы можем вызывать химические реакции. Это когда атомы одного материала взаимодействуют с атомами другого материала и во время этого взаимодействия атомы будут связываться или распадаться, электроны также могут быть захвачены или освобождены атомами в ходе химической реакции.
Хорошо, теперь, когда мы рассмотрели основы, давайте заглянем внутрь батареи и посмотрим, как она работает.
Как работает щелочная батарея?
Помните, мы кратко говорили об атомах. Ну, все эти материалы внутри батареи состоят из множества различных атомов, плотно упакованных вместе. Они представлены цветными шариками, каждый цвет которых соответствует разному материалу и, следовательно, разному атому для нашего очень упрощенного примера. Когда мы объединим все эти материалы вместе внутри капсулы, мы получим небольшую химическую реакцию, в которой атомы начнут взаимодействовать друг с другом.
Внутри батареиПрежде всего, атом иона гидроксида в электролите соединяется с атомом цинка в анодной части. Эта химическая реакция известна как окисление и создаст гидроксид цинка, поскольку соединение цинка и гидроксида высвобождает электроны. Эти электроны теперь могут свободно двигаться и будут собираться на латунном штифте.
В то же время атом оксида марганца соединяется с молекулой воды из электролита, а также со свободным электроном в химической реакции, известной как восстановление. Во время химической реакции оксид марганца превращается в немного другую версию оксида марганца, этой версии больше не нужен атом иона гидроксида, поэтому он выбрасывает его в электролит. Атом воды замещается атомом, выброшенным из реакции окисления. Ион гидроксида теперь свободен и может пройти через сепаратор. Но пока не будет, потому что в анодной секции для него нет места.
Во время химической реакции оксид марганца превращается в немного другую версию оксида марганца, этой версии больше не нужен атом иона гидроксида, поэтому он выбрасывает его в электролит. Атом воды замещается атомом, выброшенным из реакции окисления. Ион гидроксида теперь свободен и может пройти через сепаратор. Но пока не будет, потому что в анодной секции для него нет места.
Итак, как вы можете видеть, у нас есть накопление электронов на отрицательном выводе. Поскольку электроны заряжены отрицательно, и теперь у нас больше электронов на отрицательной клемме, чем на положительной, это означает, что у нас есть разница в напряжении между двумя концами, и мы можем измерить эту разницу с помощью мультиметра.
Помните, что мы можем измерить только разницу в напряжении между двумя разными точками. Если мы измерим одну и ту же точку, мы получим ноль вольт, потому что разницы нет.
Электроны отталкиваются друг от друга и хотят переместиться в область с меньшим количеством электронов. В положительной области меньше электронов, поэтому они попытаются добраться до этой клеммы. Сепаратор не позволяет им течь внутрь аккумулятора и достигать положительной клеммы.
В положительной области меньше электронов, поэтому они попытаются добраться до этой клеммы. Сепаратор не позволяет им течь внутрь аккумулятора и достигать положительной клеммы.
Следовательно, электронам нужен другой путь. Если мы предоставим электронам внешний путь, такой как провод, электроны будут течь по нему, чтобы добраться до положительной клеммы. Помещая такие вещи, как лампа, на пути электронов, электроны должны будут пройти через нее, и поэтому мы заставляем их выполнять работу за нас, например, освещать лампу.
Зажигание лампыПока у нас есть замкнутая цепь между клеммами, химическая реакция будет продолжаться, и электроны текут от отрицательной клеммы. Если мы удалим провод или разомкнем цепь, то химическая реакция прекратится.
Итак, давайте вспомним происходящую химическую реакцию. Свободные электроны попадают в батарею через положительный полюс. Это объединяется с оксидом марганца и молекулой воды на катоде, который высвобождает ион гидроксида в электролит.
Ион гидроксида проходит через сепаратор и соединяется с атомом цинка, образуя гидроксид цинка, при этом высвобождаются электроны и молекула воды. Электроны хотят добраться до области с меньшим количеством электронов, положительный полюс имеет меньше электронов, поэтому они будут течь по проводу, чтобы достичь этого, и поэтому химическая реакция непрерывно повторяется снова и снова.
Однако внутри батареи содержится лишь определенное количество материала, поэтому со временем химическая реакция будет продолжаться все труднее и труднее, и в конечном итоге электроны перестанут течь. Аккумулятор больше не будет использоваться, и его необходимо утилизировать.
Соединение батарей вместе
Мы можем использовать батарею для питания некоторых компонентов, но обычно одной батареи недостаточно для питания наших устройств, для этого нам нужно объединить батареи.
Аккумуляторы можно подключать двумя способами. Серийно или параллельно. Ранее мы подробно рассмотрели эти типы схем, посмотрите серию ЗДЕСЬ, и параллельную ЗДЕСЬ.
Когда мы соединяем батареи последовательно, напряжение каждой батареи суммируется. Таким образом, две батареи по 1,5 В дают нам 3 В, а 3 батареи дают нам 4,5 В и т. д. Фактическое напряжение может немного отличаться в реальном мире. Напряжение увеличивается, потому что каждая батарея ускоряет входящие в нее электроны, поэтому мы получаем более высокое напряжение.
ПараллельноЕсли мы подключим батареи параллельно, то мы получим только 1,5 В, независимо от того, сколько мы подключим. Это потому, что путь сливается на подаче, но разделяется на обратном пути, поэтому электроны не будут ускоряться. Однако этот тип конфигурации сможет обеспечить больший ток, а также будет иметь большую емкость, поэтому мы сможем питать что-то дольше. Например, если батарея имела емкость 1200 мАч и мы поставили две параллельно, у нас будет емкость 2400 мАч, но напряжение 1,5 В. Если мы подключим их последовательно, у нас будет емкость 1200 мАч, но напряжение 3 В.
Серия и параллельЕмкость
Мы используем батареи для питания наших цепей. Но как долго батарея может питать нашу схему? Когда мы смотрим на упаковку или лист данных для батареи, мы видим значение с буквами m.A.h рядом с ним. Это рейтинг в миллиампер-часах.
Но как долго батарея может питать нашу схему? Когда мы смотрим на упаковку или лист данных для батареи, мы видим значение с буквами m.A.h рядом с ним. Это рейтинг в миллиампер-часах.
Например, этот имеет номинал 2500 мАч. Это означает, что теоретически он может обеспечить ток 2500 миллиампер в час, или 1250 мА в течение 2 часов, или 20 мА в течение 125 часов. Однако в реальной жизни это, вероятно, не продлится так долго, потому что химическая реакция замедляется, поэтому внутреннее сопротивление батареи меняется по мере ее разрядки. Есть много других вещей, которые влияют на это, например, возраст и температура.
Нет реального способа точно рассчитать продолжительность жизни, лучше всего просто проверить ее. Однако мы можем оценить срок службы по следующей формуле:
Срок службы батареи = Емкость (мАч) / ток цепи (мА).
На нашем веб-сайте мы создали простой бесплатный калькулятор, с помощью которого вы можете рассчитать время работы аккумулятора, а также необходимую емкость. Проверьте это ЗДЕСЬ .
Проверьте это ЗДЕСЬ .
Так, например, в этой схеме мы вычисляем спрос 19мА, а батарея имеет емкость 3000 мАч. Итак, 3000/19 дает нам 157,9 часа. Это действительно лучший сценарий, и на самом деле он почти наверняка не достигнет этого.
Срок службы батареиКак измерить с помощью мультиметра
Чтобы измерить напряжение, мы просто выбираем функцию постоянного тока на нашем мультиметре, а затем подключаем красный провод к положительной клемме, а черный провод к отрицательной. Это даст нам показания напряжения.
Номинальное значение батареиВы можете видеть, что эта батарея рассчитана на 1,5 В, но когда мы протестировали ее, мы получили 1,593 В
Батарея разряженаКогда батарея разряжена, мы получаем более низкое напряжение, это показывает 1,07 В, поэтому она полностью разряжена.
Однако иногда мы могли получить напряжение около 1,5 В, даже если батарея разряжена.
Чтобы полностью протестировать батарею, нам нужно протестировать ее под нагрузкой, чтобы проверить, может ли она еще быть полезной. Для этого нам понадобится резистор.
Для этого нам понадобится резистор.
Итак, мы берем резистор около 100 Ом, хотя это не обязательно должно быть точно такое значение, но мы подключаем резистор между нашими двумя щупами. В этом случае мы просто использовали несколько зажимов типа «крокодил», чтобы соединить резистор между щупами, вот так.
Таким образом, ток будет протекать через резистор, и мы сможем снять показания напряжения, когда это произойдет. Если батарея еще в порядке, то уровень напряжения снизится лишь незначительно.
Пример батареиНапример, эта батарея имеет номинальное напряжение 1,5 В, без нагрузки 1,593 В, с подключенным резистором 1,547 В, так что это все еще хорошо.
Пример батареиЭта батарея также рассчитана на 1,5 В, когда мы измеряем ее без нагрузки, она показывает точно 1,5 В, но когда мы подключаем резистор, она падает до 0,863 В, поэтому мы знаем, что она разрядилась.
Батарея разряжена Но теперь, когда вы полностью заряжены, оформите заказ Squarespace. com , чтобы создать свое собственное веб-присутствие в Интернете, которое содержит функции, позволяющие людям запускать, делиться и продвигать свои собственные проекты.
com , чтобы создать свое собственное веб-присутствие в Интернете, которое содержит функции, позволяющие людям запускать, делиться и продвигать свои собственные проекты.
Мощные инструменты для ведения блога, чтобы демонстрировать фотографии, видео и обновления ваших проектов.
Вы можете легко планировать встречи для занятий и сессий с членами команды и клиентами с помощью встроенного инструмента. И вы даже можете собирать платежи или пожертвования, чтобы помочь поддержать ваше дело.
Посетите сайт Squarespace.com, чтобы получить бесплатную пробную версию, а когда будете готовы к запуску, перейдите по адресу Squarespace.com/engineeringmindset , чтобы сэкономить 10% на первой покупке веб-сайта или домена.
Что делает автомобильный аккумулятор и как он работает?
Традиционные свинцово-кислотные автомобильные аккумуляторы в настоящее время могут быть упущены из виду из-за безумия по поводу литий-ионных аккумуляторов для электромобилей, но эти маленькие ребята представляют собой бесценные чудеса инженерной мысли, которые десятилетиями помогали транспортным средствам питаться.
Без сложных химических реакций внутри 12-вольтовой аккумуляторной батареи вашего автомобиля вы даже не смогли бы завести автомобиль или тем более выключить электрические стеклоподъемники. Читайте дальше, чтобы узнать об оригинальных способах работы вашего автомобильного аккумулятора и о том, как он объединяется с генератором автомобиля, чтобы сделать ваш автомобиль лучшим местом для времяпрепровождения.
Как работает автомобильный аккумулятор 12 В?
Автомобильный аккумулятор работает с химическими реакциями. По сути, он переносит электроны между анодом (отрицательным выводом) туда, где они на самом деле хотят быть: катод (положительный вывод). Например, свинцово-кислотная батарея, используемая в большинстве автомобилей, получила свое название из-за того, что в ней используются пластины из диоксида свинца (и чистого свинца), погруженные в смесь воды и серной кислоты.
Эти аккумуляторы на самом деле имеют шесть элементов, каждый из которых вырабатывает около 2 В, поэтому автомобильные аккумуляторы обычно называют аккумуляторами на 12 В, хотя они не совсем 12 В. Каждая из этих шести ячеек состоит из пластин из диоксида свинца (положительный катод) и свинцовых пластин (отрицательный анод), которые погружаются в смесь серной кислоты и воды, чтобы вызвать химические реакции, которые в конечном итоге помогут батарее высвобождать электричество.
Каждая из этих шести ячеек состоит из пластин из диоксида свинца (положительный катод) и свинцовых пластин (отрицательный анод), которые погружаются в смесь серной кислоты и воды, чтобы вызвать химические реакции, которые в конечном итоге помогут батарее высвобождать электричество.
Имейте в виду, что батарея состоит из шести элементов, и каждый из них имеет различные пластины. Но в основе этого процесса лежит взаимодействие между положительной и отрицательной клеммами. Когда диоксид свинца катода взаимодействует с сульфатом в кислой смеси, ионы кислорода высвобождаются в смесь, где они взаимодействуют с водородом с образованием воды. Между тем, с отрицательной стороны, сульфат реагирует со свинцом в аноде, создавая слой сульфата свинца на аноде и высвобождая электроны.
Эти электроны накапливаются в отрицательной клемме и определенно не хотят там находиться, но они не могут проходить через раствор электролита, поэтому они направляются через отрицательную клемму и через цепь, пока в конечном итоге не достигнут положительной клеммы. Это основной принцип работы автомобильного аккумулятора, так как все остальные вспомогательные устройства в вашем автомобиле подключаются к этой цепи.
Это основной принцип работы автомобильного аккумулятора, так как все остальные вспомогательные устройства в вашем автомобиле подключаются к этой цепи.
Но это работает только при выключенной машине; в противном случае то, что на самом деле питает электронику вашего автомобиля, — это генератор переменного тока. Аккумулятор, по сути, находится в вашем автомобиле для питания стартера, когда автомобиль выключен, но как только стартер оживляет двигатель, генератор вступает во владение. Генератор переменного тока также заряжает батарею за счет реверсирования процессов, которые привели к ее разрядке.
Что делает генератор?
Как было сказано ранее, генератор переменного тока в основном выполняет работу, которую, по мнению людей, постоянно выполняет батарея. Помните, что аккумулятор быстро разряжается, если ему приходится питать все ваши стеклоподъемники, радио и вообще любое другое электронное устройство в вашем автомобиле. Итак, решение этой проблемы весьма изобретательно.
Инженеры установили в ваш автомобиль генератор переменного тока, работающий от двигателя вместо аккумулятора. Он производит достаточно электроэнергии для питания всех электрических битов вашего автомобиля. Самое замечательное в генераторе переменного тока то, что он также заряжает аккумулятор при работающем двигателе автомобиля, потому что аккумулятор действительно сильно разряжается после выполнения своей работы по запуску двигателя.
Единственная проблема генератора переменного тока заключается в том, что он вырабатывает переменный ток, который необходимо преобразовать в постоянный. Чтобы решить эту проблему, переменный ток обрабатывается выпрямителем, что позволяет генератору переменного тока выкачивать требуемый постоянный ток.
Когда генератор выходит из строя, вы начинаете повсюду замечать признаки этого. Например, электроника вашего автомобиля не будет работать правильно, и ваши фары могут внезапно погаснуть. В этих условиях ваш автомобиль может начать выдавать кучу кодов, и даже если вы подключите его к приложению OBD2, он, вероятно, не определит, что проблема на самом деле в генераторе или аккумуляторе.
Что еще хуже, во многих транспортных средствах используются усовершенствованные модули, которые откалиброваны для работы с очень малыми допусками. Если ваш генератор или аккумулятор вышли из строя, весь автомобиль может начать работать хаотично и выдавать коды, совершенно не связанные с реальной проблемой: неисправность аккумулятора или генератора.
Является ли автомобильный аккумулятор таким же, как аккумулятор электромобиля?
Нет, это не то же самое, что аккумулятор в вашем электромобиле. Свинцово-кислотные аккумуляторы значительно отличаются от литий-ионных аккумуляторов вашего электромобиля. Прежде всего, как вы уже узнали, состав свинцово-кислотных аккумуляторов в основном состоит из свинца и смеси воды и серной кислоты. С другой стороны, литий-ионные батареи состоят из таких материалов, как литий, кобальт и графит.
Кроме того, литий-ионные аккумуляторы имеют более высокую плотность энергии, чем свинцово-кислотные аккумуляторы, что особенно идеально подходит для высокопроизводительных электромобилей и электроники, где крайне важны компактность и вес.
Свинцово-кислотные батареи также имеют меньший жизненный цикл по сравнению с литий-ионными батареями. Это означает, что вы можете заряжать и разряжать литий-ионный аккумулятор во много раз чаще, чем свинцово-кислотный аккумулятор. Это, безусловно, огромный плюс для использования в электромобилях, где батарея является наиболее важным и дорогим компонентом, а некачественный жизненный цикл сделает ее бесполезной. Свинцово-кислотные батареи также требуют регулярного обслуживания, чтобы поддерживать их работу, в то время как литий-ионные батареи относительно не требуют обслуживания в течение всего срока службы.
Легко понять, почему литий-ионные батареи используются в электромобилях вместо традиционных свинцово-кислотных батарей. Если бы в электромобилях использовались свинцово-кислотные батареи, они были бы безумно тяжелыми и маломощными.
Свинцово-кислотные аккумуляторы все еще имеют свое место
Несмотря на недостатки, связанные со свинцово-кислотными аккумуляторами, они занимают свое место в автомобильной среде. Их относительно низкая стоимость по сравнению с литий-ионными батареями гарантирует, что они будут продолжать использоваться в автомобилях с бензиновым двигателем и других устройствах, где первоначальная стоимость является важным фактором.
Их относительно низкая стоимость по сравнению с литий-ионными батареями гарантирует, что они будут продолжать использоваться в автомобилях с бензиновым двигателем и других устройствах, где первоначальная стоимость является важным фактором.
Эти аккумуляторы используются в транспортных средствах уже много лет, и хотя литий-ионная технология является блестящей новинкой, свинцово-кислотные аккумуляторы всегда будут занимать свое место в автомобильной истории.
Понимание того, как работают батареи
Батареи питают все, от кардиостимуляторов, спасающих жизнь, до мобильных телефонов, которые облегчают жизнь. Они также позволяют нам транспортировать электроэнергию туда, где она нам нужна, от Южного полюса до Амазонки и повсюду между ними, обеспечивая свет, тепло, связь и многое другое. Батареи питают все, от спасательных кардиостимуляторов до наших облегчающих жизнь сотовых телефонов. . Они также позволяют нам транспортировать электроэнергию туда, где она нам нужна, от Южного полюса до Амазонки и повсюду между ними, обеспечивая свет, тепло, связь и многое другое.
Почти каждый из нас в какой-то момент полагался на батарейки, возможно, хватаясь за фонарик во время отключения электроэнергии. Наша взаимосвязь с батареями означает, что мы редко останавливаемся, чтобы спросить: «Как работают батареи?» Это руководство охватывает все, что вам нужно знать об аккумуляторах, начиная с их появления в 18 веке и заканчивая тем, почему вам не следует заряжать холодный автомобильный аккумулятор.
Знакомство с батареямиБатареи дают нам портативный электрический ток или электричество и возможность накапливать энергию. Энергия вездесуща во Вселенной в различных формах.
Электричество — это движение электронов между атомами, когда электроны сталкиваются друг с другом, создавая электрический поток. Батареи не хранят электричество — они хранят электрическую энергию в химических веществах, содержащихся в батарее. Что делает батарея, так это преобразует накопленную химическую энергию в электрический ток.
Как работают батареи? Давайте рассмотрим классическую батарейку типа АА, которая обычно используется в пультах дистанционного управления, игрушках и многом другом. На одном конце батареи находится отрицательный конец, называемый 9.0007 анод . На другом конце находится положительный конец, называемый катодом . И анод, и катод также известны как электроды или электрические клеммы.
На одном конце батареи находится отрицательный конец, называемый 9.0007 анод . На другом конце находится положительный конец, называемый катодом . И анод, и катод также известны как электроды или электрические клеммы.
Корпус батареи разделяет отрицательный и положительный электроды. Внутри корпуса батареи находятся электролиты, которые действуют как своего рода барьер между анодом и катодом. Эти три части образуют так называемый электрохимический элемент — два электрода (анод и катод) — разделенные электролитом (корпус батареи). Аккумулятор состоит из нескольких таких элементов.
Когда батарея бездействует, не образуя электрической цепи, электролиты и электроды бездействуют. Как только вы замыкаете цепь, например, вставив батарейку в фонарик и включив его, начинается химическая реакция.
Анод, наш отрицательный электрод, реагирует с электролитами и производит электроны, которые накапливаются на отрицательном полюсе батареи. Анод обычно изготавливается из материала, который любит отдавать электроны, также известного как окисленный или окисленный материал.
На положительной клемме катодный электрод вступает в реакцию с электролитами, создавая ионы — атомы со слишком малым или слишком большим количеством электронов. Катод сделан из оксида металла, который собирает как ионы, так и электроны.
Как говорится, противоположности притягиваются. Электроны стремятся пройти от отрицательного вывода (анода) к положительному полюсу (катоду). Электролиты действуют как барьер для электронов, и электроны не могут проходить через корпус батареи. При этом заряженные ионы протекают через раствор электролита, находящийся в контакте с обоими электродами.
С нашим фонариком делаем внешнюю цепь, когда вставляем батарейки и включаем фонарик. Заблокированный поток электронов ищет путь наименьшего сопротивления. Электроны хотят покинуть анод и отправиться к катоду.
Наши электроны обнаруживают, что внешняя цепь предлагает путь наименьшего сопротивления для движения по созданной нами внешней цепи. Они текут от анода через провода фонарика и лампочку к катоду. Они рекомбинируют с ионами на положительной клемме, чтобы замкнуть цепь и зажечь лампочку в пути. Помните, электричество — это движение электронов между атомами.
Они рекомбинируют с ионами на положительной клемме, чтобы замкнуть цепь и зажечь лампочку в пути. Помните, электричество — это движение электронов между атомами.
Этот процесс известен как восстановление-окисление или окислительно-восстановительная реакция, научный термин для любой реакции, связанной с обменом электронами.
Электролит батареи может провести эту химическую реакцию только определенное количество раз, прежде чем он перестанет производить ионы, и батарея разрядится.
Что внутри батареи?Мы рассмотрели три основные части батареи: отрицательный электрод (анод), положительный электрод (катод) и электролиты, разделяющие эти электроды.
Давайте посмотрим на компоненты щелочно-диоксид-марганцевой батареи размера AA, также известной как щелочные батареи.
Внешне батарея имеет положительный и отрицательный электроды со стальным покрытием, а основной стальной корпус покрыт этикеткой из ПВХ.
Внутри батарея имеет латунный стержень, действующий как центральный стержень, который действует как токосъемник. Этот латунный стержень окружен сепаратором, чтобы он не попал в раствор электролита. В аккумуляторе есть два типа электролитов — анод имеет гель порошкообразного цинка, а катод — диоксид марганца. Также есть различные уплотнения и шайбы.
Этот латунный стержень окружен сепаратором, чтобы он не попал в раствор электролита. В аккумуляторе есть два типа электролитов — анод имеет гель порошкообразного цинка, а катод — диоксид марганца. Также есть различные уплотнения и шайбы.
Батареи с разными материалами электродов и электролитов вызывают разные химические реакции. Они влияют на то, как работает батарея, от ее напряжения до емкости накопления энергии. Например, не было бы потока электронов, если бы мы использовали тот же материал для электродов.
Чтобы узнать больше, посмотрите это видео о процессе изготовления батареи.
У меня есть реферальный код
? Если вас направил другой клиент Amigo Energy, введите его личный реферальный код, чтобы получить кредит. Принять условия.
Различные типы батарейисточник
Существует множество типов батарей. Первое различие, которое необходимо сделать, заключается в том, является ли батарея основной батареей или вторичной батареей. Существует много типов батарей. Первое различие, которое необходимо сделать, заключается в том, является ли батарея основной батареей или вторичной батареей.
Существует много типов батарей. Первое различие, которое необходимо сделать, заключается в том, является ли батарея основной батареей или вторичной батареей.
Проще говоря, первичная батарея не перезаряжается, а вторичная батарея перезаряжается. Вообще говоря, первичная батарея имеет большую плотность энергии, чем вторичная батарея, а это означает, что первичная батарея может обеспечивать питание дольше, чем вторичная батарея. Еще одно важное отличие: мы можем перезаряжать и перерабатывать вторичные батареи, но перерабатываем только изношенные первичные батареи.
В рамках двух классификаций первичных и вторичных батарей существует несколько типов батарей. Сначала рассмотрим первичные батареи.
Какие существуют три основных типа основных батарей? Мы используем первичные батареи во многих важных аспектах нашей жизни благодаря их долговечности. Кардиостимулятор — фантастический пример использования основной батареи — мы не можем просто продолжать работать с людьми, чья батарея кардиостимулятора нуждается в подзарядке.
Первичные батареи также известны как сухие батареи. Но они не сухие. Термин происходит от того факта, что содержимое батареи не может быть пролито, независимо от ее положения. Различные материалы отличают каждую батарею, причем каждый материал влияет на мощность и срок службы батареи. Существует три основных типа первичных батарей:
- Цинк-углерод : Также известная как батарея Лекланше в честь ее французского изобретателя Жоржа Лекланше, была одной из первых доступных батарей и остается одной из самых дешевых по сей день. Как вы, наверное, догадались, его электроды сделаны из цинка и углерода. Эти батареи бывают цилиндрической и прямоугольной формы и, как правило, имеют относительно короткий срок службы. Они лучше работают с приборами с низким энергопотреблением, такими как игрушки или пульты дистанционного управления телевизором. Кроме того, современные угольно-цинковые батареи могут использовать хлорид цинка для увеличения их потенциала; их часто называют батареями для тяжелых условий эксплуатации.

- Щелочные батареи: Щелочные батареи приобрели известность около века назад. В нем используются другие материалы, чем в цинково-угольной батарее. Прямоугольные и цилиндрические щелочные батареи имеют цинковый анод и катод из диоксида марганца с гидроксидом калия в качестве электролита. У щелочных батарей есть много практических преимуществ по сравнению с угольно-цинковыми батареями, с более длительным и мощным разрядом, большим сроком хранения и лучшей способностью работать в более холодных условиях.
Есть и другие подмножества щелочных аккумуляторов, мощность которых зависит от его электродов — электролитом остается гидроксид калия.
Наконец, батарейки-таблетки, используемые, например, в часах и слуховых аппаратах, имеют цинковый анод и катод из оксида серебра. Батарейки-таблетки дороги, известны своим долгим сроком службы и высокой разрядкой.
Вы можете создать щелочную батарею с почти неограниченным сроком годности, называемую воздушно-цинковой батареей, снова заменив электроды. Цинковый анод в сочетании с кислородным катодом образует щелочную батарею, используемую в слуховых аппаратах, пейджерах, часах и многом другом. Воздушно-цинковые батареи имеют самую высокую плотность энергии среди всех одноразовых батарей и бывают цилиндрическими, 9-вольт и формы монет.
Цинковый анод в сочетании с кислородным катодом образует щелочную батарею, используемую в слуховых аппаратах, пейджерах, часах и многом другом. Воздушно-цинковые батареи имеют самую высокую плотность энергии среди всех одноразовых батарей и бывают цилиндрическими, 9-вольт и формы монет.
- Литиевые: Эти батареи дополняют секцию основных батарей и являются одними из самых дорогих батарей. Они обычно используются в цифровых камерах и других небольших приборах. В литиевых батареях, обычно цилиндрических или кнопочных, используется органический электролит. Литиевые батареи с более низким напряжением (1,6 В) имеют литиевый анод и катод из сульфида железа, в то время как литиевые батареи с более высоким напряжением (2,8–3,2 В) заменяют сульфид железа на катоды из диоксида марганца.
Также существует три типа вторичных или перезаряжаемых батарей. Как и первичные батареи, существуют вторичные батареи щелочного и литиевого типов. Третий тип аккумуляторной батареи — это свинцово-кислотная батарея, известная тем, что используется в качестве автомобильного аккумулятора. Точно так же изменение исходных материалов батареи влияет на ее производительность и использование. Аккумуляторы всегда следует утилизировать, поскольку их ценные компоненты можно использовать повторно.
Третий тип аккумуляторной батареи — это свинцово-кислотная батарея, известная тем, что используется в качестве автомобильного аккумулятора. Точно так же изменение исходных материалов батареи влияет на ее производительность и использование. Аккумуляторы всегда следует утилизировать, поскольку их ценные компоненты можно использовать повторно.
1) Свинцово-кислотные аккумуляторы
Это не просто автомобильные аккумуляторы; они также используются в инвалидных колясках и аварийных источниках питания. Свинцово-кислотные аккумуляторы тяжелые, дешевы в производстве и имеют увеличенный срок службы. Они оснащены свинцовыми анодами, катодами из диоксида свинца и сернокислотными электролитами.
2) Щелочные батареи
Существует два типа щелочных аккумуляторных батарей. Никель-кадмиевые батареи, также известные как никель-кадмиевые или никель-кадмиевые батареи, были широко распространены, когда люди начали использовать перезаряжаемые батареи для игрушек, персональных музыкальных плееров, игрушек и так далее. Они работали и перезаряжались хорошо, но токсичный кадмий было сложно перерабатывать.
Они работали и перезаряжались хорошо, но токсичный кадмий было сложно перерабатывать.
Кадмиевый анод был заменен анодом из лантаноидного или никелевого сплава для создания никель-металлогидридной батареи или NiMH. Они намного безопаснее, чем никель-кадмиевые аккумуляторы, обеспечивают отличное питание и хорошо заряжаются. Вы увидите в продаже цилиндрические и прямоугольные перезаряжаемые NiMH аккумуляторы, и они используются в электромобилях.
3) Литий-ионные батареи
Литий-ионные батареи произвели революцию в нашем отношении к батареям. Наши сотовые телефоны, ноутбуки и электромобили работают на этих быстрозаряжающихся батареях. Они используют угольный анод и катоды из диоксида лития-кобальта, а также органический электролит. Литий-ионные батареи также используются на гигантских аккумуляторных фермах для сбора избыточной возобновляемой энергии для последующего использования.
Какие существуют размеры батарей?источник
Батареи похожи на коробки и шкафы, когда речь заходит о хранении. Чем больше батарея, тем больше электролитов она содержит и тем больший электрический заряд она предлагает. Наиболее распространенные размеры батарей в нашей повседневной жизни:
Чем больше батарея, тем больше электролитов она содержит и тем больший электрический заряд она предлагает. Наиболее распространенные размеры батарей в нашей повседневной жизни:
- Батарейки типа АА: Известные как батареи двойного размера А, они имеют цилиндрическую форму и чаще всего используются для миллионов гаджетов.
- Батарейки AAA: Также известные как тройные батарейки A, они меньше батареек AA и часто используются в пультах дистанционного управления телевизорами и гаджетах, не требующих большой мощности.
- Батарейки C : они крупнее батареек AA или AAA и предназначены для использования в предметах повышенного спроса, таких как фонари, фонарики и игры.
- Аккумуляторы D: Они еще большего размера для более тяжелых продуктов, которые потребляют большое количество энергии или требуют питания в течение длительного времени.
Все вышеперечисленные аккумуляторы имеют напряжение 1,5 В.
Узнаваемая прямоугольная 9-вольтовая батарея обеспечивает большую мощность, а батарейки-таблетки обеспечивают длительный срок службы в небольшом корпусе в форме монеты, идеально подходящем для небольших гаджетов, таких как часы.
Существует много других специальных типов батарей, таких как CR123A, также известная как 123, для охранной сигнализации и других конкретных применений.
Что означает напряжение батареи?Напряжение батареи определяет, какой электрический потенциал она будет создавать после подключения к цепи. Например, 12 вольт автомобильного аккумулятора — это более высокое напряжение, чем 1,5 вольта батареи AAA. Это связано с тем, что для запуска автомобиля требуется достаточное количество энергии, в то время как для работы пульта дистанционного управления телевизора требуются только тройные батарейки AAA меньшего размера.
Вспомните отрицательный конец (анод) и положительный конец (катод) батареи. Термин «напряжение» связан с разницей электрических потенциалов между анодом и катодом — чем больше разница, тем выше напряжение батареи.
Термин «вольт» назван в честь Алессандро Вольта, итальянского физика, который изобрел первый в мире электрохимический элемент в 1800 году. Вольта использовал цинковый анод и медный катод с солью и водой в качестве своего электролитического раствора. В 1881 году имя Вольта было присвоено измерению разности электрических потенциалов между анодом и катодом. Таким образом, то, что когда-то называлось электродвижущей силой (ЭДС), стало называться вольтом или напряжением.
Вольта использовал цинковый анод и медный катод с солью и водой в качестве своего электролитического раствора. В 1881 году имя Вольта было присвоено измерению разности электрических потенциалов между анодом и катодом. Таким образом, то, что когда-то называлось электродвижущей силой (ЭДС), стало называться вольтом или напряжением.
Батареи также указывают значения мАч или миллиампер-часы. мАч показывает, сколько электроэнергии держит батарея. Чем выше значение мАч, тем больше энергии может хранить аккумулятор, тем дольше он будет работать, а также тем больше времени потребуется для его перезарядки.
Аккумуляторы переменного или постоянного тока?Батареи обеспечивают питание постоянным или постоянным током, обеспечивая регулярный, стабильный и контролируемый поток. Национальные сети передают электроэнергию с использованием альтернативного тока (AC), тока, который быстро меняет направление.
Являются ли батареи конденсаторами? Проще говоря, нет; батареи не конденсаторы. Батареи хранят электрическую энергию, тогда как конденсаторы тоже хранят энергию, но в электрическом поле.
Батареи хранят электрическую энергию, тогда как конденсаторы тоже хранят энергию, но в электрическом поле.
источник
Батареи — отличный способ передачи энергии, но они не всегда работают без сбоев. Первичные батареи могут разрядиться в неподходящее время. Кроме того, у вас может не оказаться под рукой зарядного устройства для подзарядки аккумуляторов или аккумулятора, подходящего для вашего прибора. Аккумуляторы — отличный способ передачи энергии, но они не всегда работают без сбоев. Первичные батареи могут разрядиться в неподходящее время. Кроме того, у вас может не оказаться под рукой зарядного устройства для подзарядки аккумуляторов или аккумулятора, подходящего для вашего прибора.
Могут ли батареи намокнуть и продолжать работать? Вода не подходит для контакта с батареями. Вода может вызвать ржавчину на корпусе аккумулятора, что иногда приводит к его саморазряду и полному разряду. Деградация батареи также может привести к ее протечке, прекращению работы и, возможно, взрыву.
Деградация батареи также может привести к ее протечке, прекращению работы и, возможно, взрыву.
Если вы случайно постирали одежду с батареей в кармане, ваша стиральная машина должна быть в порядке, потому что любая утечка будет значительно растворена во время цикла стирки машины.
В общем, лучше не мочить батареи. Если они намокли, рекомендуется прекратить их использование.
Могут ли батареи замерзнуть?Все может замерзнуть, если температура упадет достаточно низко. Таким образом, вопрос в том, можете ли вы использовать батареи в морозных погодных условиях и можете ли вы их перезаряжать?
Все батареи разные, но все они работают менее эффективно, когда температура опускается ниже нуля. Лучший совет — не заряжать замерзший аккумулятор.
Полностью заряженный свинцово-кислотный автомобильный аккумулятор может работать при температуре до -58 градусов по Фаренгейту. Если у него низкий заряд, он может замерзнуть при температуре около 30 градусов по Фаренгейту. Вы можете заряжать их при температуре окружающей среды от -4 до 122 градусов по Фаренгейту. Всегда лучше заряжать свинцово-кислотный аккумулятор при комнатной температуре, а не в холодном или замороженном состоянии — в конце концов, свинцово-кислотные аккумуляторы могут взорваться. Если вы сомневаетесь, не заряжайте аккумулятор и обратитесь за помощью к профессиональному механику.
Вы можете заряжать их при температуре окружающей среды от -4 до 122 градусов по Фаренгейту. Всегда лучше заряжать свинцово-кислотный аккумулятор при комнатной температуре, а не в холодном или замороженном состоянии — в конце концов, свинцово-кислотные аккумуляторы могут взорваться. Если вы сомневаетесь, не заряжайте аккумулятор и обратитесь за помощью к профессиональному механику.
Щелочные батареи работают от -4 до 149 градусов по Фаренгейту и заряжаются от 32 до 113 градусов по Фаренгейту.
Литий-ионные батареи работают при температуре от -4 до 140 градусов по Фаренгейту и заряжаются от 32 до 113 градусов по Фаренгейту.
У меня есть реферальный код
? Если вас направил другой клиент Amigo Energy, введите его личный реферальный код, чтобы получить кредит. Принять условия.
Разрешены ли батареи в самолетах? Большинство аккумуляторов разрешено перевозить в самолетах — почти каждый берет с собой в самолет ноутбук, планшет, видеоигру или мобильный телефон.
Сухие щелочные и никель-металлогидридные аккумуляторы можно взять с собой в самолет либо в устройстве, либо в багаже в качестве запасных частей. Эти аккумуляторы также можно сдать в зарегистрированный багаж, хотя рекомендуется брать их с собой на борт. Вы должны иметь только сухие литиевые батареи в устройствах или в качестве запасных частей на борту.
Контакты запасных батарей должны быть заклеены лентой на время полета и храниться в защитных футлярах или полиэтиленовых пакетах. Не держите дополнительные батареи рядом с металлическими предметами, так как это может привести к их короткому замыканию и перегреву.
Если вы планируете путешествовать с запасной перезаряжаемой литий-ионной батареей, заранее обратитесь за консультацией в авиакомпанию. Перезаряжаемые литий-ионные батареи, как правило, разрешены в качестве ручной клади, но часто имеют строгие ограничения по размеру.
Можно ли перерабатывать батареи? Батареи содержат несколько токсичных, вредных и ценных материалов, в зависимости от типа батареи. Ртуть, свинец, литий и кобальт являются одними из возможных материалов батареи и всегда должны утилизироваться надлежащим образом.
Ртуть, свинец, литий и кобальт являются одними из возможных материалов батареи и всегда должны утилизироваться надлежащим образом.
Батареи и их компоненты потенциально опасны и наносят ущерб людям, земле, животным и флоре. Утилизация или возврат на место производства — лучший вариант для изношенных аккумуляторов.
Не выбрасывайте батарейки в обычный мусор. Всегда консультируйтесь с местным или государственным отделом по утилизации твердых отходов для получения информации о методах переработки и утилизации. Некоторые розничные продавцы и производители также принимают возврат аккумуляторов, что особенно важно для автомобильных и литий-ионных аккумуляторов.
Посетите сайт search.earth.911com, чтобы узнать о центрах утилизации, или посетите веб-сайт call2recycle, чтобы получить информацию о переработке аккумуляторов.
Будущее батарей Батареи прошли долгий путь от раннего изобретения Алессандро Вольта. Однако они по-прежнему придерживаются его открытия о том, что накопленная химическая энергия может быть преобразована в электрическую энергию.

 на 1 кг твердого гидроксида калия и гидроксида лития.
на 1 кг твердого гидроксида калия и гидроксида лития.
 В этих клетках электрическая энергия превращается в химическую энергию.
В этих клетках электрическая энергия превращается в химическую энергию. 

 Напротив, батареи хранят свою энергию в химическом поле, которое часто не может перезаряжаться.
Напротив, батареи хранят свою энергию в химическом поле, которое часто не может перезаряжаться.
 Хорошей новостью является то, что батареи подлежат вторичной переработке. И это очень просто. У Energizer® есть сайт, который поможет вам найти места рядом с вами для переработки батарей. Вы также можете попробовать один из этих веб-сайтов:
Хорошей новостью является то, что батареи подлежат вторичной переработке. И это очень просто. У Energizer® есть сайт, который поможет вам найти места рядом с вами для переработки батарей. Вы также можете попробовать один из этих веб-сайтов: 