Рефрактометр для антифриза, электролита и незамерзайки
Наличие документов
Знак Наличие документов означает, что компания загрузила свидетельство о государственной регистрации для подтверждения своего юридического статуса компании или индивидуального предпринимателя.
Корзина
Топ продаж
Описание
Характеристики
Информация для заказа
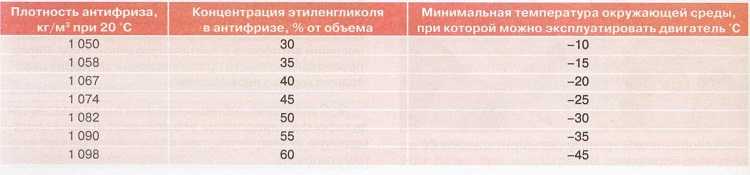
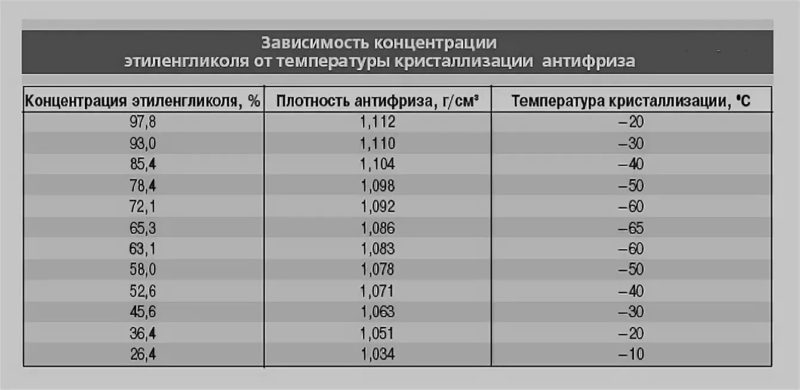
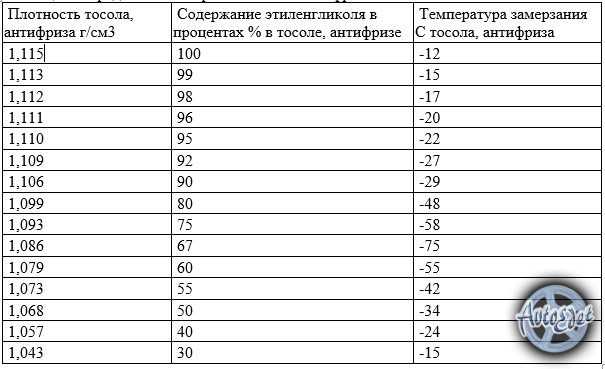
Рефрактометр для антифриза является прибором для быстрой проверки плотности антифриза и температуры замерзания любых теплоносителей и стеклоомывающих жидкостей, он также позволяет определять плотность электролита в аккумуляторах. Для этого достаточно одной капли антифриза или электролита. Может использоваться в условиях малой освещенности.
В основу процесса тестирования при помощи рефрактометра положен принцип разложения света, что позволяет производить точные измерения. Считывание показания прибора производится по четкой разделительной линии светлое/темное.
Считывание показания прибора производится по четкой разделительной линии светлое/темное.
Рефрактометр может тестировать как холодный, так и горячий антифриз. Резкость изображения регулируется вращением окуляра.
Точность прибора контролируется с помощью дистиллированной воды.
Характеристики:
- Температура замерзания антифриза на основе Гликоля Пропилена:-50~0 C
- Температура замерзания антифриза на основе Этиленового Гликоля:-50~0 C
- Температура замерзания омывающей жидкости:-40~0 C
- Концентрация Adblue (реагент для дизтоплива): 30% ~ 35% (резолюция: 0.2%)
- Плотность электролита: 1.10~1.40KG/L
Измерить плотность антифриза и температуру его замерзания при помощи рефрактометра ATC:
- 1. Убедитесь, что призма инструмента и крышка чистые.
- 2. С помощью прилагаемой пипетки поместите каплю тестируемой жидкости на призму.
- 3. Закройте крышку, это приведет к растеканию жидкости.

- 4. Поворачивайте окуляр так, чтобы добиться фокусировки.
- 5. Прочитайте значения на шкале по разделительной линии Светлое/Темное.
- 6. После каждого теста тщательно очищайте призму сухой чистой тканью.
Внимание!
Проверка точности показаний рефрактометра для антифриза осуществляется при помощи тестирования дистиллированной воды. При проверке линия светлое/темное должна совпадать с линией WATERLINE. При несовпадении отрегулируйте положение разделительной линии, поворачивая винт под колпачком.
В комплект входит:
- рефрактометр
- футляр
- пипетка
- регулировочная отвертка
Теги: электронный тестер тормозной жидкости,тестер тормозной жидкости jonnesway,тестер охлаждающей жидкости,тестер для определения качества тормозной жидкости,тестер антифриза,рефрактометр купить,рефрактометр для электролита,рефрактометр для проверки тормозной жидкости,рефрактометр для антифриза купить,рефрактометр для антифриза и электролита,рефрактометр для антифриза,рефрактометр автомобильный,прибор для проверки тормозной жидкости,прибор для проверки плотности антифриза,прибор для проверки незамерзайки,купить рефрактометр для антифриза,какая должна быть плотность антифриза,измеритель плотности антифриза,ареометр для тормозной жидкости,ареометр для антифриза купить
Как понять, что надо менять антифриз
Как автомобилист может понять, нуждается его автомобиль в замене охлаждающей жидкости еще до наступления срока замены по величине пробега? Поговорим о том, что может помочь автовладельцу правильно определить состояние антифриза.
Охлаждающая жидкость теряет со временем свои свойства и перестает выполнять свою главную функцию: защищать двигатель от перегрева, обеспечивать его бесперебойную работу и препятствовать образованию коррозии на компонентах мотора.
Для контроля состояния охлаждающей жидкости существуют и сложные приборы, и простые приспособления. Среди них — тестовые полоски, которые помогают определить кислотно-щелочной баланс охлаждающей жидкости и температуру ее замерзания. Лакмусовую бумажку нужно опустить на пару секунд в антифриз и подождать примерно 40 секунд, чтобы она высохла. Затем необходимо сверить цвета, которые проступили на полоске, с индикаторной цветовой шкалой, которая на нанесена на упаковку.
На самой полоске обычно есть несколько цветовых индикаторов. Цвет первого индикатора (самый дальний от ручки тестовой полоски) показывает уровень содержания хладагента в охлаждающей жидкости. Если при сравнении цветов оказывается, что содержание хладагента меньше 50%, то это повод заменить антифриз.
Щелочное число можно проконтролировать по второму цветовому индикатору. Если при сравнении с индикаторной шкалой видно, что цвет индикатора соответствует значению от 6.6 до 10.1, это значит, что антифриз в системе охлаждения не потерял своих качеств и достаточно защищен от окисления. Если при этом третий цветовой индикатор (определение степени кислотности) попадает в промежуток от 6.5 до 9, то охлаждающая жидкость не требует замены. Если же индикатор показывает значение ниже 6.5 или выше 9, то в этом случае рекомендуется поменять жидкость. Это тем более надо делать, если средний индикатор находится ниже значения 6.6.
Помимо тестовых полосок есть еще и другой, менее точный способ проверки состояния охлаждающей жидкости. Для этого нужно взять небольшой объем антифриза из системы охлаждения, налить его в прозрачную емкость и визуально оценить состояние жидкости. Если видно, что жидкость потеряла прозрачность, стала мутной или белой, медлить не стоит, лучше поменять. Тревожным знаком является и красноватый цвет антифриза, такой оттенок указывает на то, что в жидкость попала ржавчина, и что в самой системе охлаждения началась коррозия. Присутствие в охлаждающей жидкости инородных вкраплений, плотных образований, пены и проч., указывает на необходимость проверки всей системы охлаждения.
Присутствие в охлаждающей жидкости инородных вкраплений, плотных образований, пены и проч., указывает на необходимость проверки всей системы охлаждения.
Добавим, что срок службы антифриза и степень его износа чаще всего определяется качеством самого продукта. Некачественная охлаждающая жидкость служит недолго и часто становиться причиной поломок и дорогостоящего ремонта системы охлаждения автомобиля или даже его двигателя. И наоборот, качественный антифриз «ходит» долго и в самых крайних случаях, даже при превышении интервалов замены, не теряет своих свойств.
1.6 Математическая обработка результатов измерений – Химия
Цели обучения
К концу этого раздела вы сможете:
- Объяснять подход размерного анализа (метка фактора) к математическим расчетам с использованием величин
- Использовать размерный анализ для преобразования единиц измерения для заданного свойства и вычислений, включающих два или более свойства
Часто бывает так, что интересующую величину нелегко (или даже невозможно) измерить напрямую, а вместо этого ее необходимо рассчитать на основе других непосредственно измеренных свойств и соответствующих математических взаимосвязей.
Спринтер олимпийского уровня может пробежать 100 м примерно за 10 с, что соответствует средней скорости
.Обратите внимание, что эта простая арифметика включает в себя деление чисел каждой измеренной величины, чтобы получить число вычисляемой величины (100/10 = 10) и аналогично
.jpg) Чтобы получить искомое свойство, время, уравнение должно быть изменено соответствующим образом:
Чтобы получить искомое свойство, время, уравнение должно быть изменено соответствующим образом:Время может быть вычислено как:
Опять же, арифметика с числами (25/10 = 2,5) сопровождалась той же арифметикой с единицами (м/м/с = с), чтобы получить число и единицу результата, 2,5 с. Обратите внимание, что, как и в случае с числами, когда единица делится на идентичную единицу (в данном случае m/m), результат равен «1» или, как обычно говорят, единицы «отменяются».
Эти расчеты являются примерами универсального математического подхода, известного как анализ измерений (или метод меток факторов ). Размерный анализ основан на этой предпосылке: единицы величин должны подвергаться тем же математическим операциям, что и связанные с ними числа . Этот метод может применяться к вычислениям, начиная от простого преобразования единиц измерения и заканчивая более сложными многоэтапными вычислениями, включающими несколько различных величин.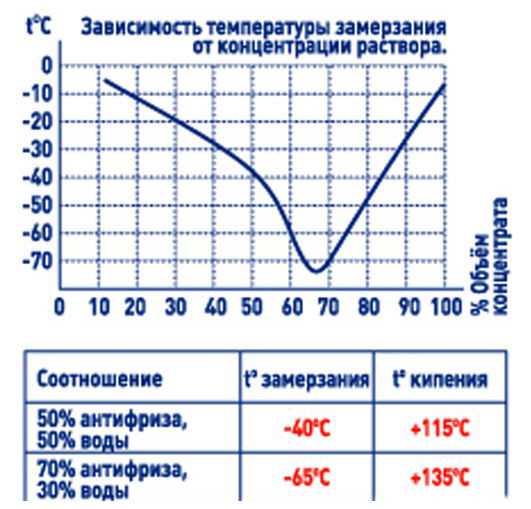
Отношение двух эквивалентных величин, выраженное в разных единицах измерения, может быть использовано в качестве коэффициента преобразования единиц . Например, длины 2,54 см и 1 дюйм эквивалентны (по определению), поэтому коэффициент преобразования единиц измерения может быть получен из отношения
Несколько других часто используемых коэффициентов преобразования приведены в таблице 6.
Когда мы умножаем величину (например, расстояние в дюймах) на соответствующий коэффициент преобразования единиц, мы преобразуем величину в эквивалентное значение с другими единицами измерения (например, расстояние в сантиметрах). Например, вертикальный прыжок баскетболиста на 34 дюйма можно перевести в сантиметры следующим образом:
Например, вертикальный прыжок баскетболиста на 34 дюйма можно перевести в сантиметры следующим образом:
Поскольку эта простая арифметика включает величин , предпосылка размерного анализа требует, чтобы мы умножали как чисел, так и единиц. Числа этих двух величин перемножаются, чтобы получить число количества продукта, 86, тогда как единицы умножаются, чтобы получить . Так же, как и для чисел, отношение одинаковых единиц также численно равно единице, и поэтому единичное произведение упрощается до см . (Когда идентичные единицы делятся, чтобы получить коэффициент, равный 1, говорят, что они «отменяются».) Используя анализ размерностей, мы можем определить, что коэффициент преобразования единиц был установлен правильно, проверив, чтобы подтвердить, что исходная единица будет аннулирована, и результат будет содержать искомую (преобразованную) единицу.
Пример 1
Использование коэффициента преобразования единиц измерения
Масса фрисби для соревнований составляет 125 г.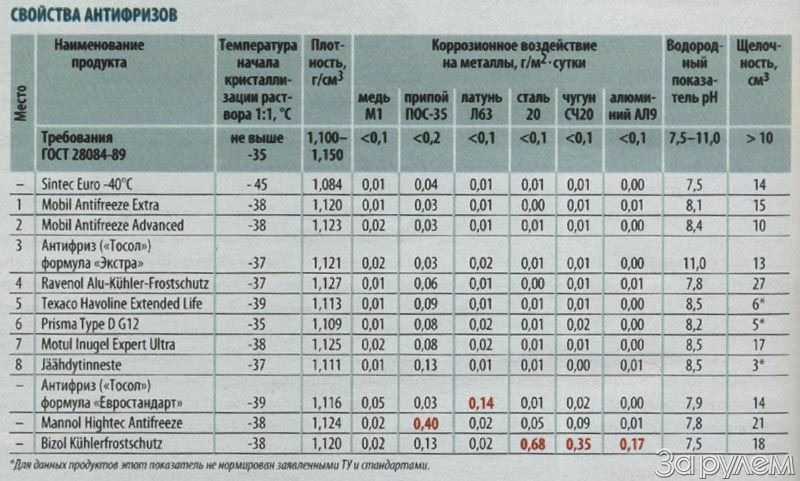 Переведите его массу в унции, используя коэффициент преобразования единиц измерения, полученный из соотношения 1 унция = 28,349 г (таблица 6).
Переведите его массу в унции, используя коэффициент преобразования единиц измерения, полученный из соотношения 1 унция = 28,349 г (таблица 6).
Решение
Если у нас есть коэффициент преобразования, мы можем определить массу в килограммах, используя уравнение, аналогичное тому, которое используется для преобразования длины из дюймов в сантиметры.
Мы записываем коэффициент преобразования единиц измерения в двух формах:
Правильным коэффициентом преобразования единиц измерения является соотношение, которое отменяет единицы измерения граммы и оставляет унции.
Проверьте свои знания
Преобразуйте объем 9,345 кварты в литры.
Ответ:
8,844 л
Помимо простого преобразования единиц измерения, метод меток факторов может использоваться для решения более сложных задач, связанных с вычислениями. Независимо от деталей, основной подход один и тот же: все факторов, участвующих в расчете, должны быть соответствующим образом ориентированы, чтобы гарантировать, что их
015 метки (единицы) будут соответствующим образом отменять и/или комбинировать, чтобы получить желаемую единицу в результате. Вот почему он называется методом факторной метки. По мере продолжения изучения химии у вас будет много возможностей применить этот подход.
Вот почему он называется методом факторной метки. По мере продолжения изучения химии у вас будет много возможностей применить этот подход.
Пример 2
Расчет величин по результатам измерений и известным математическим соотношениям
Какова плотность обычного антифриза в единицах г/мл? Образец антифриза объемом 4,00 кварты весит 90,26 фунта
Раствор
Поскольку плотность = , нам нужно разделить массу в граммах на объем в миллилитрах. В общем: количество единиц B = количество единиц A × коэффициент преобразования единиц. Необходимые коэффициенты пересчета приведены в таблице 6: 1 фунт = 453,59 г; 1 л = 1,0567 кварты; 1 л = 1000 мл. Мы можем преобразовать массу из фунтов в граммы за один шаг:
Нам нужно использовать два шага, чтобы преобразовать объем из кварт в миллилитры.
- Перевести кварты в литры.
- Преобразование литров в миллилитры.
Затем,
В качестве альтернативы расчет можно настроить таким образом, чтобы последовательно использовать три коэффициента преобразования единиц измерения, как показано ниже: 1,0567 кварты и 1 кварта = 32 унции (точно)?
Ответ:
Пример 3
Вычисление величин по результатам измерений и известным математическим соотношениям
Во время поездки из Филадельфии в Атланту на расстояние около 1250 км Lamborghini Aventador Roadster 2014 года потребляет 213 литров бензина.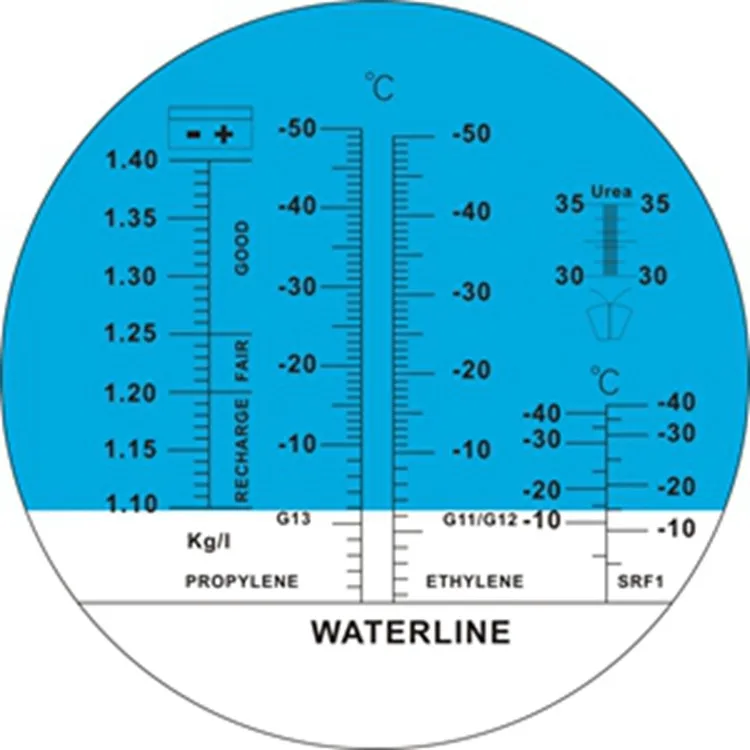
(a) Какая (средняя) экономия топлива в милях на галлон была достигнута родстером во время этой поездки?
(b) Если бензин стоит 3,80 доллара за галлон, сколько стоило топливо для этой поездки?
Решение
(a) Сначала мы преобразуем расстояние из километров в мили:
, а затем переводим объем из литров в галлоны:
Затем
В качестве альтернативы расчет можно настроить таким образом, чтобы последовательно использовать все переводные коэффициенты, следующим образом:
(b) Используя ранее рассчитанный объем в галлонах, мы находим:
Проверьте свои знания
Автомобиль Toyota Prius Hybrid использует 59,7 л бензина для поездки из Сан-Франциско в Сиэтл на расстояние 1300 км (две значащие цифры).
(a) Какой (средний) расход топлива в милях на галлон был у Prius во время этой поездки?
(b) Если бензин стоит 3,90 доллара за галлон, сколько стоило топливо для этой поездки?
Ответ:
(а) 51 миль на галлон; (б) $62
Мы используем слово температура для обозначения тепла или холода вещества. Одним из способов измерения изменения температуры является использование того факта, что большинство веществ расширяются при повышении их температуры и сжимаются при понижении температуры. Ртуть или спирт в обычном стеклянном термометре меняют свой объем при изменении температуры. Поскольку объем жидкости изменяется больше, чем объем стакана, мы можем видеть, как жидкость расширяется при нагревании и сжимается при охлаждении.
Одним из способов измерения изменения температуры является использование того факта, что большинство веществ расширяются при повышении их температуры и сжимаются при понижении температуры. Ртуть или спирт в обычном стеклянном термометре меняют свой объем при изменении температуры. Поскольку объем жидкости изменяется больше, чем объем стакана, мы можем видеть, как жидкость расширяется при нагревании и сжимается при охлаждении.
Чтобы отметить шкалу термометра, нам нужен набор эталонных значений: Два наиболее часто используемых значения — это температура замерзания и кипения воды при заданном атмосферном давлении. По шкале Цельсия 0 °С соответствует температуре замерзания воды, а 100 °С — температуре кипения воды. Пространство между двумя температурами разделено на 100 равных интервалов, которые мы называем градусами. По шкале по шкале Фаренгейта точка замерзания воды определяется как 32 ° F, а температура кипения — как 212 ° F. Пространство между этими двумя точками на термометре Фаренгейта разделено на 180 равных частей (градусов).
Определение температурных шкал Цельсия и Фаренгейта, как описано в предыдущем абзаце, приводит к несколько более сложной взаимосвязи между значениями температуры по этим двум шкалам, чем для разных единиц измерения других свойств. Большинство единиц измерения для данного свойства прямо пропорциональны друг другу (y = mx). Используя знакомые единицы длины в качестве примера:
, где y = длина в футах, x = длина в дюймах, а константа пропорциональности, м, является коэффициентом преобразования. Однако температурные шкалы Цельсия и Фаренгейта не имеют общей нулевой точки, поэтому связь между этими двумя шкалами скорее линейная, чем пропорциональная (y = mx + b). Следовательно, преобразование температуры из одной из этих шкал в другую требует большего, чем простое умножение на коэффициент преобразования m, оно также должно учитывать различия в нулевых точках шкалы (b).
Линейное уравнение, связывающее температуры по Цельсию и по Фаренгейту, легко получить из двух температур, используемых для определения каждой шкалы. Представив температуру по Цельсию как x и температуру по Фаренгейту как y , наклон м вычисляется как:
Представив температуру по Цельсию как x и температуру по Фаренгейту как y , наклон м вычисляется как:
Точка пересечения у уравнения, b , затем рассчитывается с использованием любой из пар эквивалентных температур (100 °C, 212 °F) или (0 °C, 32 °F), как:
Уравнение, связывающее температурные шкалы, будет таким:
Сокращенная форма этого уравнения без единиц измерения:
Преобразование этого уравнения дает форму, пригодную для преобразования градусов Фаренгейта в градусы Цельсия:
Как упоминалось ранее в этой главе, единицей измерения температуры в системе СИ является кельвин (К). В отличие от шкал Цельсия и Фаренгейта, шкала Кельвина представляет собой абсолютную температурную шкалу, в которой 0 (ноль) К соответствует самой низкой температуре, которая теоретически может быть достигнута. начало 19Открытие в 19 веке связи между объемом газа и температурой показало, что объем газа будет равен нулю при температуре -273,15 °C. В 1848 году британский физик Уильям Томпсон, позже принявший титул лорда Кельвина, предложил абсолютную температурную шкалу, основанную на этой концепции (дальнейшее рассмотрение этой темы содержится в главе этого текста, посвященной газам).
В 1848 году британский физик Уильям Томпсон, позже принявший титул лорда Кельвина, предложил абсолютную температурную шкалу, основанную на этой концепции (дальнейшее рассмотрение этой темы содержится в главе этого текста, посвященной газам).
Температура замерзания воды по этой шкале составляет 273,15 К, а температура ее кипения — 373,15 К. Обратите внимание, что числовая разница между этими двумя эталонными температурами составляет 100, то же самое, что и для шкалы Цельсия, поэтому линейная зависимость между этими двумя температурными шкалами будет показать наклон . Следуя тому же подходу, уравнения для преобразования шкалы температуры по шкале Кельвина в шкалу Цельсия выводятся следующим образом:
Число 273,15 в этих уравнениях определено экспериментально, поэтому оно неточно. На рис. 1 показано соотношение между тремя температурными шкалами. Напомним, что мы не используем знак градуса при температурах по шкале Кельвина.
Рис. 1. Сравниваются температурные шкалы Фаренгейта, Цельсия и Кельвина.

Хотя кельвиновая (абсолютная) температурная шкала является официальной температурной шкалой СИ, шкала Цельсия обычно используется во многих научных контекстах и является предпочтительной шкалой для ненаучных контекстов почти во всех регионах мира. Очень немногие страны (США и их территории, Багамы, Белиз, Каймановы острова и Палау) до сих пор используют градусы Фаренгейта для прогнозов погоды, медицины и приготовления пищи.
Пример 4
Преобразование из градусов Цельсия
Нормальная температура тела обычно принимается равной 37,0 °C (хотя она варьируется в зависимости от времени суток и метода измерения, а также у разных людей). Какова эта температура по шкале Кельвина и по шкале Фаренгейта?
Решение
Проверьте свои знания
Преобразование 80,92 °C в K и °F.
Ответ:
354,07 К, 177,7 °F
Пример 5
Преобразование по шкале Фаренгейта
Выпечка готовой пиццы требует температуры в духовке 450 °F.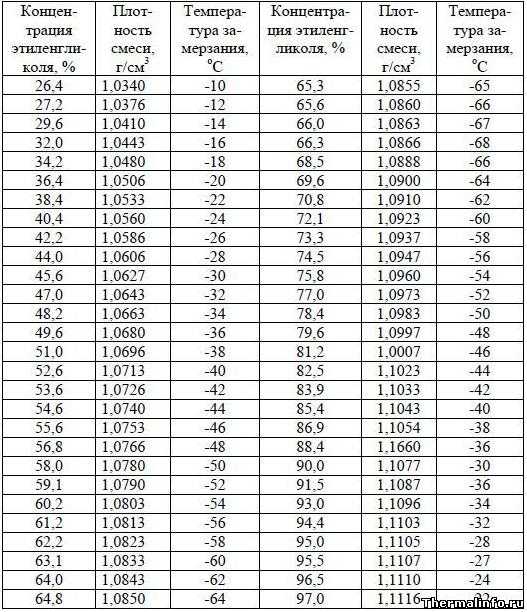 Если вы находитесь в Европе, и ваш термометр для духовки использует шкалу Цельсия, какова настройка? Что такое температура по Кельвину?
Если вы находитесь в Европе, и ваш термометр для духовки использует шкалу Цельсия, какова настройка? Что такое температура по Кельвину?
Решение
Проверьте свои знания
Преобразование 50 °F в °C и K.
Ответ:
10 °C, 280 K
Измерения производятся с использованием различных единиц измерения. Часто бывает полезно или необходимо преобразовать измеренную величину из одних единиц в другие. Эти преобразования выполняются с использованием коэффициентов преобразования единиц измерения, которые получаются путем простого применения математического подхода, называемого методом факторной метки или размерным анализом. Эта стратегия также используется для расчета искомых величин с использованием измеренных величин и соответствующих математических соотношений.
- анализ размеров
- (также метод меток факторов) универсальный математический подход, который можно применять к вычислениям, начиная от простых преобразований единиц измерения и заканчивая более сложными многоэтапными вычислениями, включающими несколько различных величин
- по Фаренгейту
- единица измерения температуры; вода замерзает при 32 °F и кипит при 212 °F по этой шкале
- коэффициент пересчета единиц
- отношение эквивалентных величин, выраженное в разных единицах измерения; используется для преобразования одной единицы измерения в другую единицу измерения
ChemTeam: Расчеты с моляльностью, молярностью, плотностью, массовым процентом, мольной долей (задачи №11
ChemTeam: Расчеты с моляльностью, молярностью, плотностью, массовыми процентами, мольной долей (задачи №11–25)Расчеты с моляльностью, молярностью, плотностью, массовым процентом, мольной долей
Задачи №11 — 25
Пятнадцать примеров
Проблемы 1 — 10
Вернуться в меню решений
Задача №11: Рассчитайте молярность и молярную долю ацетона в 2,28-молярном растворе ацетона (CH 3 COCH 3 ) в этаноле (C 2 H 5OH). (Плотность ацетона = 0,788 г/см 3 ; плотность этанола = 0,789 г/см 3 .) Предположим, что объемы ацетона и этанола складываются.
(Плотность ацетона = 0,788 г/см 3 ; плотность этанола = 0,789 г/см 3 .) Предположим, что объемы ацетона и этанола складываются.
Раствор для молярности: 903:50
Помните, что 2,28-моляль означает 2,28 моль ацетона в 1,00 кг этанола.
1) Определить объемы ацетона и этанола, затем общий объем:
ацетон
2,28 моль x 58,0794 г/моль = 132,421 г132,421 г разделить на 0,788 г/см 3 = 168,047 см 3
этанол
1000 г разделить на 0,789 г/см 3 = 1267,427 см 3
общий объем
168,047 + 1267,427 = 1435,474 см 3
2) Определите молярность:
2,28 моль/1,435 л = 1,59 М
Раствор для мольной доли:
1) Определите количество молей этанола:
1000 г / 46,0684 г/моль = 21,71 моль
2) Определите мольную долю ацетона:
2,28 / (2,28 + 21,71) = 0,0950
Задача №12: Рассчитайте нормальность 4,0-молярного раствора серной кислоты с плотностью 1,2 г/мл.
Напоминания:
N = #эквивалентов/л раствора
#эквиваленты = молекулярная масса / n (n = количество H + или OH¯, высвобождаемых при диссоциации.)
моляль = моль растворенного вещества / кг растворителя
Решение:
1) Определить граммы H 2 SO 4 присутствует:
4,0 моляля = 4,0 моля H 2 SO 4 / 1000 г раствора4,0 моль умножить на 98,09 г/моль = 392,32 г
2) Определить эквивалентный вес для H 2 СО 4 :
98,09 г/моль / 2 диссоциирующего водорода/моль = 49,05 г/эквивалент
3) Определить # эквивалентов в 392,32 г:
392,32 г раз (1 эквивалент / 49,05 г) = 8,0 эквивалента
4) Определить объем раствора:
392,32 г + 1000 г = 1392,32 г (общая масса раствора)1392,32 г / 1,2 г/мл = 1160,27 мл
5) Определить нормальность:
Н = 8,0 эквивалентов / 1,16027 Д = 6,9 Н
Задача № 13: Смесь автомобильного антифриза получают путем смешивания равных объемов этиленгликоля (d = 1,114 г/мл, молярная масса 62,07 г/моль) и воды (d = 1,000 г/мл) при 20,0 °C. Плотность раствора 1,070 г/мл.
Плотность раствора 1,070 г/мл.
Выразите концентрацию этиленгликоля как:
(а) объемные проценты
(б) массовые проценты
(c) молярность
(г) моляльность
(e) мольная доля
Решение (а):
Поскольку объемы равны, объемный процент этиленгликоля составляет 50%
Решение (б):
1) Определить массы равных объемов (будем использовать 50,0 мл) двух веществ:
этиленгликоль: (50,0 мл) (1,114 г/мл) = 55,7 г
вода: (50,0 мл) (1,000 г/мл) = 50,0 г
2) Определить процентное содержание этиленгликоля:
55,7 г / 105,7 г = 52,7%
Решение (с):
1) Определить количество молей этиленгликоля:
55,7 г / 62,07 г/моль = 0,89737 моль
2) Определить объем раствора:
105,7 г / 1,070 г/мл = 98,785 мл
3) Определите молярность:
0,89737 моль/0,098785 л = 9,08 М
Решение (г):
0,89737 моль/0,050 кг = 17,9 мОбратите внимание на большую разницу между молярностью и моляльностью.
Решение (д):
1) Определить количество молей воды:
50,0 г / 18,0 г/моль = 2,77778
2) Определите мольную долю этиленгликоля:
0,89737 моль / 3,67515 моль = 0,244
Задача № 14: Какова массовая доля CsCl в 0,0711 М растворе CsCl с плотностью 1,09 г/мл?
Решение:
1) Определить массу растворенного CsCl:
Допустим, 100,0 мл раствора.МВ = граммы / молярная масса
(0,0711 моль/л) (0,100 л) = x / 168,363 г/моль
х = 1,197 г
2) Определите массу раствора:
1,09 г/мл умножить на 100,0 мл = 109 г
Определить массовую долю CsCl в растворе:
1,197 г / 109 г = 1,098%до трех знаков инжира: 1,10%
Задача № 15: 8,77 М раствор кислоты HX имеет плотность 0,853 г/мл. Кислота HX имеет молярную массу 31,00 г/моль. Определите молярную концентрацию этого раствора, Χ HX (молярная доля HX) и % вес/вес (массовые проценты). Растворителем в этом растворе является вода, H 2 О.
Определите молярную концентрацию этого раствора, Χ HX (молярная доля HX) и % вес/вес (массовые проценты). Растворителем в этом растворе является вода, H 2 О.
Комментарий: Может ли 8,77 М раствор кислоты иметь плотность 0,853 г/мл? Какая разница? Мы просто решим проблему.
Решение:
Для решения задач такого типа есть хитрость: предположим, что имеется 1,00 л (или 1000 мл) раствора. (Другое место, где используется подобный трюк, — это определение эмпирических формул, где вы предполагаете, что присутствует 100 г вещества.)
1) Некоторые предварительные расчеты:
моль кислоты: 1,00 л x (8,77 моль/л) = 8,77 моль HX (используется в моляльности и мольной доле)масс. кислота: 8,77 моль x 31,00 г/моль = 272 г НХ (проценты по массе)
масса раствора: 1000 мл x 0,853 г/мл = 853 г раствора (в процентах по массе)
масса растворителя: 853 г минус 272 г = 581 г = 0,581 кг (моляльность)
моль растворителя: 581 г разделить на 18,015 г) = 32,25 (молярная доля)
2) Расчеты для ответа на вопросы:
моляльность = 8,77 моль / 0,581 кг = 15,1 ммольных долей = 8,77 / (8,77 + 32,25) = 0,214
% масс.
/масс. = (272 г / 853 г) x 100 = 31,9%
Задача №16: Раствор перекиси водорода, H 2 O 2 , содержит 30,0% по массе и имеет плотность 1,11 г/см 3 . Рассчитайте моляльность (а), молярность (б) и молярную долю (в).
Решение:
1) Масса 1 л раствора:
1,11 г/см 3 раз (1000 см 3 / л) = 1110 г/л
2) Масса двух компонентов раствора:
масса H 2 O 2 —> 30,0% от 1110 г = 333 г
масса H 2 O —> 70,0% от 1110 г = 777 г
3) Моль перекиси водорода:
333 г / 34,0138 г/моль = 9,79 моль
4) Моляльность:
9,79 моль/0,777 кг = 12,6 м
5) Молярность
9,79 моль/1,00 л = 9,79 М
6) Молярная доля
моль H 2 O 2 = 9,79
моль H 2 O = 43,13всего молей —> 9,79 + 43,13 = 52,92
мольная доля —> 9,79 / 52,92 = 0,185
Задача №17: Бытовая перекись водорода представляет собой водный раствор, содержащий 3,0% перекиси водорода по массе. Какова молярность этого раствора? (Примите плотность 1,01 г/мл.)
Какова молярность этого раствора? (Примите плотность 1,01 г/мл.)
Решение:
1) Имеем под рукой 1000 г раствора. По объему раствора:
1000 г разделить на 1,01 г/мл = 990,1 мл
2) Поскольку H 2 O 2 составляет 3% по массе, мы знаем, что в 1000 г раствора присутствует 30 граммов H 2 O 2 .
MV = масса / молярная масса(x) (0,9901 л) = 30 г / 34,0138 г/моль
х = 0,8
М
Цифры в два знака кажутся разумными, поэтому 0,89 M.
Задача №18: 6,90 М раствор КОН в воде содержит 30% КОН по весу. Рассчитайте плотность раствора КОН.
Решение:
Предположим, у нас имеется 1,00 литр раствора. Это означает, что у нас есть 6,90 моль КОН. Определим массу КОН:6,90 моль умножить на 56,1049 г/моль = 387,124 г
387,124 г составляет 30% от общей массы раствора. (Вода составляет остальные 70%.
) Чтобы получить массу раствора, сделайте следующее:
387,124 г равно 0,3, так как x равно 1х = 1290 г
плотность раствора —> 1290 г/1000 мл = 1,29г/мл (до трех знаков инжира)
Задача №19: Водный раствор NaCl готовят из 138 г NaCl, разбавленного до общего объема раствора 1,30 л.
(A) Рассчитайте молярность раствора.
(B) Рассчитайте моляльность раствора. (Примите плотность раствора 1,08 г/мл.)
(C) Рассчитайте массовый процент раствора. (Примите плотность раствора 1,08 г/мл.)
Решение:
Часть А:
MV = масса / молярная масса(x) (1,30 л) = 138 г / 58,443 г/моль
х = 1,82 М
Часть Б:
моляльность – количество молей растворенного вещества на кг растворителя. Я буду использовать 2,3613 моль (сохраняя несколько защитных цифр).Предположим, имеется 1000 мл раствора.
Это говорит нам о том, что присутствует 2,3613 моль растворенного вещества (это 138 г NaCl).
1,08 г/мл умножить на 1000 мл = 1080 г 1080 г минус 138 г = 942 г 942 г = 0,942 кг
2,3613 моль/0,942 кг = 2,51 м
Часть С:
138 г растворенного вещества было растворено в 1080 г общего раствора(138 / 1080) умножить на 100 = 12,8% 100% минус 12,8% = 87,2% 2O
Другой тип вопросов в этой области состоит в том, чтобы попросить вас определить молярную долю каждого вещества. Для этого вам нужно знать количество молей воды:
942 г / 18,015 г/моль = 52,29 мольМолярная доля NaCl:
2,3613 моль / (2,3613 моль + 52,29 моль) = 0,0432
Мольная доля воды:
1 − 0,0432 = 0,9568
Задача №20: Раствор готовят растворением 28,0 г глюкозы (C 6 H 12 O 6 ) в 350 г воды. Конечный объем раствора составляет 384 мл. Для этого решения вычислите каждое из следующих значений:
Для этого решения вычислите каждое из следующих значений:
1) молярность; 2) моляльность; 3) проценты по массе; 4) мольная доля; 5) мольных процентов
Решение:
1) Молярность – это количество молей, деленное на объем растворителя в литрах.
28,0 г / 180 г/моль = 0,156 моль0,156 моль/0,384 л = 0,405 М
2) Моляльность – это количество молей, деленное на массу растворителя в килограммах.
0,156 моль/0,350 кг = 0,444 м
3) Процент по массе, как следует из названия, представляет собой массу растворенного вещества, деленную на общую массу, умноженную на 100%.
28,0 г / (350 г + 28 г) умножить на 100 = 7,41% C 6 H 12 O 6 по массе
4) Молярная доля – это количество молей растворенного вещества, деленное на общее количество молей.
350 г / 18,015 г/моль = 19,428 моль воды0,156 моль / (19,428 + 0,156) = 0,0080 молярная доля C 6 H 12 O 6
Мольная доля воды:
1 − 0,0080 = 0,992
5) Молярный процент равен мольной доле, умноженной на 100%.
0,0080 x 100 = 0,80 % C 6 H 12 O 6 молями
Задача №21: Сколько граммов глюкозы надо растворить в 3 литрах воды, чтобы получить 40% раствор?
Решение:
Растворите x г глюкозы в 3 литрах воды, чтобы получить 40% раствор.вес глюкозы = х
вес воды = 3 литра = 3000 г (примите плотность воды равной 1,00 г/мл)
, значит, общий вес раствора = x + 3000 г.процент глюкозы —> х / (х + 3000) = 0,40 х = 0,4 (х + 3000)
х = 0,4 х + 1200
х — 0,4 х = 1200
0,6х = 1200
х = 2000 г
Проблема № 22: Уксус, продаваемый в продуктовых магазинах, описан как 5% (об./об.) уксусной кислоты. Какова молярность этого раствора (плотность 100% уксусной кислоты 1,05 г/мл)?
Решение:
1) 5% (об./об.) означает, что 5% объема приходится на уксусную кислоту. Таким образом, 1,00 л уксуса содержит 50 мл уксусной кислоты:
(0,05)(1000 мл) = 50 мл
2) Масса этой уксусной кислоты:
(1,05 г/мл) (50 мл) = 52,5 г
3) Для молярности используйте MV = масса / молярная масса
(x) (1,00 л) = 52,5 г / 60,0516 г/мольx = 0,874 M (до трех цифр)
Задача № 23: Путем титрования было определено, что молярность уксусной кислоты в уксусе составляет 0,870 М. Переведите это значение в % (об./об.). (Плотность уксусной кислоты 1,05 г/мл)
Переведите это значение в % (об./об.). (Плотность уксусной кислоты 1,05 г/мл)
Решение:
1) Предположим, что имеется 1,00 л раствора. Используйте MV = масса/молярная масса для определения массы присутствующей уксусной кислоты:
(0,870 моль/л) (1,00 л) = х / 60,0516 г/мольх = 52,245 г
2) Определите, какой это объем чистой уксусной кислоты:
52,245 г разделить на 1,05 г/мл = 49,757 мл
3) Определить %(об./об.):
(49,757 мл / 1000 мл) * 100 = 4,9757При округлении получается 4,98% (об./об.), обычно дается как 5% (об./об.).
Задача № 24: В водном растворе серной кислоты концентрация кислоты составляет 2,40 мольных процента, а плотность раствора составляет 1,079.г/мл. Рассчитайте (1) молярную концентрацию кислоты, (2) массовый процент кислоты и (3) молярность раствора.
Решение:
2,40 мольных процента кислоты означает 97,60 мольных процентов воды.Предположим, что имеется 100 моль раствора. Это означает, что 2,40 моль раствора представляет собой H 2 SO 4 , а 97,60 моль — вода.
(1) Для определения моляльности нам нужно знать кг воды —> 97,60 моль умножить на 18,015 г/моль = 1758,264 г = 1,758264 кг
моляльность —> 2,40 моль / 1,758264 кг = 1,365 м (от 1,36 м до трех сиг инжира)
(2) Для весовых процентов нам нужна масса H 2 SO 4 —> 2,40 моль умножить на 98,0768 г/моль = 235,38432 г
весовых процента —> 235,38432 г / (235,38432 + 1758,264 г) = 0,118067 = 11,8% (три знака инжира)
(3) Для молярности нам нужно знать объем раствора —> 1993,64832 г разделить на 1,079 г/мл = 1847,68 мл = 1,84768 л
Примечание: 1993,64832 г — общая масса раствора.
молярность —> 2,40 моль / 1,84768 л = 1,2989 М (от 1,30 М до трех сиг)
Кстати, мольные проценты — это мольные доли, записанные в процентах. Мольные доли в приведенной выше задаче равны 0,0240 и 0,9760.
Задача № 25: Рассчитайте моляльность, молярность и молярную долю FeCl 3 в 26,3% (вес/вес) растворе (плотность = 1,28 г/мл).
Решение:
Молярность:
Предположим, что имеется 100 г раствора.Присутствует 26,3 г FeCl 3 .
100 г разделить на 1,28 г/мл = 78,125 мл
Используйте MV = масса / молярная масса
(х) (0,078125 л) = 26,3 г / 162,204 г/моль
x = 2,08 M (до трех знаков)
Моляльность
100 г − 26,3 г = моляльность 73,7 г —> (26,3 г / 162,204 г/моль) / 0,0737 кг = 2,20 м (до трех знаков инжира)
Мольная доля FeCl 3 :
моль FeCl 3 —> 26,3 г / 162,204 г/моль = 0,1621415 мольмоль воды —> 73,7 г / 18,015 г/моль = 4,0
мольмольная доля —> [0,1621415 моль / (0,1621415 моль + 4,0
моль)] = 0,0381 (до трех знаков цифры)Задача №26: Молярная доля в растворе Na 2 S равна 0,125.
Рассчитайте массовое содержание (вес/вес) Na 2 S в этом растворе.
Решение:
Молярная доля Na 2 S составляет 0,125. Следовательно, мольная доля воды в растворе равна 0,875. МассаNa 2 S —> 0,125 моль умножить на 78,045 г/моль = 9,755625 г
масса воды —> 0,875 моль 18,015 г/моль = 15,763125 г % (мас./мас.) Na 2 S —> [9,755625 / (9,755625 + 15,763125) * 100] = 38,2% (до трех знаков фиг.)
Задача №27: В разбавленной азотной кислоте концентрация HNO 3 равна 6,00 М, а плотность этого раствора равна 1,19.г/мл. Используйте эту информацию для расчета массового процента и мольной доли HNO 3 в растворе.
Решение №1:
1) Предположим, имеется 1000 мл раствора. Некоторые предварительные расчеты:
1000 мл x 1,19 г/мл = 1190 г (это масса наших 1000 мл)6,00 моль/л x 1,00 л = 6,00 моль (это количество молей HNO 3 в наших 1000 мл)
6,00 моль x 63,012 г/моль = 378,072 г (масса HNO 3 в нашем 1000 мл)
1190 г минус 378,072 г = 811,928 г (масса воды в 1000 мл раствора)
2) Рассчитайте массовый процент HNO 3 :
378,072 г / 1190 г = 31,8% (до трех знаков инжира)3) Рассчитайте мольную долю HNO 3 :
811,928 г / 18,015 г/моль = 45,07 моль H 2 O6,00 моль / (6,00 моль + 45,07 моль) = 0,118 (до трех цифр)
Решение №2: 903:50
1) Предположим, что имеется 1000 г раствора.
Некоторые предварительные расчеты:
1000 г / 1,19 г/мл = 840,336 мл (объем наших 1000 г раствора)6,00 моль/л x 0,840336 л = 5,042 моль (это количество молей HNO 3 в наших 840,336 мл)
5,042 моль x 63,012 г/моль = 317,7065 г (масса HNO 3 в нашем 840,336 мл)
1000 г минус 317,7065 г = 682,2935 г (масса воды в 1000 г раствора)
2) Рассчитайте массовый процент HNO 3 :
317,7065 г / 1000 г = 31,8% (до трех знаков инжира)3) Рассчитайте мольную долю HNO 3 :
682,2935 г / 18,015 г/моль = 37,874 моль H 2 O5,042 моль / (5,042 моль + 37,874 моль) = 0,117 (до трех цифр)
Комментарий: В решении № 2 я получил 0,117485, что технически равно 0,117 (а не 0,118) при округлении до трех цифр.
Задача № 28: 0,100 М раствор NaOH будет приготовлен путем разбавления 50,0% (масс.
/масс.) раствора NaOH. Этот раствор имеет плотность 1,53 г/мл. Вычислите объем этого раствора, необходимый для приготовления 1,00 x 10 3 мл 0,100 М NaOH.
Решение:
1) Определите количество молей NaOH в 1,0 x 10 3 мл 0,10 М раствора:
МВ = моли(0,100 моль/л) (1,00 л) = 0,100 моль
2) Определить массу 0,100 моль NaOH
моль x молярная масса = грамм(0,100 моль) (40,00 г/моль) = 4,00 г
3) Масса 50,0% (вес/вес) раствора, содержащего 4,00 г NaOH:
использовать соотношение и пропорцию50 г соответствует 100 г, как 4 г соответствует x
х = 8,00 мл
4) Определите объем раствора, содержащего 8,00 г NaOH:
Люк, уууууууууууууууууууууууууууууууузу сиву!8,00 г / 1,53 г/мл = 5,23 мл
Задача № 29: Какова молярность раствора NaOH плотностью 1,33 г/мл, приготовленного из 70,0 мл воды, если моляльность равна 10,7 моляль?
Решение:
1) Используйте моляльность, чтобы определить, сколько NaOH было использовано с 70,0 г воды:
10,7 моль = 10,7 моль растворенного вещества на кг растворителя10,7 моль/кг = х/0,0700 кг
х = 0,749 моль NaOH
2) Определить граммы NaOH:
(0,749 моль) (40,0 г/моль) = 29,96 г3) Общая масса раствора:
70,0 г + 30,0 г = 100,0 г4) Объем раствора:
100,0 г / 1,33 г/мл = 75,2 мл5) Молярность:
0,749 моль/0,0752 л = 9,96 МЗадача №30a: Сколько мл 3,78%-ного (вес/вес) раствора можно приготовить из 18,00 г сахарозы?
Решение:
3,78 соответствует 18, как 100 соответствует хx = 476,19 г 476,19 — 18,00 = 458,19 г Примите 1 г/мл за плотность и отсутствие изменения объема при объединении 458,19 г воды и 18,00 г сахарозы.


 /масс. = (272 г / 853 г) x 100 = 31,9%
/масс. = (272 г / 853 г) x 100 = 31,9% ) Чтобы получить массу раствора, сделайте следующее:
) Чтобы получить массу раствора, сделайте следующее: Это говорит нам о том, что присутствует 2,3613 моль растворенного вещества (это 138 г NaCl).
Это говорит нам о том, что присутствует 2,3613 моль растворенного вещества (это 138 г NaCl).
 Рассчитайте массовое содержание (вес/вес) Na 2 S в этом растворе.
Рассчитайте массовое содержание (вес/вес) Na 2 S в этом растворе.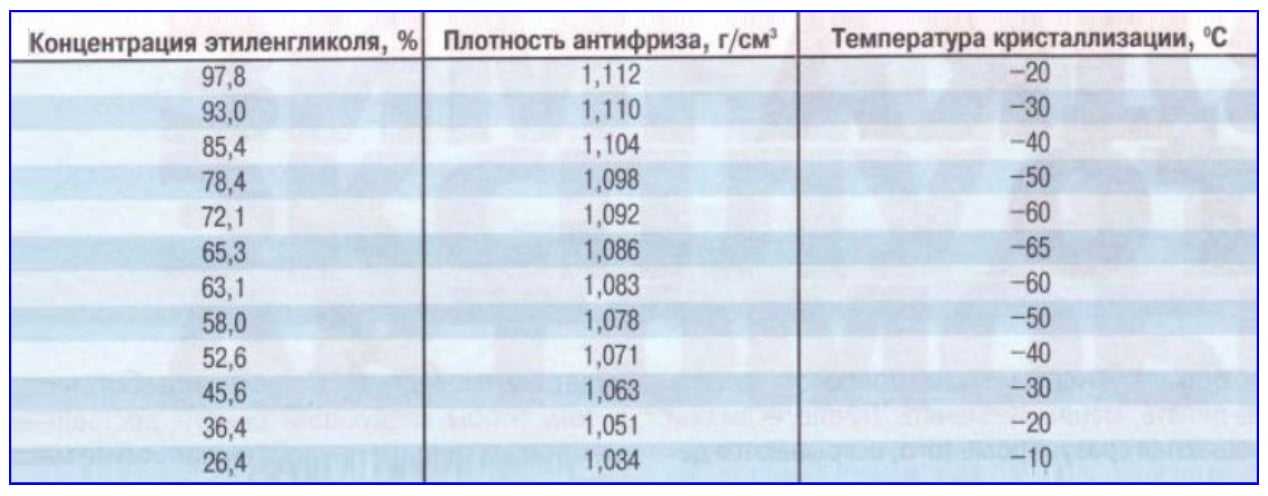 Некоторые предварительные расчеты:
Некоторые предварительные расчеты: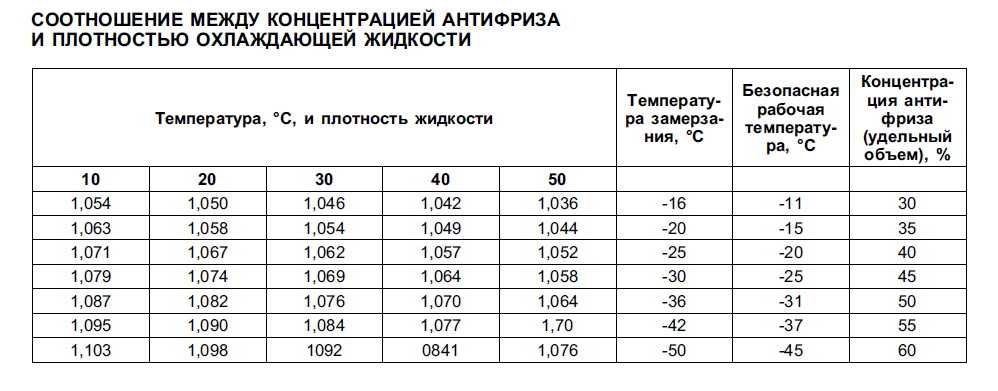 /масс.) раствора NaOH. Этот раствор имеет плотность 1,53 г/мл. Вычислите объем этого раствора, необходимый для приготовления 1,00 x 10 3 мл 0,100 М NaOH.
/масс.) раствора NaOH. Этот раствор имеет плотность 1,53 г/мл. Вычислите объем этого раствора, необходимый для приготовления 1,00 x 10 3 мл 0,100 М NaOH.