Какая кислота используется в аккумуляторе (название и состав электролита)
Содержание
- Какая кислота используется в аккумуляторах
- Почему используют именно кислоту
- Характеристики электролита
- Норма плотности и контроль зимой и летом
- Срок службы и возможность замены
Свинцово-кислотные аккумуляторы широко распространены в автомобильной технике в качестве стартерных и тяговых источников тока. В них энергия запасается и отдается в процессе обратимых электрохимических реакций с участием свинца, оксида свинца и серной кислоты. АКБ, изготовленные по современным технологиям (EFB, GEL, AGM) также содержат серную кислоту, но не всегда в свободном виде.
Какая кислота используется в аккумуляторах
В кислотно-свинцовые элементы, из которых состоит автомобильная батарея, в качестве жидкого реагента заливают серную кислоту, разбавленную водой. Для приготовления такого электролита применяют дистиллированную воду – продукт перегонки обычной воды. Она свободна от механических и химических примесей, поэтому не дает дополнительных химических реакций, ухудшающих работу аккумулятора. Отсутствие механических частиц гарантирует отсутствие дополнительного осадка на поверхности пластин, также ведущего к снижению параметров.
Она свободна от механических и химических примесей, поэтому не дает дополнительных химических реакций, ухудшающих работу аккумулятора. Отсутствие механических частиц гарантирует отсутствие дополнительного осадка на поверхности пластин, также ведущего к снижению параметров.
Главным реагентом в электролите является серная кислота – именно это вещество обеспечивает протекание необходимых реакций. Название субстанции указывает на наличие серы и кислорода, входящих в состав кислотного остатка. H2SO4 относится к категории сильных кислот, при попадании на кожу и в дыхательные пути она может вызвать ожоги и сильное отравление, поэтому при обращении с электролитом надо принимать меры предосторожности и пользоваться средствами защиты органов дыхания и кожи.
Почему используют именно кислоту
Вопрос о разновидности кислоты, которая используется в АКБ, нельзя рассматривать отдельно от остальных реагентов. В кислотно-свинцовом аккумуляторе происходят определенные химические реакции, в результате которых возникает электродвижущая сила.
В кислотно-свинцовом аккумуляторе происходят определенные химические реакции, в результате которых возникает электродвижущая сила.
В процессе разрядки батареи жидкая серная кислота вступает в реакцию с диоксидом свинца положительных пластин и свинцом отрицательных пластин. В результате образуется новые вещества — сульфат свинца, оседающий на электродах, и вода.
PbO2 + Pb + 2H2SO4 → 2PbSO4 + 2H2O
При зарядке АКБ происходит обратный процесс:
2PbSO4 + 2H2O → PbO2 + Pb + 2H2SO4
Очевидно, что если заменить любой из реагентов, включая электролит, то реакции пойдут по-другому, и не факт, что при этом возникнет ЭДС достаточного уровня. Поэтому использование серной кислоты завязано на протекание необходимых электрохимических процессов, и замена этого реагента, например, на соляную кислоту, к результату не приведет. Аккумулятор если и будет кое-как работать, то не выдаст нужных параметров по напряжению, токоотдаче и емкости.
Характеристики электролита
Кислота в стартерном аккумуляторе автомобиля должна иметь определенные параметры. Если они не соответствуют норме, батарея не будет обеспечивать заявленное напряжение, емкость и ток холодной прокрутки. В первую очередь надо следить за уровнем электролита. Его понижение означает недостаток реагента и снижение емкости батареи. Также пониженный уровень может привести к высыханию и осыпанию части активной массы пластин. Эта неисправность необратима и ведет к снижению емкости АКБ. Но не менее важно контролировать плотность жидкого реагента.
Норма плотности и контроль зимой и летом
Плотность является значимой характеристикой электролита. Она определяется соотношением воды и кислоты в жидкости. Плотность воды при нормальных условиях составляет 1 г/куб.см, а концентрированной серной кислоты – 1,83 г/куб.см. Очевидно, что чем больше в электролите воды, тем ниже ее плотность. И наоборот, чем больше кислоты, тем плотность выше. Свинцово-кислотные батареи изобретены еще в XIX веке, за это время выяснено оптимальное соотношение воды и серной кислоты – 1:2. Это дает плотность 1,27 куб.см.
Она определяется соотношением воды и кислоты в жидкости. Плотность воды при нормальных условиях составляет 1 г/куб.см, а концентрированной серной кислоты – 1,83 г/куб.см. Очевидно, что чем больше в электролите воды, тем ниже ее плотность. И наоборот, чем больше кислоты, тем плотность выше. Свинцово-кислотные батареи изобретены еще в XIX веке, за это время выяснено оптимальное соотношение воды и серной кислоты – 1:2. Это дает плотность 1,27 куб.см.
Выше показано, что при разряде H2SO4 расходуется с образованием воды. Поэтому плотность электролита разряженного аккумулятора падает. При зарядке плотность снова растет, и надо стремиться, чтобы удельный вес жидкого реагента при полном запасе энергии составлял заветные 1,27 куб.см. Пониженная плотность ведет к неполному протеканию реакций и ухудшению параметров батареи. Повышенная – к усиленной коррозии пластин и сокращению срока службы батареи.
Читайте также
Как повысить плотность электролита в аккумуляторе
Эта цифра идеальна для температуры +25 град. С. Но климатические условия на территории России таковы, что зимой температура эксплуатации в большинстве регионов намного ниже, а летом – намного выше. Поэтому плотность в районах с умеренным надо корректировать в зависимости от сезона:
С. Но климатические условия на территории России таковы, что зимой температура эксплуатации в большинстве регионов намного ниже, а летом – намного выше. Поэтому плотность в районах с умеренным надо корректировать в зависимости от сезона:
- Зимой надо добиваться несколько более высокой плотности – 1,28..1,29 г/куб.см.
- Летом – чуть более низкой – 1,26..1,25 г/куб.см.
Для самых северных и самых южных регионов страны удельный вес аккумуляторной кислоты надо держать круглогодично:
- для районов крайнего севера – 1,29 г/куб.см;
- для южных и субтропических областей, где зиа практически отсутствует – 1,24..1,25 г/куб.см.
Надо помнить, что пониженная плотность в зимнее время может привести к замерзанию электролита. Это означает выход аккумулятора из строя.
Корпус и платины АКБ, деформированные в результате замерзания жидкости.Рекомендуем: Какая должна быть плотность в автомобильном аккумуляторе
Срок службы и возможность замены
Кислотный электролит может прослужить без замены весь срок эксплуатации аккумулятора.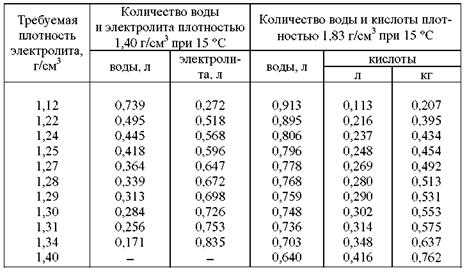 Надо лишь следить за плотностью и вовремя ее корректировать, доливая по необходимости воду или кислоту. Но есть ситуации, когда жидкий реагент придется заменить. Например, если плотность в результате глубокого разряда упала ниже 1,1 г/куб.см. Зарядкой параметры такого электролита не восстановить, придется менять.
Надо лишь следить за плотностью и вовремя ее корректировать, доливая по необходимости воду или кислоту. Но есть ситуации, когда жидкий реагент придется заменить. Например, если плотность в результате глубокого разряда упала ниже 1,1 г/куб.см. Зарядкой параметры такого электролита не восстановить, придется менять.
Также замена нужна, когда электролит изменил свой цвет на серый. Это означает осыпание части активной намазки, емкость батареи при этом снижается, но ее еще можно некоторое время эксплуатировать, если есть крайняя необходимость. Если цвет жидкости изменился на коричневый, это означает короткое замыкание пластин внутри банки. Заменять электролит без ремонта элемента нет смысла.
Жидкость коричневого цвета – признак КЗ.Серная кислота является незаменимым реагентом в свинцово-кислотной батарее. И так будет, пока этот тип аккумуляторов не будет вытеснен другими технологиями, но это дело достаточно далекого будущего.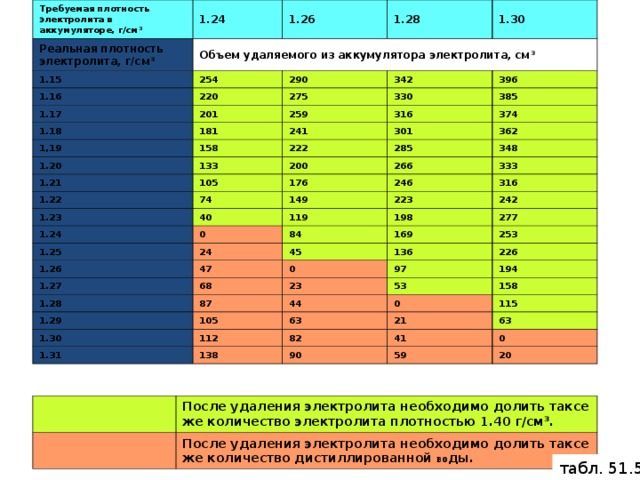
Какая кислота применяется в аккумуляторах автомобиля — название жидкости, используемой в АКБ, соляная кислота в аккумуляторе
Многих пользователей интернета интересует, какая кислота в аккумуляторе автомобиля используется и каковы ее свойства? Вопрос на самом деле очень интересный, потому что ответ связан с особенностями химического процесса, который непрерывно протекает в батарее. Рассмотрим строение и особенности химических реакций, также обсудим, как на них можно повлиять, чтобы улучшить эффективность работы АКБ.
Использование кислоты и ее типы
Независимо от типа источника питания, в аккумуляторе в любом случае используется серная кислота. Притом, она там находится не в виде концентрата, а в растворе, то есть в разбавленном состоянии. Концентрация серной кислоты по отношению к воде составляет 1:2,5. То есть, 35% от всего объема занимает кислота и 65% — дистиллированная вода. Именно такой состав используется во всех распространенных батареях для автомобиля.
Все автомобильные аккумуляторы можно разделить на 2 типа по виду электролита: кислотные и щелочные. К первым относится абсолютное большинство, и они также существуют нескольких видов:
- свинцово-сурьмянистые классические;
- кальций-сурьмянистые или кальций-кальциевые;
- AGM с абсорбером в виде стекловолоконного наполнителя;
- гелевые Gel.
В батареях AGM содержится та же серная кислота, только ей пропитан специальный волокнистый наполнитель. Это дает возможность обеспечивать надежный контакт с пластинами в любом пространственном положении. Данное свойство сделало возможным их применение в речном транспорте, который подвержен качке. В гелевых электролит связан и не растекается, за счет чего пластины всегда контактируют с диэлектриком. Состав электролита и концентрация остаются прежними. В нем содержится 35% серной кислоты h3SO4, что является наиболее оптимальным соотношением для нормальной работы источника постоянного тока в любых условиях.
Область применения серной кислоты
Серная кислота является универсальным химикатом, используемым во множестве отраслей. Но основное ее предназначение — травление металла. Существуют технологии выполнения таким способом на стальных изделиях рисунков и нанесения фирменных знаков. Существенная ее доля применяется в производстве свинцово-кислотных аккумуляторов в разбавленном с дистиллированной водой виде.
В аккумуляторной промышленности для производства электролитической жидкости используется несколько сортов серной кислоты:
- Нитрозная. Ее концентрация составляет не более 75%, плотность не превышает 1,67г/см3. Название связано с технологией производства в башнях нитрозным методом.
- Контактная. Ее концентрация составляет 92,5-98%, плотность вещества выше нитрозной и составляет 1,837 г/см3.
- Аккумуляторная. Ее концентрация составляет 92-94 %, плотность вещества — 1,835 г в см куб. Это специальная кислота для производства АКБ, но разбавляется в разной концентрации и, как правило, в 2 этапа.
 Сразу в большей, для хранения между производственными операциями, а затем в нормированной ГОСТами.
Сразу в большей, для хранения между производственными операциями, а затем в нормированной ГОСТами.
Химические реакции в автомобильном аккумуляторе
Выбирая электролит в автомобильный аккумулятор, следует понимать, какие химические реакции в нем протекают. Это даст общее понятие о количестве активного вещества, которое нужно добавить в жидкость.
Аккумулятор состоит из парных пластин, которые погружены в водный раствор серной кислоты. Пластины заполнены диоксидом свинца, представляющим собой пористый материал, зафиксированный в решетках. Электроды изготовлены не из чистого свинца, а из сплава. Добавляемым компонентом может быть сурьма или кальций в зависимости от типа батареи.
В состоянии покоя электроны сконцентрированы возле положительного вывода и там наблюдается их избыток. На отрицательном электроде их недостаточно. Когда замыкается цепь, они начинают перемещаться по пути наименьшего сопротивления от плюса к минусу. Внутри происходит реакция разложения серной кислоты и соединение ее продуктов со свинцом с образованием воды и сульфата свинца. Он представляет собой белый налет на пластинах, который частично осыпается на дно банок. На отрицательном электроде также наблюдается реакция соединения свинца и сульфида с образованием сульфата.
Он представляет собой белый налет на пластинах, который частично осыпается на дно банок. На отрицательном электроде также наблюдается реакция соединения свинца и сульфида с образованием сульфата.
В процессе зарядки происходит гидролиз и электрохимическая реакция восстановления серной кислоты, металлического свинца и диоксида свинца до исходного состояния. Электроны вновь концентрируются вблизи положительного вывода.
Особенности восстановления электродов
К особенностям работы свинцово-кислотной батареи относится то, что электроды восстанавливаются не полностью. Всегда какие-то микрочастицы оседают на дно емкости, где накапливаются, а толщина контактного элемента уменьшается. В результате этого процесса неизбежно:
- уменьшается плотность электролита в аккумуляторе;
- сокращается величина отдаваемого максимального тока из-за разрушения электродов и обсыпания активной пасты;
- увеличивается время зарядки, так как раствор засоряется и интенсивность зарядки сильно падает;
- уменьшается внутреннее сопротивление из-за увеличения проводимости диэлектрика.

В процессе заряда/разряда постоянно меняется плотность жидкости в аккумуляторе. В новых необслуживаемых моделях гибридного типа имеется специальный индикатор. По сути, встроенный ареометр, по которому можно проконтролировать состояние зарядки или разрядки, а также уровень электролита.
В нормальном состоянии, при температуре окружающей среды 25 градусов, плотность составляет 1,23-1,28 г/см3. По мере разрядки она снижается до 1,19 г/см3. Если разрядка батареи продолжится, то к плотности 1,15 на пластинах будет сформирован толстый слой сульфата свинца.
Если аккумулятора\ авто оказался в глубоком разряде впервые или второй раз, количество сульфата не блокирует работу источника тока. Его еще можно восстановить, применив комбинированный метод. Сначала на выводы подается обратное напряжение, а затем прямое с малым током. Электрический стресс должен способствовать стряхиванию частиц сульфата в раствор, где они должны вступить в реакцию восстановления металлического свинца и диоксида свинца.
Зависимость плотности батареи от температуры
Напомним, что емкость в аккумуляторе сильно зависит от температуры. В таблице представлены данные исследований.
|
Плотность, г/см3 |
Напряжение без нагрузки, В |
Напряжение с нагрузкой (100А), В |
Состояние заряда, % |
Температура, оС |
|
1,11 |
11,7 |
8,4 |
0 |
-7 |
|
1,15 |
11,94 |
9 |
25 |
-13 |
|
1,21 |
12,3 |
9,9 |
62,5 |
-32 |
|
1,27 |
12,66 |
10,8 |
100 |
-60 |
Сразу после снятия батареи с зарядного устройства на его вводах регистрируется напряжение до 15 В, но даже без нагрузки в течение нескольких минут оно опускается до номинального 12,6В. Даже за такое короткое время на пластинах уже начинает образовываться слой сульфата свинца. Именно по этой причине крайне нежелательно регулярно заряжать АКБ от внешнего устройства без активного контроля. Это, как ни странно, после его отключения способно быстро привести к состоянию разряда из-за сформированного слоя сульфата. Следует применять заводские приборы, способные контролировать процесс и отключать зарядку при достижении заданной емкости и величины тока.
Даже за такое короткое время на пластинах уже начинает образовываться слой сульфата свинца. Именно по этой причине крайне нежелательно регулярно заряжать АКБ от внешнего устройства без активного контроля. Это, как ни странно, после его отключения способно быстро привести к состоянию разряда из-за сформированного слоя сульфата. Следует применять заводские приборы, способные контролировать процесс и отключать зарядку при достижении заданной емкости и величины тока.
Обслуживание аккумулятора
Каждый аккумулятор нуждается в проведении регулярной диагностики его электрических и физических параметров. Пользователи старых кислотных батарей с этим процессом хорошо знакомы. В еще более ранних моделях доливать воду требовалось еще чаще, из-за несовершенства технологии производства. Современные модели, даже самые дешевые, нуждаются в этом крайне редко. Необходимость выполнить доливку может возникать только на 4-5 году эксплуатации для продления работы батареи не более, чем на 1 год.
Причины доливки электролита:
- Длительный срок службы батареи, так как в процессе работы жидкость постепенно испаряется, точнее, испаряется в ней вода, так как кислота не способна на это из-за отсутствия в ней летучего водорода.

- Закипание из-за нарушения режима зарядки аккумулятора. Перезарядка и длительное воздействие большим током приводит именно к таким результатам.
- Течь электролита из поврежденного корпуса. Утечку нужно быстро обнаружить и устранить, потому что электролит очень опасен для кожи любой органики в целом. Даже при попадании серной кислоты на руки, их срочно нужно тщательно вымыть, пока не образовался серьезный ожог. Выполнять доливку и измерения данного химиката нужно в защитной экипировке.
Проверка уровня электролита
Если на корпусе нет индикатора состояния заряда батареи, но это обслуживаемая модель источника тока, то проверить уровень электролита можно через пробку. Для этого установите батарею на горизонтальную поверхность и открутите пробки со всех 6-ти банок. Затем возьмите прозрачную трубку, а если такой нет, то можно воспользоваться корпусом от старой шариковой ручки. Важно, чтобы пластмасса была наполовину прозрачной, и через нее можно было определить фактический уровень вещества. Итак, вы нашли трубку. Опустите ее в каждую банку по очереди и упретесь в пластины. Зажмите отверстие сверху и поднимите трубку. Уровень электролита в ней должен составлять 10-12 мм. Это важно, так как именно при таком значении обеспечивается оптимальная эффективность работы источника питания и обеспечено его сбалансированное химическое количество.
Итак, вы нашли трубку. Опустите ее в каждую банку по очереди и упретесь в пластины. Зажмите отверстие сверху и поднимите трубку. Уровень электролита в ней должен составлять 10-12 мм. Это важно, так как именно при таком значении обеспечивается оптимальная эффективность работы источника питания и обеспечено его сбалансированное химическое количество.
Если уровень меньше, что очевидно, так как в нутрии протекает необратимый химический процесс, связанный с постоянным убавлением электролита, то его нужно добавлять. Для этого приобретите дистиллированную воду и долейте в каждую банку ровно столько, сколько необходимо.
Измерение плотности электролита
Чтобы объективно оценить состояние аккумулятора, необходимо также измерить его плотность. Это важная процедура, которая может сказать, стоит ли что-то делать с батареей или ее лучше утилизировать и заменить на новую. Процесс заключается в применении ареометра. Это специальный прибор, с помощью которого определяется химическое количество активного вещества.
Ареометр представляет собой стеклянную трубку, внутри которой находится ртуть. Также есть модели с дробью, они показывают значение не хуже ртутных устройств. На верхней части прибора расположена шкала. На нее нанесен ограниченный диапазон измерений в пределах от 1,1 до 1,3 г на см куб. Устройство находится внутри стеклянной колбы, на верхушке которой располагается груша. Для определения плотности электролита необходимо выполнить следующие действия:
- Опустить нижнюю часть колбы в банку и надавить на грушу.
- Затем нужно отпустить грушу, тем самым, набрав электролита.
- Далее нужно вынуть прибор и определить по шкале значение.
Существуют модели ареометров, в которых вместо шкалы используются надписи: «Полный заряд», «Половина» и «Разряжен». Суть из-за смены градуировки не меняется, и принцип измерения плотности остается прежним.
В случае заниженного значения плотности, нужно произвести ее поднятие. В данном случае добавление воды нецелесообразно.
Для поднятия плотности необходимо:
- Из каждой банки откачать половину объема старого электролита.
- Восполнить его новым химикатом с плотностью не менее 1,275 г/см3.
- Для эффективного перемешивания жидкости в банках проще подключить небольшую нагрузку к выводам батареи, например, лампочку и подождать некоторое время. Химическая реакция начнется и электролит перемешается.
- Нужно еще раз измерить плотность тем же способом. В случае ее недостатка, химикат нужно долить еще.
- Повторяйте процедуры, пока плотность жидкости не поднимется до нормального уровня.
Как вы видите, восстановить работу АКБ своими силами можно в домашних условиях при наличии ареометра. Он стоит недорого, также его можно попросить у аккумуляторщиков. Электролит можно купить в готовом виде, поэтому самостоятельно ничего разводить не нужно.
Он стоит недорого, также его можно попросить у аккумуляторщиков. Электролит можно купить в готовом виде, поэтому самостоятельно ничего разводить не нужно.
Статью подготовил:
Интернет-магазин AKBMOSCOW
Автомобильный свинцово-кислотный аккумулятор
Свинцово-кислотные аккумуляторы были первым изобретенным типом перезаряжаемых аккумуляторов. Их изобрел в 1859 году французский физик Гастон Планте. Они очень полезны в транспортных средствах из-за их низкой стоимости, надежности, высокой устойчивости к неправильному обращению и большого отношения мощности к весу. свинцово-кислотные аккумуляторы используются не только в автомобилях, но и на подводных лодках, для освещения, в портативном оборудовании, в качестве неинтерпретируемых источников питания и т.д.
При зарядке каждая ячейка содержит электроды из элементарного свинца (Pb) и диоксида свинца (PbO 2 ), в электролите серной кислоты (H 2 SO 4 ). В разряженном состоянии оба электрода превращаются в сульфат свинца (II) (PbSO 4 ), а электролит теряет растворенную серную кислоту, превращаясь в основном в воду. В результате понижения точки замерзания воды батарея разряжается, и концентрация серной кислоты снижается, что делает батарею более восприимчивой к замерзанию в зимнюю погоду. (Технология аккумуляторов – гальванические элементы, хранящие химическую энергию. (nd).)
В результате понижения точки замерзания воды батарея разряжается, и концентрация серной кислоты снижается, что делает батарею более восприимчивой к замерзанию в зимнюю погоду. (Технология аккумуляторов – гальванические элементы, хранящие химическую энергию. (nd).)
Химические реакции от разряженного аккумулятора к заряженному следующие:
Однако у этого типа аккумуляторов есть несколько недостатков. Свинцово-кислотные автомобильные аккумуляторы могут быть очень опасны из-за открытых элементов с жидким электролитом, которые содержатся в подавляющем большинстве из них. Перезарядка высоким напряжением приведет к образованию газообразных кислорода и водорода в результате электролиза воды, создавая нестабильную смесь. (Зарядка свинцово-кислотного аккумулятора. (n.d.)) Кислотный электролит также может вызывать коррозию. Кроме того, они токсичны, и их неправильная утилизация может нанести серьезный вред окружающей среде. Они также очень тяжелые и громоздкие. Сульфатирование — это процесс, который может происходить в этих батареях, вызывая необратимые повреждения . Сульфатация может произойти, если аккумулятор хранится в течение длительного времени в полностью разряженном состоянии или в состоянии очень низкого заряда, или если он никогда не заряжается полностью, или если уровень электролита стал ненормально низким из-за чрезмерной потери воды в результате перезарядки и/или или испарения. Сульфатация — это увеличение внутреннего сопротивления батареи из-за образования крупных кристаллов сульфата свинца, которые не сразу превращаются обратно в свинец, диоксид свинца и серную кислоту во время перезарядки. В экстремальных случаях большие кристаллы могут вызвать деформацию и короткое замыкание пластин. Иногда сульфатацию можно исправить очень медленной зарядкой (низким током) при более высоком, чем обычно, напряжении. (Свинцово-кислотные аккумуляторы. (без даты))
Сульфатация может произойти, если аккумулятор хранится в течение длительного времени в полностью разряженном состоянии или в состоянии очень низкого заряда, или если он никогда не заряжается полностью, или если уровень электролита стал ненормально низким из-за чрезмерной потери воды в результате перезарядки и/или или испарения. Сульфатация — это увеличение внутреннего сопротивления батареи из-за образования крупных кристаллов сульфата свинца, которые не сразу превращаются обратно в свинец, диоксид свинца и серную кислоту во время перезарядки. В экстремальных случаях большие кристаллы могут вызвать деформацию и короткое замыкание пластин. Иногда сульфатацию можно исправить очень медленной зарядкой (низким током) при более высоком, чем обычно, напряжении. (Свинцово-кислотные аккумуляторы. (без даты))
Несмотря на то, что с момента изобретения батареи прошло 140 лет, до сих пор регулярно вносятся усовершенствования. Кроме того, несмотря на значительный прогресс в технологии и конкуренцию со стороны других типов аккумуляторов, свинцово-кислотные аккумуляторы остаются самыми популярными в своей области.
Автор: Уильям Андерсон (редакционная группа Schoolworkhelper)
Homepage
Репетитор и писатель-фрилансер. Учитель естественных наук и любитель сочинений. Последняя рецензия статьи: 2020 | Институт Святой Розмари © 2010-2022 | Креатив Коммонс 4.0
Почему на автомобильном аккумуляторе есть коррозия?
Каждый редакционный продукт выбирается независимо, хотя мы можем получать компенсацию или партнерскую комиссию, если вы покупаете что-то по нашим ссылкам. Рейтинги и цены точны, а товары есть в наличии на момент публикации.
Заметили белые порошкообразные вещества вокруг клемм аккумуляторной батареи вашего автомобиля? Это коррозия. Узнайте, почему автомобильные аккумуляторы ржавеют и что с этим делать.
Хорхе Вильяльба/Getty Images
Когда вы видите коррозию, это признак химического действия, в результате которого что-то постепенно распадается. В случае коррозии аккумулятора вашего автомобиля кислота внутри вступает в реакцию с металлом снаружи.
В случае коррозии аккумулятора вашего автомобиля кислота внутри вступает в реакцию с металлом снаружи.
На этой странице
Что вызывает коррозию аккумуляторной батареи
Если вы периодически открываете капот автомобиля, чтобы проверить масло, омывающую жидкость, трансмиссионную жидкость или что-либо еще, скорее всего, вы в конечном итоге увидите беловато-голубое гранулированное вещество. вокруг клемм аккумулятора. Это признак коррозии, и его нельзя игнорировать. Есть несколько возможных причин, но все они сводятся к одному: коррозионные жидкости или газы внутри батареи выходят и реагируют с металлическими контактами и клеммами батареи, вызывая их коррозию.
Если вы заметили коррозию на аккумуляторе, немедленно очистите клеммы и кабельные разъемы. Если коррозия аккумулятора проявится слишком долго, это может привести к тому, что клеммы аккумулятора перестанут работать должным образом, что нанесет вред аккумулятору и транспортному средству. Важно очистить клеммы аккумулятора от коррозии, а также понять, почему это происходит.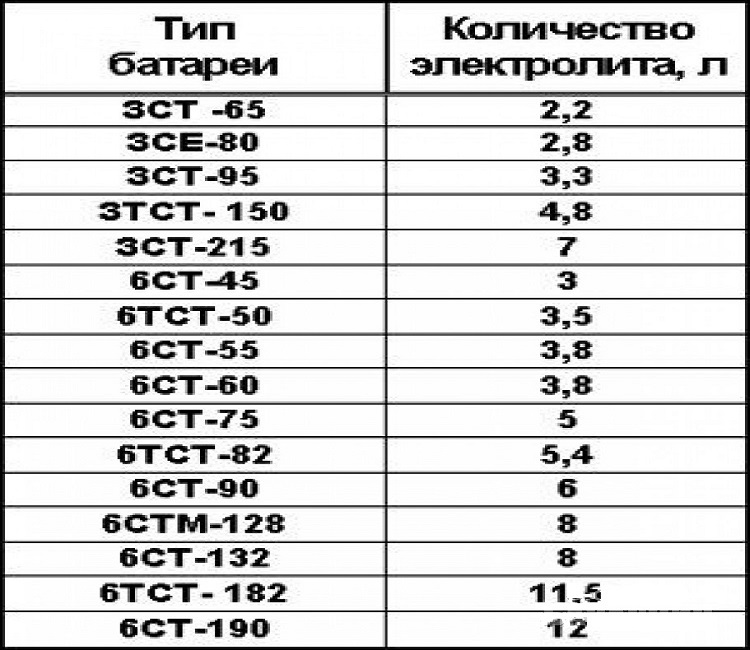
Утечка жидкости из аккумуляторной батареи
Все автомобильные аккумуляторные батареи содержат смесь серной кислоты и воды, которая вступает в реакцию с пластинами из свинцового сплава внутри корпуса аккумуляторной батареи, что приводит к выработке электроэнергии. Аккумуляторы старого образца (также известные как необслуживаемые или многоразовые) имеют съемные крышки для проверки и долива кислотного раствора дистиллированной водой, если он становится низким. Эти крышки имеют крошечные вентиляционные отверстия, через которые может вытекать небольшое количество кислоты, если батарея переполнена.
Если вытекшая серная кислота из аккумуляторной жидкости коснется клемм аккумуляторной батареи или контактов кабеля, это вызовет их коррозию. Если это продолжается достаточно долго, может образоваться большое отложение порошкообразной коррозии.
Тепло, выделяемое при перезарядке батареи, также может привести к утечке электролита из аккумулятора, поскольку жидкость расширяется и вытекает через вентиляционные отверстия.
Отвод газов
Даже если ваша батарея не является многоразовой, в ней есть небольшие вентиляционные отверстия, через которые могут выходить сернистые газы внутри. Если эти выделяющиеся газы регулярно контактируют с клеммами аккумулятора или кабелями, может возникнуть коррозия. Является ли это причиной проблемы с коррозией вашей батареи, зависит от расположения вентиляционных отверстий вашей батареи и от того, сколько газа выходит через них.
Старая батарея
Если вашей батарее больше пяти-семи лет, вероятно, срок ее службы приближается к концу, и она постепенно теряет способность удерживать заряд. Когда батареи достигают этой стадии, следует ожидать коррозии вокруг клемм. Если вы исключили утечку электролита из аккумулятора как причину коррозии, а срок службы аккумулятора составляет пять или более лет, проведите несколько тестов, чтобы определить, не требуется ли его замена.
Удаление следов коррозии
Если вы не перезаряжали аккумулятор или он не перезаряжаемый, и вы не переполнили его, вы мало что можете сделать, чтобы предотвратить появление коррозии.

 Сразу в большей, для хранения между производственными операциями, а затем в нормированной ГОСТами.
Сразу в большей, для хранения между производственными операциями, а затем в нормированной ГОСТами.
