Неисправность коробки передач Toyota Сorolla — причины, способы устранения неисправности КПП Тойота Королла
Если какая-либо из передач на автомобиле модели «Тойота Королла» отказывается включаться, можно устранить неисправность самостоятельно. В ситуации, когда это сделать не удается, стоит обратиться в специализированные технические центры официального дилера японской марки Тойота Люберцы и Тойота Измайлово.
Возможные причины неисправности
Нарушения в переключении передач на автомобилях, оснащенных механическими коробками передач ММТ, могут происходит по ряду причин.
- Может быть нарушено функционирование цилиндров системы сцепления — рабочего или главного.
- Возможно, состояние трубопровода, соединяющего рабочий и главный цилиндры системы, нарушено.
- Еще одна причина — нарушения в состоянии троса, отвечающего за включение передачи.
- Могут быть изношены элементы сцепления (1 ряд): речь идет о фрикционных настройках, маховиках, ведомом диске сцепления, выжимном подшипнике или нажимном диске;
- Износившиеся элементы системы сцепления (синхронизаторы, шестерни, подшипники) также могут стать причиной невозможности включить передачу.

При наличии роботизированной коробки передач ММТ нарушения в переключении передач, как правило, возникают, когда
- сцепление (ряд 1) перегревается: об это свидетельствует звуковой сигнал и включение лампы на приборной панели, сообщающей о том, что возникла неисправность;
- выходит из строя актуатор выжима;
- нарушается работа актуатора выбора передачи;
- детали системе сцепления изношены: нажимной диск, выжимной подшипник, фрикционные накладки ведомого диска сцепления, маховик.
Если в автомобиле установлены автоматическая коробка передач, нарушения в переключении сцепления могут быть вызваны
- неисправностью гидротрансформатора;
- нарушениями в работе гидроблока;
- проблемами в работе блока управления трансмиссией;
- снижением уровня трансмиссионной жидкости в коробке передач.
Самостоятельное устранение неисправности
В некоторых случаях нарушение можно исправить самостоятельно.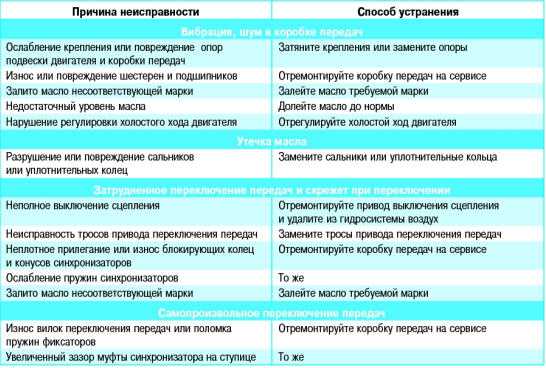 Так, если возник перегрев сцепления, рекомендуется остановить автомобиль, заглушить двигатель и подождать, пока сцепление остынет. Затем можно двигаться снова.
Так, если возник перегрев сцепления, рекомендуется остановить автомобиль, заглушить двигатель и подождать, пока сцепление остынет. Затем можно двигаться снова.
В ситуации, когда в автоматической коробке передач чрезмерно снижается уровень трансмиссионной жидкости, ее необходимо долить до нужного уровня. Проверить показатели при помощи щупа.
Устранение неполадок в техническом центре
При обращении автовладельца в наши технические центры с данной проблемой специалисты сначала диагностируют состояние системы, определяют причину поломки — тот элемент, который неисправен.
Далее выполняется замена поврежденной детали или узла. Работа трансмиссии тестируется.
Для записи обращайтесь к менеджерам продаж нашей компании по телефону или через форму заказа обратного звонка.
Запись на ТО
Возможные неисправности коробки передач и способы их устранения • Ремонт КамАЗ 4310, 43114, 43118, 65111
Затрудненное включение всех передач, передача заднего хода и первая передача включаются со скрежетом.
• Неполное выключение сцепления (сцепление «ведет»).
Устранение: Отрегулировать свободный ход муфты выключения сцепления.
Большое усилие на рычаге переключения передач.
• Загрязнение опор тяг дистанционного управления.
• Отсутствие или загустевание смазочного материала.
Устранение: Промыть опоры и заполнить их свежей смазкой.
Включение второй, третьей, четвертой и пятой передач с ударом и скрежетом.
• Износ конусных колец синхронизатора, блокирующих фасок.
• Снижение усилия, необходимое для вывода кареток из нейтрального положения.
Устранение: Заменить синхронизатор пальцев и каретки.
Износ сухарей вилки переключения передач делителя.
• Отсутствие вывода воздуха в окружающую среду при переключении передач в делителе, обусловленное загрязнением каналов и сапуна клапана.
 При сборке клапана все трущиеся поверхности смазать смазкой № 158 включения делителя.
При сборке клапана все трущиеся поверхности смазать смазкой № 158 включения делителя.• Отсутствие зазора между кареткой синхронизатора и сухарем вилки переключения передач.
Устранение: Отрегулировать зазор.
Самовыключение передач при движении автомобиля.
• Неполное выключение передачи из-за неисправности фиксаторов механизма переключения, износа лапок или сухарей вилок, ослабление крепления вилок и рычагов, нарушение регулировки дистанционного управления.
Устранение: Подтянуть детали крепление, заменить изношенные детали, отрегулировать привод дистанционного управления
• Отказ в работе замка шлицев вторичного вала.
Устранение: Заменить вал и соответствующий синхронизатор.
Передачи не включаются в основной коробке
• Износ деталей и нарушение регулировки дистанционного привода управления коробкой.
Устранение: Отрегулировать привод и заменить изношенные детали, подтянуть детали крепления.
• Разрушение подшипников зубчатых колес вторичного вала.
Устранение: Заменить неисправные детали.
Повышенный уровень шума при работе коробки передач
• Повышенный износ или поломка зубьев зубчатых колес. Разрушение подшипников зубчатых колес.
Устранение: Заменить неисправные детали.
• Разрушение подшипников валов. Устранение: Заменить неисправные детали.
Передачи не включаются в делителе
• Заедание поршней воздухораспределителя.
Устранение: Разобрать, промыть и смазать детали воздухораспределителя.
• Нарушение регулировки положения упора клапана включения делителя.
Устранение: Отрегулировать положение упора клапана.
• Поломка упора клапана.
Устранение: Заменить упор.
• Засорение пневмосистемы управления делителем.
Устранение: Промыть и продуть дросселирующие отверстия, воздухопроводы и клапаны.
• Обрыв троса крана управления делителем.
Устранение: Заменить трос.
Течь масла из коробки передач.
• Износ манжет или потеря ими эластичности.
Устранение: Заменить манжеты.
• Повышенное давление в картере коробки передач.
Устранение: Промыть сапун.
• Нарушение герметичности по уплотняющим поверхностям.
Устранение: Подтянуть детали крепления или заменить прокладки.
Износ латунных колец синхронизаторов основной коробки
• Неполное выключение сцепления при переключении передач.
Устранение: Заменить синхронизаторы. Проверить работу сцепления и привода.
Износ латунных колец синхронизаторов делителя передач
• Нарушение регулировки упора клапана включения делителя.
Устранение: Заменить синхронизаторы. Отрегулировать положение упора клапана.
• Неполное выключение сцепления.
Устранение: Проверить исправность работы сцепления и привода.
Запчасти на КАМАЗ-4310 КамАЗ-5490 КПП КПП ZF Раздаточные коробки Редукторы
Покупайте запчасти у нас :
| Комплектуем заявки любой сложности, конкурентные цены, система скидок от объема. | |
| Мы даем понятную гарантию качества запчастей от производителей | |
| Оперативная доставка по России | |
| Звоните по телефону , или напишите на [email protected] Потребуется информация: модель авто, год выпуска, модель агрегата, класс Евро. |
19.5: Нарушение контрольных точек клеточного цикла может вызвать рак
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 16538
- Gerald Bergtrom
- University of Wisconsin-Milwaukee
Если контрольная точка выходит из строя, или если клетка подвергается физическому повреждению хромосом во время клеточного деления, или если она подвергается изнурительной соматической мутации в предыдущей фазе S , она может самоуничтожиться в ответ на последующую биохимическую аномалию.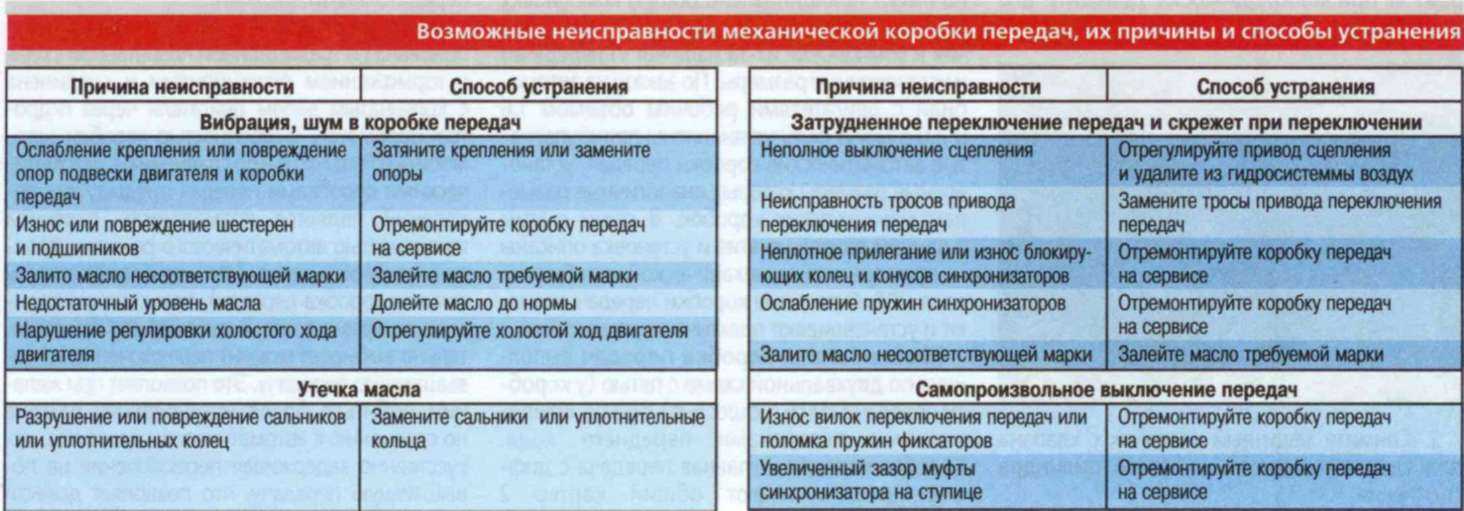 Это еще один пример апоптоза . С другой стороны, когда клетки умирают от внешнего повреждения, они подвергаются некрозу , случайной , а не запрограммированной смерти. В клетках, показанных ниже, химически индуцировали апоптоз или некроз, после чего идентифицировали как апоптоз или некроз с использованием флуоресцентных маркеров (йодид пропидия, зеленый; акридиновый оранжевый, оранжевый).
Это еще один пример апоптоза . С другой стороны, когда клетки умирают от внешнего повреждения, они подвергаются некрозу , случайной , а не запрограммированной смерти. В клетках, показанных ниже, химически индуцировали апоптоз или некроз, после чего идентифицировали как апоптоз или некроз с использованием флуоресцентных маркеров (йодид пропидия, зеленый; акридиновый оранжевый, оранжевый).
Только зелено-флуоресцирующие (апоптотические) клетки в конечном итоге образуют апоптотические тельца. Напротив, некротические (флуоресцирующие оранжевым цветом) клетки теряют свои плазматические мембраны, не образуют таких «тел» и в конечном итоге распадаются. (400-кратное увеличение). Различия в ультраструктуре между некрозом и апоптозом также видны на электронных микрофотографиях колбочек и палочек (слева и справа соответственно) ниже. Звездочка указывает на цитоплазматическое набухание, характерное для некротического конуса. Белые стрелки указывают на ядра, характерные для апоптоза палочек.
Как мы уже отмечали, циклические клетки продолжают делиться, пока не достигнут G 0 в терминально дифференцированном состоянии. Большинство терминально дифференцированных клеток очищаются путем апоптоза , когда они достигают конца своей эффективной жизни, чтобы быть замененными стволовыми клетками. Мы также отметили, что случайная передача сигналов может вывести клетки из G 0 , что приведет к возобновлению клеточной пролиферации. Хотя эти клетки явно аномальны, они не обнаруживаются механизмами защиты от апоптоза. Таким образом, они подвергаются неконтролируемому клеточному делению, становясь раковыми клетками. Точно так же физически поврежденные или мутировавшие клетки могут иногда не подвергаться апоптозному клиренсу. Когда они это сделают, они также могут стать раковыми клетками. Апоптотический клиренс и неконтролируемая пролиферация раковых клеток сравниваются ниже
346 Апоптоз (запрограммированная гибель клеток) и некроз
A.
 Белок P53 опосредует нормальный контроль клеточного цикла
Белок P53 опосредует нормальный контроль клеточного циклаРаковый рост может возникнуть, если нормальная делящаяся клетка подвергнется соматической мутации, нарушающей нормальный контроль клеточного цикла. Подумайте, например, о чрезмерном выражении cdk . В качестве альтернативы представьте себе уровня циклина в дочерних клетках, которые никогда не падают; такие клетки никогда не перестанут циркулировать.
Другие возможности включают ячейку в G 0 , который стимулируется к возобновлению цикла из-за неподходящей встречи с гормоном или другим сигналом. Если их не обнаружить, эти аномалии могут трансформировать клетки в раковые. Белок p53 (показан ниже) представляет собой ДНК-связывающий белок, регулирующий гены, который обнаруживает некоторые из этих аномалий и позволяет делящимся клеткам восстанавливать повреждения, прежде чем пройти контрольные точки клеточного цикла… или, если это не удастся, приведет к апоптозу. клетки.
клетки.
Неудивительно, что мутации в гене белка P53 (называемого у людей TP53 ) связаны со многими видами рака человека (поджелудочной железы, легких, почечных клеток, молочной железы и т. д.). Половина случаев рака у человека связана с мутацией генов p53 . Таким образом, p53 является одним из класса белков-супрессоров опухолей . Исследования людей с состоянием, известным как LFS ( синдром Ли-Фраумени ), выявили по крайней мере одну мутацию аллель р53 . Мутация приводит к ~ 100% риску развития рака в течение всей жизни, начиная с детства. В культивируемых клетках мутагенизированные гены p53 проявляют ключевые характеристики раковых клеток, включая нерегулируемую клеточную пролиферацию и подавление апоптоза.
1. Как работает p53
Белок p53 обычно связан с активным белком Mdm2 . Чтобы включить контрольные точки клеточного цикла, p53-Mdm2 должны быть разделены и храниться отдельно, чтобы дать p53 время для действия. В делящихся клетках физический стресс или химический стресс, например, повреждение ДНК во время роста клеток, могут активировать
В делящихся клетках физический стресс или химический стресс, например, повреждение ДНК во время роста клеток, могут активировать
Каждый из белков и ферментов, фосфорилированных киназой ATM, играет роль в функционировании контрольной точки клеточного цикла и остановке клеточного цикла при исправлении ошибок:
- Теперь отделено от Mdm2, Phospho-p53 активно активирует несколько генов, включая ген p21 .
- Белок P21 связывается с cdks ; циклины не могут связываться с P21-cdks .
- Active Phospho-Chk2 катализирует фосфорилирование циклина; фосфоциклины не могут связываться с p21-cdks .

- Неспособность циклинов связывать cdks специфически блокирует клеточный цикл между G 1 и S , а также фазы G 2 -к- M .
Эти опосредованные киназой события в контрольных точках клеточного цикла проиллюстрированы ниже.
Клеточный цикл остается остановленным, пока клетка пытается завершить основные биохимические процессы, необходимые для исправления вызванных стрессом или других физических или химических аберраций, прежде чем перейти к следующей фазе цикла. Если репарация ДНК или другие исправления успешны, клетка может перейти к следующей фазе.
Если нет, протеасомы нацелены на деградацию комплекса Chk2-циклин . Аналогичным образом любой P53 , остающийся связанным с нефосфорилированным Mdm2 , также подвергается разрушению протеасомами. В результате любая клетка, неспособная исправить последствия стресса или химического повреждения или восстановить повреждение ДНК, становится мишенью для апоптоза .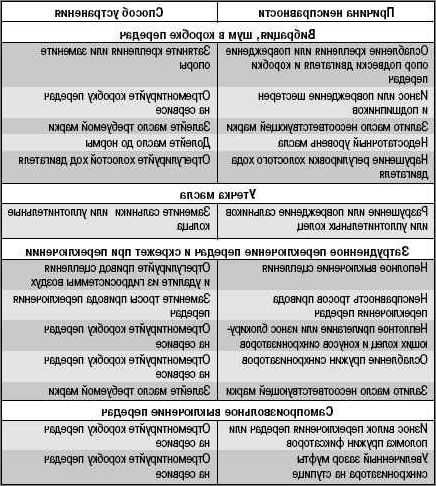
Уровни и активность p53 , а также других белков, обсуждавшихся выше, контролируют как количество p53 белок, способный реагировать на аномалии клеточного цикла, и сам ответ. Фосфорилирование (активация) p53 приводит не только к быстрой остановке клеточного цикла, но и к активации генов, кодирующих белки, необходимые для репарации ДНК и белков, необходимых для апоптоза (в случае неудачи попыток репарации) . Взаимодействия p53 с различными белками, приводящие к альтернативным клеточным судьбам, суммированы ниже.
Подводя итог, можно сказать, что p53 подавляет рост злокачественных опухолей либо за счет
- , позволяя репарировать ДНК или другие клетки до возобновления нормального клеточного цикла, предотвращая нерегулируемые клеточные деления; после восстановления p53 и другие белки инактивируются и/или разрушаются, и клеточный цикл может возобновиться.

- Неспособность восстановить/исправить проблемы клеточного цикла запускает события, ведущие к апоптозу, тем самым также блокируя онкогенез путем уничтожения поврежденных клеток.
Теперь должно быть ясно, почему мутант p53 , который снижает или устраняет выработку белка p21 или блокирует выработку необходимого белка репарации ДНК, позволяет поврежденным клеткам проникать в S и поддерживать их репликацию и деление, превращая их в раковые клетки. Интересно, что по сравнению с людьми от рака умирают лишь немногие киты или слоны, несмотря на то, что у них в тысячи раз больше клеток, чем у людей. Причина, по-видимому, в том, что, по крайней мере, у слонов целых 20 копий (40 аллелей) генов p53! Таким образом, мутация в одном аллеле одного из них может оказывать незначительное влияние, в то время как преобладают опухоле-репрессирующие эффекты остальных генов р53. Прочтите об этом недавнем исследовании на сайте Киты и слоны не болеют раком!
2.
 Центральная роль р53 в регуляции клеточного цикла
Центральная роль р53 в регуляции клеточного циклаИз-за его многочисленных ролей в регуляции и содействии репарации ДНК, а также в контроле контрольных точек клеточного цикла р53 был назван « Хранителем генома »! Вот еще одно свидетельство этой центральной роли.
a) «Онкогенные вирусы»
Вирусы, вызывающие рак, включают вирус папилломы человека ( HPV ), вирус Эпштейна-Барра ( EBV ), вирус иммунодефицита человека (0032 ВИЧ ), вирусы гепатита В и С ( HBV, HCV ), вирус герпеса человека 8 ( HHV-8 ) и обезьяний вирус 40 ( SV40 ).
Доказана связь между SV40, p53 и раком. SV40 является вирусным контаминантом вакцин против полиомиелита, которые использовались в 1960-х годах. Вирус является онкогенным у млекопитающих, хотя связь SV40 и рака у людей не доказана. В инфицированных клетках ДНК SV40 проникает в ядро, где может интегрироваться в геном клетки-хозяина.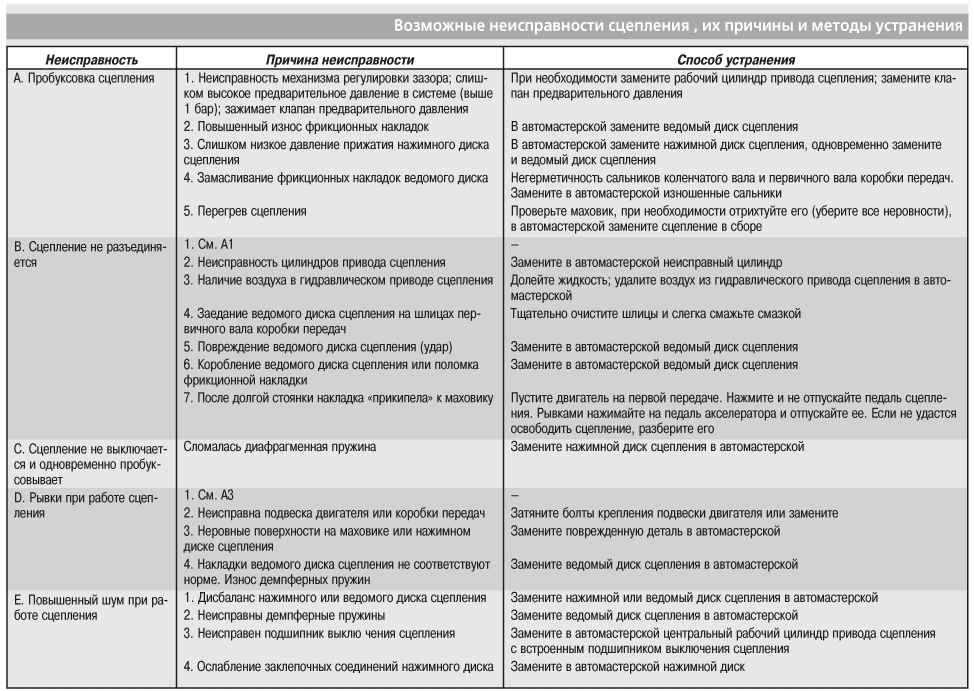 Инфекции SV40 обычно латентны (т. е. не причиняют вреда). Однако активация может привести к клеточной трансформации и росту злокачественных сарком в мышцах, а также опухолей в других органах. РНК-полимераза II в инфицированных клетках транскрибирует гены SV40, продуцируя белки, которые реплицируют и инкапсулируют вирусную ДНК в мембрану для создания новых вирусных частиц. Однако относительно небольшой геном SV40 не кодирует все ферменты и факторы, необходимые для репликации вирусной ДНК. Инфицированные клетки сами обеспечивают эти факторы, производя их только в течение 9 дней.0032 S фаза. В это время большой Т-антиген SV40 (выработанный вскоре после заражения) проникает в ядро клетки-хозяина, где он регулирует транскрипцию генов, необходимых для репликации вируса и образования вирусных частиц. Большой Т-антиген также связывается с р53 , препятствуя транскрипции белков, гены которых регулируются р53 . Неспособная выполнять функции контрольной точки, клетка-хозяин бесконтрольно делится, образуя раковые опухоли.
Инфекции SV40 обычно латентны (т. е. не причиняют вреда). Однако активация может привести к клеточной трансформации и росту злокачественных сарком в мышцах, а также опухолей в других органах. РНК-полимераза II в инфицированных клетках транскрибирует гены SV40, продуцируя белки, которые реплицируют и инкапсулируют вирусную ДНК в мембрану для создания новых вирусных частиц. Однако относительно небольшой геном SV40 не кодирует все ферменты и факторы, необходимые для репликации вирусной ДНК. Инфицированные клетки сами обеспечивают эти факторы, производя их только в течение 9 дней.0032 S фаза. В это время большой Т-антиген SV40 (выработанный вскоре после заражения) проникает в ядро клетки-хозяина, где он регулирует транскрипцию генов, необходимых для репликации вируса и образования вирусных частиц. Большой Т-антиген также связывается с р53 , препятствуя транскрипции белков, гены которых регулируются р53 . Неспособная выполнять функции контрольной точки, клетка-хозяин бесконтрольно делится, образуя раковые опухоли. Дерегуляция клеточного цикла на большой Т-антиген обеспечивает переход к S-фазе и нерегулируемую корепликацию ДНК вируса и клетки-хозяина.
Дерегуляция клеточного цикла на большой Т-антиген обеспечивает переход к S-фазе и нерегулируемую корепликацию ДНК вируса и клетки-хозяина.
b) p53 и передача сигнала
Стресс может активировать пути передачи сигнала. Например, мутации, влияющие на сигнальный путь MAPK (MAP kinase), могут приводить к онкогенезу. Это может быть объяснено наблюдением, что при активации путь MAPK приводит к усиленной продукции киназы, которая фосфорилирует p53 . Активный фосфо-р53 , в свою очередь, усиливает активацию пути передачи сигнала МАРК. Вы можете вспомнить, что передача сигнала MAPK обычно заканчивается митогенным ответом.
Другим примером взаимодействия р53 является белок FAK (киназа фокальной адгезии ). Активность FAK повышается за счет интегрина опосредованной передачи сигнала. Напомним, что мембранные интегрины связывают фибронектин , способствуя формированию внеклеточного матрикса, или ЕСМ . Повышенная активность FAK участвует в регуляции межклеточной и межклеточной адгезии ВКМ в фокальных точках адгезии . Другая роль FAK заключается в непосредственном связывании с неактивным p53 и увеличении связывания p53-Mdm2. Как мы только что видели, устойчивый p53-Mdm2 нацелен на убиквитинирование… и окончательное уничтожение! Фактически, аномально высокие уровни FAK связаны со многими различными линиями опухолевых клеток (толстая кишка, молочная железа, щитовидная железа, яичники, меланома, саркома…). Это происходит, когда p53 не может должным образом активировать контрольные точки клеточного цикла.
Повышенная активность FAK участвует в регуляции межклеточной и межклеточной адгезии ВКМ в фокальных точках адгезии . Другая роль FAK заключается в непосредственном связывании с неактивным p53 и увеличении связывания p53-Mdm2. Как мы только что видели, устойчивый p53-Mdm2 нацелен на убиквитинирование… и окончательное уничтожение! Фактически, аномально высокие уровни FAK связаны со многими различными линиями опухолевых клеток (толстая кишка, молочная железа, щитовидная железа, яичники, меланома, саркома…). Это происходит, когда p53 не может должным образом активировать контрольные точки клеточного цикла.
В то время как взаимодействия, подразумеваемые здесь, сложны и активно изучаются, эти действия p53 определенно подтверждают его центральную роль как защитника генома , так и защитника клеточного деления .
B. Рост и поведение раковых клеток
Различные типы раковых клеток имеют разные ростовые и другие поведенческие свойства.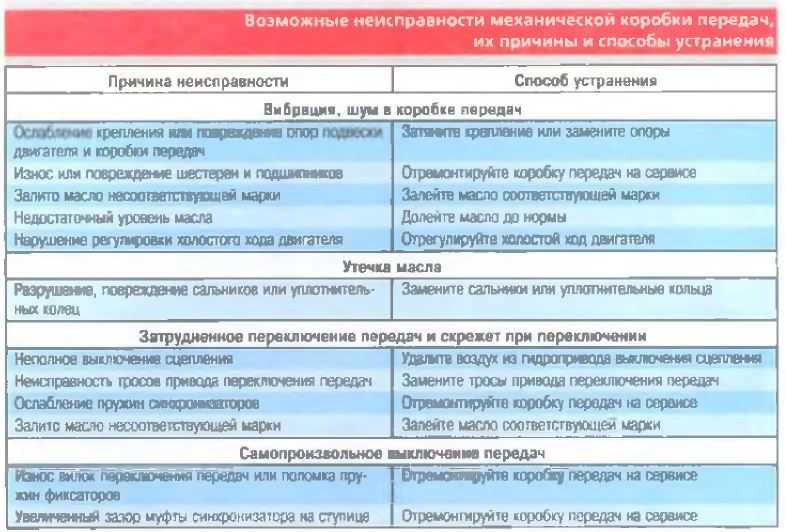 Возможно, вы слышали о медленно растущих и быстрорастущих видах рака. Рак толстой кишки обычно медленно растет. Периодический Колоноскопия , выявляющая и удаляющая колоректальные опухоли у людей среднего и пожилого возраста, может предотвратить заболевание (хотя риски заболевания и сама процедура должны быть сбалансированы). Рак поджелудочной железы быстро растет и обычно остается незамеченным, пока не достигнет поздней стадии. Двумя целями медицинских исследований являются обнаружение различных видов рака на достаточно ранней стадии для успешного вмешательства и, конечно же, поиск эффективных методов лечения.
Возможно, вы слышали о медленно растущих и быстрорастущих видах рака. Рак толстой кишки обычно медленно растет. Периодический Колоноскопия , выявляющая и удаляющая колоректальные опухоли у людей среднего и пожилого возраста, может предотвратить заболевание (хотя риски заболевания и сама процедура должны быть сбалансированы). Рак поджелудочной железы быстро растет и обычно остается незамеченным, пока не достигнет поздней стадии. Двумя целями медицинских исследований являются обнаружение различных видов рака на достаточно ранней стадии для успешного вмешательства и, конечно же, поиск эффективных методов лечения.
Одна мутировавшая клетка в ткани может стать точкой роста опухоль , по сути, масса клеток, клонированных из исходной мутировавшей. Доброкачественные опухоли или новообразования (например, груди и матки миомы у женщин или обычные родинки у любого из нас) перестают расти и не опасны для жизни. Их часто удаляют хирургическим путем для удобства пациента (или потому, что клетки в некоторых других доброкачественных опухолях могут стать раковыми).
Их часто удаляют хирургическим путем для удобства пациента (или потому, что клетки в некоторых других доброкачественных опухолях могут стать раковыми).
Злокачественные опухоли (также называемые злокачественными новообразованиями ) являются раковыми и могут разрастаться за пределы самой опухоли. Когда опухолевые клетки выделяются, они могут попадать в кровоток и перемещаться в другие части тела, явление, называемое метастазированием . Раковые клетки, которые метастазируют, могут стать очагом образования новых опухолей во многих различных тканях. Поскольку раковые клетки продолжают циклически повторять свою ДНК, они могут подвергаться еще большему количеству соматических мутаций. Эти дальнейшие изменения могут способствовать метастазированию и росту раковых клеток в разных частях тела.
C. Стратегии лечения рака
Существует множество различных видов рака, возникающих в различных тканях организма. Все они разделяют свойство неконтролируемого клеточного деления, хотя и по разным молекулярным и не всегда понятным причинам. Две основные стратегии лечения рака, разработанные в 20 веке, направлены на то, чтобы каким-то образом нарушить репликацию.
Две основные стратегии лечения рака, разработанные в 20 веке, направлены на то, чтобы каким-то образом нарушить репликацию.
- Лучевая терапия основана на том факте, что большинство клеток в нашем организме не делятся, и направлена мутагенная радиация на опухоли в надежде, что реплицирующаяся ДНК будет мутирована во многих местах (то есть в генах), что опухолевые клетки не смогут дольше выживают или размножаются должным образом.
- Химиотерапия используется для борьбы с опухолями, которые плохо реагируют на облучение или труднодоступны для лучевых технологий, а также для борьбы с раковыми заболеваниями, которые даже не образуют очаговых опухолей (таких как лимфомы и лейкемии, поражающие лимфатические клетки и клетки крови) . Эти химиотерапии также направлены на нарушение репликации или митотической активности. Например, вспомните кордицепин (дидезоксиаденозинтрифосфат или ддАТФ). Присутствуя во время репликации, ddATP встраивается в растущую цепь ДНК, после чего в цепь ДНК не могут быть добавлены дополнительные нуклеотиды.
 Это делает ddATP мощным химиотерапевтическим разрушителем репликации. Taxol — еще один химиопрепарат, который действует в этом случае не за счет ингибирования репликации S-фазы, а за счет блокирования деполимеризации микротрубочек веретенообразных волокон, тем самым блокируя митотические анафазы и телофазы в последней части М- и С-фаз цикла. Колхицин (растительный алкалоид) атакует раковые (и другие делящиеся) клетки, блокируя образование микротрубочек и тем самым предотвращая образование веретенообразных волокон в митотической профазе.
Это делает ddATP мощным химиотерапевтическим разрушителем репликации. Taxol — еще один химиопрепарат, который действует в этом случае не за счет ингибирования репликации S-фазы, а за счет блокирования деполимеризации микротрубочек веретенообразных волокон, тем самым блокируя митотические анафазы и телофазы в последней части М- и С-фаз цикла. Колхицин (растительный алкалоид) атакует раковые (и другие делящиеся) клетки, блокируя образование микротрубочек и тем самым предотвращая образование веретенообразных волокон в митотической профазе.
Эти методы лечения не эффективны против всех видов рака, и, конечно же, они не нацелены на определенные виды раковых клеток. Их успех основан просто на том факте, что раковые клетки быстро и постоянно размножаются, в то время как другие типы клеток этого не делают. Многие, если не все, побочные эффекты лучевой и химиотерапии возникают в результате повреждения нормальных делящихся клеток (например, клетки волосяных фолликулов вызывают выпадение волос у многих больных раком, истощение клеток крови, которые не могут быть заменены стволовыми клетками в костной ткани). костный мозг).
костный мозг).
В настоящее время многие исследования сосредоточены на мобилизации собственной иммунной системы организма для создания более конкретных и целенаправленных методов лечения рака. В захватывающей истории более 100 лет назад доктор Уильям Б. Коли ввел неизлечимому больному раком стрептококковые бактерии, которые затем избавились от опухоли после выздоровления от инфекции (подробности см. Испытания). Феномен «Dr. Токсины Коли изначально считались противоопухолевым эффектом бактерий. Но к 1948 это широко связывали с иммунным ответом, активируемым инфекцией. В 1990-х годах ученые вновь обратились к иммунному ответу на рак, и на рубеже 21-го века исследования иммунотерапии рака набрали обороты (и более существенное финансирование исследований!).
Недавние эксперименты по иммунотерапии на животных и клинические испытания на людях являются многообещающими. Несколько видов иммунотерапии уже одобрены Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA). Стратегии иммунотерапии рака основаны на том факте, что ваше тело иногда распознает маркеры раковых клеток (например, молекулы клеточной поверхности) как чужеродные, тем самым создавая иммунную защиту против этих клеток. Но этот ответ иногда недостаточно силен, чтобы уничтожить новые, быстро делящиеся раковые клетки. Рак, по-видимому, возникает, когда иммунный ответ слаб. Существуют разные, иногда пересекающиеся подходы к иммунотерапии рака. Все они основаны на том факте, что раковые клетки каким-то образом мутировали и производят аберрантные белки, которые иммунная система может воспринимать как достаточно чужеродные, чтобы вызвать иммунный ответ, каким бы слабым он ни был. Некоторые виды иммунотерапии стремятся усилить этот иммунный ответ. Другие стремятся изолировать или создать уникальные антигены раковых клеток, которые будут иммунизировать пациента при введении этих раковых антигенов. Некоторые виды иммунотерапии приведены в таблице на следующей странице. Как видно из таблицы, иммунотаргетирование раковых клеток уже доказало свою высокую эффективность.
Стратегии иммунотерапии рака основаны на том факте, что ваше тело иногда распознает маркеры раковых клеток (например, молекулы клеточной поверхности) как чужеродные, тем самым создавая иммунную защиту против этих клеток. Но этот ответ иногда недостаточно силен, чтобы уничтожить новые, быстро делящиеся раковые клетки. Рак, по-видимому, возникает, когда иммунный ответ слаб. Существуют разные, иногда пересекающиеся подходы к иммунотерапии рака. Все они основаны на том факте, что раковые клетки каким-то образом мутировали и производят аберрантные белки, которые иммунная система может воспринимать как достаточно чужеродные, чтобы вызвать иммунный ответ, каким бы слабым он ни был. Некоторые виды иммунотерапии стремятся усилить этот иммунный ответ. Другие стремятся изолировать или создать уникальные антигены раковых клеток, которые будут иммунизировать пациента при введении этих раковых антигенов. Некоторые виды иммунотерапии приведены в таблице на следующей странице. Как видно из таблицы, иммунотаргетирование раковых клеток уже доказало свою высокую эффективность.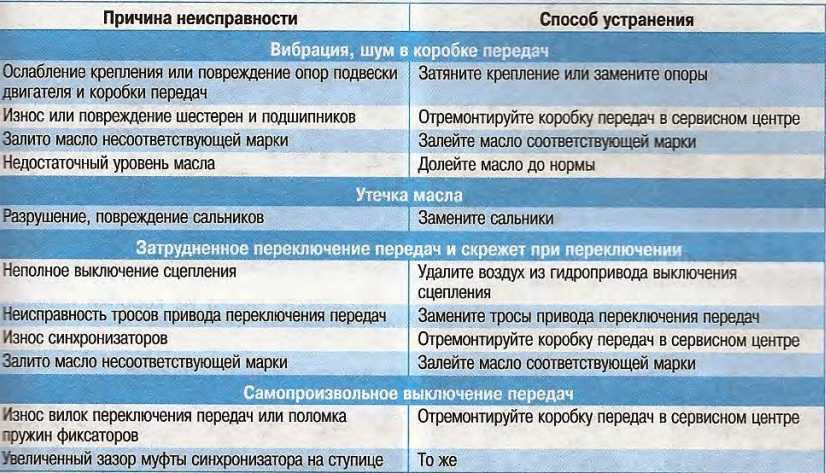 В некоторых случаях терапия представляет собой пример персонализированная медицина , в которой лечение индивидуально адаптировано для вас как пациента. Проблемы с иммунотерапией заключаются в том, что
В некоторых случаях терапия представляет собой пример персонализированная медицина , в которой лечение индивидуально адаптировано для вас как пациента. Проблемы с иммунотерапией заключаются в том, что
- они требуют много времени и труда, а их производство дорого.
- , хотя они могут «вылечить» вас, они, скорее всего, не подействуют на кого-то другого.
- Как и лучевая и химиотерапия, иммунотерапия имеет свои неприятные, а иногда и серьезные побочные эффекты.
Более подробное обсуждение иммунотерапии рака находится на Cancer.gov Веб-сайт компании «Лечение рака» Immunotherpay.
ПРИМЕЧАНИЕ. Термин ингибитор контрольных точек в контексте иммунотерапии отличается от термина контрольных точек , описывающего порталы для прохождения эукариотического клеточного цикла.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Джеральд Бергтром
- Лицензия
- СС BY
- Показать оглавление
- нет
- Теги

Природа контрольных точек клеточного цикла: факты и заблуждения | Журнал биологии
- Мнение
- Опубликовано:
- Алексей Ходжаков 1 и
- Конли Л. Ридер 1
Журнал биологии том 8 , Номер статьи: 88 (2009) Процитировать эту статью
31 тыс. обращений
33 Цитаты
2 Альтметрический
Сведения о показателях
Abstract
Концепция контрольных точек произвела революцию в нашем понимании клеточного цикла. Здесь мы возвращаемся к определяющим чертам контрольных точек и утверждаем, что неспособность правильно оценить концепцию приводит к неправильной интерпретации экспериментальных результатов. Мы иллюстрируем, используя митотический контрольный пункт, проблемы, которые могут возникнуть из-за несоблюдения строгих определений и точной терминологии.
Здесь мы возвращаемся к определяющим чертам контрольных точек и утверждаем, что неспособность правильно оценить концепцию приводит к неправильной интерпретации экспериментальных результатов. Мы иллюстрируем, используя митотический контрольный пункт, проблемы, которые могут возникнуть из-за несоблюдения строгих определений и точной терминологии.
«Клеточная биология не является заведомо самокритичной областью. Мы, клеточные биологи, не скрываем прорывов и обещаний неизбежных революций. современные откровения. Ничто из того, что мы узнали о митозе с тех пор, как оно было открыто столетие назад, не является столь ошеломляющим, как само открытие» [1].
Несомненно, каждое поколение ученых собирает больше информации о митозе, чем его предшественники. Но, несмотря на ошеломляющие достижения в области визуализации, которые позволяют визуализировать многие детали сборки веретена и поведения хромосом, и одновременные успехи в молекулярной генетике и биохимии, выявившие множество молекул и взаимодействий, прямо или косвенно необходимых для правильного митоза, основные концептуальные успехи, как считает Даниэль Мациа в приведенной выше цитате, редки. Тем не менее, мы считаем, что концепция контроля контрольных точек клеточного цикла, сформулированная в конце 20-го века Леландом Хартвеллом (за которую он разделил Нобелевскую премию в 2001 году), была прорывом, конкурирующим с открытием самого митоза.
Тем не менее, мы считаем, что концепция контроля контрольных точек клеточного цикла, сформулированная в конце 20-го века Леландом Хартвеллом (за которую он разделил Нобелевскую премию в 2001 году), была прорывом, конкурирующим с открытием самого митоза.
Идея Хартвелла отошла от традиционного представления о том, что постепенный прогресс в клеточном цикле происходит всякий раз, когда имеется достаточно средств для продвижения вперед. Вместо этого он утверждал, что прогрессия активно контролируется внешними механизмами, которые сами по себе не присущи процессу. Контрольные точки защищают критические переходы клеточного цикла, гарантируя, что предыдущая фаза завершена и безошибочна, прежде чем ячейке будет разрешено двигаться вперед. Однако с момента своего появления 20 лет назад концепция контрольно-пропускных пунктов была изменена, чтобы соответствовать различным точкам зрения, многие из которых основаны на вводящей в заблуждение терминологии и неверных представлениях. Например, задержки в митозе часто приписывают «активации» митотической контрольной точки, дескриптору, который не может распознать, что контрольная точка по определению активна, когда клетка начинает митоз. И наоборот, завершение митоза в присутствии смещенных хромосом часто автоматически интерпретируется как указание на дефектную контрольную точку, даже если в отсутствие критического тестирования альтернативные интерпретации столь же вероятны. В этой статье мы определяем критические характеристики контрольных точек и показываем, как путаница, вызванная непоследовательным использованием терминологии, может препятствовать прогрессу, поощряя утверждения, которые имеют совершенно разные значения для разных исследователей. Мы проиллюстрируем наши пункты примерами из контрольной точки, которая контролирует прогрессирование митоза (рис. 1).
И наоборот, завершение митоза в присутствии смещенных хромосом часто автоматически интерпретируется как указание на дефектную контрольную точку, даже если в отсутствие критического тестирования альтернативные интерпретации столь же вероятны. В этой статье мы определяем критические характеристики контрольных точек и показываем, как путаница, вызванная непоследовательным использованием терминологии, может препятствовать прогрессу, поощряя утверждения, которые имеют совершенно разные значения для разных исследователей. Мы проиллюстрируем наши пункты примерами из контрольной точки, которая контролирует прогрессирование митоза (рис. 1).
Работа митотической контрольной точки. Клеточный цикл управляется циклинзависимыми киназами (CDK), которые активируются путем связывания с циклинами, специфичными для различных фаз клеточного цикла, и определяют мишени для киназ. Выход из каждой фазы клеточного цикла происходит при деградации связанного циклина. Комплекс CDK-циклин, который необходим для вступления в митоз, представляет собой CDK1-циклин B, и клетки переводятся из G2 в митоз за счет его внезапной активации. Выход из митоза в анафазе происходит при активации комплекса, стимулирующего анафазу (АРС), крупной убиквитинлигазы, которая нацелена на деградацию циклина В. Секурин, который скрепляет митотические хромосомы в метафазе, также помечен для деградации с помощью APC. Митотическая контрольная точка представляет собой внешнюю систему мониторинга, которая сама по себе не требуется для митотической прогрессии, но выявляет наличие хромосом, которые не прикреплены к митотическому веретену через свои кинетохоры, и в их присутствии инициирует каскад, запрещающий активацию АПК и таким образом, разделение хромосом и выход из митоза. Когда последняя кинетохора прикрепляется к микротрубочкам, контрольная точка удовлетворяется, что позволяет активировать APC и продвигаться к выходу из митоза. Однако, даже когда он удовлетворен, путь контрольной точки продолжает искать неприкрепленные кинетохоры, которые, если они возникают, легко повторно накладывают блокировку.
Комплекс CDK-циклин, который необходим для вступления в митоз, представляет собой CDK1-циклин B, и клетки переводятся из G2 в митоз за счет его внезапной активации. Выход из митоза в анафазе происходит при активации комплекса, стимулирующего анафазу (АРС), крупной убиквитинлигазы, которая нацелена на деградацию циклина В. Секурин, который скрепляет митотические хромосомы в метафазе, также помечен для деградации с помощью APC. Митотическая контрольная точка представляет собой внешнюю систему мониторинга, которая сама по себе не требуется для митотической прогрессии, но выявляет наличие хромосом, которые не прикреплены к митотическому веретену через свои кинетохоры, и в их присутствии инициирует каскад, запрещающий активацию АПК и таким образом, разделение хромосом и выход из митоза. Когда последняя кинетохора прикрепляется к микротрубочкам, контрольная точка удовлетворяется, что позволяет активировать APC и продвигаться к выходу из митоза. Однако, даже когда он удовлетворен, путь контрольной точки продолжает искать неприкрепленные кинетохоры, которые, если они возникают, легко повторно накладывают блокировку.
Изображение полного размера
Контрольные точки не важны (в счастливых клетках)
Существование критических «триггеров» или «точек невозврата» на ключевых переходах клеточного цикла было постулировано Мазиа еще в 1961 г. [2], хотя, как он позже признал в 1987 году, первоначально сформулированная концепция оказалась непродуктивной. Проблема заключалась в том, что триггеры считались важными внутренними компонентами молекулярных каскадов, управляющих клеточным циклом. Контрольные точки, напротив, представляют собой внешние механизмы контроля, которые не требуются для продвижения вперед [3]. Таким образом, фундаментальной особенностью контрольно-пропускного пункта является то, что его деятельность не проявляется в условиях, в которых возможность ошибок минимальна: только когда условия становятся напряженными и вероятны ошибки, контрольно-пропускные пункты становятся важными инструментами выживания. Этот критерий лег в основу ранних скринингов для идентификации компонентов митотических контрольных точек у дрожжей [4]. Название трех хорошо известных белков митотических контрольных точек, Mad1-3, происходит от аббревиатуры «Mitotic Arrest Deficient», отражающей тот факт, что 9Мутанты 0489 Mad проходят через митоз со сходной кинетикой, независимо от того, присутствует веретено или нет (и, следовательно, в присутствии неприкрепленных кинетохоров, которые обычно останавливают митоз — см. легенду к рис. 1). Напротив, клетки дикого типа останавливаются в митозе, когда образование веретена ингибируется ядами микротрубочек. Однако в нормальных условиях как клетки дикого типа, так и Mad-дефицитные клетки или организмы с низким числом хромосом и эффективными механизмами сборки веретена (например, дрожжи и Drosophila ) одинаково хорошо растут, что отражает тот факт, что митотическая контрольная точка не является существенной, когда частота ошибок естественно низка.
Название трех хорошо известных белков митотических контрольных точек, Mad1-3, происходит от аббревиатуры «Mitotic Arrest Deficient», отражающей тот факт, что 9Мутанты 0489 Mad проходят через митоз со сходной кинетикой, независимо от того, присутствует веретено или нет (и, следовательно, в присутствии неприкрепленных кинетохоров, которые обычно останавливают митоз — см. легенду к рис. 1). Напротив, клетки дикого типа останавливаются в митозе, когда образование веретена ингибируется ядами микротрубочек. Однако в нормальных условиях как клетки дикого типа, так и Mad-дефицитные клетки или организмы с низким числом хромосом и эффективными механизмами сборки веретена (например, дрожжи и Drosophila ) одинаково хорошо растут, что отражает тот факт, что митотическая контрольная точка не является существенной, когда частота ошибок естественно низка.
Некоторые утверждают, что функция митотической контрольной точки у дрожжей и Drosophila отличается от таковой у млекопитающих, поскольку у млекопитающих инактивация генов контрольных точек приводит к летальному исходу даже при отсутствии других стрессов. Этот аргумент концептуально ошибочен, поскольку наблюдаемая разница в судьбах просто отражает различия в скорости сборки шпинделя. Из-за стохастической природы взаимодействия кинетохор и микротрубочек веретена присутствие многочисленных хромосом и/или центросом (полюсов веретена) значительно увеличивает время, необходимое для сборки веретена. При этом условии, если выход из митоза не задерживается контрольной точкой до тех пор, пока все кинетохоры не прикрепятся к веретену, потомство будет анеуплоидным. По этой причине инактивация митотической контрольной точки у млекопитающих приводит к быстрому росту анеуплоидии и, в конечном итоге, к смерти [5]. Прекрасная иллюстрация взаимодействия между контрольной точкой, кинетикой сборки веретена и жизнеспособностью клетки/организма была получена в недавней работе 9.0489 Drosophila , которые накапливают лишние центросомы. Хотя само по себе это состояние не ставит под угрозу жизнеспособность, оно замедляет скорость сборки веретена. Как и ожидалось, устранение митотической контрольной точки путем делеции Mad2, которое не оказывает влияния на Drosophila дикого типа , становится летальным для мух с нештатными центросомами [6].
Этот аргумент концептуально ошибочен, поскольку наблюдаемая разница в судьбах просто отражает различия в скорости сборки шпинделя. Из-за стохастической природы взаимодействия кинетохор и микротрубочек веретена присутствие многочисленных хромосом и/или центросом (полюсов веретена) значительно увеличивает время, необходимое для сборки веретена. При этом условии, если выход из митоза не задерживается контрольной точкой до тех пор, пока все кинетохоры не прикрепятся к веретену, потомство будет анеуплоидным. По этой причине инактивация митотической контрольной точки у млекопитающих приводит к быстрому росту анеуплоидии и, в конечном итоге, к смерти [5]. Прекрасная иллюстрация взаимодействия между контрольной точкой, кинетикой сборки веретена и жизнеспособностью клетки/организма была получена в недавней работе 9.0489 Drosophila , которые накапливают лишние центросомы. Хотя само по себе это состояние не ставит под угрозу жизнеспособность, оно замедляет скорость сборки веретена. Как и ожидалось, устранение митотической контрольной точки путем делеции Mad2, которое не оказывает влияния на Drosophila дикого типа , становится летальным для мух с нештатными центросомами [6]. Важно подчеркнуть, что в последнем случае клетки не «убиты контрольной точкой», как это иногда описывается в литературе. Вместо этого клетки умирают, потому что в конечном итоге они становятся сильно анеуплоидными при отсутствии функциональной контрольной точки. Функция митотической контрольной точки состоит в предотвращении преждевременного выхода из митоза и ни в чем другом.
Важно подчеркнуть, что в последнем случае клетки не «убиты контрольной точкой», как это иногда описывается в литературе. Вместо этого клетки умирают, потому что в конечном итоге они становятся сильно анеуплоидными при отсутствии функциональной контрольной точки. Функция митотической контрольной точки состоит в предотвращении преждевременного выхода из митоза и ни в чем другом.
Неспособность отличить истинные белки контрольных точек от белков, участвующих в пути, на который направлена митотическая контрольная точка, является обычным явлением и обычно является результатом слишком узкого внимания к молекулярным взаимодействиям без учета концептуального контекста. Очевидно, что белки контрольных точек должны взаимодействовать не только с отслеживаемой структурой или событием (например, с неприкрепленной кинетохорой), но также с путями и структурами, активность которых необходима для запуска прогрессии клеточного цикла. В этом случае, поскольку сама контрольная точка не требуется для продвижения вперед, белки, мутации которых продлевают митоз, никогда не могут считаться истинными компонентами контрольной точки.
Например, для выхода из митоза требуется активация крупной убиквитинлигазы, называемой комплексом, способствующим анафазе (APC) или циклосомой, который помечает белки для разрушения, которые удерживают реплицированные хромосомы вместе или удерживают клетку в митозе (к ним относятся секурин и циклин В; рисунок 1). APC активируется белком-активатором Cdc20, и если Cdc20 истощается, клетка останавливается в митозе. Несмотря на то, что Cdc20 напрямую взаимодействует с bona fide белками контрольных точек (например, Mad2), этот фенотип ясно демонстрирует, что сам Cdc20 не является белком контрольной точки. Ожидается взаимодействие между Cdc20 и белками контрольных точек, поскольку целью митотической контрольной точки является биохимическое предотвращение преждевременной активации APC путем секвестрации Cdc20. Ошибочное рассмотрение Cdc20 или др. белков, внутренне необходимых для прямой митотической прогрессии, как непосредственно вовлеченных в контрольную точку, деградирует концепцию контрольной точки до уровня внутренних «триггеров» Mazia.
Когда птица улетела, запирать клетку уже поздно
Хотя активность контрольной точки во время митоза не очевидна при отсутствии постоянных ошибок, это не означает, что контрольная точка неактивна, как подразумевается слишком распространенное утверждение, что состояние или лечение внезапно «активируют» или «запускают» контрольную точку. Это вводящая в заблуждение оксюмора: поскольку роль контрольно-пропускного пункта заключается в обнаружении проблемы, механизм мониторинга (то есть контрольно-пропускной пункт) должен быть активирован еще до того, как возникнет проблема (до того, как птица вылетит из клетки). Как и все контрольные точки, митотическая контрольная точка представляет собой конститутивный путь, активный в начале сборки веретена.
Вопреки мнению некоторых, митотическая контрольная точка не «выключается», как только она удовлетворена, а продолжает оставаться функциональной. Это видно из того факта, что обработка клеток ядом веретена после того, как они инициировали выход из митоза, быстро останавливает дальнейшую деградацию циклина В и продвигается к анафазе [7]. Таким образом, до определенного момента повторное появление состояния, отслеживаемого контрольной точкой, восстанавливает блокировку. Точка, в которой контрольная точка становится действительно инактивированной, отмечает точку невозврата, после которой переход к следующей стадии клеточного цикла уже не может быть остановлен.
Таким образом, до определенного момента повторное появление состояния, отслеживаемого контрольной точкой, восстанавливает блокировку. Точка, в которой контрольная точка становится действительно инактивированной, отмечает точку невозврата, после которой переход к следующей стадии клеточного цикла уже не может быть остановлен.
Два способа пересечь границу: получить визу или вывести из строя охранника
Еще одним фундаментальным свойством контрольно-пропускного пункта является то, что всегда есть два пути его прохождения. Один состоит в том, чтобы удовлетворить его, устранив условие, которое он отслеживает. Другой — отменить сам контрольно-пропускной пункт. (Соображения объема не позволяют обсуждать адаптацию контрольных точек у дрожжей или проскальзывание у млекопитающих, которые, поскольку биологический контроль не эффективен на 100%, позволяют некоторым клеткам в конечном итоге избежать митоза после длительного блока.) Неспособность провести различие между удовлетворением и отменой митотического checkpoint часто приводит к ошибочной интерпретации фенотипов контрольных точек. Существует необоснованная тенденция заключать, что контрольная точка является дефектной всякий раз, когда прогрессирование происходит в присутствии неправильно ориентированных или неправильно расположенных хромосом.
Существует необоснованная тенденция заключать, что контрольная точка является дефектной всякий раз, когда прогрессирование происходит в присутствии неправильно ориентированных или неправильно расположенных хромосом.
История хромосомной нестабильности (CIN) прекрасно иллюстрирует этот момент. В течение многих лет предполагалось, что индивидуальный фенотип неправильной сегрегации хромосом клеток CIN является результатом дефекта или ослабления митотической контрольной точки. Однако недавние исследования на живых клетках показали, что митотическая контрольная точка в большинстве клеток CIN совершенно нормальна [8]. Вместо этого так называемый фенотип с дефицитом контрольных точек при CIN является результатом аномальной динамики микротрубочек веретена и/или проблем в конститутивном механизме, ответственном за коррекцию ошибок прикрепления хромосом, который не является частью каскада контрольных точек [9].]. Эти проблемы позволяют в конечном итоге выполнить контрольную точку в условиях, в которых сегрегация хромосом может быть ненормальной.
Как отметили Хартвелл и Вейнерт [3], «существование механизма контроля предполагается, когда обнаруживаются химические вещества, мутанты или другие условия, которые… позволяют произойти позднему событию, даже когда раннее, обычно необходимое событие предотвращено». Поскольку этот критерий освобождения от зависимости является отличительной чертой контрольной точки, можно заключить, что митотическая контрольная точка действительно не функционирует в клетке только в том случае, если она не может задержать митоз в условиях, которые, как известно, препятствуют его удовлетворению. На практике лучшим тестом на недостаточность митотической контрольной точки является степень задержки клеток в митозе в отсутствие микротрубочек веретена. (Обратите внимание, что использование препаратов или условий, которые просто нарушают динамику микротрубочек, например, таксола или низких концентраций нокодазола, неинформативны в отношении митотической контрольной точки, поскольку они все же позволяют ее удовлетворить, иногда очень быстро [10]. )
)
Сколько существует митотических контрольных точек?
Очевидно, что во время митоза должны выполняться несколько различных условий, чтобы реплицированные хромосомы были равномерно распределены в дочерних клетках. Таким образом, можно предусмотреть несколько контрольных точек (или несколько ветвей одной контрольной точки), каждая из которых выявляет одно из этих условий. В качестве альтернативы ряд аномалий может в конечном итоге слиться в одно состояние, обнаруженное только одной контрольной точкой. Это очень разные возможности: первая подразумевает существование сложных множественных независимых петель обратной связи, а вторая опирается на одну основную защиту.
Из исследований лазерной абляции ясно, что одна неприкрепленная кинетохора препятствует выполнению митотической контрольной точки [11]. Аналогичным образом, из достоверных биохимических и генетических данных очевидно, что генерация сигнала контрольной точки ‘ожидания анафазы’ включает белки, подобные Mad2, которые присутствуют на неприкрепленных, но не прикрепленных кинетохорах. Таким образом, нет сомнений в том, что проблема, выявляемая митотической контрольной точкой, заключается в наличии кинетохор, не прикрепленных к микротрубочкам веретена. Учитывая это, возникает вопрос, существуют ли другие условия, которые задерживают прогрессирование митоза и не зависят от неприкрепленных кинетохор.
Таким образом, нет сомнений в том, что проблема, выявляемая митотической контрольной точкой, заключается в наличии кинетохор, не прикрепленных к микротрубочкам веретена. Учитывая это, возникает вопрос, существуют ли другие условия, которые задерживают прогрессирование митоза и не зависят от неприкрепленных кинетохор.
Предпосылкой для равного расхождения хромосом является то, что все хромосомы должны приобрести амфителическое прикрепление к веретену до наступления анафазы: то есть одна сестринская кинетохора должна прикрепиться к одному полюсу веретена, а другая — к противоположному полюсу. Однако при нормальном ходе сборки веретена хромосомы могут приобретать ошибочное прикрепление: у одних обе сестринские кинетохоры прикрепляются к одному полюсу (синтелическое прикрепление), а у других одна кинетохора присоединяется одновременно к обоим полюсам (меротетическое прикрепление) (рис. 2). Интуитивно имеет смысл отложить выход из митоза до тех пор, пока эти ошибки не будут исправлены. Однако ключевым неинтуитивным и поэтому часто упускаемым из виду фактом является то, что такая задержка необходима только в том случае, если механизм исправления таких ошибок работает медленно. Точно так же, как митотическая контрольная точка не является существенной в счастливых клетках (см. выше), быстрые и эффективные внутренние механизмы коррекции делают ненужным наличие дополнительного пути контрольной точки, который обнаруживает неправильное прикрепление кинетохор.
Однако ключевым неинтуитивным и поэтому часто упускаемым из виду фактом является то, что такая задержка необходима только в том случае, если механизм исправления таких ошибок работает медленно. Точно так же, как митотическая контрольная точка не является существенной в счастливых клетках (см. выше), быстрые и эффективные внутренние механизмы коррекции делают ненужным наличие дополнительного пути контрольной точки, который обнаруживает неправильное прикрепление кинетохор.
Неприкрепленные кинетохоры возникают при коррекции неправильно прикрепленных хромосом. Хотя митотическая контрольная точка не может напрямую отличить нормальное прикрепление кинетохор от ошибочного, коррекция последнего может привести к образованию неприкрепленной кинетохоры, обнаруживаемой контрольной точкой. Подробности смотрите в тексте.
Изображение в полный размер
Важно подчеркнуть, что коррекция синтетического прикрепления включает отделение одной кинетохоры от связанного с ней пучка микротрубочек. Это приводит к неприкрепленной кинетохоре (монотелической хромосоме), что неизбежно предотвращает выполнение митотической контрольной точки (рис. 2). Это легко объясняет, почему, хотя синтетические присоединения не обнаруживаются контрольной точкой, условия, способствующие их образованию, продлевают митоз [12]. В самом деле, когда механизм исправления ошибок ингибируется, например, путем нокдауна кинезина 13 (деполимеразы микротрубочек), клетки, содержащие синтетические хромосомы, быстро удовлетворяют митотической контрольной точке, потому что неприкрепленные кинетохоры больше не могут генерироваться. С другой стороны, исправление другого типа ошибочных прикреплений, меротелиальных, не приводит к образованию неприкрепленных кинетохоров, поэтому наличие меротелиальных прикреплений не задерживает клетки в митозе. Таким образом, нет прямых доказательств того, что митотическая контрольная точка обнаруживает какую-либо проблему или состояние, кроме присутствия неприкрепленных кинетохор, даже неправильного расположения хромосом или ошибочного прикрепления кинетохор.
Это приводит к неприкрепленной кинетохоре (монотелической хромосоме), что неизбежно предотвращает выполнение митотической контрольной точки (рис. 2). Это легко объясняет, почему, хотя синтетические присоединения не обнаруживаются контрольной точкой, условия, способствующие их образованию, продлевают митоз [12]. В самом деле, когда механизм исправления ошибок ингибируется, например, путем нокдауна кинезина 13 (деполимеразы микротрубочек), клетки, содержащие синтетические хромосомы, быстро удовлетворяют митотической контрольной точке, потому что неприкрепленные кинетохоры больше не могут генерироваться. С другой стороны, исправление другого типа ошибочных прикреплений, меротелиальных, не приводит к образованию неприкрепленных кинетохоров, поэтому наличие меротелиальных прикреплений не задерживает клетки в митозе. Таким образом, нет прямых доказательств того, что митотическая контрольная точка обнаруживает какую-либо проблему или состояние, кроме присутствия неприкрепленных кинетохор, даже неправильного расположения хромосом или ошибочного прикрепления кинетохор.
В таком случае, что из множества заявлений о том, что в дополнение к митотической контрольной точке на основе кинетохор ход митоза также контролируется различными другими путями, которые реагируют на все, от статуса р53 или р38 до целостности хромосом? и цепочка ДНК? Во-первых, в некоторых из этих заявлений не учитывается, что несколько условий, например, все, что вызывает повреждение ДНК, может затруднить установление стабильной связи одной или нескольких кинетохор с веретеном. Таким образом, хотя конкретное лечение или состояние действительно может задерживать клетки в митозе, до тех пор, пока убедительно не будет продемонстрировано, что задержка не зависит от контрольной точки митоза, нет никаких оснований заявлять о наличии дополнительной контрольной точки во время митоза (особенно у млекопитающих).
«Не все то золото, что блестит»
Путаница в определении контрольной точки или того, что контролирует митотическая контрольная точка, является одной из причин необоснованных заявлений о том, что ход митоза регулируется путями контрольных точек, отличными от тех, которые обнаруживают неприкрепленные кинетохоры . Другой причиной является использование совершенно разных определений одного и того же термина в разных областях биологии. Например, поиск в PubMed в настоящее время дает 3505 статей по ключевой фразе «митотическая прогрессия». Проблема здесь в том, что многие используют этот термин для обозначения прохождения через «митотический клеточный цикл» (старая терминология клеточного цикла), в то время как другие считают, что это означает (как и мы) продвижение через митоз. В этом случае утверждения о том, что определенный путь необходим для «митотической прогрессии» или участвует в ней, часто просто означают, что на самом деле он необходим для прохождения через G2, а не для митоза. Еще больший источник путаницы возникает из-за широкого использования термина «G2/M», который первоначально вошел в обиход, потому что сортировка клеток, активируемая флуоресценцией (FACS), не может различать 4 N G2 из 4 N митотических клеток (или даже 4 N G1 клеток, которые не смогли разделить хромосомы).
Другой причиной является использование совершенно разных определений одного и того же термина в разных областях биологии. Например, поиск в PubMed в настоящее время дает 3505 статей по ключевой фразе «митотическая прогрессия». Проблема здесь в том, что многие используют этот термин для обозначения прохождения через «митотический клеточный цикл» (старая терминология клеточного цикла), в то время как другие считают, что это означает (как и мы) продвижение через митоз. В этом случае утверждения о том, что определенный путь необходим для «митотической прогрессии» или участвует в ней, часто просто означают, что на самом деле он необходим для прохождения через G2, а не для митоза. Еще больший источник путаницы возникает из-за широкого использования термина «G2/M», который первоначально вошел в обиход, потому что сортировка клеток, активируемая флуоресценцией (FACS), не может различать 4 N G2 из 4 N митотических клеток (или даже 4 N G1 клеток, которые не смогли разделить хромосомы). В настоящее время существует 5729 статей, посвященных «клетке G2/M», что, очевидно, является оксюмороном, поскольку клетка не может находиться в двух разных фазах клеточного цикла одновременно. Точно так же статьи, в которых основное внимание уделяется «аресту G2/M» (2437 статей) или «контрольно-пропускному пункту G2/M» (704 статьи), следует рассматривать просто как признание технических ограничений, которые не позволяют авторам определить, являются ли камеры в G2 или в митозе. Несмотря на это серьезное ограничение, термин «фаза G2/M» (4 105 статей) в настоящее время широко используется в качестве bona fide стадия (фаза) клеточного цикла без учета первоначального значения термина. Точно так же, как не существует такой вещи, как ячейка G2/M или фаза G2/M, не существует такой вещи, как контрольная точка G2/M. Скорее, есть контрольные точки, которые контролируют продвижение через G2, и, как мы утверждали, есть единственная контрольная точка, которая контролирует продвижение через митоз, но нет четких доказательств наличия какой-либо контрольной точки, которая контролирует прохождение как через G2, так и через митоз.
В настоящее время существует 5729 статей, посвященных «клетке G2/M», что, очевидно, является оксюмороном, поскольку клетка не может находиться в двух разных фазах клеточного цикла одновременно. Точно так же статьи, в которых основное внимание уделяется «аресту G2/M» (2437 статей) или «контрольно-пропускному пункту G2/M» (704 статьи), следует рассматривать просто как признание технических ограничений, которые не позволяют авторам определить, являются ли камеры в G2 или в митозе. Несмотря на это серьезное ограничение, термин «фаза G2/M» (4 105 статей) в настоящее время широко используется в качестве bona fide стадия (фаза) клеточного цикла без учета первоначального значения термина. Точно так же, как не существует такой вещи, как ячейка G2/M или фаза G2/M, не существует такой вещи, как контрольная точка G2/M. Скорее, есть контрольные точки, которые контролируют продвижение через G2, и, как мы утверждали, есть единственная контрольная точка, которая контролирует продвижение через митоз, но нет четких доказательств наличия какой-либо контрольной точки, которая контролирует прохождение как через G2, так и через митоз.
Мало кто не согласится с тем, что научные достижения зависят от способности вовлеченных ученых ясно общаться. Не менее важной частью научного познания является способность помещать отдельные результаты в более широкий контекст предыдущих и параллельных исследований. Это требует глубокого понимания критических концепций, определяющих область. Несоблюдение этих концепций и использование неточной терминологии отвлекает внимание от реальных проблем и может маскировать ограничения отдельных экспериментальных подходов и препятствовать продуктивному научному общению.
Ссылки
Mazia D: Хромосомный цикл и центросомный цикл в митотическом цикле. Int Rev Cytol. 1987, 100: 49-92.
Артикул КАС пабмед Google Scholar
Mazia D: Митоз и физиология клеточного деления. Мейоз и митоз. Под редакцией: Brachet J, Mirsky AE.
 1961, Нью-Йорк: Academic Press, 77–412.
1961, Нью-Йорк: Academic Press, 77–412.Google Scholar
Hartwell LH, Weinert TA: Контрольные точки: элементы управления, обеспечивающие порядок событий клеточного цикла. Наука. 1989, 246: 629-634.
Артикул КАС пабмед Google Scholar
Li R, Murray AW: Контроль митоза с обратной связью у почкующихся дрожжей. Клетка. 1991, 66: 519-531.
Артикул КАС пабмед Google Scholar
Доблс М., Либерал В., Скотт М.Л., Бенезра Р., Зоргер П.К.: Неправильная сегрегация хромосом и апоптоз у мышей, лишенных белка митотической контрольной точки Mad2. Клетка. 2000, 101: 635-645.
Артикул КАС пабмед Google Scholar
Basto R, Brunk K, Vinogradova T, Peel N, Franz A, Khodjakov A, Raff JW: Амплификация центросом может инициировать онкогенез у мух.
 Клетка. 2008, 133: 1032-1042.
Клетка. 2008, 133: 1032-1042.Артикул ПабМед Центральный КАС пабмед Google Scholar
Clute P, Pines J: временной и пространственный контроль разрушения циклина B1 в метафазе. Nat Cell Biol. 1999, 1: 82-87.
Артикул КАС пабмед Google Scholar
Gascoigne KE, Taylor SS: Раковые клетки демонстрируют глубокие внутри- и межлинейные вариации после длительного воздействия антимитотических препаратов. Раковая клетка. 2008, 14: 111-122.
Артикул КАС пабмед Google Scholar
Бахум С.Ф., Томпсон С.Л., Мэннинг А.Л., Комптон Д.А.: Стабильность генома обеспечивается временным контролем динамики кинетохор-микротрубочек. Nat Cell Biol. 2009 г., 11: 27-35.
Артикул ПабМед Центральный КАС пабмед Google Scholar
«>Ридер С.Л., Коул Р.В., Ходжаков А., Слудер Г. Контрольная точка, задерживающая анафазу в ответ на моноориентацию хромосом, опосредована ингибирующим сигналом, производимым неприкрепленными кинетохорами. Джей Селл Биол. 1995, 130: 941-948.
Артикул КАС пабмед Google Scholar
Пинский Б.А., Биггинс С.: Контрольная точка шпинделя: натяжение по сравнению с креплением. Тенденции клеточной биологии. 2005, 15: 486-493.
Артикул КАС пабмед Google Scholar
Yang Z, Kenny A, Brito D, Rieder CL: Клетки удовлетворяют митотической контрольной точке в таксоле и делают это быстрее в концентрациях, которые стабилизируют синтетические связи. Джей Селл Биол. 2009, 186: 675-684.
Артикул ПабМед Центральный КАС пабмед Google Scholar
Скачать ссылки
Благодарности
Мы благодарим Тима Ханта за то, что он побудил нас выразить эти взгляды. Исследования в наших лабораториях поддерживаются грантами Национального института здравоохранения GM 59.363 (к АК) и GM 40198 (к CLR). Мы приносим свои извинения нашим коллегам, чья работа не была должным образом процитирована в этом мнении из-за ограничений формата.
Исследования в наших лабораториях поддерживаются грантами Национального института здравоохранения GM 59.363 (к АК) и GM 40198 (к CLR). Мы приносим свои извинения нашим коллегам, чья работа не была должным образом процитирована в этом мнении из-за ограничений формата.
Author information
Authors and Affiliations
Wadsworth Center, PO Box 509, Albany, NY, 12201-0509, USA
Alexey Khodjakov & Conly L Rieder
Authors
- Alexey Khodjakov
View author публикации
Вы также можете искать этого автора в PubMed Google Академия
- Conly L Rieder
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
Авторы, переписывающиеся
Переписка с Алексей Ходжаков или Конли Л. Ридер.
Оригинальные файлы изображений, представленные авторами
Ниже приведены ссылки на оригинальные файлы изображений, представленные авторами.




 Это делает ddATP мощным химиотерапевтическим разрушителем репликации. Taxol — еще один химиопрепарат, который действует в этом случае не за счет ингибирования репликации S-фазы, а за счет блокирования деполимеризации микротрубочек веретенообразных волокон, тем самым блокируя митотические анафазы и телофазы в последней части М- и С-фаз цикла. Колхицин (растительный алкалоид) атакует раковые (и другие делящиеся) клетки, блокируя образование микротрубочек и тем самым предотвращая образование веретенообразных волокон в митотической профазе.
Это делает ddATP мощным химиотерапевтическим разрушителем репликации. Taxol — еще один химиопрепарат, который действует в этом случае не за счет ингибирования репликации S-фазы, а за счет блокирования деполимеризации микротрубочек веретенообразных волокон, тем самым блокируя митотические анафазы и телофазы в последней части М- и С-фаз цикла. Колхицин (растительный алкалоид) атакует раковые (и другие делящиеся) клетки, блокируя образование микротрубочек и тем самым предотвращая образование веретенообразных волокон в митотической профазе.
 1961, Нью-Йорк: Academic Press, 77–412.
1961, Нью-Йорк: Academic Press, 77–412. Клетка. 2008, 133: 1032-1042.
Клетка. 2008, 133: 1032-1042.