Как поднять плотность электролита в аккумуляторе? — Блог
Сегодня без труда можно найти целую кипу материалов о том, как поднять плотность электролита в аккумуляторе автомобиля. К сожалению, обычный пользователь в 99% случаев наталкивается на советы о доливке или замене электролита. В итоге этот метод закрепляется в памяти, как единственно эффективный, и многие применяют его на практике. В результате вернуть аккумулятор к жизни не получается такими методами ни у кого, и пользователи поголовно покупают новый. Задача этого материала — объяснить простыми словами, что такое плотность, почему она может быть низкой, как её правильно повысить, и как делать не стоит.
- Что такое плотность электролита?
- Основные причины низкой плотности электролита
- Способы поднять плотность электролита
Что такое плотность электролита?
Электролит в АКБ — это растворённая в дистиллированной воде (H2O) серная кислота (PbSO4). Плотность воды почти равна 1 г/см3. Если измерить её автолюбительским ареометром, то его поплавок полностью всплывёт, и покажет значение близкое к единице (если вода реально чистая). Плотность концентрированной серной кислоты составляет 1,83 г/см3. Если измерить её тем же ареометром, то его поплавок полностью «утонет» и покажет соответствующее значение.
Плотность воды почти равна 1 г/см3. Если измерить её автолюбительским ареометром, то его поплавок полностью всплывёт, и покажет значение близкое к единице (если вода реально чистая). Плотность концентрированной серной кислоты составляет 1,83 г/см3. Если измерить её тем же ареометром, то его поплавок полностью «утонет» и покажет соответствующее значение.
Плотность электролита — это показатель того, сколько серной кислоты растворено в воде. Чем больше кислоты, тем выше плотность, и наоборот. В исправном аккумуляторе этот показатель может варьироваться в диапазоне 1,11…1,28 г/см3.
Данная цифра зависит от нескольких факторов. В первую очередь, от степени заряженности аккумулятора. Если батарея заряжена на 100%, то плотность составляет 1,26…1,28 г/см3. Соответственно, если разряжена, что называется, в ноль (но не мёртвая совсем), ареометр показывает 1,10…1,11 г/см3. Если же аккумулятор совсем дохлый, например, в нём есть закороченные «банки», то именно в них может быть практически чистая вода без кислоты. То есть, плотность стремится к единице.
То есть, плотность стремится к единице.
Как это работает на практике, и куда «отлучается» кислота из электролита, понижая его плотность? Проще всего это объяснить по вот этой упрощённой дальше некуда формуле:
Pb + PbO + H2SO4 — PbSO4 + H20,
где:
Pb — это чистый свинец, из которого сделаны «минусовые» пластины АКБ;
PbO — оксид свинца, или «плюсовые» пластины АКБ;
H2SO4 — кислота, которая есть в электролите;
PbSO4— сульфат свинца, который образуется на пластинах АКБ в виде бело-серых кристаллов;
H20 — вода.
Если читать эту формулу слева направо, то мы увидим процесс разряда аккумулятора. Кислота взаимодействует с пластинами, благодаря чему с выводов АКБ мы получаем электроэнергию. На пластинах образуется сульфат свинца в виде кристаллов, а электролит постепенно «теряет» кислоту, превращаясь в воду. Его плотность, соответственно, снижается.
Его плотность, соответственно, снижается.
Если читать формулу справа налево, то мы увидим процесс заряда аккумулятора (от генератора или зарядного устройства). Под воздействием электрического тока сульфаты свинца разрушаются, и в электролит возвращается кислота. Его плотность, соответственно, повышается.
Диванные эксперты скажут, что это неполная формула и слишком примитивное объяснение процессов, происходящих в АКБ. И это тот редкий случай, когда они будут правы. Но мы не химики, а автолюбители. И сейчас наша задача — поднять плотность электролита. А изложенной информации более, чем достаточно, чтобы решить эту задачу адекватными методами.
Основные причины низкой плотности электролита
Низкая плотность электролита — это когда в нём недостаточно кислоты. Поплавок ареометра «всплывает», и не «тонет» до зелёной зоны на шкале. Где «прячется» кислота, мы уже знаем — она превращается в сульфат свинца, и откладывается в виде кристаллов на пластинах аккумулятора.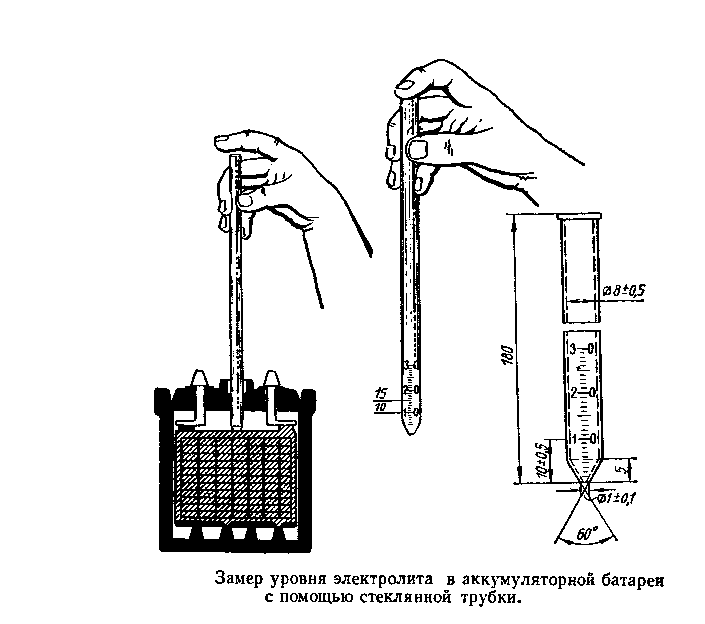 Как же поднять плотность, то есть, заставить кислоту «вернуться» в электролит и раствориться в воде?
Как же поднять плотность, то есть, заставить кислоту «вернуться» в электролит и раствориться в воде?
Чтобы ответить на этот вопрос, надо сначала выяснить, почему плотность электролита низкая. Если аккумулятор не переворачивали, не роняли, и из него ничего не проливалось — причин может быть только четыре. Рассмотрим их.
Аккумулятор разряжен
Разряд аккумулятора и снижение в результате плотности электролита — это нормальные процессы, благодаря которым мы и можем запускать двигатель. Чем больше энергии отдаёт АКБ, тем больше кислоты превращается в сульфат свинца, и тем сильнее падает плотность в ячейках. По плотности даже можно узнать, на сколько процентов разряжен или заряжен аккумулятор. Поэтому, первая причина низкой плотности — АКБ разряжена или заряжена неполностью (здесь как с наполовину пустым или полным стаканом).
Аккумулятор заряжен неправильно
Многие зарядные устройства имеют крайне примитивную схемотехнику, и заряжают аккумуляторы неправильно. Одни приборы завышают напряжение. Другие не умеют его поддерживать на нужном уровне. Третьи не могут ограничивать зарядный ток. В результате использования таких зарядных устройств аккумуляторы, в принципе, заряжаются. Но не на 100%.
Одни приборы завышают напряжение. Другие не умеют его поддерживать на нужном уровне. Третьи не могут ограничивать зарядный ток. В результате использования таких зарядных устройств аккумуляторы, в принципе, заряжаются. Но не на 100%.
Например, если не ограничивать ток заряда, и он будет слишком большим для конкретной модели АКБ, первая стадия зарядки пройдёт быстрее, чем положено. Но энергии аккумулятор накопит меньше, чем он вообще может. То есть, под воздействием тока не весь сульфат свинца успеет раствориться в воде, и повысить плотность электролита.
Если же в зарядном устройстве отсутствует стабилизация напряжения или оно даёт его слишком высокое, аккумулятор раньше времени начинает «кипеть». «Кипение» электролита — это процесс электролиза, в ходе которого вода распадается на кислород и водород, и эти вещества в газообразном состоянии безвозвратно покидают аккумулятор. В итоге, помимо того, что падает уровень электролита, не успевает подняться до нормы его плотность.
Хотя, если измерить плотность, не доливая сначала потерянную из-за электролиза воду, то ареометр может показать даже завышенные цифры. Также уже здесь, наверное, скажем, что сразу после доливания воды в АКБ измерять плотность бессмысленно. В верхних слоях, откуда мы берём электролит ареометром, будет априори низкая концентрация кислоты. Об этом многие не знают, или забывают, из-за чего преждевременно начинают паниковать.
Также уже здесь, наверное, скажем, что сразу после доливания воды в АКБ измерять плотность бессмысленно. В верхних слоях, откуда мы берём электролит ареометром, будет априори низкая концентрация кислоты. Об этом многие не знают, или забывают, из-за чего преждевременно начинают паниковать.
Всякие дешёвые зарядные устройства, позиционирующиеся, как автоматические, поголовно прекращают процесс зарядки слишком рано. То есть, они не заряжают АКБ до 100%. В результате на пластинах ещё остаётся сульфат свинца, часть кислоты в электролит не возвращается, а значит и плотность его не поднимается до нормы.
Неправильный заряд АКБ — это одна из распространённых причин низкой плотности электролита.
Сульфатация
В принципе, сульфатация в чистом виде — это такой же нормальный процесс для АКБ, как заряд и разряд. Но чаще всего этим термином обозначают так называемую необратимую сульфатацию. Это когда сульфат свинца не разрушается, и часть кислоты не возвращается в электролит. Происходит такое сплошь и рядом, а причин может быть, как минимум, две.
Происходит такое сплошь и рядом, а причин может быть, как минимум, две.
Первая причина, и она более распространена, случается тогда, когда аккумулятор долгое время находится в полностью или наполовину разряженном состоянии. В результате такой эксплуатации кристаллы солей свинца увеличиваются в размерах, и в процессе последующих зарядок разрушаются неполностью. Чем чаще и глубже аккумулятор пребывал в разряженном состоянии, тем больше и твёрже на его пластинах «налипает» нерастворимые или труднорастворимые сульфаты. То есть, часть кислоты не возвращается в электролит, даже если мы заряжаем АКБ правильно. Плотность, соответственно, не поднимается до нормы. А ещё при сульфатации аккумулятор накапливает меньше энергии, а значит снижается его ёмкость. Пусковые токи, кстати, тоже «слабеют».
Вторая распространённая причина сульфатации — это длительная эксплуатация АКБ с низким уровнем электролита. То есть, когда свинцовые пластины, на которых уже, как правило, есть сульфаты, внезапно «оголяются», и долго находятся вне электролита.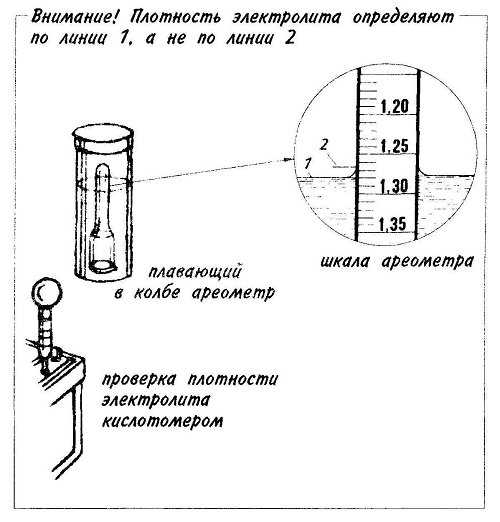 Понятно, что накопленные в таких зонах сульфаты там и остаются. Более того, чем дольше они там «висят», тем прочнее и труднорастворимее они становятся. В итоге, даже когда мы доливаем воду, чтобы восполнить уровень электролита, пострадавшая от «жажды» часть пластин оказывается уже нерабочей, либо крайне неэффективной.
Понятно, что накопленные в таких зонах сульфаты там и остаются. Более того, чем дольше они там «висят», тем прочнее и труднорастворимее они становятся. В итоге, даже когда мы доливаем воду, чтобы восполнить уровень электролита, пострадавшая от «жажды» часть пластин оказывается уже нерабочей, либо крайне неэффективной.
Сульфатация — это частая причина заниженной плотности электролита.
Неравномерная плотность электролита
Последняя причина низкой плотности, о которой ещё лет 20 назад никто не сталкивался — это неравномерная плотность. На практике проблема выглядит следующим образом. Когда мы заряжаем аккумулятор, плотность электролита, который находится непосредственно возле активной зоны пластин, повышается. Над пластинами же, откуда мы набираем электролит в ареометр, плотность заниженная, так как в этой зоне вышеописанные процессы не проходят.
Раньше это не было проблемой, так как все аккумуляторы поголовно «закипали» даже при нормальном напряжении бортовой сети или ЗУ. Электролит активно бурлил, и нижние его слои смешивались с верхними. В результате плотность электролита выравнивалась по всему объёму ячеек и, набирая его в ареометр, мы получали удовлетворяющие нас показания. Проблема была только в том, что «кипение» является не очень полезным эффектом для АКБ. Как минимум потому, что из электролита в газообразном виде улетучивается водород и кислород, который до этого был водой. В итоге аккумуляторы сплошь и рядом эксплуатировались с низким уровнем электролита, что нехорошо отражалось на их ёмкости и ресурсе.
Электролит активно бурлил, и нижние его слои смешивались с верхними. В результате плотность электролита выравнивалась по всему объёму ячеек и, набирая его в ареометр, мы получали удовлетворяющие нас показания. Проблема была только в том, что «кипение» является не очень полезным эффектом для АКБ. Как минимум потому, что из электролита в газообразном виде улетучивается водород и кислород, который до этого был водой. В итоге аккумуляторы сплошь и рядом эксплуатировались с низким уровнем электролита, что нехорошо отражалось на их ёмкости и ресурсе.
Сегодня эта проблема решена. Пластины современных АКБ сделаны так, что электролиз («кипение») в них начинается при напряжении, значительно превышающем норму. То есть, при обычном напряжении ЗУ или бортовой сети электролит «не кипит» никогда. Это позволило уменьшить случаи эксплуатации с низким уровнем электролита, и избавило автолюбителей от надобности постоянно доливать в АКБ дистиллированную воду. Более того, часть аккумуляторов и вовсе остались без заливных пробок, и в народе их окрестили необслуживаемыми.
Одну беду побороли, но вторая пришла. Электролит во время правильной зарядки АКБ теперь «не кипит», а значит и не перемешивается. Отсюда и возникает проблема с низкой плотностью. В «дебрях» аккумулятора она, может быть, и нормальная. А вот там, где мы забираем электролит ареометром, она ниже. Более того, если электролит разной плотности так и не смешивается, в аккумуляторе происходит так называемая стратификация. То есть, простыми словами, расслоение электролита. Это тоже проблема, которой раньше не было, а сегодня она уже частично решена.
Способы поднять плотность электролита
Все вышеописанные четыре причины в большинстве случаев — устраняемы. Но это только при условии, что вы знали о них, и своевременно принимали соответствующие меры. Чаще же всего на низкую плотность обращают внимание, когда поднять её адекватными, то есть, естественными методами — сложно или даже невозможно. И тогда люди начинают чудить — сливать электролит, заливать новый, доливать концентрированную кислоту, сверлить необслуживаемые АКБ, чтобы проделать всё вышеперечисленное…
Так делать не стоит. Разве только ради спортивного интереса. Положительного результата эти действия не принесут, и вы, всё равно, купите новый аккумулятор. Если же ещё не поздно, и ваш аккумулятор ещё не отдал концы, плотность электролита можно повысить нормальными методами. С ними вы сейчас и познакомитесь.
Разве только ради спортивного интереса. Положительного результата эти действия не принесут, и вы, всё равно, купите новый аккумулятор. Если же ещё не поздно, и ваш аккумулятор ещё не отдал концы, плотность электролита можно повысить нормальными методами. С ними вы сейчас и познакомитесь.
Даже если у вас ничего не получится, и всё закончится покупкой нового аккумулятора, вы будете знать, как его правильно эксплуатировать, и уже он то прослужит вам положенные 5…7 лет.
Своевременная зарядка аккумулятора
Это самое главное правило эксплуатации АКБ, которое поможет не сталкиваться никогда с низкой плотностью электролита. Заключается оно в том, что уровень заряда аккумулятора следует стараться поддерживать выше отметки в 65…75%. Как только разрядился больше указанного — подзарядите. Случился глубокий разряд? Как можно быстрее зарядите. Затем выясните и устраните причину, из-за которой батарея высадилась в ноль.
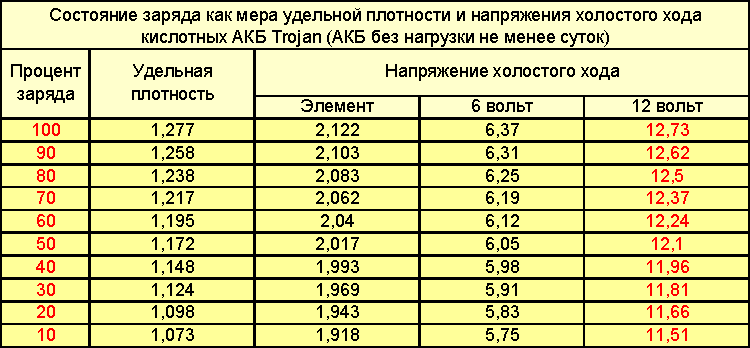
Самый простой способ контролировать уровень заряженности АКБ — это замер напряжения на клеммах. Если мультиметр или бортовой вольтметр показывает меньше 12,30 В — надо подзарядить. Всё просто. Но есть одна важная особенность. Оценивать уровень заряженности АКБ по напряжению можно только после того, как она постоит без дела 8…12 часов. Сразу после зарядки от ЗУ или генератора это делать бессмысленно, так как напряжение всегда будет завышенным и практически ни о чём не говорящим.
Если мультиметр или бортовой вольтметр показывает меньше 12,30 В — надо подзарядить. Всё просто. Но есть одна важная особенность. Оценивать уровень заряженности АКБ по напряжению можно только после того, как она постоит без дела 8…12 часов. Сразу после зарядки от ЗУ или генератора это делать бессмысленно, так как напряжение всегда будет завышенным и практически ни о чём не говорящим.
Обычно, если аккумулятор «живой», на борту присутствует не менее 14,2…14,7 В, машина ездит каждый день более, чем по часу, на улице не зима, а ток утечки в норме — подзаряжать ничего не приходится. Если же в вашем случае эти условия не выполняются, контролируйте уровень заряженности АКБ по утру хотя бы раз в неделю. Со временем, когда вы проделаете контрольные замеры несколько раз, вы будете на уровне интуиции знать, как часто ваш аккумулятор требует внимания.
Правильная зарядка АКБ
Правильно зарядить аккумуляторную батарею можно только двумя способами. Первый — купить реально толковое зарядное устройство, которое выдаёт нормальное стабильное напряжение, ограничивает ток, не вырубается раньше времени, обманывая, что АКБ заряжена на 100%.
Что в случае с хорошими ЗУ, что с регулируемыми блоками питания — оптимальный алгоритм зарядки выглядит следующим образом:
- На начальной стадии ток не должен превышать 10% от реальной ёмкости* АКБ (чем ток меньше, тем лучше).
- Напряжение на клеммах АКБ не должно превышать 14,4 В.
- Заряжать аккумулятор надо до тех пор, пока при указанном напряжении ток заряда не снизится до 0,1 А.
Для зарядки современных кальциевых АКБ в этот алгоритм следует добавить ещё один шаг, но о нём немного позже.
*Реальная ёмкость — это те ампер-часы, которые в действительности способен накопить ваш аккумулятор, а не те, что написаны на этикетке. Её можно измерить специальными приборами. Делается это для того, чтобы не жарить АКБ, на которой написано 60 А*ч, током 6 ампер, когда реально в ней не более 40…50 А*ч. Такое может быть как с новым аккумулятором, и гарантированно есть, если ему несколько лет.
Делается это для того, чтобы не жарить АКБ, на которой написано 60 А*ч, током 6 ампер, когда реально в ней не более 40…50 А*ч. Такое может быть как с новым аккумулятором, и гарантированно есть, если ему несколько лет.
Десульфатация или тренировка
Десульфатация или тренировка (что одно и то же) — это принудительное разрушение сульфатов свинца, которые не растворяются в ходе нормальной зарядки АКБ. Достигается несколькими методами, в частности, путём зарядки малыми токами, циклических зарядов-разрядов, а также зарядкой с кратковременной разрядкой. К сожалению, к десульфатации прибегают уже тогда, когда она аккумулятору, как мёртвому припарки. То есть, когда кристаллы сульфата свинца настолько «бронированные», что разрушить их не может даже самое умное в мире зарядное устройство.
Как выполнить десульфатацию, если у вас в наличии нет «умной» зарядки, но есть регулируемый блок питания или ЗУ с регулировками напряжения и тока? Самый простой способ представляет собой последовательность следующих шагов:
- Ограничьте ток заряда до 5% от реальной ёмкости АКБ (опять же, чем ток меньше, тем лучше, но процесс затянется по времени).

- Напряжение должно быть не более 14,4 В.
- Подготовьте обычную (не светодиодную) 12-вольтовую лампу с проводами.
- Заряжайте АКБ, не превышая указанные напряжение и ток.
- Раз в 10…30 минут (как позволяет время и желание) нагружайте на 3…5 минут АКБ лампой.
- Продолжайте заряд, пока при напряжении 14,4 В ток заряда не снизится до 0,1 А.
- Разрядите АКБ и повторите весь цикл ещё разок-другой (если сульфатация жёсткая, что видно по светло-серым пластинам).
В принципе, положительные результаты даёт даже тренировка без лампочки. То есть, обычная зарядка пониженными токами, затем разрядка и повторение процедуры. Как правило, при каждой следующей зарядке процесс будет проходить заметно дольше. Это означает, что сульфатов стало меньше, и батарея способна накапливать больше энергии (повышается ёмкость).
Если десульфатация увенчалась успехом, то и плотность неминуемо повысится. При этом всё, что придётся доливать в АКБ, это исключительно дистиллированную воду. И то, только если в этом есть необходимость.
И то, только если в этом есть необходимость.
Перемешивание электролита
Проблема эта многим известна и достаточно легко устраняется без танцев с бубном. Одни производители частично решили её внесением новшеств в конструкцию АКБ. В таких аккумуляторах есть элементы, способствующие перемешиванию электролита во время движения автомобиля. Производители кальциевых АКБ предлагают в прилагаемых инструкциях смешивать электролит принудительным «кипячением». На последнем и остановимся.
Чтобы перемешать более плотный электролит с менее плотным, надо заставить его немного «покипеть». Поскольку «кипение» в данном случае вызывается ничем иным, как электролизом (а не нагревом, как в случае с приготовлением пищи), его и будем провоцировать.
Делается правильно это следующим образом:
- Заряжайте АКБ током 10% от реальной ёмкости.
- Не превышайте напряжение 14,4 В.
- Дождитесь, когда при напряжении 14,4 В ток заряда снизится до 0,1 А (первые три шага — это обычный цикл зарядки АКБ).

- Повысьте напряжение заряда до 15,5…16,1 В.
- Ток, при этом, не должен превышать 5% от ёмкости (для 60-ки 3 А).
- Контролируя температуру АКБ, заряжайте в таком режиме 20…40 минут.
- Проверяйте плотность электролита.
Если на аккумуляторе есть цветовой индикатор, то до пункта три включительно он, как правило, будет оставаться красным. Это означает, что плотность в верхних слоях АКБ не дотягивает до нормы, хотя возле пластин она, скорее всего, уже в норме. После шагов 4-5-6 индикатор позеленеет, что укажет на успешное перемешивание и выровнявшуюся плотность. Только после этого есть смысл измерять её ареометром. До «кипячения» плотность всегда будет заниженной.
Перемешаться электролит в заряженной аккумуляторной батарее может и без «кипячения» описанным способом. Плотность часто выравнивается после поездки по не очень ровным дорогам, в тот же день, или к следующему утру (индикатор внезапно зеленеет).
Тем не менее, трясти АКБ в руках, чтобы смешать принудительно электролиты разной плотности, ни в коем случае нельзя. Но это уже другая история.
Итоги
Как видите, материал подошёл к концу, и в нём нет ни одного совета доливать в АКБ свежий электролит или концентрированную серную кислоту. Доливать нужно только воду, и то, если в этом есть необходимость. Если же вам ничего из вышеописанного не помогло поднять плотность, значит вашему аккумулятору пришёл конец. Вы, конечно, можете попробовать заменить электролит, долить кислоты, посверлить корпус необслуживаемой батареи, залить в АКБ воду с содой и многое другое, что советуют на просторах Интернета. Это всё будет очень интересно и познавательно, но от покупки нового аккумулятора подобные мероприятия не спасут.
причины, как увеличить показатель с помощью долива воды
Раствор электролита является катализатором электрохимической реакции, благодаря которой аккумуляторная батарея работает. Он на 65% состоит из дистиллированной воды, а оставшиеся 35% составляет кислота. Чтобы реакция протекала с необходимой скоростью, электролит должен обладать определенной концентрацией. Разобравшись с причиной, почему падает плотность электролита в аккумуляторе, можно восстановить работу АКБ.
Он на 65% состоит из дистиллированной воды, а оставшиеся 35% составляет кислота. Чтобы реакция протекала с необходимой скоростью, электролит должен обладать определенной концентрацией. Разобравшись с причиной, почему падает плотность электролита в аккумуляторе, можно восстановить работу АКБ.
Содержание
- Причины падения показателя
- Подготовка батареи
- Восстановление плотности
Причины падения показателя
Перед тем как увеличить плотность в аккумуляторе, необходимо разобраться в причинах происходящего. Для любой аккумуляторной батареи изменение этого параметра считается нормальным явлением. Когда АКБ разряжается, то он падает и наоборот.Если же после зарядки аккумулятор не способен удерживать заряд, то плотность электролита упала ниже минимально допустимого уровня.
Причин, почему падает плотность в аккумуляторе, может быть несколько:
- Батарея просто разряжена.

- Из-за перезаряда АКБ часть раствора выкипела.
- Вода была долита, но концентрация раствора не контролировалась.
С первым пунктом все предельно ясно, и дополнительных комментариев здесь не требуется. А вот причины кипения раствора известны далеко не каждому автовладельцу. Следует заметить, что этот процесс в сравнении с кипением воды имеет иную природу. Во втором случае он активируется благодаря нагреванию емкости. Вполне очевидно, что аккумулятор никто не подогревает, но при этом электролит кипит.
Причина этого в физически-химических процессах, протекающих в АКБ. Если она отключена от бортовой электросети или зарядного устройства, то электролит не будет кипеть. Под воздействием электрического тока в растворе активируется процесс электролиза, а молекулы воды распадаются на водород и кислород. Именно эти газы и поднимаются в виде пузырьков.
Многим автолюбителям, особенно начинающим, известна ситуация: долил воды в аккумулятор — пропала плотность.
Во время технического обслуживания батареи необходимо в обязательном порядке контролировать этот показатель. В противном случае концентрация раствора будет постепенно снижаться.
Подготовка батареи
Когда автолюбителю известно, почему упала плотность электролита в аккумуляторе, то сразу поднимать ее не стоит. Необходимо провести некоторые подготовительные мероприятия. Для этого следует убедиться в выполнении нескольких условий:
- Батарея заряжена.
- Температура раствора в элементах питания составляет от 20 до 25 градусов.
- Уровень электролита в каждой банке соответствует норме.
- Аккумулятор не имеет механических повреждений.
Если АКБ оказалась разряжена, сначала следует восстановить ее емкость. Затем в обязательном порядке проводится измерение плотности раствора, так как концентрация кислоты может быть ниже нормы. Возможна ситуация, в которой этот параметр раствора после перезарядки в элементах питания отличается. Следует помнить, что допустимая разница этого показателя составляет максимум 0,01 кг/см
Следует помнить, что допустимая разница этого показателя составляет максимум 0,01 кг/см
- Сила тока уменьшается в 2−3 раза в сравнении с номинальным показателем.
- Батарея заряжается в течение 1−2 часов.
Если этот метод не помог решить проблему, придется предпринимать более серьезную меру, долив корректирующего электролитного раствора. Здесь необходимо заметить, что использовать его можно только в крайнем случае.
Корректирующим называется электролит, плотность которого составляет 1,4 кг/см3.
Сначала автолюбитель должен проверить АКБ и узнать, почему пропадает концентрация раствора. Если это произошло из-за кипения воды, то корректирующий электролит доливать нельзя. Используется он лишь в двух случаях:
Используется он лишь в двух случаях:
- Обнаружена утечка жидкости из элементов питания.
- В банки было залито много дистиллированной воды, что и стало причиной снижения плотности раствора.
Восстановление плотности
Это кропотливый процесс и автолюбителю потребуется затратить довольно много времени. Причем решить поставленную задачу можно двумя способами и каждый из них необходимо рассмотреть. Начать стоит с доливания корректирующего электролита. Нормальной считается плотность раствора в диапазоне от 1,25 до 1,27 г/см3. Также следует помнить, что это значение должно быть одинаковым в каждом элементе питания батареи. Чтобы приготовить корректирующий электролит, в емкость следует первой залить дистиллированную воду и лишь затем добавить к ней кислоту. В противном случае будет наблюдаться сильное кипение жидкости.
Сначала необходимо из банки откачать раствор с помощью простой спринцовки либо аэрометра. Затем в элемент питания заливается аналогичное количество корректирующего электролита. После этого батарею необходимо поставить на зарядку. После завершения процесса проводится замер параметра и при необходимости процедура повторяется.
После этого батарею необходимо поставить на зарядку. После завершения процесса проводится замер параметра и при необходимости процедура повторяется.
Для реализации второго способа потребуется зарядное устройство. Однако оно должно предоставлять возможность тонко регулировать выходное напряжение. Автоматические зарядные устройства здесь использовать нельзя. Чтобы восстановить плотность, необходимо выполнить следующие действия:
- Полностью зарядить АКБ.
- Когда электролит закипит, силу тока необходимо снизить на 1−2 А.
- Время кипения жидкости зависит от конкретной ситуации и может достигать 24 часов.
После завершения процедуры проводится замер показателя плотности, и при необходимости процесс повторяется. Однако в некоторых ситуациях ни один из этих методов может не сработать. Чаще всего это наблюдается при падении плотности до уровня 1,18 кг/см3 и ниже. В этом случае следует откачать максимальное количество раствора. Затем батарея переворачивается, и в дне каждого элемента питания просверливаются отверстия.
В этом случае следует откачать максимальное количество раствора. Затем батарея переворачивается, и в дне каждого элемента питания просверливаются отверстия.
Вернув АКБ в нормальное положение, остатки электролита выливаются. Банки промываются дистиллированной водой, а затем отверстия надежно запаиваются. После всех этих манипуляций остается лишь залить новый электролит. Проблема падения плотности раствора не является сложной, и она может быть быстро устранена. Однако важно своевременно обнаружить падение показателя, чтобы АКБ не вышла из строя раньше срока.
Ионы в воде и электропроводность
Ионы в воде и электропроводность
До сих пор мы имели дело с законом Ома и проводимостью в целом, и надеемся, что вы поняли его концепцию. Вы можете, однако, задаться вопросом, какое это имеет отношение к измерению электропроводности воды — настоящий вопрос с самого начала. Итак, мы подошли к основной теме.
Под потоком заряда до сих пор подразумевался электрический ток. Металл, например электрический провод, содержит большое количество свободных электронов. Эти электроны передают электрический ток от одного к другому, как шеренга людей, образующих бригаду ведер. Такой металл называется проводником.
Металл, например электрический провод, содержит большое количество свободных электронов. Эти электроны передают электрический ток от одного к другому, как шеренга людей, образующих бригаду ведер. Такой металл называется проводником.
Во-вторых, введем ионный проводник, электрический ток которого переносится ионами, например, раствором электролита.
Сейчас мы обсудим некоторые новые термины, которые появились. Когда определенное вещество растворяется в жидкости — воде в случае Твин — и если полученная таким образом жидкость может проводить электричество, такая жидкость называется раствором электролита, а растворенное вещество называется электролитом. И каждая корпускула, несущая электричество, называется ионом (греческое слово, означающее странник).
Поваренная поваренная соль (NaCl) является электролитом, и когда она растворяется в воде с образованием соленой воды, она превращается в ионы натрия (Na + ) и ионы хлорида (Cl — ), каждый из которых представляет собой корпускулу который проводит электричество.
Вернемся к проводимости. Электропроводность — это показатель того, насколько легко протекает электричество. В воде именно ионы передают электричество от одного к другому. Это означает, что чем больше Na + и Cl — содержится в воде, тем больше электричества переносится и тем выше проводимость.
Подводя итог, если мы знаем электропроводность образца соленой воды, мы можем рассчитать, насколько соленая вода. (Это то, что происходит при преобразовании солености для получения значения, отображаемого кондуктометром Twin.)
Соленость (плотность соли в соленой воде) и электропроводность
Температура жидкости 25°C IEEE J.Ocean.Eng., ОЕ-5(1),3~8(1980).
| Плотность NaCl (В/об) % | Электропроводность (мСм/см) | NaCl density (W / V) % | Conductivity (mS / cm) |
|---|---|---|---|
0. 1 1 | 2.0 | 1.1 | 19.2 |
| 0.2 | 3.9 | 1.2 | 20.8 |
| 0.3 | 5.7 | 1.3 | 22.4 |
| 0.4 | 7.5 | 1.4 | 24.0 |
| 0.5 | 9.2 | 1.5 | 25.6 |
| 0.6 | 10.9 | 1.6 | 27.1 |
| 0.7 | 12.6 | 1.7 | 28.6 |
| 0.8 | 14.3 | 1.8 | 30.1 |
| 0.9 | 16.0 | 1,9 | 31,6 |
| 1,0 | 17,6 | 2,0 | 33.0 |
Сильные электролиты. Некоторые из вас могут задаться вопросом, можно ли также измерить сахарную воду. К сожалению, кондуктометр не может определить плотность сахара в воде. Хотя сахар растворим в воде, он не образует ионов, а значит, не является электролитом.
 Только когда в воде образуются ионы, можно рассчитать плотность растворенного вещества по проводимости, измеренной с помощью кондуктометра.
Только когда в воде образуются ионы, можно рассчитать плотность растворенного вещества по проводимости, измеренной с помощью кондуктометра.Как и человек, электролит обладает множеством свойств. Электролиты можно условно разделить на сильные электролиты и слабые электролиты. Давайте потратим немного времени на эту тему.
Сильные электролиты
Соль содержит NaCl и KCl, которые при растворении в воде образуют электролиты, большая часть которых становится ионами. Зависимость между плотностью и проводимостью почти линейна. Однако, как видно на диаграмме, в отличие от зоны низкой плотности, в зоне высокой плотности не наблюдается увеличения проводимости при дальнейшем увеличении плотности. Наступает точка насыщения, мало чем отличающаяся от дорожной пробки, когда ионы взаимодействуют друг с другом, и это затрудняет протекание электричества.
Слабые электролиты
В зоне очень низкой плотности проводимость имеет линейную зависимость от плотности, как это видно для органических кислот. Хорошим примером является раствор уксусной кислоты. Однако с увеличением плотности скорость ионизации уменьшается. В зоне высокой плотности ионизируется только часть электролита, и из-за переполненности большая часть потенциальных ионов остается растворенной в воде в виде молекул.
Хорошим примером является раствор уксусной кислоты. Однако с увеличением плотности скорость ионизации уменьшается. В зоне высокой плотности ионизируется только часть электролита, и из-за переполненности большая часть потенциальных ионов остается растворенной в воде в виде молекул.
При ионизации CH 3 COOH становится CH 3 COO — и H + , но поскольку это слабый электролит, большая часть молекул остается CH 3 COOH. Другими словами, они хорошая пара. Когда ацетат натрия (CH 3 COONa) ионизируется, он превращается в ацетат ионов CH 3 COO — и ион натрия Na + , но, поскольку он является сильным электролитом, в отличие от ацетата, он проявляет разделение большинства его молекул. В отличие от ацетата, ацетат натрия похож на плохую пару.
О моль/л (моль на литр): моль (обозначение единицы моль в системе СИ) — это одна из химических единиц, которую мы используем для выражения измеренного количества вещества. Число атомов или молекул в одном моле вещества равно константе Авогадро, которая имеет значение 6,022 х 10 23 . Поэтому единица плотности моль/л (моль на литр) показывает, какое количество вещества (в молях) растворено в 1 л раствора.
Число атомов или молекул в одном моле вещества равно константе Авогадро, которая имеет значение 6,022 х 10 23 . Поэтому единица плотности моль/л (моль на литр) показывает, какое количество вещества (в молях) растворено в 1 л раствора.
История электропроводности
Алессандро Вольта был физиком, родившимся в Италии в 1745 году. Он стал известен в 1800 году как изобретатель первой электрической батареи. В отличие от фрикционных батарей, известных до того времени, батарея Вольта обеспечивала непрерывный электрический ток и была одним из величайших изобретений века. Это достижение Вольта проложило путь таким, как Георг Ом, немецкий физик, измеривший проводимость металлов и в 1827 году открывший знаменитый теперь закон Ома.
Майкл Фарадей родился в 179 г.1, сын английского кузнеца. В 13 лет он стал учеником переплетчика, что дало ему доступ ко многим книгам. В 1833 году он стал ассистентом профессора Дэвиса в Королевской исследовательской лаборатории. Он проделал выдающуюся работу в области химии и физики, а в 1833 году сформулировал закон электролиза и представил ион состоящим из корпускул, которые передают электричество в растворе.
Он проделал выдающуюся работу в области химии и физики, а в 1833 году сформулировал закон электролиза и представил ион состоящим из корпускул, которые передают электричество в растворе.
Электропроводность электролитов была энергетически измерена Фридрихом Кольраушем из Германии в 1869 г.и 1880. Говорят, что он начал измерять проводимость как средство получения ионного продукта. Мост Кольрауша, изобретенный им в то время для измерения электропроводности, хорошо известен и сегодня.
| A. Volta | (Italy) | 1745-1827 |
|---|---|---|
| G. Ohm | (Germany) | 1787-1854 |
| M. Faraday | (England) | 1791-1867 |
| F. Kohlrausch | (Германия) | 1840-1910 |
Следующая страница Нормы Кондуктометры
Сильно растворяющие электролиты или мало растворяющие электролиты?
[1]
Ю, Х.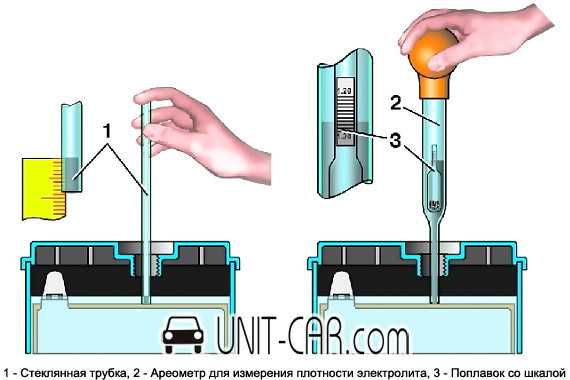 В.; Мантирам, А. Устойчивые аккумуляторные материалы для хранения электроэнергии нового поколения. Доп. Энергетическая поддержка. Рез. 2021 , 2 , 2000102.
В.; Мантирам, А. Устойчивые аккумуляторные материалы для хранения электроэнергии нового поколения. Доп. Энергетическая поддержка. Рез. 2021 , 2 , 2000102.
DOI Академия Google
[2]
Лян Ю.Р.; Чжао, CZ; Юань, Х .; Чен, Ю .; Чжан, WC; Хуанг, JQ; Ю, Д. С.; Лю, Ю.Л.; Титиричи, М.М.; Chueh, Y.L. и соавт. Обзор аккумуляторных батарей для портативных электронных устройств. InfoMat 2019 , 1 , 6–32.
ДОИ Google Scholar
[3]
Чжао М.; Ли, Б.К.; Чжан, XQ; Хуанг, JQ; Чжан, Q. Перспективы практических литий-серных батарей. АКЦ Цент. науч. 2020 , 6 , 1095–1104.
ДОИ Google Scholar
[4]
Нитта, Н.; Ву, FX; Ли, Дж. Т.; Юшин Г. Материалы литий-ионных аккумуляторов: настоящее и будущее. Матер. Сегодня 2015 , 18 , 252–264.
ДОИ Google Scholar
[5]
Wu, FX; Майер, Дж.; Ю, Ю. Руководящие принципы и тенденции для перезаряжаемых литиевых и литий-ионных аккумуляторов нового поколения. Хим. соц. Рев. 2020 , 49 , 1569–1614.
ДОИ Google Scholar
[6]
Ye, HL; Ли, Ю. Г. Обзор многовалентных перезаряжаемых металлоорганических батарей. Энергетическое топливо 2021 , 35 , 7624–7636.
ДОИ Google Scholar
[7]
Jin, C.B.; Лю, Т. Ф.; Шэн, О. В.; Ли, М.; Лю, ТК; Юань, Ю. Ф.; Най, JW; Ю, ZJ; Чжан, В.К.; Лю, Ю.Дж. и соавт. Восстановление мертвого лития в литий-металлических анодах за счет окислительно-восстановительного потенциала йода. Нац. Энергетика 2021 , 6 , 378–387.
ДОИ Google Scholar
[8]
Li, YG; Лу, Дж. Металло-воздушные батареи: станут ли они предпочтительным электрохимическим накопителем энергии в будущем? ACS Energy Письмо.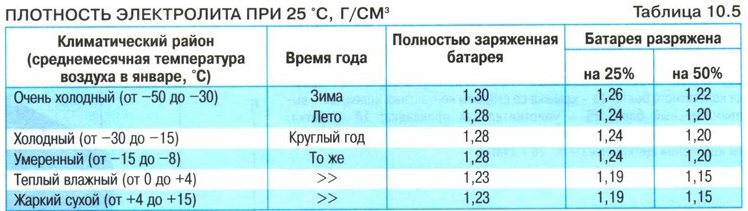 2017 , 2 , 1370–1377.
2017 , 2 , 1370–1377.
ДОИ Google Scholar
[9]
Бхаргав, А.; Он, JR; Гупта, А .; Мантирам, А. Литий-серные батареи: достижение критических показателей. Дж 2020 , 4 , 285–291.
ДОИ Google Scholar
[10]
Панг, К.; Лян, X .; Квок, CY; Назар Л.Ф. Достижения в области литий-серных аккумуляторов на основе многофункциональных катодов и электролитов. Нац. Энергия 2016 , 1 , 16132.
DOI Google Scholar
[11]
Ли М.; Лу, Дж.; Джи, XL; Ли, Ю.Г.; Шао, Ю.Ю.; Чен, ZW; Чжун, К.; Амин, К. Стратегии проектирования неводных многовалентных и одновалентных ионных аккумуляторных анодов. Нац. Преподобный Матер. 2020 , 5 , 276–294.
ДОИ Google Scholar
[12]
Ye, HL; Ли, Ю. Г. Батареи металл-сера при комнатной температуре: чему мы можем научиться у литий-серы? InfoMat 2022 , 4 , e12291.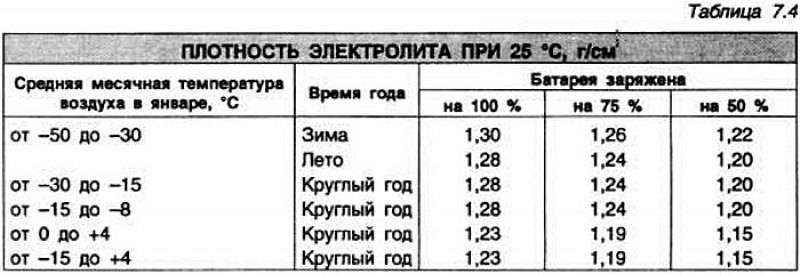
ДОИ Google Scholar
[13]
Yang, YX; Чжун, Ю. Р.; Ши, QW; Ван, ZH; Солнце, К.Н.; Ван, Х.Л. Электрокатализ в литий-серных батареях в условиях обедненного электролита. Анж. хим., межд. Эд. 2018 , 57 , 15549–15552.
ДОИ Google Scholar
[14]
Ян, Ю. Ю.; Ченг, К.; Чжан, Л.; Ли, Ю.Г.; Лу, Дж. Расшифровка механизма реакции литий-серных батарей с помощью in situ / Operando методов определения характеристик на основе синхротрона. Доп. Энергия Матер. 2019 , 9 , 1
8.
DOI Академия Google
[15]
Чжоу Л.; Данилов, Д. Л.; Эйхель, Р.А.; Notten, PHL. Обзор основных материалов, закрепляющих полисульфиды в батареях Li – S. Доп. Энергия Матер. 2021 , 11 , 2001304.
DOI Google Scholar
[16]
Ян, X. Ф.; Ли, Х .; Адэр, К.; Чжан, HM; Sun, XL. Структурный дизайн литий-серных батарей: от фундаментальных исследований к практическому применению. Электрохим. Энергия Ред. 2018 , 1 , 239–293.
Ф.; Ли, Х .; Адэр, К.; Чжан, HM; Sun, XL. Структурный дизайн литий-серных батарей: от фундаментальных исследований к практическому применению. Электрохим. Энергия Ред. 2018 , 1 , 239–293.
ДОИ Google Scholar
[17]
Ye, HL; Ли, Дж. Ю. Твердые добавки для улучшения характеристик серных катодов в литий-серных батареях — адсорбенты, медиаторы и катализаторы. Малые методы 2020 , 4 , 1
DOI Google Scholar
[18]
Pan, HL; Чен, JZ; Цао, Р.Г.; Муругасан, В .; Раджпут, Н.Н.; Хан, К.С.; Перссон, К.; Эстевес, Л.; Энгельхард, MH; Чжан, Дж. Г. и соавт. Подход без инкапсуляции для высокопроизводительных Li-S аккумуляторов посредством контролируемого зарождения и роста. Нац. Энергетика 2017 , 2 , 813–820.
ДОИ Google Scholar
[19]
Wu, FX; Ли, Дж. Т.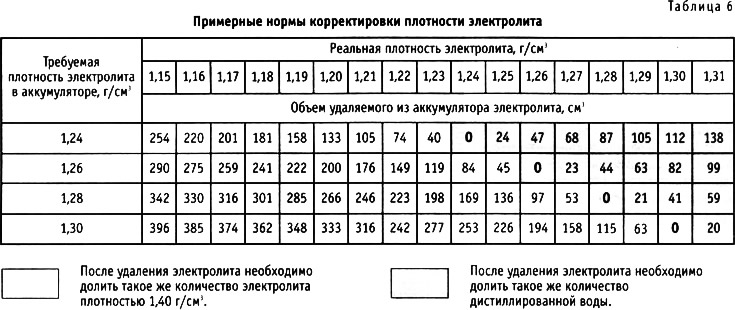 ; Нитта, Н .; Ким, Х .; Бородин, О .; Юшин Г. Иодид лития как перспективная добавка к электролиту для литий-серных аккумуляторов: механизмы повышения производительности. Доп. Матер. 2015 , 27 , 101–108.
; Нитта, Н .; Ким, Х .; Бородин, О .; Юшин Г. Иодид лития как перспективная добавка к электролиту для литий-серных аккумуляторов: механизмы повышения производительности. Доп. Матер. 2015 , 27 , 101–108.
ДОИ Академия Google
[20]
Ченг, Л.; Кертисс, Лос-Анджелес; Завадил, К.Р.; Гевирт, А.А.; Шао, Ю.Ю.; Галлахер, К. Г. Экономно сольватирующие электролиты для литий-серных батарей с высокой плотностью энергии. ACS Energy Письмо. 2016 , 1 , 503–509.
ДОИ Google Scholar
[21]
Li, G. R.; Ван, С.; Чжан, Ю. Н.; Ли, М.; Чен, ZW; Лу, Дж. Пересмотр роли полисульфидов в литий-серных батареях. Доп. Матер. 2018 , 30 , 1705590.
DOI Google Scholar
[22]
Дерфлер, С.; Штрубель, П.; Яуманн, Т .; Трошке, Э.; Хиппауф, Ф.; Кенси, К.; Шекель, А .; Алтьюс, Х .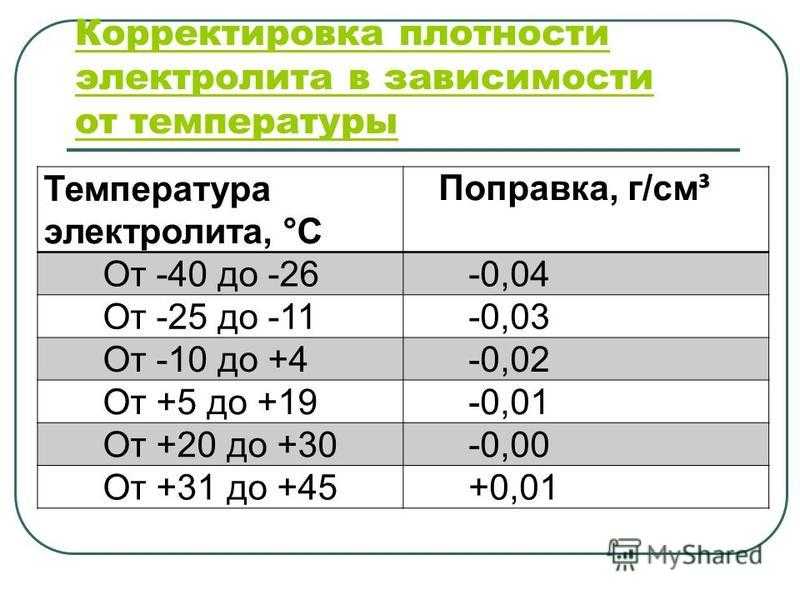 ; Гибелер, Л.; Освальд, С. и др. О механистической роли легированных азотом углеродных катодов в литий-серных батареях с малой долей массы электролита. Nano Energy 2018 , 54 , 116–128.
; Гибелер, Л.; Освальд, С. и др. О механистической роли легированных азотом углеродных катодов в литий-серных батареях с малой долей массы электролита. Nano Energy 2018 , 54 , 116–128.
ДОИ Академия Google
[23]
Чжао М.; Ли, Б.К.; Пэн, HJ; Юань, Х .; Вэй, JY; Хуанг, Дж. К. Литий-серные батареи в условиях обедненного электролита: проблемы и возможности. Анжю. хим., межд. Эд. 2020 , 59 , 12636–12652.
ДОИ Google Scholar
[24]
Ян, X. Ф.; Луо, Дж .; Sun, XL. На пути к высокоэффективным твердотельным батареям Li-S: от фундаментального понимания к инженерному проектированию. Хим. соц. Рев. 2020 , 49 , 2140–2195.
ДОИ Google Scholar
[25]
Чжоу, Г. М.; Чжао, С.Ю.; Ван, Т.С.; Ян, С.З.; Йоханнессен, Б.; Чен, Х .; Лю, CW; Е, Ю. С.; Ву, YC; Пэн, Ю.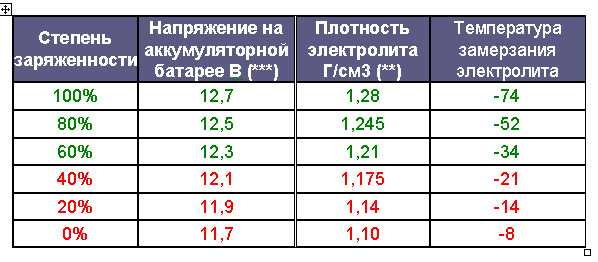 С. и соавт. Теоретические расчеты привели к разработке одноатомных катализаторов для создания быстрых кинетических и долговечных литий-серийных батарей. Нано Летт. 2020 , 20 , 1252–1261.
С. и соавт. Теоретические расчеты привели к разработке одноатомных катализаторов для создания быстрых кинетических и долговечных литий-серийных батарей. Нано Летт. 2020 , 20 , 1252–1261.
ДОИ Академия Google
[26]
Ye, H.L.; Сан, Дж. Г.; Чжао, Ю .; Ли, Дж. Ю. Комплексный подход к улучшению характеристик литий-серных батарей с обедненным электролитом. J. Energy Chem. 2022 , 67 , 585–592.
ДОИ Google Scholar
[27]
Ян, К.; Ли, П.; Ю, Дж.; Чжао, Л. Д.; Конг, Л. Подход к энергоемким и экономичным литий-серным батареям: из соображений химии материалов и цены. Энергетика 2020 , 201 , 117718.
DOI Google Scholar
[28]
Zhang, ZW; Пэн, HJ; Чжао, М .; Хуанг, Дж. К. Гетерогенные/гомогенные медиаторы для литий-серных аккумуляторов высокой плотности энергии: прогресс и перспективы.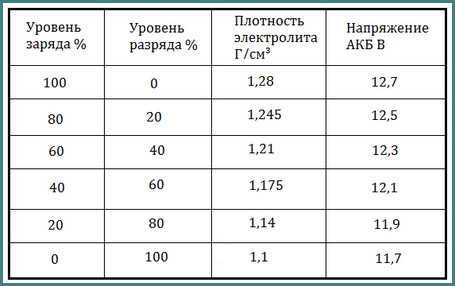 Доп. Функц. Матер. 2018 , 28 , 1707536.
Доп. Функц. Матер. 2018 , 28 , 1707536.
DOI Google Scholar
[29]
Се, Дж.; Пэн, HJ; Песня, YW; Ли, Б.К.; Сяо, Ю .; Чжао, М .; Юань, Х .; Хуанг, JQ; Чжан, К. Пространственное и кинетическое регулирование электрохимии серы на полуиммобилизованных окислительно-восстановительных медиаторах в рабочих батареях. Анж. хим., межд. Эд. 2020 , 59 , 17670–17675.
ДОИ Google Scholar
[30]
Jin, C.B.; Шэн, О. В.; Чжан, В.К.; Луо, JM; Юань, HD; Ян, Т .; Хуанг, Х .; Ган, Ю. П.; Ся, Ю .; Лян, К. и др. Устойчивый, недорогой, естественно многофункциональный углерод из биомассы как для металлического литиевого анода, так и для катода из серы. Материал для хранения энергии. 2018 , 15 , 218–225.
ДОИ Google Scholar
[31]
Fan, F.Y.; Пан, MS; Лау, KC; Ассари, Р.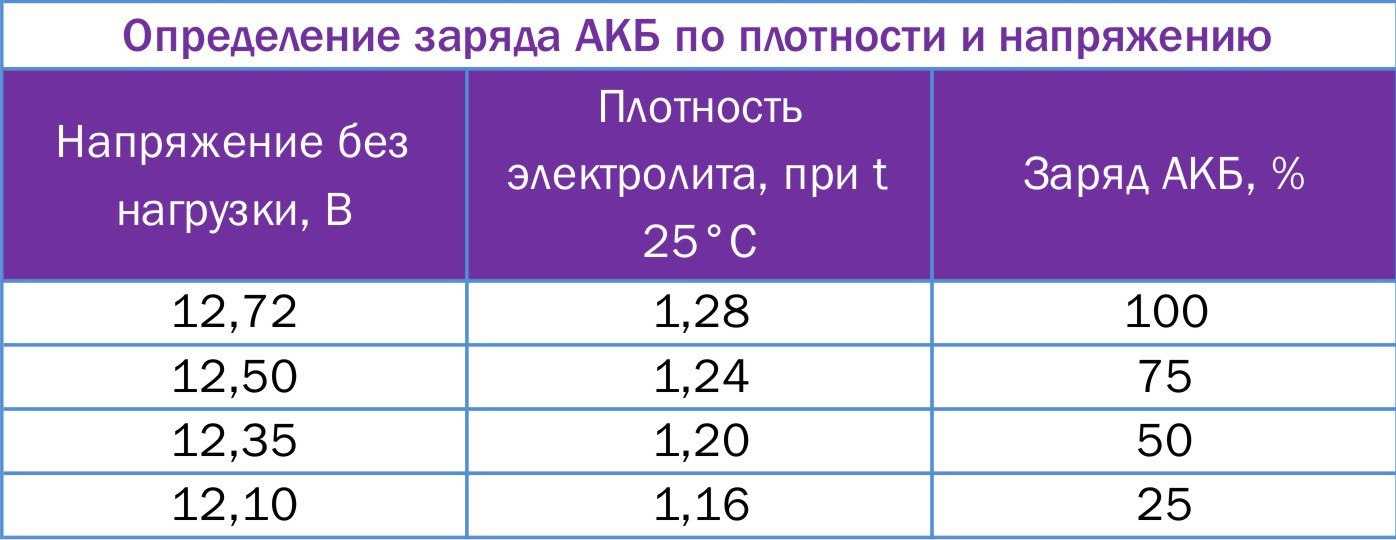 С.; Вудфорд, WH; Кертисс, Лос-Анджелес; Картер, WC; Чанг, Ю.М. Влияние растворителя на кинетику окислительно-восстановительного потенциала полисульфидов и ионную проводимость в литий-серных батареях. Дж. Электрохим. соц. 2016 , 163 , А3111–А3116.
С.; Вудфорд, WH; Кертисс, Лос-Анджелес; Картер, WC; Чанг, Ю.М. Влияние растворителя на кинетику окислительно-восстановительного потенциала полисульфидов и ионную проводимость в литий-серных батареях. Дж. Электрохим. соц. 2016 , 163 , А3111–А3116.
ДОИ Google Scholar
[32]
Huang, JD; Ли, Ф .; Ву, М.Ф.; Ван, HP; Ци, С.Х.; Цзян, GX; Ли, Х .; Ма, Дж. М. Химия электролитов для литий-металлических батарей. Науч. Китайская химия . 2022 , 65 , 840–857.
ДОИ Google Scholar
[33]
Ye, HL; Сан, Дж. Г.; Лим, XF; Чжао, Ю .; Ли, Дж. Ю. Катализ конверсии полисульфидов с помощью посредника для литий-серных батарей с высокой нагрузкой, работающих в условиях обедненного электролита. Материал для хранения энергии. 2021 , 38 , 338–343.
ДОИ Академия Google
[34]
Конг, Л. ; Инь, LH; Сюй, Ф .; Биан, Дж. К.; Юань, HM; Лу, З.Г.; Чжао, Ю.С. Химия сольватации электролита для литий-серных аккумуляторов с обедненным электролитом. J. Energy Chem. 2021 , 55 , 80–91.
; Инь, LH; Сюй, Ф .; Биан, Дж. К.; Юань, HM; Лу, З.Г.; Чжао, Ю.С. Химия сольватации электролита для литий-серных аккумуляторов с обедненным электролитом. J. Energy Chem. 2021 , 55 , 80–91.
ДОИ Google Scholar
[35]
Лю, Ю. Т.; Элиас, Ю.; Мэн, Дж. С.; Аурбах, Д.; Цзоу, RQ; Ся, Д.Г.; Панг, К. К. Дизайн электролитных растворов для литий-серных аккумуляторов. Джоуль 2021 , 5 , 2323–2364.
ДОИ Google Scholar
[36]
Цзоу, К. Л.; Лу, Ю. К. Дизайн жидких электролитов для металл-серных батарей: механистическое понимание и перспектива. EcoMat 2021 , 3 , e12115.
ДОИ Google Scholar
[37]
Урбонайте С.; Поукс, Т .; Новак, П. Продвижение к коммерчески жизнеспособным аккумуляторным батареям Li-S. Доп. Энергия Матер. 2015 , 5 , 1500118.
DOI Google Scholar
[38]
Чанг С. Х.; Чанг, CH; Мантирам, А. Прогресс в отношении критических параметров литий-серных батарей должен стать практически жизнеспособным. Доп. Функц. Матер. 2018 , 28 , 1801188.
DOI Google Scholar
[39]
Чен, X.; Хоу, Т.З.; Перссон, К.А.; Чжан, К. Объединение теории и эксперимента в литий-серных батареях: текущий прогресс и перспективы на будущее. Матер. Сегодня 2019 , 22 , 142–158.
ДОИ Google Scholar
[40]
Yin, YX; Синь, С .; Го, Ю.Г.; Ван, Л. Дж. Литий-серные батареи: электрохимия, материалы и перспективы. Анжю. хим., межд. Эд. 2013 , 52 , 13186–13200.
ДОИ Google Scholar
[41]
Хе, Дж.; Мантирам, А. Обзор состояния и проблем электрокатализаторов в литий-серных батареях. Хранилище энергии . 2019 , 20 , 55–70.
Хранилище энергии . 2019 , 20 , 55–70.
ДОИ Google Scholar
[42]
Song, YZ; Кай, WL; Конг, Л.; Кай, Дж. С.; Чжан, В.; Сан, Дж. Ю. Рационализация электрокатализа химии Li-S с помощью конструкции медиатора: прогресс и перспективы. Доп. Энергия Матер. 2020 , 10 , 1
DOI Google Scholar
[43]
Лю, Д. Х.; Чжан, К.; Чжоу, GM; Лв, Вт.; Линг, GW; Чжи, LJ; Ян, К. Х. Каталитические эффекты в литий-серных батареях: ускорение преобразования серы и снижение эффекта челнока. Доп. науч. 2018 , 5 , 1700270.
DOI Google Scholar
[44]
Гофер, Ю.; Эли, Ю. Э.; Аурбах Д. Химия поверхности лития в 1,3-диоксолане. Электрохим. Acta 1992 , 37 , 1897–1899.
ДОИ Google Scholar
[45]
Чжан, Г.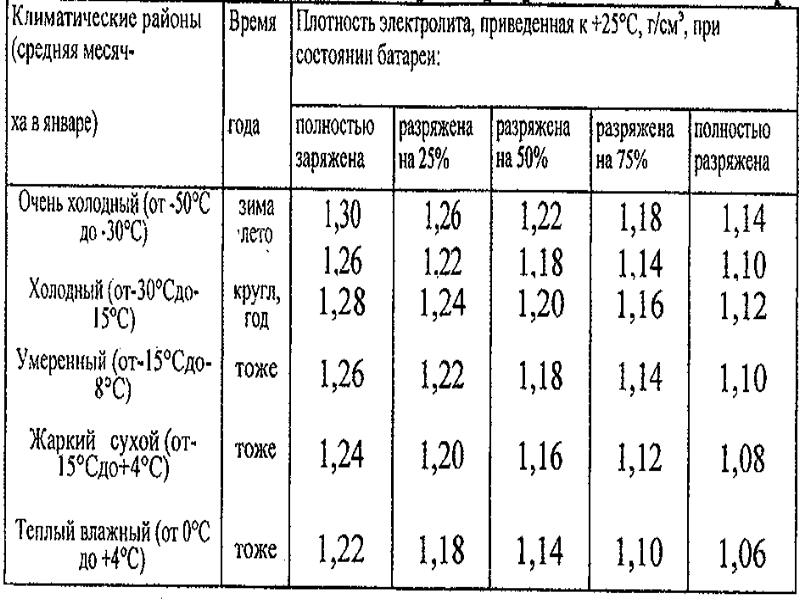 ; Чжан, ZW; Пэн, HJ; Хуанг, JQ; Чжан, В. Набор инструментов для исследования литий-серных батарей: методы и протоколы. Малые методы 2017 , 1 , 1700134.
; Чжан, ZW; Пэн, HJ; Хуанг, JQ; Чжан, В. Набор инструментов для исследования литий-серных батарей: методы и протоколы. Малые методы 2017 , 1 , 1700134.
DOI Google Scholar
[46]
Qian, J.; Ван, FJ; Ли, Ю .; Ван, С.; Чжао, Ю.Ю.; Ли, В.Л.; Син, Ю .; Дэн, Л.; Солнце, В.; Ли, Л. и др. Электрокаталитическая прослойка с быстрой диффузией полисульфидов лития для литий-серных аккумуляторов для улучшения электрохимической кинетики в условиях обедненного электролита. Доп. Функц. Матер. 2020 , 30 , 2000742.
DOI Google Scholar
[47]
Pan, HL; Хан, К.С.; Энгельхард, MH; Цао, Р.Г.; Чен, JZ; Чжан, Дж. Г.; Мюллер, К. Т.; Шао, Ю.Ю.; Лю, Дж. Решение проблем пассивации литий-серных аккумуляторов в условиях обедненного электролита. Доп. Функц. Матер. 2018 , 28 , 1707234.
DOI Google Scholar
[48]
Fu, YZ; Су, Ю. С.; Мантирам, А. Ли 2 Многослойные электроды из S-углерода с превосходными характеристиками для литий-серных аккумуляторов. Доп. Энергия Матер. 2014 , 4 , 1300655.
С.; Мантирам, А. Ли 2 Многослойные электроды из S-углерода с превосходными характеристиками для литий-серных аккумуляторов. Доп. Энергия Матер. 2014 , 4 , 1300655.
DOI Google Scholar
[49]
Чжан, Б.Х.; Ву, Дж. Ф.; Гу, JK; Ли, С .; Ян, Т.Ю.; Гао, XP. Фундаментальное понимание полисульфидов лития в электролите на основе эфира для литий-серных батарей. ACS Energy Письмо. 2021 , 6 , 537–546.
ДОИ Google Scholar
[50]
Ye, HL; Ли, М.; Лю, ТК; Ли, Ю.Г.; Лу, Дж. Активация Li 2 S в качестве литийсодержащего катода в литий-серных батареях. ACS Energy Письмо. 2020 , 5 , 2234–2245.
ДОИ Google Scholar
[51]
Ye, HL; Сан, Дж. Г.; Чжан, С.Л.; Лин, HB; Чжан, Т.Р.; Яо, QF; Lee, JY. Ступенчатый электрокатализ как стратегия борьбы с челночным перемещением полисульфидов в Li-S батареях. ACS Nano 2019 , 13 , 14208–14216.
ACS Nano 2019 , 13 , 14208–14216.
ДОИ Google Scholar
[52]
Fan, F.Y.; Чанг, Ю.М. Кинетика электроосаждения в батареях Li-S: влияние низкого соотношения электролит/сера и состав поверхности осаждения. Дж. Электрохим. соц. 2017 , 164 , А917–А922.
ДОИ Google Scholar
[53]
Гупта, А.; Бхаргав, А .; Мантирам, А. Высокосольватирующие электролиты для литий-серных аккумуляторов. Доп. Энергия Матер. 2019 , 9 , 1803096.
DOI Google Scholar
[54]
Гупта, А.; Бхаргав, А .; Мантирам, А. Вызов конверсии с высоким числом доноров и сероорганической конверсией в литий-серных батареях. ACS Energy Письмо. 2021 , 6 , 224–231.
ДОИ Google Scholar
[55]
Lee, C.W.; Панг, К.; Имеет.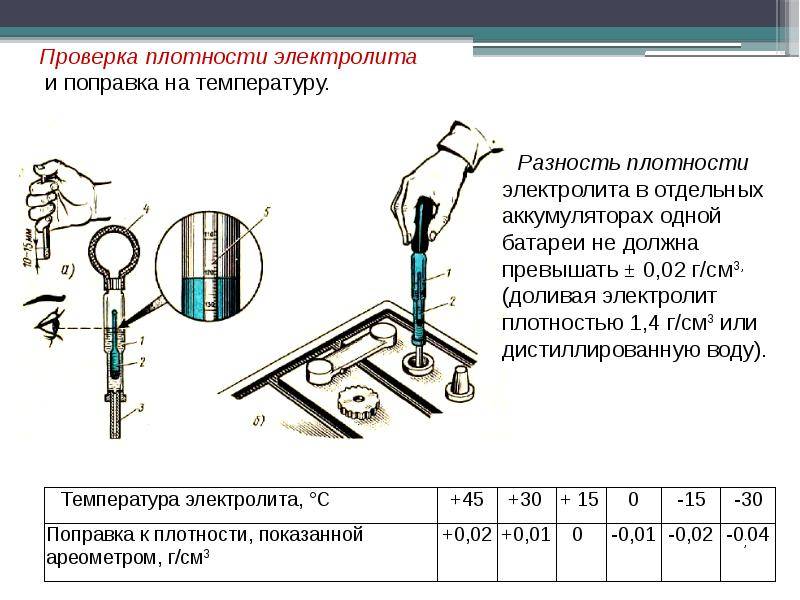 ; Ченг, Л.; Хан, SD; Завадил, К.Р.; Галлахер, К.Г.; Назар, Л.Ф.; Баласубраманян, М. Направление пути реакции литий-сера с помощью умеренно сольватирующих электролитов для батарей с высокой плотностью энергии. АКЦ Цент. науч. 2017 , 3 , 605–613.
; Ченг, Л.; Хан, SD; Завадил, К.Р.; Галлахер, К.Г.; Назар, Л.Ф.; Баласубраманян, М. Направление пути реакции литий-сера с помощью умеренно сольватирующих электролитов для батарей с высокой плотностью энергии. АКЦ Цент. науч. 2017 , 3 , 605–613.
ДОИ Google Scholar
[56]
Бэк М.; Шин, Х .; Чар, К .; Чой, Дж. В. Новый электролит с высоким содержанием доноров для литий-серных батарей. Доп. Матер. 2020 , 32 , 2005022.
DOI Google Scholar
[57]
Ye, HL; Сан, Дж. Г.; Чжан, С.Л.; Чжан, Т.Р.; Чжао, Ю .; Песня, CY; Яо, QF; Ли, Дж. Ю. Катализ усиленной полисульфидной конверсии в литий-серных батареях с добавками к электролиту для очистки поверхности. Хим. англ. Дж. 2021 , 410 , 128284.
DOI Google Scholar
[58]
Jiang, Z.P.; Цзэн, ZQ; Лян, XM; Ян, Л . ; Ху, В .; Чжан, К.; Хан, ZL; Фэн, JW; Се, Дж. Фторбензол, экономичный и бифункциональный углеводородный сорастворитель с низкой плотностью для практических литий-металлических батарей. Доп. Функц. Матер. 2021 , 31 , 2005991.
; Ху, В .; Чжан, К.; Хан, ZL; Фэн, JW; Се, Дж. Фторбензол, экономичный и бифункциональный углеводородный сорастворитель с низкой плотностью для практических литий-металлических батарей. Доп. Функц. Матер. 2021 , 31 , 2005991.
DOI Академия Google
[59]
Cuisinier, M.; Харт, К.; Баласубраманян, М.; Гарсуч, А .; Назар, Л.Ф. Радикальный или нерадикальный: новый взгляд на электрохимию лития и серы в неводных электролитах. Доп. Энергия Матер. 2015 , 5 , 1401801.
DOI Google Scholar
[60]
Li, Z. J.; Чжоу, YC; Ван, Ю.; Lu, YC. Электроосаждение Li 2 S с помощью растворителя: важный манипулятор в литий-серных батареях. Доп. Энергия Матер. 2019 , 9 , 1802207.
DOI Google Scholar
[61]
Чжан, Г.; Пэн, HJ; Чжао, CZ; Чен, X .; Чжао, Л. Д.; Ли, П.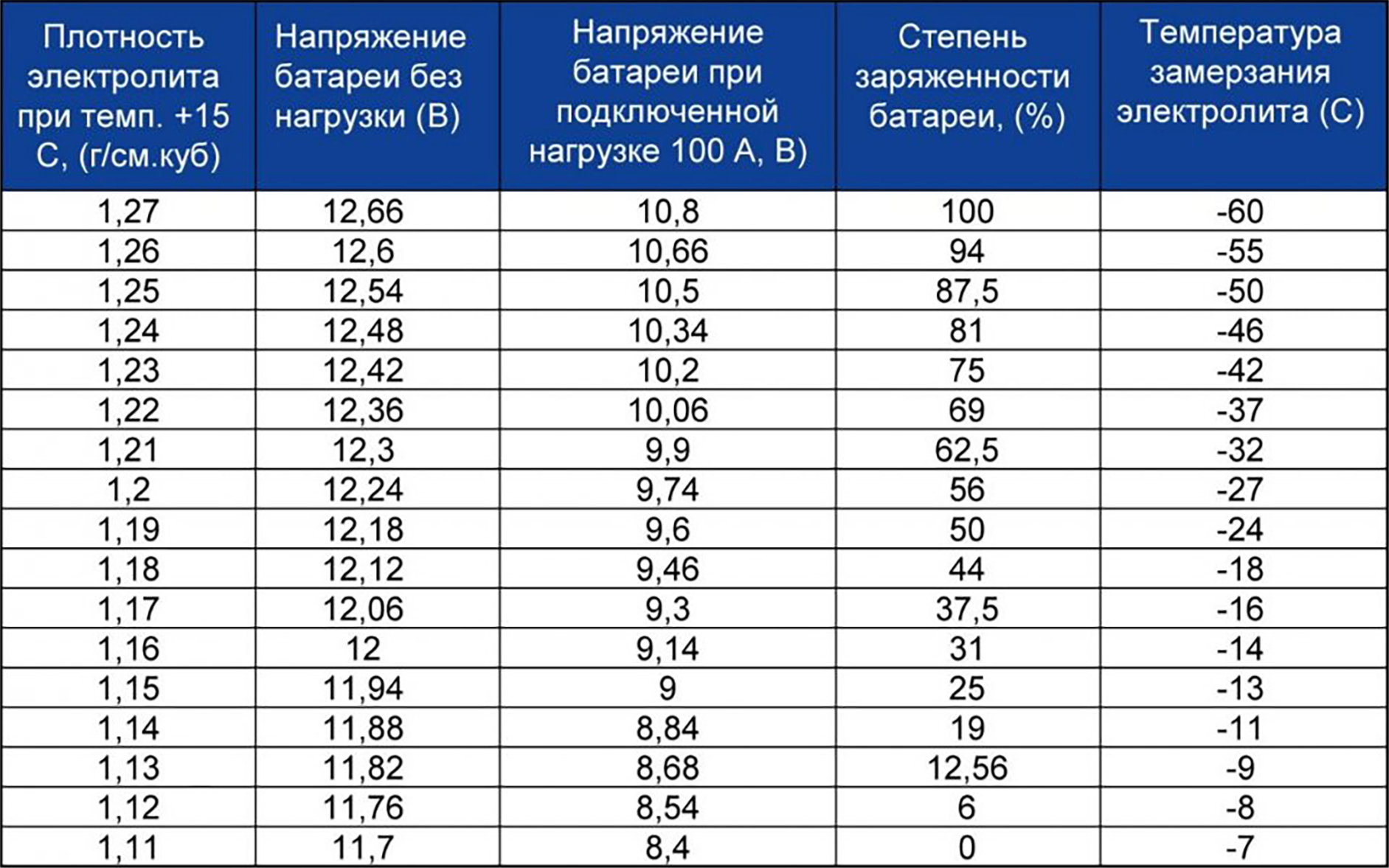 ; Хуанг, JQ; Чжан, К. Радикальный путь, основанный на металл-литий-совместимом электролите с высокой диэлектрической проницаемостью для литий-серных батарей. Анжю. хим., межд. Эд. 2018 , 57 , 16732–16736.
; Хуанг, JQ; Чжан, К. Радикальный путь, основанный на металл-литий-совместимом электролите с высокой диэлектрической проницаемостью для литий-серных батарей. Анжю. хим., межд. Эд. 2018 , 57 , 16732–16736.
ДОИ Академия Google
[62]
Чу, Х.; Но, Х .; Ким, YJ; Юк, С .; Ли, Дж. Х.; Ли, Дж.; Квак, Х .; Ким, Ю .; Ян, Д.К.; Ким, Х. Т. Достижение трехмерного роста сульфида лития в литий-серных батареях с использованием анионов с большим числом доноров. Нац. коммун. 2019 , 10 , 188.
DOI Google Scholar
[63]
Лиан, Дж.; Го, В .; Фу, Ю. З. Изомерные дитиолорганические добавки для улучшения межфазной химии в перезаряжаемых батареях Li-S. Дж. Ам. хим. соц. 2021 , 143 , 11063–11071.
ДОИ Google Scholar
[64]
Gao, XJ; Ян, XF; Ли, MS; Солнце, В.; Лян, Дж.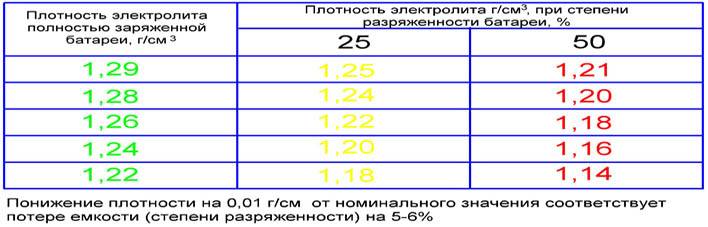 Н.; Луо, Дж .; Ван, JW; Ли, WH; Лян, JW; Лю, Ю.Л. и соавт. Легированный кобальтом SnS 2 с двойными активными центрами синергетического абсорбционно-каталитического эффекта для Li-S аккумуляторов с высоким содержанием серы. Доп. Функц. Матер. 2019 , 29 , 1806724.
Н.; Луо, Дж .; Ван, JW; Ли, WH; Лян, JW; Лю, Ю.Л. и соавт. Легированный кобальтом SnS 2 с двойными активными центрами синергетического абсорбционно-каталитического эффекта для Li-S аккумуляторов с высоким содержанием серы. Доп. Функц. Матер. 2019 , 29 , 1806724.
ДОИ Google Scholar
[65]
Панг, К.; Лян, X .; Шьямсандер, А .; Назар, Л.Ф. Поверхностный слой твердого электролита, сформированный in vivo , обеспечивает стабильное покрытие металлическим литием. Джоуль 2017 , 1 , 871–886.
ДОИ Google Scholar
[66]
Лян, Дж. В.; Ли, XN; Чжао, Ю .; Гончарова, Л. В.; Ван, GM; Адэр, К.Р.; Ван, CH; Ли, Р.Ю.; Чжу, YC; Qian, Y.T. et al. Insit u Li 3 PS 4 Твердотельные электролитные защитные слои для превосходных долговечных и высокопроизводительных литий-металлических анодов. Доп. Матер. 2018 , 30 , 1804684.
Доп. Матер. 2018 , 30 , 1804684.
DOI Google Scholar
[67]
Чу, Х.; Юнг, Дж.; Но, Х .; Юк, С .; Ли, Дж.; Ли, Дж. Х.; Бэк, Дж.; Ро, Ю .; Квон, Х .; Чой, Д. и соавт. Раскрытие двойной функциональности аниона с высоким числом доноров в литий-серных батареях с обедненным электролитом. Доп. Энергия Матер. 2020 , 10 , 2000493.
DOI Google Scholar
[68]
Du, G.Y.; Лю, CY; Ли, Э. Ю. Исследование DFT происхождения механизма восстановления полисульфидов, зависящего от растворителя, в перезаряжаемых батареях Li – S. Катализаторы 2020 , 10 , 911.
DOI Google Scholar
[69]
Fan, F.Y.; Картер, WC; Чанг, Ю.М. Механизм и кинетика Li 2 Осаждение S в литий-серных батареях. Доп. Матер. 2015 , 27 , 5203–5209.
ДОИ Google Scholar
[70]
He, JR; Бхаргав, А . ; Мантирам, А. Высокоэффективные безанодные литий-серийные батареи со встроенным катодом Li 2 S-электрокатализатора. ACS Energy Письмо. 2022 , 7 , 583–590.
; Мантирам, А. Высокоэффективные безанодные литий-серийные батареи со встроенным катодом Li 2 S-электрокатализатора. ACS Energy Письмо. 2022 , 7 , 583–590.
ДОИ Академия Google
[71]
Сян, Дж. Л.; Чжао, YW; Ван, Л.; Жа, С.Ю. Стратегия предварительной сольватации катодов Li 2 S для литий-серных батарей: обзор. Дж. Матер. хим. А 2022 , 10 , 10326–10341.
ДОИ Google Scholar
[72]
Юань, Х. Д.; Чжан, В.К.; Ван, Дж. Г.; Чжоу, GM; Чжуан, ZZ; Луо, JM; Хуанг, Х .; Ган, Ю. П.; Лян, К.; Ся, Ю. и др. Облегчение реакции выделения серы углеродными нанохлопьями, легированными пиридиновым азотом, для высокостабильных литий-серных аккумуляторов. Energy Storage e Mater. 2018 , 10 , 1–9.
ДОИ Google Scholar
[73]
Юань, Х.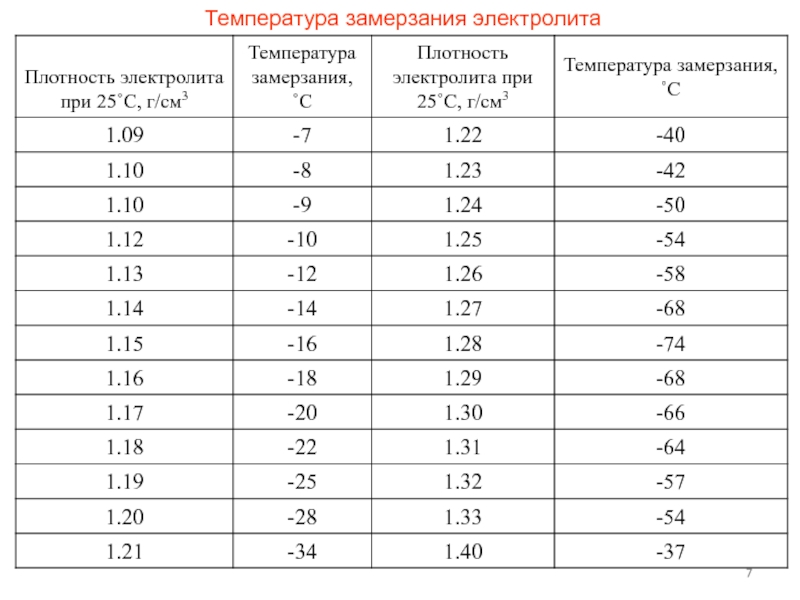 Д.; Чен, XL; Чжоу, GM; Чжан, В.К.; Луо, JM; Хуанг, Х .; Ган, Ю. П.; Лян, К.; Ся, Ю .; Чжан, Дж. и др. Эффективная активация Li 2 S наночастицами фосфидов переходных металлов для высокостабильных литий-серных аккумуляторов. ACS Energy Письмо. 2017 , 2 , 1711–1719.
Д.; Чен, XL; Чжоу, GM; Чжан, В.К.; Луо, JM; Хуанг, Х .; Ган, Ю. П.; Лян, К.; Ся, Ю .; Чжан, Дж. и др. Эффективная активация Li 2 S наночастицами фосфидов переходных металлов для высокостабильных литий-серных аккумуляторов. ACS Energy Письмо. 2017 , 2 , 1711–1719.
ДОИ Google Scholar
[74]
Li, H. T.; Ли, Ю.Г.; Чжан, Л. Принципы разработки усовершенствованных серных катодов для практических литий-серных батарей. SusMat 2022 , 2 , 34–64.
ДОИ Google Scholar
[75]
Панг, К.; Шьямсандер, А .; Нараянан, Б.; Квок, CY; Кертисс, Лос-Анджелес; Назар, Л.Ф. Настройка структуры электролитной сети, чтобы вызвать квазитвердое преобразование серы и подавить образование литиевых дендритов в батареях Li-S. Нац. Энергетика 2018 , 3 , 783–791.
ДОИ Google Scholar
[76]
Хуан, Ф. Ф.; Гао, LJ; Цзоу, Ю. П.; Ма, GQ; Чжан, JJ; Сюй, SQ; Ли, ZX; Лян, X. Акин двухфазное преобразование твердого состояния в твердое в батарее Li-S, достигнутое с помощью скоординированных карбонатных электролитов. Дж. Матер. хим. А 2019 , 7 , 12498–12506.
Ф.; Гао, LJ; Цзоу, Ю. П.; Ма, GQ; Чжан, JJ; Сюй, SQ; Ли, ZX; Лян, X. Акин двухфазное преобразование твердого состояния в твердое в батарее Li-S, достигнутое с помощью скоординированных карбонатных электролитов. Дж. Матер. хим. А 2019 , 7 , 12498–12506.
ДОИ Академия Google
[77]
Веллер, К.; Пампель, Дж.; Дерфлер, С .; Алтьюс, Х .; Каскель, С. Подавление полисульфидного челнока электролитами с низкой плотностью для высокоэнергетических литий-серных аккумуляторов. Энергетика. 2019 , 7 , 1
DOI Google Scholar
[78]
Ченг, К.; Сюй, WH; Цинь, С.Ю.; Дас, С .; Джин, Т. В.; Ли, Эй Джей; Ли, AC; Ци, Б.Ю.; Яо, ПК; Чжай, Х.В. и соавт. Полное растворение всего семейства сульфидов лития (Li 2 S 8 по Li 2 S) в безопасном эвтектическом растворителе для литий-серных аккумуляторных батарей. Анжю. хим., межд. Эд. 2019 , 58 , 5557–5561.
хим., межд. Эд. 2019 , 58 , 5557–5561.
ДОИ Google Scholar
[79]
Чжэн, Дж.; Джи, Великобритания; Фан, XL; Чен, Дж.; Ли, В.; Ван, HY; Ян, Ю .; ДеМелла, KC; Рагхаван, С.Р.; Ван, К.С. Высокофторированные электролиты для Li-S аккумуляторов. Доп. Энергия Матер. 2019 , 9 , 1803774.
DOI Google Scholar
[80]
Шин В.; Чжу, Л. Д.; Цзян, Х .; Stickle, WF; Фанг, К.; Лю, К.; Лу, Дж.; Ji, XL. Фторированный сорастворитель обещает литий-серийные батареи в условиях обедненного электролита. Матер. Сегодня 2020 , 40 , 63–71.
ДОИ Google Scholar
[81]
Yamada, Y.; Ван, JH; Ко, С .; Ватанабэ, Э .; Ямада, А. Успехи и проблемы в разработке аккумуляторных электролитов на основе солей. Нац. Энергетика 2019 , 4 , 269–280.
ДОИ Google Scholar
[82]
Cuisinier, M. ; Кабельген, ЧП; Адамс, Б.Д.; Гарсуч, А .; Баласубраманян, М.; Назар Л.Ф. Уникальное поведение нерастворителей для полисульфидов в литий-серных батареях. Энергетика Окружающая среда. науч. 2014 , 7 , 2697–2705.
; Кабельген, ЧП; Адамс, Б.Д.; Гарсуч, А .; Баласубраманян, М.; Назар Л.Ф. Уникальное поведение нерастворителей для полисульфидов в литий-серных батареях. Энергетика Окружающая среда. науч. 2014 , 7 , 2697–2705.
ДОИ Google Scholar
[83]
См. К. А.; Ву, HL; Лау, KC; Шин, М .; Ченг, Л.; Баласубраманян, М.; Галлахер, К.Г.; Кертисс, Лос-Анджелес; Гевирт, А.А. Влияние добавления гидрофторэфирного сорастворителя на сольватацию Li в сольватных электролитах на основе ацетонитрила и его влияние на восстановление S в Li-S батарее. Приложение ACS Матер. Интерфейсы 2016 , 8 , 34360–34371.
ДОИ Google Scholar
[84]
Pan, HL; Хан, К.С.; Виджаякумар, М .; Сяо, Дж.; Цао, Р.Г.; Чен, JZ; Чжан, Дж. Г.; Мюллер, К. Т.; Шао, Ю.Ю.; Лю, Дж. Добавки аммония для растворения сульфида лития за счет связывания водорода для высокоэнергетических литий-серных батарей. Разное
Разное





 Во время технического обслуживания батареи необходимо в обязательном порядке контролировать этот показатель. В противном случае концентрация раствора будет постепенно снижаться.
Во время технического обслуживания батареи необходимо в обязательном порядке контролировать этот показатель. В противном случае концентрация раствора будет постепенно снижаться.