Оптимальная плотность электролита! | Статьи компании ООО «KRONVUZ» г Москва
Мы часто сталкиваемся с вопросом об эксплуатации автомобильных аккумуляторов, число автовладельцев возрастает, и, конечно, весь круг автолюбителей знает, что аккумулятор не работает без электролита. Плотность данного вещества зависит от многих факторов, но принято считать, что оптимальная плотность электролита составляет 1,26 г/см3.
По плотности электролита можно установить, в каком состоянии находится батарея. В том случае, когда АКБ плохо держит заряд, нужно проверить концентрацию жидкости внутри нее. Когда батарея находится в рабочем состоянии, вода постепенно испаряется, что способствует большей концентрации электролита, а это оказывает отрицательное влияние на состояние аккумуляторной батареи.
Отрицательно влияет на АКБ как повышенная, так и пониженная плотность электролита. Излишняя плотность активирует химические процессы, протекающие в батарее постоянно. Из этого следует быстрое разрушение пластин и снижение срока службы аккумулятора.
Единой рекомендации оптимальной плотности электролита не существует, потому что его плотность зависит от критических значений температуры в определенных регионах, для каждого из которых есть свое собственное значение.
- В условиях Крайнего Севера плотность электролита должна составлять не менее 1,29 г/см3;
- Для большей части территории РФ приемлем показатель 1,26– 1,27 г/см3;
- В теплых районах нормальная плотность составляет 1,23–1,25 г/см3;
- Минимальным значением является показатель 1,23 г/см3.
Опираясь на эту статистику, можно расценивать показатель 1,26 г/см3 как оптимальный. При заливке электролита готовить раствор рекомендуется, опираясь на минимальный показатель данных диапазонов, а для щелочного аккумулятора плотность содержимого должна составлять около 1,2 г/см3.
Прибор для измерения плотности электролита называется денсиметр. Выполнить проверку плотности можно и с помощью вольтметра.
К каждой АКБ прилагается инструкция по эксплуатации, в которой описаны материалы АКБ, технология изготовления АКБ, а также, к какой категории относится данная АКБ.
Аккумуляторные батареи бывают обслуживаемыми, малообслуживаемыми (на протяжении длительного времени не требующие доливки воды) и необслуживаемые.
К сожалению, не всегда удается уследить за состоянием акб и вовремя его обслуживать. Если жидкость в аккумуляторе поменяла цвет, это значит, что упала плотность и необходимо слить и заменить электролит.
Более подробно узнать информацию об электролите и его замене можно в статье «Замена электролита в аккумуляторе».
Наша компания производит целый ряд устройств для обслуживания аккумуляторных батарей и контроля электролита. Вся продукция производства предприятия «KRONVUZ» выполнена по высоким технологиям, что способствует бесперебойной эксплуатации длительное время.
Рекомендуем ознакомиться со следующими материалами:
Как правильно повысить плотность электролита в аккумуляторе
Пониженная или повышенная плотность электролита в аккумуляторе уменьшает эффективность работы батареи и ускоряет ее износ. Поэтому периодически необходимо измерять данный показатель и в случае отклонений от нормы проводить корректировку. Разберем детально, как это правильно сделать.
Содержание
- Чем и как проверять плотность электролита для аккумуляторов
- Как повысить плотность электролита в автомобильном аккумуляторе
- Резюме
Чем и как проверять плотность электролита для аккумуляторов
Нормой считается показатель в 1,27 грамма на кубический сантиметр.
Вот несколько правил, которые следует соблюдать:
- Измерения нужно проводить при полностью заряженной батарее.
- Проверять необходимо каждую банку.
- Температура воздуха должна быть 20–25 градусов тепла.
С учетом последнего пункта может возникнуть вопрос о том, как повысить плотность электролита в аккумуляторе зимой. Если автомобиль стоит не в теплом гараже, придется снять батарею и занести ее домой. Полностью зарядить и только потом проверить каждую банку.
Как повысить плотность электролита в автомобильном аккумуляторе
Прежде чем приступить к работе, подготавливаем все необходимое. Важно помнить, что данная жидкость представляет собой соединение, опасное для человека. Его попадание на открытые участки кожи может вызвать сильные химические ожоги. Поэтому работать необходимо в защитных резиновых перчатках. Кроме того, потребуются:
- ареометр;
- стеклянная емкость;
- корректирующий электролит;
- дистиллированная вода.
Суть работы заключается в том, чтобы откачать часть жидкости из аккумуляторной батареи и заместить ее корректирующим электролитом. Для откачки можно использовать ареометр. Набираем в него жидкость из батарейных банок и сливаем ее в заранее подготовленную емкость.
При откачивании важно помнить о том, что нельзя оголять аккумуляторные пластины. Необходимо, чтобы они все время были покрыты жидкостью.
Многие автовладельцы задаются вопросом, какой корректирующий электролит для аккумуляторов купить? Хорошим вариантом является «ДРЕКО», имеющий плотность 1,3 г/см3.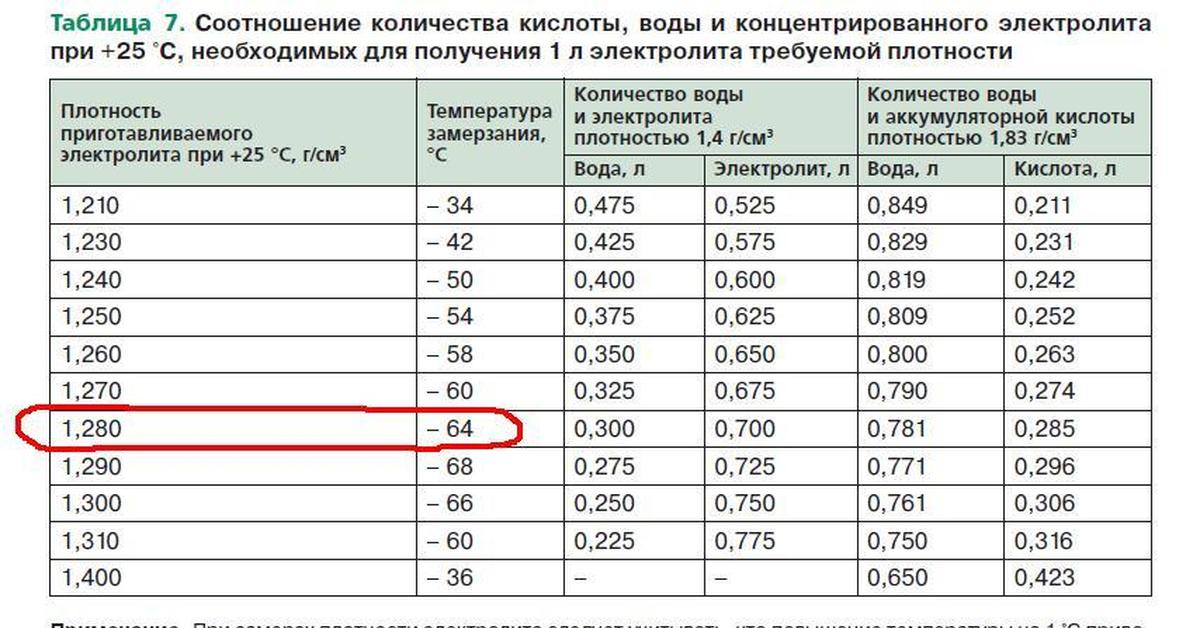
Вы спросите, а что будет, если переборщить? Параметры 1,28–1,29 г/см3 — это уже повышенная плотность электролита, которую в новом аккумуляторе нужно обязательно снизить. Просто добавляем дистиллированную воду. Использовать обычную, из-под крана, нельзя.
Резюме
Быстрый разряд и слабый пусковой ток далеко не всегда говорят о том, что батарею пора менять. Возможно, что причина неэффективной работы кроется именно в понизившейся плотности. Чтобы решить проблему, достаточно купить электролит для аккумуляторов, имеющий повышенную концентрацию, и с его помощью довести показатели до нормы.
Как проверить АКБ автомобиля, как проверить автомобильный аккумулятор на работоспособность
Проверка аккумулятора автомобиля – необходимость, с которой часто сталкиваются автовладельцы. Это можно сделать в автосервисах, доверив диагностику специалистам, и самостоятельно специальными приборами или подручными средствами.
Этапы диагностики
Алгоритм как проверить аккумулятор автомобиля на работоспособность :
- визуальная диагностика;
- контроль уровня электролита;
- контроль напряжения;
- исследование с помощью нагрузочной вилки;
- определение плотности электролита в банках;
- проверка объема АКБ.
Визуальный осмотр
Специалисты рекомендуют проводить внешний осмотр аккумулятора при каждом открытии капота. Корпус должен быть целым, а крепление клемм надежным.
В процессе эксплуатации на поверхности прибора скапливаются грязь, влага, подтеки от кипящего электролита. Клеммы должны быть чистыми — их окисление в совокупности с внешними загрязнениями приводит к росту риска глубокого разряда, который сокращает срок службы прибора.
Как проверить аккумулятор на наличие саморазряда: подключите вольтметр к клемме, другим проведите по поверхности аккумулятора. Если был разряд, проведите чистку — уберите остатки электролита раствором пищевой соды. Зачистите клеммы наждачной бумаги.
Проверка уровня электролита
Для диагностики аккумулятора используется стеклянная уровневая трубка с делениями. Нормальный уровень электролита – 10-12 мм выше пластин.
Состояние аккумулятора проверяется так:
- трубку вводят в заливное отверстие;
- аккуратно продвигают до соприкосновения с сеткой сепаратора;
- затыкают отверстие пальцем;
- вытаскивают трубку.
Уровень жидкости в трубке соответствует уровню электролита в аккумуляторе.
Из-за снижения уровня электролита открываются свинцовые пластины и окисляются, что сокращает срок службы прибора. Восстанавливают уровень дистиллированной водой.
Также обращайте внимание на прозрачность жидкости. Если цвет электролита темный, значит он с примесями окислов. Это снижает способность держать зарядку.
Измерение напряжения
Измерение напряжения – важный этап в диагностике АКБ . Проверять его нужно мультиметром. Это недорогой прибор, который в электронной версии стоит приобрести каждому автовладельцу.
Как проверить заряд аккумулятора автомобиля мультиметром:
- перевести прибор в режим измерения постоянного напряжения;
- установить диапазон выше стандартных максимальных значений;
- черный щуп мультиметра подключить на минус АКБ;
- красный щуп подключить на плюс;
- зафиксировать показания.
Стандартный уровень напряжения аккумулятора – 12,6 вольт. Если оно ниже, требуется зарядка аккумулятора.
С помощью мультиметра также моно проверить АКБ на замыкание. Для этого подсоедините щупы к выходам полностью заряженной батареи.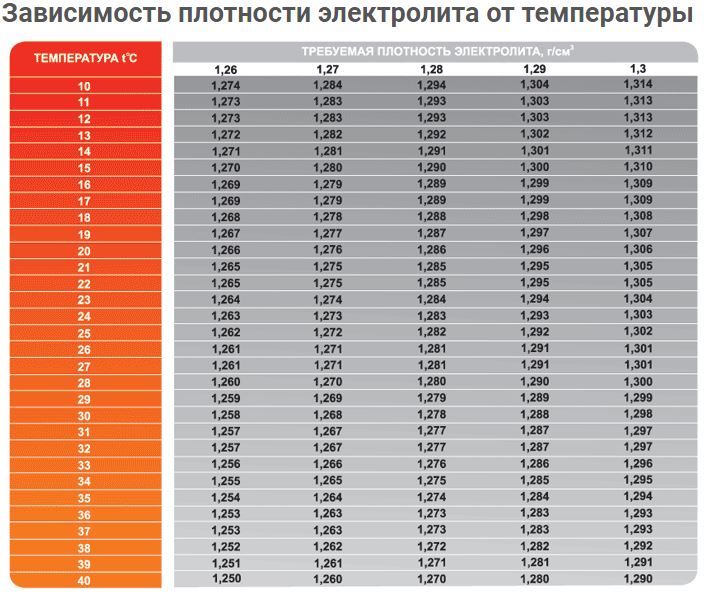
Проверка нагрузочной вилкой
Проверка с помощью нагрузочной вилки (прибора, создающего нагрузку аналогичную, возникающую при работающем двигателе) позволяет выявить работоспособность аккумулятора и оценить его состояние.
Этапы диагностики:
- подключите клеммы контрольного прибора к выходам АКБ;
- если показания ниже 12,6 -1 2,9 вольт, зарядите аккумулятор;
- подайте нагрузку на 5 секунд;
- зафиксируйте показания.
Нормальное напряжение – свыше 10,2 вольт. Показания около 9 вольт говорят, что батарея изношена. Если напряжение ниже 9 вольт, требуется замена аккумулятора.
Проверка плотности электролита
Проверка плотности проводится ареометром. Для этого трубку помещают в заливное отверстие и откачивают часть жидкости. Электролит нужно проверять в каждой банке. Рекомендуем проводить проверку при температуре 20-30 °C., тогда стандартными показателями будут 1.27 – 1.29. При повышенной плотности долейте дистиллированную воду. Если плотность снижена, добавьте раствор электролита (можно добавить жидкость из банки с нормальной либо повышенной плотностью).
Низкая плотность электролита зимнее время можем привести к замерзанию жидкости и, как следствие, деформации корпуса или трещинам.
Повышенная плотность станет причиной преждевременной коррозии элементов аккумулятора, и выведет батарею из строя.
Проверка емкости АКБ
Емкость автомобильного аккумулятора всегда указывается в сопроводительных документах. В процессе эксплуатации показатель уменьшается, что приводит к потере мощностью и снижению эксплуатационных характеристик.
Проверить реальную емкость автомобильного аккумулятора можно контрольным разрядом: АКБ полностью заряжают, разряжают, замеряют время до окончания заряда и по формуле высчитывают емкость:
Е [А*час]=I[А]*T[час] .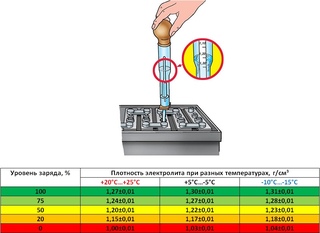
Если реальная емкость отличается от номинальной на 70% и больше, АКБ нужно срочно заменить.
Общие советы:
- Поверхность батареи должна быть чистой, своевременно удаляйте следы масла, подтеки электролита, механические загрязнения
- Регулярно заряжайте батарею
- Проверяйте уровень электролита, особенно в летнее время
- Контролируйте и корректируйте плотность электролита в банках аккумулятора
Эти простые меры позволят вам продлить срок эксплуатации прибора и избежать возникновения нештатных ситуаций.
Хотите обновить машины? Посмотрите онлайн каталог новых и б/у авто в салоне «FAVORIT MOTRS». Мы показываем полную информацию о машине с пробегом до осмотра и тест-драйва в личном кабинете. Забронируйте бесплатно до 3 машин и приезжайте на осмотр в наши автосалоны в Москве. Бронь доступна для всех жителей России.
Оцените наш сервис и подберите себе хорошую машину по доступной цене!
Page not found — автомануал заказ автокниг с доставкой в любую точку мира
НАШИ ПАРТНЕРЫ:
Любой современный легковой или грузовой автомобиль можно обслуживать и
ремонтировать самостоятельно, в обычном гараже. Все что для этого потребуется – набор инструмента и заводское руководство по ремонту с подробным (пошаговым) описанием выполнения операций. Такое
руководство должно содержать типы применяемых эксплуатационных жидкостей, масел и смазок, а самое главное – моменты затяжки всех резьбовых соединений деталей узлов и агрегатов автомобиля.
Итальянские автомобили – Fiat (Фиат) Alfa Romeo (Альфа Ромео) Lancia (Лянча) Ferrari (Феррари) Mazerati (Мазерати) имеют свои конструктивные особенности. Также в особую группу можно выделить все французские машины – Peugout (Пежо), Renault (Рено) и Citroen (Ситроен). Немецкие машины сложные.
Особенно это относится к Mercedes Benz (Мерседес Бенц), BMW (БМВ), Audi (Ауди) и Porsche (Порш), в чуть меньшей — к
Volkswagen (Фольксваген)
и Opel (Опель). Следующую
большую группу, обособленную по конструктивным признакам составляют американские производители- Chrysler, Jeep, Plymouth, Dodge, Eagle, Chevrolet, GMC, Cadillac, Pontiac, Oldsmobile, Ford, Mercury, Lincoln. Из Корейских фирм следует отметить Hyundai/Kia, GM-DAT
(Daewoo), SsangYong.
Следующую
большую группу, обособленную по конструктивным признакам составляют американские производители- Chrysler, Jeep, Plymouth, Dodge, Eagle, Chevrolet, GMC, Cadillac, Pontiac, Oldsmobile, Ford, Mercury, Lincoln. Из Корейских фирм следует отметить Hyundai/Kia, GM-DAT
(Daewoo), SsangYong.
Совсем недавно японские машины отличались относительно низкой первоначальной стоимостью и доступными ценами на запасные части, но в последнее время они догнали по этим показателям престижные европейские марки. Причем это относится практически в одинаковой степени ко всем маркам автомобилей из страны восходящего солнца – Toyota (Тойота), Mitsubishi (Мицубиси), Subaru (Субару), Isuzu (Исудзу), Honda (Хонда), Mazda (Мазда или как говорили раньше Мацуда), Suzuki (Сузуки), Daihatsu (Дайхатсу), Nissan (Ниссан). Ну, а машины, выпущенные под японо-американскими брендами Lexus (Лексус), Scion (Сцион), Infinity (Инфинити), Acura (Акура) с самого начала были недешевыми.
Отечественные автомобили также сильно изменились с введением норм евро-3. лада калина, лада приора и даже лада нива 4х4 теперь значительно сложнее в обслуживании и ремонте.
что делать если машина не заводится, как зарядить аккумулятор, как завести машину в мороз. ответы на эти вопросы можно найти на страницах сайта и книг. представленных здесь же
Автомануал — от англ. manual — руководство. Пособие по ремонту автомобиля или мотоцикла. различают заводские руководства и книги , выпущенные специализированными автомобильными издательствами.
Cайт Автомануал не несет никакой ответственности за возможные повреждения техники или несчастные случаи, связанные с использованием размещенной информации.
Как проверить плотность электролита в аккумуляторе авто?
У кислотных аккумуляторов есть весомое преимущество по сравнению с более современными батареями, что обусловлено возможностью реанимировать их. Благодаря возможности обслуживать такие АКБ, можно восстановить плотность электролита и вернуть батарее ее свойства. Поэтому, обслуживая аккумулятор, плотность электролита в обязательном порядке требуется замерять, потому что от этого параметра зависит корректная работа АКБ. Не стоит избегать решения этой задачи, так как рано или поздно данная проблема даст о себе знать.
Благодаря возможности обслуживать такие АКБ, можно восстановить плотность электролита и вернуть батарее ее свойства. Поэтому, обслуживая аккумулятор, плотность электролита в обязательном порядке требуется замерять, потому что от этого параметра зависит корректная работа АКБ. Не стоит избегать решения этой задачи, так как рано или поздно данная проблема даст о себе знать.
Рекомендуется обратиться в автосервис, если руки не доходят до самостоятельного обслуживания батареи. Его особенность заключается в том, что измерить плотность электролита аккумуляторе можно самостоятельно, имея под рукой ареометр и зная, каким параметрам она должна соответствовать. Параллельно с этим замером выявляется уровень электролита, затем данные сравниваются с выходным напряжением батареи. Это дает общую картину о состоянии АКБ, что необходимо для правильного выполнения восстановительных работ.
Для тех кто не знает, как измерить плотность аккумулятора, сразу оговоримся, что это необходимо делать в каждой банке со свинцовыми пластинами, так как они не зависят друг от друга. Поэтому плотность и уровень электролита, а также выходное напряжение у них будет отличаться. Рассмотрим детально, как измерить плотность электролита с учетом всех технических нюансов, которые необходимо знать.
Когда должна выполняться проверка плотности автомобильного аккумулятора
Кроме того, что плотность электролита автомобильного аккумулятора проверяется при каждом плановом обслуживании машины, существует ряд признаков, указывающих на снижение этого параметра.
Самый распространенный заключается в уменьшении периодичности заряд/разряд. Это значит, что АКБ стал хуже держать заряд, а так происходит в результате снижения уровня электролита или его свойств. Это повод проверить плотность автомобильного аккумулятора, не дожидаясь планового техосмотра.
Также следует выполнить эту работу, если в последнее время батарея систематически перезаряжалась. Это способствует выкипанию электролита и снижению его уровня.
 В зимнее время эту задачу приходится выполнять чаще, так как плотность АКБ при отрицательной температуре быстрее снижается.
В зимнее время эту задачу приходится выполнять чаще, так как плотность АКБ при отрицательной температуре быстрее снижается.
Как проверить плотность автомобильного аккумулятора
Если вы знаете, как проверить плотность АКБ и уже сделали это, значит вы понимаете, что нужно быть готовым к необходимости восстановления этого параметра, если он не будет соответствовать требованиям. Поэтому необходимо подготовить следующее:
ареометр;
мерный стакан;
грушу-клизму;
емкость, чтобы развести новый электролит;
кислоту или корректирующий электролит.
Посредством ареометра сначала нужно проверить плотность автомобильного аккумулятора. Это выполняется с помощью груши, изготовленной из мягкой резины, в которую вставлена трубка из стекла с ареометром внутри. Для выполнения замера необходимо набрать немного жидкости из банки, сжав грушу. Затем нужно следить, чтобы ареометр не касался стенок трубки. Вся полученная информация записывается, потому что данная задача выполняется в каждой банке, но перед этим необходимо полностью зарядить батарею. Дальнейшие действия зависят от того, повышена плотность или понижена. В последнем случае необходимо сделать следующее:
отобрать немного жидкости из банки, и в таком же объеме залить корректирующий электролит;
поставить АКБ на 30 минут заряжаться;
снять с зарядки и дать батарее остыть в течение 2 часов;
повторно замерить плотность.
Если вы знаете, как проверить плотность аккумулятора автомобиля, значит понимаете зачем это делать. С добавлением коррекционного электролита повышается плотность жидкости. Чтобы замеры ареометром были точны, необходимо смешать жидкости, что происходит во время зарядки батареи. Остывать ей нужно потому, что максимальная точность замера ареометром возможна только при холодной батарее.
Если проверка плотности электролита автомобильного аккумулятора покажет увеличение данного показателя, необходимо выполнить все также, как в вышеуказанной последовательности, но вместо коррекционного электролита добавить дистиллированную воду. За счет этого плотность снизится. Если после первого раза электролит не достигнет нужного состояния, необходимо повторить процедуру еще раз. И так до тех пор, пока не нормализуется электролит, плотность при этом должна соответствовать нужному значению.
За счет этого плотность снизится. Если после первого раза электролит не достигнет нужного состояния, необходимо повторить процедуру еще раз. И так до тех пор, пока не нормализуется электролит, плотность при этом должна соответствовать нужному значению.
Что значит, если плотность аккумулятора автомобиля не соответствует заводским значениям
Если замеры покажут, что плотность электролита АКБ не соответствует параметрам в банках, значит батарея уже выработала свой ресурс и пластины подвергались сульфатации. Придется заменить АКБ, потому что восстановлению он не подлежит.
Сульфатация – это необратимый процесс, который настигает каждую батарею, отработавшую свой ресурс, заявленный производителем. Если плотность электролита аккумулятора напротив, выше нормы, это тоже плохо для батареи. Скорее всего он закипел, и повышение его плотности необходимо скорректировать способом, описанным выше. Рекомендуется в будущем не допускать повторного закипания, потому что это может окончательно вывести устройство из эксплуатации.
Если проверка плотности электролита в аккумуляторе показывает, что она низкая в одной из банок, значит между электродами произошло замыкание. В такой ситуации тоже требуется замена батареи, так как содержимое банок не подлежит восстановлению.
Какой должна быть плотность аккумулятора авто
Тот кто знает, как проверить плотность электролита в АКБ, должен понимать, как зависит это значение от параметров аккумулятора. На него влияет и такие технические характеристики, как емкость батареи и сила выходного тока. Поэтому не следует ориентироваться общепринятыми стандартами, лучше изучить этикетку изделия, чтобы выяснить, какая необходима плотность. Также стоит оговориться, что проверка плотности электролита в АКБ должна определяться с учетом температуры окружающей среды. Для определения погрешности, зависящей от температуры, необходимо пользоваться специальной таблицей. Найти данную информацию можно в техническом паспорте автомобиля или руководстве производителя, прилагаемом к аккумуляторной батарее. Зная, как проверить плотность электролита в аккумуляторе, не стоит торопиться делать этого без оценки цвета жидкости.
Зная, как проверить плотность электролита в аккумуляторе, не стоит торопиться делать этого без оценки цвета жидкости.
То, какой она имеет оттенок, поможет предварительно определить состояние батареи. Коричневый цвет предупреждает о скором выходе из строя аккумулятора, а если это происходит еще и в канун зимы, первые морозы он может и не пережить. Если оттенок темный, значит активная масса осыпалась с электродов в раствор, что затрудняет протекание электрохимических реакций. В этом случае замена батареи неизбежна, так как восстановить плотность электролита в автомобильном аккумуляторе не получится. Учитывая то, что активная масса осыпается после длительного срока эксплуатации, это вполне оправдывает затраты на покупку нового устройства.
Как говорилось выше, проверка плотности АКБ выполняется во всех банках, и в каждой из них это значение должно быть одинаковым. Допускается погрешность, но не более 1 г/см3. Критический показатель плотности аккумулятора – менее 1:18 г/см3. Но и в такой ситуации возможна реанимация, если цвет не обрел коричневый или темный оттенок. Только в данной ситуации те, кто знает, какая плотность электролита должна быть в аккумуляторе, используют не коррекционный электролит, а серную кислоту 1:18 г/см3. Чтобы работать с данным веществом, необходим опыт, так как можно добавить его слишком много, сделав плотность больше, чем требуется. В результате неумелое обращение с веществом потребует много времени на решение данной задачи. Даже тем, кто может проверить плотность аккумулятора автомобиля, понимая как ее вернуть, нелегко добиться одинаковой плотности в каждой из банок, используя кислоту. Поэтому рекомендуется обращаться в автосервисы Oiler, чтобы выполнить обслуживание аккумуляторной батареи.
Чем поможет автосервис?
В условиях любого СТО нашей компании имеются все необходимые устройства и опытные специалисты, которые сумеют проверить плотность электролита и скорректировать ее в день обращения. Особенность наших услуг заключается в том, что мы решаем технические задачи в день обращения.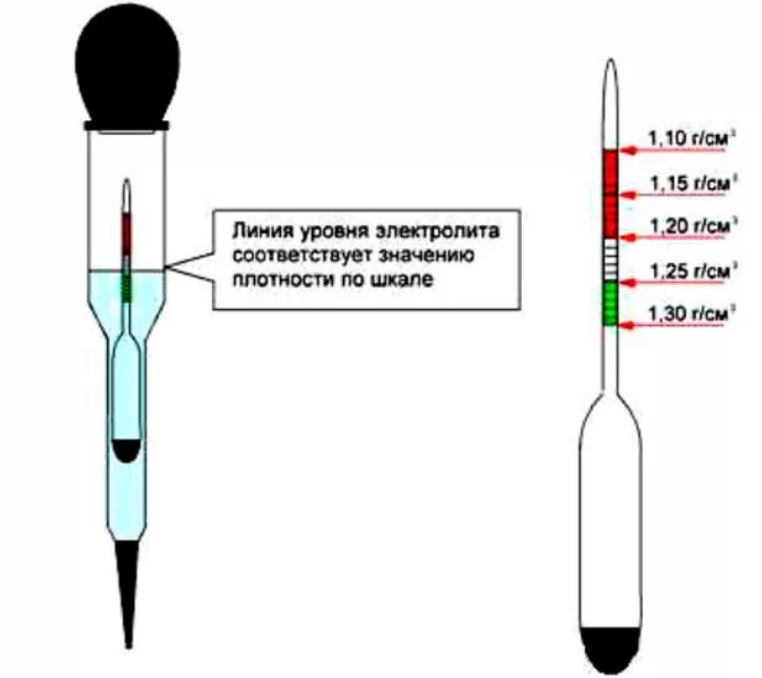 Кроме того, услуги предлагаются по фиксированной цене, что позволяет предварительно рассчитать бюджет на обслуживание и ремонт своего автомобиля.
Кроме того, услуги предлагаются по фиксированной цене, что позволяет предварительно рассчитать бюджет на обслуживание и ремонт своего автомобиля.
Мы рассмотрели, как проверить электролит в АКБ, и что делать, если его плотность отклонилась от нормы. Детально узнать о состоянии аккумуляторной батареи вы сможете, посетив автосервис Oiler в Киеве, предварительно записавшись на прием на нашем сайте.
Плотность электролита в аккумуляторе (АКБ)
Концентрация серной кислоты в электролите характеризуется плотностью электролита. Плотность любой жидкости определяется как отношение ее удельного веса к удельному весу воды. Иными словами, чем удельный вес вещества (жидкости) больше, тем выше ее плотность. Эталоном плотности выбрана дистиллированная вода, плотность которой принята равной 1,000 при температуре 80°Ф (27°С). Плотность чистой серной кислоты составляет 1,835. Нормальная концентрация водного раствора серной кислоты (раствора, состоящего на 64% из воды и на 36% из серной кислоты, называемого электролитом) характеризуется плотностью электролита в пределах от 1,260 до 1,280 при температуре 80°Ф (27°С). Чем выше плотность электролита в аккумуляторной батарее, тем выше степень ее заряженности.
Рис. В процессе разряда аккумуляторной батареи плотность электролита снижается
Индикаторы степени заряженности аккумулятора
Некоторые типы аккумуляторных батарей оснащены встроенным индикатором степени заряженности. Такой индикатор представляет собой просто небольшой ареометр шарикового типа, вмонтированный в одну из ячеек аккумуляторной батареи. В этом ареометре используется пластмассовый шарик, который всплывает в электролите нормальной плотности (когда аккумулятор заряжен примерно на 65%). Когда шарик всплывает, он появляется в окошке ареометра, изменяя его цвет.
Рис. Типичный индикатор степени заряженности аккумуляторной батареи. При низкой плотности электролита (разряженная аккумуляторная батарея) шарик-поплавок тонет, соскальзывая с отражательной призмы.
При достаточной степени заряженности аккумуляторной батареи шарик всплывает, и его цвет (обычно зеленый) приводит к изменению света, отражаемого призмой в сторону окошка индикатора, — оно темнеет
Рис. Аккумуляторная батарея с частично удаленным корпусом, в котором виден вмонтированный индикатор степени заряженности аккумулятора. Если уровень электролита опускается ниже дна призмы, окошко индикатора становится прозрачным (светлым). Производители аккумуляторных батарей предупреждают о том, что в случае снижения уровня электролита в герметизированной аккумуляторной батарее, такая аккумуляторная батарея подлежит немедленной замене. Попытка зарядить аккумуляторную батарею, имеющую недостаточный уровень электролита, может привести к скоплению в ней газов и закончиться взрывом аккумуляторной батареи
Поскольку ареометр контролирует плотность электролита только в одной из ячеек аккумуляторной батареи (а в 12-вольтовой аккумуляторной батарее их — шесть), и поскольку шарик ареометра может легко застрять в одном положении, полагаться на его показания, как на достоверную информацию о степени заряженности аккумуляторной батареи, не следует.
Связь между плотностью электролита, степенью заряженности и напряжением аккумуляторной батареи
Ниже в таблице приведены значения плотности электролита и соответствующие им значения степени заряженности и напряжения аккумуляторной батареи при температуре 80°Ф (27°С).
| Плотность электролита | Степень заряженности аккумуляторной батареи | Напряжение аккумуляторной батареи (В) |
| 1,265 | Полностью заряжена | Не ниже 12,6 |
| 1,225 | Заряжена на 75% | 12,04 |
| 1,19 | Заряжена на 50% | 12,2 |
| 1.155 | Заряжена на 25% | 12 |
Ниже 1. 120 120 | Разряжена | 11,9 и ниже |
Крепление аккумуляторной батареи в автомобиле
Аккумуляторная батарея, во избежание ее повреждения, должна быть обязательно надежно закреплена в автомобиле. Под действием нормальной вибрации автомобиля активная масса может осыпаться с пластин аккумуляторной батареи. Зажимы и кронштейны крепления аккумуляторной батареи обеспечивают ослабление ее вибрации, которая может стать причиной значительного снижения емкости и ресурса любой аккумуляторной батареи.
Что нельзя делать с аккумулятором летом, чтобы он не «умер» зимой
Когда ваш автомобильный аккумулятор подводит и машина не заводится, это крайне неприятно. Между тем нередко виноват сам водитель, не выполнявший ряд простых правил. Разберемся, какие именно ошибки могут сократить жизнь АКБ даже летом.
Как можно убить аккумулятор быстрее всего
Самый простой путь вывести из строя аккумулятор — это долить в электролит обычную воду — электроды в таком случае выйдут из строя.
Жизнь АКБ может радикально сократить также заряд током чрезмерно большой силы, перегрев электролита и его повышенная плотность, повышенное и пониженное напряжение в бортовой сети автомобиля, загрязнение электролита и короткое замыкание (возможно при неосторожном обращении с инструментом вблизи контактов батареи, или при повреждения изоляции силового кабеля). Однако существуют и менее явные огрехи, которые также вредны для АКБ. Читайте о них ниже.
Не поддерживать чистоту
При эксплуатации автомобиля в особенности в условиях повышенной загрязненности (пыль, песок, пыльца деревьев и т.п.) следует уделять особое внимание чистоте корпуса АКБ. Ведь если грязь просочится в электролит, печальная судьба батареи по сути предрешена.
Загрязнения на корпусе следует регулярно устранять мягкой тряпкой, смоченной в растворе нашатырного спирта или кальцинированной соды.
Используйте зубную щетку или мелкую шкурку, чтобы удалить любые следы коррозии, если вы обнаружите их на клеммах аккумулятора. Лишняя грязь и следы окисления на клеммах провоцируют замыкание и разрядку АКБ. Не забывайте также проверять надежность крепления как самого аккумулятора, так и его клемм.
Лишняя грязь и следы окисления на клеммах провоцируют замыкание и разрядку АКБ. Не забывайте также проверять надежность крепления как самого аккумулятора, так и его клемм.
Игнорировать температурный режим
Не секрет, что аккумуляторы постепенно подсаживаются от скачков температуры в межсезонье и долгого отсутствия нагрузки. При падении плотности электролит замерзает — это вызывая деформации и осыпание пластин, равно как прожоги от коротких замыканий. Поэтому не следует оставлять ваш автомобиль на недели и месяцы на улице в мороз.
Регулярно заводите ваш автомобиль зимой, а еще лучше — совершайте хотя бы короткие поездки, чтобы батарея могла подзарядиться. Гаражное хранение — идеальный вариант, но даже в этом случае следует замерять тестером уровень заряда АКБ на заглушенном двигателе хотя бы раз в месяц. При полном заряде показания стремятся к значению 12.7 вольт. При почти полной разрядке будет примерно 12 вольт. При нормальной плотности электролита, которая должно составлять 1,27 г/см куб., образование льда начнется только при температуре ниже -65 град.
Перегружать батарею
Прежде всего, не перегружайте сеть. Различные усилители, доп.оборудование и девайсы типа видеорегистратора, радар-детектора и просто несколько подключенных к «мультимедийке» гаджетов — это, конечно, замечательно. Но такая прорва потребителей неизбежно повысит нагрузку на сеть.
Нередки также случаи запредельных разрядов, например, после пуска двигателя стартером. Или, скажем, если вы регулярно даете «прикурить» друзьям и соседям (особенно если потенциал их АКБ больше, чем у вашего), это также не идет на пользу батарее. Кроме того, помогая такому аккумулятору, который уже «дышит на ладан», донор может еще и спалить бортовую электронику.
Неправильное обслуживание
Если ваш аккумулятор обслуживаемый, то в рамках самостоятельного «ТО» следует долить нужное количество смести дистиллированной воды и электролита (у автомобильных аккумуляторов принято считать нормальным уровень заливки на 10-15 мм выше верхней кромки пластин) и убедиться в том что раствор имеют оптимальную плотность (1.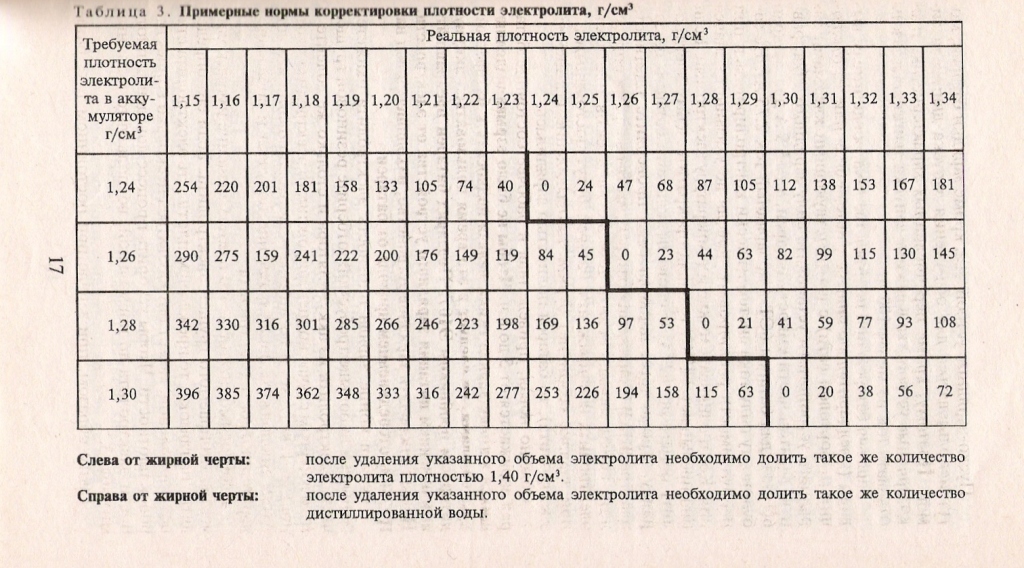 27 г/см3).
27 г/см3).
Если в АКБ пониженная плотность смеси, то это может привести к быстрому разряду и замерзанию раствора. Если плотность повышенная — тоже плохо: чревато «обезвоживанием», и, как следствие, разъеданием пластин. Плотность состава измеряется специальным прибором — ареометром (денсиметром).
Совет «подснежникам» — отнесите аккумулятор домой зимой
Есть категория водителей, которые по тем или иным причинам не ездят зимой. Для таких людей имеет прямой смысл позаботится об аккумуляторе. АКБ необходимо снять и отнести домой или в теплый гараж. Хранить батарею рекомендуется при комнатной температуре. При этом каждые два — три месяца аккумулятор рекомендуется подзаряжать, предварительно проверяя уровень зарядки с помощью вольтметра.
(PDF) Измерение плотности электролита в свинцово-кислотных аккумуляторах
Sensors 2010, 10
2607
10. Dakin, J .; Калшоу Б. Оптоволоконный датчик; Artech House: Норвуд, Массачусетс, США, 1989;
Том 2.
11. Zubía, J .; Арру, Дж. Пластиковые оптические волокна: введение в их технологические процессы и приложения
. Опт. Fiber Technol. 2001, 7, 101–140.
12. Хармер А.Л. В оптоволоконном рефрактометре с использованием ослабления мод оболочки.В материалах
1-й Международной конференции по оптоволоконным датчикам, Лондон, Великобритания, 26–28 апреля 1983 г.
13. Lomer, M .; Quintela, A .; López-Amo, M .; Zubía, J .; Лопес-Хигуэра, Дж. М. Квазираспределенный датчик уровня
, основанный на изогнутом полированном сбоку пластиковом оптоволоконном кабеле. Измер. Sci. Technol. 2007,
18, 2261–2267.
14. El-Sherif, M .; Бансал, Л .; Юань Дж. Оптоволоконные датчики для обнаружения токсичных и биологических угроз.
Датчики 2007, 7, 3100–3118.
15. Montero, D .; Vázquez, C .; Möllers, I .; Arrúe, J .; Jägger, D. Полимерный оптоволоконный датчик
на основе саморегулирующегося датчика интенсивности для обнаружения жидкостей. Датчики 2009, 9, 6446–6455.
Датчики 2009, 9, 6446–6455.
16. Armenta, C .; Doria, J .; de Andrés, M.C .; Urrutia, J .; Fullea, J .; Graña, F. Новый метод
, устанавливающий степень заряда свинцово-кислотных аккумуляторов с циркуляцией электролита. J. Power
Источники 1989, 27, 189–200.
17. Snyder, A .; Любовь, Дж.Теория оптических волноводов, 2-е изд .; Чепмен и Холл: Лондон, Великобритания, 1983.
18. Маркузе Д. Деформация поля и потери, вызванные кривизной оптических волокон. J. Opt. Soc. Являюсь.
1976, 66, 311–320.
19. Love, J .; Винклер, К. Затухание мощности в изогнутых многомодовых ступенчатых пластинах и волоконных волноводах.
Электрон. Lett. 1978, 14, 32–34.
20. Маркузе Д. Формула потери кривизны для оптических волокон. J. Opt. Soc. Являюсь. 1975, 66, 216–220.
21.Глоге Д. Потери на изгибе в многомодовых волокнах с градиентным и неклассифицированным индексом сердцевины. Прил. Опт.
1972, 11, 2506–2513.
22. Ghatak, A .; Sharma, E .; Компелла, Дж. Точные пути в изогнутых волноводах. Прил. Опт. 1988, 27,
3180–3184.
23. Snyder, A .; Лав, Дж. Отражение на изогнутой диэлектрической границе раздела — электромагнитное туннелирование. IEEE
Пер. Теория СВЧ. 1975, 23, 134–141.
24. Durana, G .; Zubía, J .; Arrue, J .; Алдабалдетреку, Г.; Матео, Дж. Зависимость потерь на изгибе от толщины оболочки
в пластиковых оптических волокнах. Прил. Опт. 2003, 42, 997–1002.
25. Club Des Fibers Optiques Plastiques. Пластиковые оптические волокна. Практическое применение; John Wiley
& Sons: Hoboken, NJ, USA, 1997.
26. Cao, A .; Marcos, J .; Doval, J .; Peñalver, C. Оптимизированный оптоволоконный датчик для измерения
плотности электролита в свинцово-кислотных аккумуляторах. In Proceedings of Eurosensors XIX, Barcelona,
Spain, 11–14 сентября 2005 г.
27. Cao, A .; Marcos, J .; Doval, J .; дель Рио, А. Компенсация температурной зависимости компонентов оптоэлектроники
с помощью оборудования и обработки данных.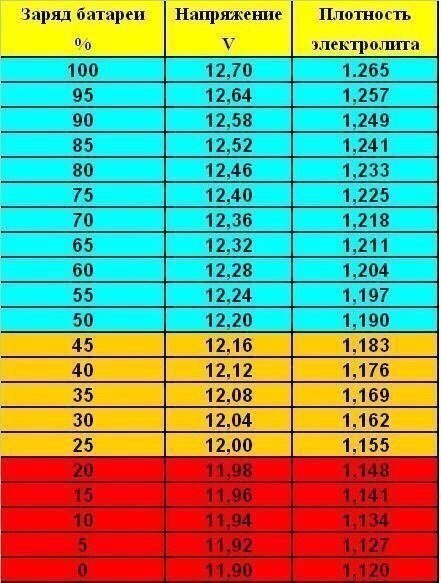 В материалах
В материалах
POF & MOC 2006, Совместная международная конференция по пластиковому оптическому волокну и микрооптике,
Сеул, Корея, 11–14 сентября 2006 г .; С. 126–131.
28. Marcos, J .; Álvarez, J .; Doval, J .; Cao, A .; Peñalver, C .; Nogueiras, A .; Лаго, А. Менеджмент
Электронная системадля быстрой зарядки свинцово-кислотных аккумуляторов.In Proceedings of Advanced Automotive
Batteries Conference, AABC-05, Honolulu, HI, USA, 13–17 июня 2005 г.
Замена обычных добавок к электролиту в аккумуляторные батареи производными диоксолона для литий-ионных аккумуляторов высокой плотности
Гуденаф, Дж. Б. и Ким, Ю. Проблемы перезаряжаемых литиевых батарей. Chem. Матер. 22 , 587–603 (2010).
CAS Статья Google Scholar
Тараскон, Дж. М. и Арман, М. Проблемы и проблемы, с которыми сталкиваются перезаряжаемые литиевые батареи. Природа 414 , 359–367 (2001).
ADS CAS PubMed Статья Google Scholar
Арико, А. С., Брюс, П., Скросати, Б., Тараскон, Дж. М. и ван Шалквейк, В. Наноструктурированные материалы для передовых устройств преобразования и хранения энергии. Nat. Матер. 4 , 366–377 (2005).
ADS PubMed Статья CAS Google Scholar
Лю К., Ли, Ф., Ма, Л. П. и Ченг, Х. М. Современные материалы для хранения энергии. Adv. Матер. 22 , E28 – E62 (2010).
CAS PubMed Статья Google Scholar
Чае, С., Чой, С. Х., Ким, Н., Сунг, Дж. И Чо, Дж. Интеграция графитовых и кремниевых анодов для коммерциализации высокоэнергетических литий-ионных аккумуляторов. Angew. Chem. Int. Эд. 58 , 2–28 (2019).
Артикул CAS Google Scholar

Liu, W. et al. Насыщенный никелем слоистый оксид переходного металла лития для высокоэнергетических литий-ионных аккумуляторов. Angew. Chem. Int. Эд. 54 , 4440–4457 (2015).
CAS Статья Google Scholar
Мантирам, А., Найт, Дж.К., Мён, С. Т., О, С. М. и Сан, Ю. К. Катоды из слоистого оксида с высоким содержанием никеля и лития: прогресс и перспективы. Adv. Energy Mater. 6 , 1501010 (2016).
Артикул CAS Google Scholar
Касаваджула, У., Ван, К. и Эпплби, А. Дж. Вставные аноды на основе нано- и объемного кремния для литий-ионных вторичных элементов. J. Источники энергии 163 , 1003–1039 (2007).
ADS CAS Статья Google Scholar
МакДауэлл, М. Т., Ли, С. В., Никс, В. Д. и Цуй, Ю. Статья в честь 25-летия: понимание литиирования кремния и других легирующих анодов для литий-ионных аккумуляторов. Adv. Матер. 25 , 4966–4985 (2013).
CAS PubMed Статья Google Scholar
Чен, З., Шеврие, В., Кристенсен, Л. и Дан, Дж. Р. Конструирование электродов из аморфного сплава для литий-ионных аккумуляторов. Электрохим. Solid State Lett. 7 , A310 – A314 (2004).
CAS Статья Google Scholar
Choi, N.-S. и другие. Влияние добавки фторэтиленкарбоната на межфазные свойства кремниевого тонкопленочного электрода. J. Источники энергии 161 , 1254–1259 (2006).
ADS CAS Статья Google Scholar
Shobukawa, H., Alvarado, J., Yang, Y. & Meng, Y. S. Электрохимические характеристики и межфазное исследование композитного кремниевого анода для литий-ионных аккумуляторов в полноэлементных элементах.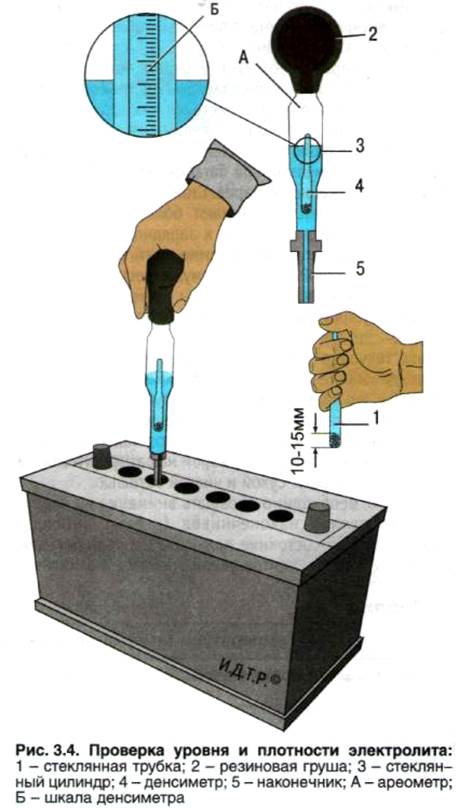 J. Источники энергии 359 , 173–181 (2017).
J. Источники энергии 359 , 173–181 (2017).
ADS CAS Статья Google Scholar
Zhao, H. et al. Пленкообразующие добавки к электролиту для литий-ионных аккумуляторов: прогресс и перспективы. J. Mater.Chem. А 7 , 8700–8722 (2019).
CAS Статья Google Scholar
Xu, G. et al. Назначение функциональных добавок для устранения плохих характеристик высоковольтных (класс 5 В) литий-ионных аккумуляторов LiNi0,5 Mn1,5 O4 / MCMB. Adv. Energy Mater. 8 , 1701398 (2018).
Артикул CAS Google Scholar
Хан, Дж.G. et al. Несимметричный фторированный малонатоборат как амфотерная добавка для литий-ионных аккумуляторов с высокой плотностью энергии. Energy Environ. Sci. 11 , 1552–1562 (2018).
CAS Статья Google Scholar
Haregewoin, A. M., Wotango, A. S. и Hwang, B. J. Электролитные добавки для электродов литий-ионных аккумуляторов: прогресс и перспективы. Energy Environ. Sci. 9 , 1955–1988 (2016).
CAS Статья Google Scholar
Choi, N.-S. и другие. Проблемы, с которыми сталкиваются литиевые батареи и электрические двухслойные конденсаторы. Angew. Chem. Int. Эд. 51 , 9994–10024 (2012).
CAS Статья Google Scholar
Jo, H. et al. Стабилизация межфазного слоя твердого электролита и циклические характеристики кремний-графитового анода батареи с помощью бинарной добавки фторированных карбонатов. J. Phys. Chem. С 120 , 22466–22475 (2016).
CAS Статья Google Scholar

Nguyen, C.C. и Lucht, B.L. Улучшенные характеристики циклирования анодов из наночастиц Si за счет введения метиленэтиленкарбоната. Электрохим. Commun. 66 , 71–74 (2016).
CAS Статья Google Scholar
Чен, Л., Ван, К., Се, X. и Се, Дж. Влияние виниленкарбоната (ВК) в качестве добавки к электролиту на электрохимические характеристики кремниевого пленочного анода для литий-ионных аккумуляторов. J. Источники энергии 174 , 538–543 (2007).
ADS CAS Статья Google Scholar
Далави, С., Гудуру, П. и Лучт, Б.Л. Добавки к электролиту, улучшающие характеристики литий-ионных батарей с кремниевыми анодами. J. Electrochem. Soc. 159 , A642 – A646 (2012).
CAS Статья Google Scholar
Etacheri, V. et al. Влияние фторэтиленкарбоната (FEC) на характеристики и химию поверхности анодов литий-ионных аккумуляторов с Si-нанопроволокой. Langmuir 28 , 965–976 (2012).
CAS PubMed Статья Google Scholar
Xu, C. et al. Улучшенные характеристики кремниевого анода для литий-ионных аккумуляторов: понимание механизма модификации поверхности фторэтиленкарбоната как эффективной добавки к электролиту. Chem. Матер. 27 , 2591–2599 (2015).
CAS Статья Google Scholar
Jaumann, T. et al. Срок службы и производительность: понимание роли FEC и VC в литий-ионных батареях высокой энергии с нанокремниевыми анодами. Energy Storage Mater. 6 , 26–35 (2017).
Артикул Google Scholar
Kim, K. et al. Понимание термической нестабильности фторэтиленкарбоната в электролитах на основе LiPF6 для литий-ионных аккумуляторов. Электрохим. Acta 225 , 358–368 (2017).
Электрохим. Acta 225 , 358–368 (2017).
CAS Статья Google Scholar
Шиле, А.и другие. Критическая роль фторэтиленкарбоната в газовыделении кремниевых анодов для литий-ионных аккумуляторов. ACS Energy Lett. 2 , 2228–2233 (2017).
CAS Статья Google Scholar
Schwenke, K.U., Solchenbach, S., Demeaux, J., Lucht, B.L. и Gasteiger, H.A. Воздействие CO 2 возникло из VC и FEC во время образования графитовых анодов в литий-ионных батареях. Дж.Электрохим. Soc. 166 , A2035 – A2047 (2019).
CAS Статья Google Scholar
Aurbach, D. et al. Об использовании виниленкарбоната (ВК) в качестве добавки к растворам электролитов для литий-ионных аккумуляторов. Электрохим. Acta 47 , 1423–1439 (2002).
CAS Статья Google Scholar
Buqa, H. et al.Формирование пленки SEI на высококристаллических графитовых материалах в литий-ионных батареях. J. Источники энергии 153 , 385–390 (2006).
ADS CAS Статья Google Scholar
Michan, A. L. et al. Восстановление фторэтиленкарбоната и виниленкарбоната: понимание добавок к электролиту литий-ионных аккумуляторов и межфазного образования твердого электролита. Chem. Матер. 28 , 8149–8159 (2016).
CAS Статья Google Scholar
Ushirogata, K., Sodeyama, K., Okuno, Y. & Tateyama, Y. Аддитивный эффект на восстановительное разложение и связывание карбонатного растворителя с образованием межфазной фазы твердого электролита в литий-ионной батарее. J. Am. Chem. Soc. 135 , 11967–11974 (2013).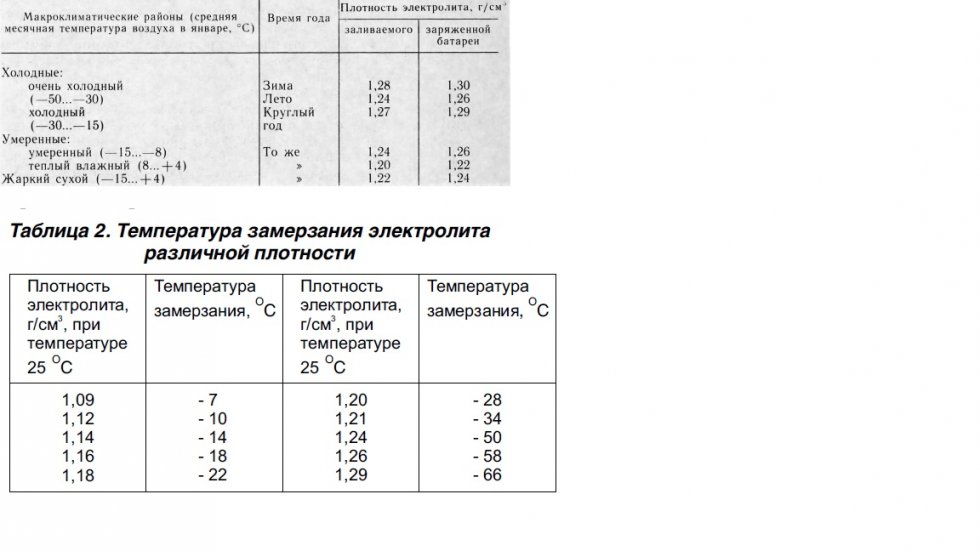
CAS PubMed Статья Google Scholar
Ота, Х., Саката, Ю., Иноуэ, А., Ямагучи, С. Анализ слоев SEI, полученных из виниленкарбоната, на графитовом аноде. J. Electrochem. Soc. 151 , A1659 – A1669 (2004).
CAS Статья Google Scholar
Wang, Y., Nakamura, S., Tasaki, K. & Balbuena, PB Теоретические исследования для понимания химического состава поверхности угольных анодов для литий-ионных батарей: как виниленкарбонат играет свою роль в качестве добавки к электролиту ? Дж.Являюсь. Chem. Soc. 124 , 4408–4421 (2002).
CAS PubMed Статья Google Scholar
Herstedt, M., Andersson, A. M., Rensmo, H., Siegbahn, H. & Edström, K. Характеристика SEI, образованного на природном графите в электролитах на основе ПК. Электрохим. Acta 49 , 4939–4947 (2004).
CAS Статья Google Scholar
Zhang, S. S., Xu, K. & Jow, T. R. Исследование EIS по образованию твердой поверхности раздела электролита в литий-ионной батарее. Электрохим. Acta 51 , 1636–1640 (2006).
CAS Статья Google Scholar
Son, H. B. et al. Влияние восстанавливающих циклических карбонатных добавок и линейных карбонатных сорастворителей на быструю заряжаемость ячеек LiNi0.6Co0.2Mn0.2O2 / графит. J. Источники энергии 400 , 147–156 (2018).
ADS CAS Статья Google Scholar
Deng, B. et al. Влияние потенциала отсечки заряда на добавку электролита для полных ячеек с мезоуглеродными микрогранулами LiNi0.6Co 0.2Mn0.2O2. Energy Technol. 7 , 1800981 (2019).
Артикул CAS Google Scholar

Zuo, X. et al. Влияние трис (триметилсилил) бората на сохранение высоковольтной емкости LiNi0.5Co0.2Mn0.3O2 / графитовые ячейки. J. Источники энергии 229 , 308–312 (2013).
CAS Статья Google Scholar
Deng, B. et al. Исследование влияния высоких температур на циклическую стабильность катода LiNi0.6Co0.2Mn0.2O2 с использованием инновационной добавки к электролиту. Электрохим. Acta 236 , 61–71 (2017).
ADS CAS Статья Google Scholar
Han, J.-G., Kim, K., Lee, Y. & Choi, N.-S. Поглощающие материалы для стабилизации LiPF6-содержащих электролитов на основе карбоната для литий-ионных аккумуляторов. Adv. Матер. 31 , 1804822 (2019).
Артикул CAS Google Scholar
Фенг, П., Ли, К. Н., Ли, Дж. У., Чжан, С. и Нгаи, М. Ю. Доступ к новому классу синтетических строительных блоков посредством трифторметоксилирования пиридинов и пиримидинов. Chem. Sci. 7 , 424–429 (2016).
CAS PubMed Статья Google Scholar
Alpegiani, M., Zarini, F. & Perrone, E. О получении 4-гидроксиметил-5-метил-1,3-диоксол-2-она. Synth. Commun. 22 , 1277–1282 (1992).
CAS Статья Google Scholar
Liu, J. B. et al. Серебро-опосредованное окислительное трифторметилирование фенолов: прямой синтез арилтрифторметиловых эфиров. Angew. Chem. Int. Эд. 54 , 11839–11842 (2015).
CAS Статья Google Scholar
Фарлоу М.В., Мэн Э. Х. и Таллок Д. В. Карбонилфторид. Неорганические синтезы (Rochow, E.G. ed.) Vol. 6, 155–158 (McGraw-Hill Book Company, Inc., 1960). https://doi. org/10.1002/9780470132371.ch58.
org/10.1002/9780470132371.ch58.
Аватанео, М., Де Патто, У., Галимберти, М. и Маркионни, Г.Синтез α, ω-диметоксифторполиэфиров: механизм реакции и кинетика. J. Fluor. Chem. 126 , 631–637 (2005).
Артикул Google Scholar
Petzold, D. et al. Опосредованное видимым светом высвобождение и превращение фторфосгена in situ. Chem. Евро. J. 25 , 361–366 (2019).
CAS PubMed Статья Google Scholar
Xu, W., Vegunta, S. S. & Flake, J. C. Аноды из кремниевых нанопроволок с модифицированной поверхностью для литий-ионных аккумуляторов. J. Источники энергии 196 , 8583–8589 (2011).
ADS CAS Статья Google Scholar
Zhang, J. et al. Прямое наблюдение неоднородной межфазной границы твердого электролита на аноде из MnO с помощью атомно-силовой микроскопии и спектроскопии. Nano Lett. 12 , 2153–2157 (2012).
ADS CAS PubMed Статья Google Scholar
Wan, G. et al. Подавление роста дендритного лития путем образования на месте химически стабильной и механически прочной межфазной границы твердого электролита. ACS Appl. Матер. Интерфейсы 10 , 593–601 (2018).
CAS PubMed Статья Google Scholar
Снеддон, И.Н. Связь между нагрузкой и проникновением в осесимметричной задаче Буссинеска для штампа произвольного профиля. Внутр. J. Eng. Sci. 3 , 47–57 (1965).
MathSciNet МАТЕМАТИКА Статья Google Scholar
Колле, Дж. П., Шуман, Х., Леджер, Р. Э., Ли, С. и Вайзель, Дж. У. Эластичность отдельного фибринового волокна в сгустке.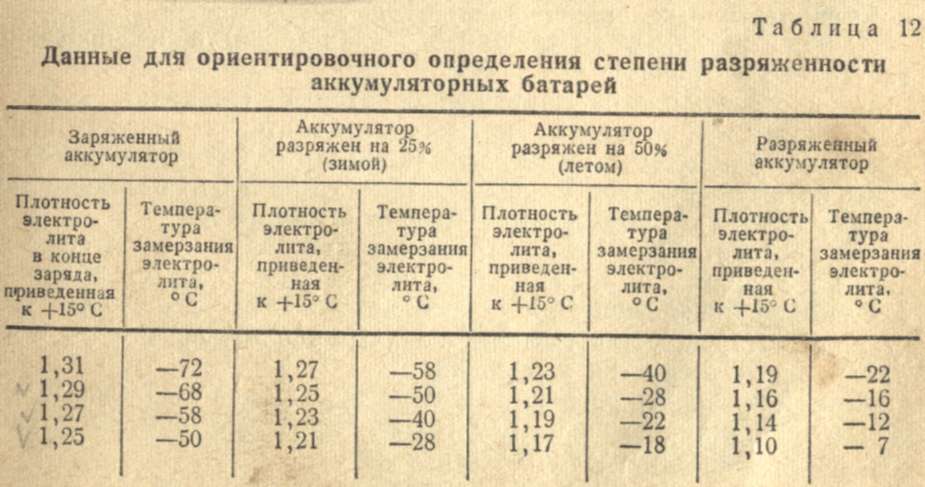 Proc. Natl Acad. Sci. США 102 , 9133–9137 (2005).
Proc. Natl Acad. Sci. США 102 , 9133–9137 (2005).
ADS CAS PubMed Статья Google Scholar
Чжан, К., Ву, Т., Лу, Дж. И Амин, К. Растворение, миграция и осаждение ионов переходных металлов в литий-ионных батареях на примере катодов на основе марганца — критический обзор . Energy Environ. Sci. 11 , 243–257 (2018).
CAS Статья Google Scholar
Гилберт, Дж.А., Шкроб И. А. и Абрахам Д. П. Растворение переходных металлов, миграция ионов, электрокаталитическое восстановление и потеря емкости в полных литий-ионных элементах. J. Electrochem. Soc. 164 , A389 – A399 (2017).
CAS Статья Google Scholar
Ravdel, B. et al. Термостойкость электролитов литий-ионных аккумуляторов. J. Источники энергии 119-121 , 805–810 (2003).
ADS CAS Статья Google Scholar
Ko, M. et al. Масштабируемый синтез графита, внедренного в кремний в нанослой, для высокоэнергетических литий-ионных аккумуляторов. Nat. Энергетика 1 , 16113 (2016).
ADS CAS Статья Google Scholar
Делли, Б. Полностью электронный численный метод решения функционала локальной плотности для многоатомных молекул. J. Chem. Phys. 92 , 508–517 (1990).
ADS CAS Статья Google Scholar
Делли Б. От молекул к твердым телам с помощью подхода DMol 3 . J. Chem. Phys. 113 , 7756–7764 (2000).
ADS CAS Статья Google Scholar
Klamt, A. & Schüürmann, G. COSMO: новый подход к диэлектрическому экранированию в растворителях с явными выражениями для экранирующей энергии и ее градиента. J. Chem. Soc. Perkin Trans. 2 , 799–805 (1993).
J. Chem. Soc. Perkin Trans. 2 , 799–805 (1993).
Артикул Google Scholar
Холл, Д. С., Селф, Дж. И Дан, Дж. Р. Диэлектрические постоянные для квантовой химии и литий-ионных аккумуляторов: смеси растворителей этиленкарбоната и этилметилкарбоната. J. Phys. Chem. С 119 , 22322–22330 (2015).
CAS Статья Google Scholar
Лойенга Х. Диэлектрические проницаемости гетерогенных смесей. Physica 31 , 401–406 (1965).
ADS CAS Статья Google Scholar
Влияние температуры электролита и плотности тока на микротвердость слоя, создаваемую анодным окислением алюминия
В статье исследуется влияние химического состава и температуры электролита, времени окисления, напряжения и плотности тока на Виккерса. микротвердость слоев оксида алюминия одновременно.Слои создавались в электролитах с разной концентрацией серной и щавелевой кислот и плотностями поверхностного тока 1 А · дм −2 , 3 А · дм −2 и 5 А · дм −2 . Температура электролита изменялась от -1,78 ° С до 45,78 ° С. Результаты показали, что при повышении температуры электролита при плотности тока 1 А · дм −2 увеличение значений микротвердости слоев составляет примерно 66%. При одновременном увеличении молярной концентрации H 2 SO 4 в электролите скорость роста значения микротвердости снижается.При плотности тока 3 А · дм −2 за счет повышения температуры электролита происходит снижение микротвердости сформированного слоя при времени анодного окисления менее 25 мин. Температура электролита не имеет значения при изменении значений микротвердости слоя при напряжениях менее 10,5 В.
1. Введение
Свойства поверхностных слоев, образованных анодным оксидом алюминия (AAO), такие как высокая поверхностная твердость слой, коррозионная стойкость [1, 2] и износостойкость предопределяют обработанные таким образом изделия из алюминия для широкого применения не только в традиционных областях машиностроения, транспорта и строительства, но и для потенциального использования в магнитных носителях записи [3 ], фотоэлектрические солнечные элементы [4], фильтры [5], химические сенсоры [6], фотоника [7] и металлические нанопроволоки [8, 9].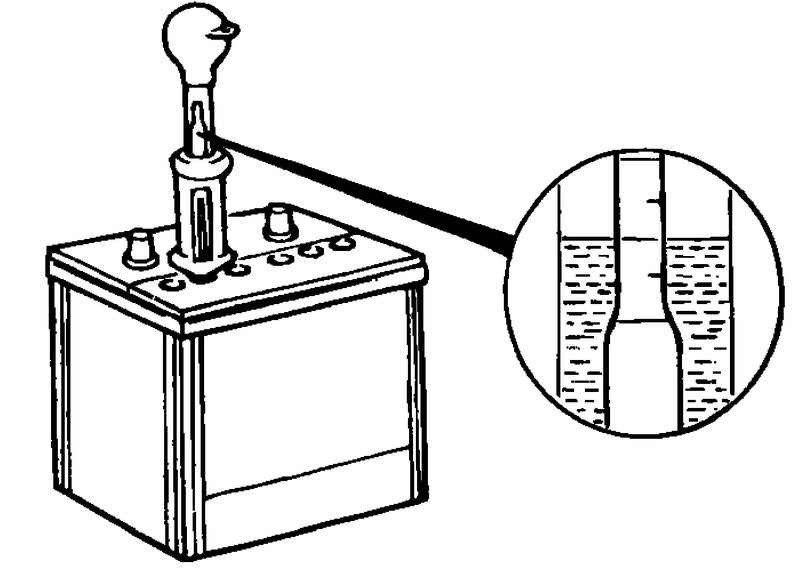
Большинство экспериментальных работ в области (микротвердости) проводится в «сложных» условиях анодирования. Сюда можно отнести низкие температуры электролита, а часто и особый химический состав электролитов. Их основная цель — достижение высоких значений микротвердости слоев. По словам Скотта [10], который для анодного окисления в серной кислоте при постоянной плотности тока 4 А · дм −2 , изменял температуру от -5 ° C до 15 ° C, микротвердость в этих условиях влияет в незначительной степени, что также связано с износостойкостью.Другое исследование, опубликованное Коидзуми и соавт. [11] посвящено анодному окислению алюминия в гальваностатическом режиме. Использовались плотности тока от 1 до 8 А · дм −2 ; электролит состоял из серной кислоты и щавелевой кислоты. Температура электролита составляла от –5 ° С до 20 ° С. Коидзуми и др. [11] утверждают, что микротвердость и износостойкость практически постоянны в интервале температур от –5 ° C до 5 ° C независимо от приложенной плотности тока. Кроме того, в этом исследовании утверждается, что повышение температуры электролита приводит к постепенному снижению значения микротвердости.Более значительное снижение микротвердости происходит при использовании меньших значений плотности тока. К этому утверждению, однако, следует относиться с осторожностью, поскольку время анодного окисления в этом эксперименте всегда было постоянным, то есть 45 минут, независимо от используемых плотностей тока. В результате были созданы и впоследствии оценены слои большей толщины. Толщина формируемого слоя напрямую влияет на результирующие значения микротвердости и износостойкости [12–14].
Слои АОА толщиной 25 мкм мкм и более, образованные в электролите, состоящем из серной кислоты, при температурах в интервале от 15 ° С до 30 ° С и при различных значениях приложенных плотностей тока (от 1 до 4 A · дм −2 ), по мнению некоторых авторов [15], имеют более мягкий внешний слой, что снижает прозрачность слоя, а также его микротвердость и износостойкость. На основании публикации [16] было замечено, что на размер пор влияют напряжение, температура электролита и время анодного окисления.Вертикальный рост пор (10–250 нм · мин –1 ) экспоненциально зависит от напряжения и линейно зависит от изменения температуры электролита. С другой стороны, диаметр пор (50-130 нм) линейно изменяется вместе с приложенным напряжением. Размер и количество пор сильно влияют на микротвердость слоя. В работе [17], посвященной реанодированию с целью экспериментального получения кинетики на основе рассчитанных зависимостей, делается вывод, что имеющиеся значения констант, зависящие от напряженности электрического поля и температуры, неприменимы к анодному окисление при высоких плотностях тока.В качестве возможного объяснения дается повышение температуры внутри сформированного слоя.
На основании публикации [16] было замечено, что на размер пор влияют напряжение, температура электролита и время анодного окисления.Вертикальный рост пор (10–250 нм · мин –1 ) экспоненциально зависит от напряжения и линейно зависит от изменения температуры электролита. С другой стороны, диаметр пор (50-130 нм) линейно изменяется вместе с приложенным напряжением. Размер и количество пор сильно влияют на микротвердость слоя. В работе [17], посвященной реанодированию с целью экспериментального получения кинетики на основе рассчитанных зависимостей, делается вывод, что имеющиеся значения констант, зависящие от напряженности электрического поля и температуры, неприменимы к анодному окисление при высоких плотностях тока.В качестве возможного объяснения дается повышение температуры внутри сформированного слоя.
Целью авторов является экспериментальный анализ зависимости микротвердости слоя от изменения температуры электролита и плотности тока. Процессы обработки поверхности представляют собой сложные многофакторные системы со значительным эффектом взаимодействия. Эти взаимодействия обычно оказываются более значительными, чем влияние отдельных факторов. Таким образом, микротвердость анализируется также с учетом влияния других рабочих факторов.Таким образом, можно делать более точные выводы и рекомендации.
2. Экспериментальная
Алюминиевый лист EN AW-1050 A-h34 толщиной 0,5 мм использовался в качестве экспериментального анодного материала. Химический состав экспериментального материала приведен в таблице 1.
| ||||||||||||||||||||||||||||
Образцы с размерами 100 × 0,5 мм были химически обезжирены в растворе бикарбонат натрия <20%, пентагидрат метасиликата натрия <5%, фосфаты <30%, бораты <40% и поверхностно-активные вещества <5% при температуре ° C в течение 15 минут. Затем образцы тщательно промывали в деионизованной воде и погружали в 45% раствор гидроксида натрия при температуре ° C на 1 мин.Анодирование было выполнено на основе методологии Плана экспериментов, соответствующей вращающейся центральной композитной конструкции с 44 испытательными запусками. Отдельные прогоны проводились в соответствии с планом эксперимента как комбинация уровней факторов, соответствующих таблице 2.
Затем образцы тщательно промывали в деионизованной воде и погружали в 45% раствор гидроксида натрия при температуре ° C на 1 мин.Анодирование было выполнено на основе методологии Плана экспериментов, соответствующей вращающейся центральной композитной конструкции с 44 испытательными запусками. Отдельные прогоны проводились в соответствии с планом эксперимента как комбинация уровней факторов, соответствующих таблице 2.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
После анодирования образцы были немедленно промыты в охлажденной (приблизительно 10 ° C) деминотермической промывке в течение 1 минуты. проточной водопроводной водой еще 2 минуты, чтобы вымыть электролит, застрявший в дефектах. После этого образцы сушили сжатым воздухом и сушили в печи (при температуре 50 ° C в течение 20 минут).
В области обработки поверхности ячейка Халла в основном используется для проверки функциональности электролита и химического состава электролита. Ячейка Халла в форме прямоугольной трапеции с размерами, соответствующими рисунку 1, использовалась для обоих проведенных экспериментов. На рисунке 1 также показано подключение экспериментальной установки, которая включает в себя регулируемый источник постоянного тока (постоянный контроль напряжения от 0 до 20 В), амперметр для контроля измерения постоянного тока, протекающего через электрическую цепь (регулировка тока от 0 до 5). А) и вольтметр для измерения полного напряжения.
3. Результаты и обсуждение
Первоначальный эксперимент проводился для определения основных физических эффектов, таких как напряжение, температура электролита и общий ток. Графическое представление временной зависимости приведено на рисунке 2.
График (рисунок 2 (a)) показывает, что изменение полного тока во времени сильно зависит от температуры электролита. Кинетику роста анодного слоя можно увидеть на рисунке 2 (б), который представляет временную зависимость протекающего тока.Первые 30 секунд — важный временной интервал, когда образуется непористый барьерный слой. Первый этап характеризуется резким увеличением значения полного тока за очень короткое время и его последующим снижением. Здесь происходит рост анодного потенциала. На этом этапе образуются зародыши оксидных клеток и поверхностный барьерный оксидный слой. Первые ячейки образуются в местах узлов границ между кристаллами поверхности алюминия [18]. Вдоль этих границ образуются другие оксидные ячейки.Образование оксидных ячеек в этих местах связано с более высоким химическим потенциалом этих областей и высокой концентрацией кристаллографических дефектов. В конце этого этапа происходит повторный рост общего тока и уменьшение анодного потенциала. В этой фазе количество оксидных ячеек уменьшается. При этом происходит увеличение их размеров по механизму «конкуренции» (увеличение размеров ячеек за счет других, бесперспективно). В то же время происходит утолщение распределения клеток и, следовательно, уменьшение неклеточных площадей барьерного оксидного слоя.На этом этапе больше нет резкого падения потенциала анода. Размеры оксидных ячеек увеличиваются, но скорость этого процесса существенно снижается. На третьем этапе, который характеризуется постоянным значением тока, а также значением потенциала анода, анодно окисленный слой увеличивается с учетом его толщины, и слой имеет пористую структуру (рис. 3).
Первые ячейки образуются в местах узлов границ между кристаллами поверхности алюминия [18]. Вдоль этих границ образуются другие оксидные ячейки.Образование оксидных ячеек в этих местах связано с более высоким химическим потенциалом этих областей и высокой концентрацией кристаллографических дефектов. В конце этого этапа происходит повторный рост общего тока и уменьшение анодного потенциала. В этой фазе количество оксидных ячеек уменьшается. При этом происходит увеличение их размеров по механизму «конкуренции» (увеличение размеров ячеек за счет других, бесперспективно). В то же время происходит утолщение распределения клеток и, следовательно, уменьшение неклеточных площадей барьерного оксидного слоя.На этом этапе больше нет резкого падения потенциала анода. Размеры оксидных ячеек увеличиваются, но скорость этого процесса существенно снижается. На третьем этапе, который характеризуется постоянным значением тока, а также значением потенциала анода, анодно окисленный слой увеличивается с учетом его толщины, и слой имеет пористую структуру (рис. 3).
Анализ значений микротвердости слоев, создаваемых анодным окислением алюминия, в зависимости от температуры представлен на рисунках 4–12.В рамках экспериментального анализа оценивается влияние других эксплуатационных факторов на изменение значения микротвердости. На рис. 4 при плотности тока 1 А · дм −2 можно наблюдать сильно нелинейную зависимость микротвердости слоя от температуры электролита.
В диапазоне температур электролита от -1,5 до 8.5 ° С происходит снижение микротвердости слоя. Это снижение можно объяснить низким напряжением, а также низким значением молярной концентрации H 2 SO 4 . Повышение температуры электролита более 8,5 ° С приводит к резкому увеличению значения микротвердости слоя. В интервале температуры электролита от 11,5 ° С до 45,5 ° С произойдет увеличение микротвердости слоя на 78%. При плотностях тока 3 А · дм −2 и 5 А · дм −2 температура электролита не оказывает существенного влияния на значение микротвердости слоя.При 3 А · дм −2 повышение температуры электролита вызывает снижение микротвердости слоя даже на 7%. При плотности тока 5 А · дм −2 наблюдается небольшое увеличение микротвердости слоя около 4%.
Зависимость микротвердости от температуры электролита при увеличении молярной концентрации серной кислоты до 1,43 моль · л −1 представлена на рисунке 5. Здесь также можно наблюдать область минимальных значений микротвердости слоя при текущем токе. плотность 1 А · дм −2 .Абсолютное значение микротвердости слоя в области минимума (1,5-8,5 ° С) в среднем составляет около 30%. Увеличение молярной концентрации H 2 SO 4 от 0,09 моль • л -1 до 1,43 моль • л -1 в областях низких температур приводит к увеличению микротвердости слоя почти на 54% при плотность тока 1 А · дм −2 . При плотности тока 3 А · дм −2 наблюдается уменьшение микротвердости слоя с повышением температуры электролита.Это снижение значения микротвердости составляет 23%. Снижение микротвердости по сравнению с электролитом с c (H 2 SO 4 ) = 0,09 моль · л −1 составляет почти 16%. Развитие микротвердости слоя при плотности тока 5 А · дм −2 можно считать постоянным. Температура электролита не оказывает существенного влияния на микротвердость слоя при плотности тока 5 А · дм −2 .
Дальнейшее увеличение молярной концентрации серной кислоты до 2.76 моль · л −1 (рис. 6) при плотности тока 1 А · дм −2 приводит к расширению областей минимальных значений и увеличению среднего значения микротвердости. Область минимума увеличена с 1,5 до 11,5 ° C. Среднее значение микротвердости по сравнению с электролитом с c (H 2 SO 4 ) = 1,43 моль · л −1 увеличивается на 36%. При плотности тока 3 А · дм −2 наблюдается значительное снижение микротвердости слоя в зависимости от температуры электролита.Это снижение составляет 35%. Увеличение абсолютного среднего значения микротвердости слоя по сравнению с электролитом с c (H 2 SO 4 ) = 1,43 моль · л −1 , при плотности тока 3 А · дм — 2 , составляет в среднем 12%. При температуре электролита -1,5 ° С разница значений микротвердости составляет 20%. С повышением температуры электролита разница уменьшается до значения 12% при температуре 45,5 ° C. При плотности тока 5 А · дм −2 наблюдается лишь незначительное увеличение микротвердости слоя в зависимости от температуры электролита.Величина повышения составляет 2,5%.
На основании анализа температура электролита является значимым фактором при плотности тока 1 А · дм −2 . Это также наиболее важный фактор, влияющий на микротвердость слоя. Доля температуры в общей изменчивости значений микротвердости составляет 14%. Сильная зависимость микротвердости слоя от температуры электролита также отражается на взаимодействии с молярной концентрацией серной кислоты в электролите.При одновременном повышении температуры электролита и молярной концентрации серной кислоты среднее значение микротвердости увеличивается. Это связано с природой анодного окисления. При разработке пористых оксидных слоев в одной и той же системе существуют две параллельные реакции: одна для электрохимического анодного образования оксида металла (), а другая для химического растворения того же оксида в том же электролите [19]. : Уравнение (1) представляет электрохимическую анодную реакцию.Изменение его свободной энергии регулируется уравнением Нернста и является функцией потенциала электрода, который определяет способность металла преобразовываться в электролите в ионную форму: где — число перенесенных электронов, — постоянная Фаррадея, и — потенциал электрода, на который влияет приложенное напряжение. Уравнение (2) выражает химическую реакцию с изменением свободной энергии на постоянное значение независимо от приложенного напряжения. Из-за повышения температуры электролита происходит преобладание химического растворения.Увеличение плотности тока обычно приводит к увеличению толщины слоя и, как следствие, к увеличению тепла на границе оксид-электролит [14].
Эти эффекты могут создавать большие градиенты температуры электролита и состава вдоль более глубоких стенок пор с возможным благоприятным влиянием на растворение оксидов и адсорбцию сульфат-анионов на стенках пор [20]. Кроме того, более высокая движущая сила ускоряет реакции на границе раздела подложка-оксид и, как следствие, появление дефектов.Ожидается, что эти локальные эффекты уменьшат микротвердость анодных оксидных слоев [14].
Для плотностей тока 3 А · дм −2 и 5 А · дм −2 температура электролита имеет значение только во взаимодействии с молярной концентрацией серной кислоты, напряжением и временем анодирования. Можно предположить, что уменьшение микротвердости слоя вызвано, помимо повышения температуры, еще и продолжительным периодом анодирования. При длительных периодах анодного окисления создаются условия для растворения образовавшегося слоя.Это растворение травит слой и значительно ухудшает механические и эксплуатационные свойства созданного слоя.
Зависимость микротвердости слоя от изменения температуры электролита при времени анодирования 1,22 мин представлена на рисунке 7. При плотности тока 1 А · дм −2 две области изменения микротвердости развития наблюдаются. В интервале от -1,5 ° С до 11,5 ° С происходит снижение микротвердости. Этот эффект можно объяснить сочетанием низкой температуры электролита, низкого напряжения и короткого времени анодирования.Из-за повышения температуры электролита выше 11,5 ° С происходит резкое увеличение микротвердости слоя. Повышение температуры на 1 ° C соответствует увеличению микротвердости на 2,2%. При плотности тока 3 А · дм −2 наблюдается рост значений микротвердости слоя с ростом температуры электролита. Среднее увеличение значения микротвердости в диапазоне температур электролита от -1,5 ° С до 45,5 ° С составляет 62%. Увеличение плотности тока до 5 А · дм −2 не оказывает существенного влияния на изменение значения микротвердости слоя в зависимости от температуры электролита.
Влияние температуры электролита на микротвердость слоя при времени анодирования 25 мин показано на рисунке 8. При плотности тока 1 А · дм −2 наблюдается увеличение значения микротвердости во всем диапазоне. диапазон температуры электролита. Изменение температуры с -1,5 ° C до 45,5 ° C повысит микротвердость почти на 65%. При плотности тока 3 А · дм −2 наблюдается значительное снижение значения микротвердости с увеличением температуры электролита.Можно предположить, что увеличение времени анодирования до 25 мин за счет повышения температуры электролита создает условия для растворения образовавшегося слоя. Снижение микротвердости слоя на 1,5% по результатам эксперимента соответствует повышению температуры электролита на 1 ° С. Дальнейшее увеличение плотности тока до 5 А · дм −2 не приводит к изменению значения микротвердости слоя из-за изменения температуры электролита.Микротвердость во всем диапазоне температур электролита (от -1,5 ° С до 45,5 ° С) изменится всего на 2,8%.
При времени анодирования 48,78 мин зависимость микротвердости слоя от изменения температуры электролита можно увидеть на рис. 9.
При плотности тока 1 А · дм −2 зависимость микротвердость слоя от температуры электролита можно разделить на две области: область увеличения микротвердости слоя и область уменьшения значения микротвердости.Эти области можно разделить по значению критической температуры. Экспериментально выявленная зависимость изменения микротвердости от температуры электролита при плотности тока 1 А · дм −2 , для конкретных условий анодного окисления ( c (H 2 SO 4 ) = 1,43 моль · л −1 , c (C 2 H 2 O 4 ) = 0,06 моль · л −1 , U = 10 В, t = 48,78 мин) , можно выразить в виде: Локальные экстремумы функции вычисляются, если первая производная (4) равна нулю: Решая (5), мы получим стационарные точки, а именно, и.Поскольку диапазон температур (Таблица 2) составляет от -1,78 ° C до 48,78 ° C, это значение будет считаться допустимым решением. Подставляя значение из интервала в (5), первая производная больше нуля; то есть функция (4) на интервале возрастает. Подставляя значение из интервала в (5), первая производная меньше нуля; то есть функция (4) на интервале убывает. Таким образом, значение является локальным максимумом функции (4), и при этой температуре микротвердость слоя достигает максимального значения; это, .В области ниже критической температуры скорость роста микротвердости слоя в зависимости от температуры составляет в среднем 55%. В области выше критической температуры скорость снижения микротвердости слоя составляет 12,8%. При плотности тока 3 А · дм −2 из-за повышения температуры электролита происходит снижение микротвердости слоя. Средняя скорость уменьшения значения микротвердости слоя в диапазоне экспериментальных температур электролита составляет 691%.При плотности тока 5 А · дм −2 наблюдается лишь минимальное влияние температуры электролита на значение микротвердости слоя. Скорость роста микротвердости слоя 1,8%.
Еще одним важным фактором, влияющим на формирование анодного слоя, является напряжение. Напряжение существенно влияет на механические свойства слоя, а также на микротвердость слоев. На рисунках 10–12 представлена зависимость микротвердости слоя от температуры электролита при изменении напряжения для плотностей тока 1 А · дм −2 , 3 А · дм −2 и 5 А · дм . −2 .Зависимость микротвердости слоя от температуры электролита при напряжении 8,5 В представлена на рисунке 10.
При плотности тока 1 А · дм −2 наблюдается незначительное уменьшение значения микротвердости слоя в диапазоне — Наблюдается от 1,78 ° C до 11,5 ° C. Это снижение микротвердости слоя составляет около 2,3%. В этих условиях анодирования проводимость электролита слишком низкая. Приложенное напряжение относится к ситуации, когда всегда ниже, чем. В этом случае оксид образуется на основе (1), но он нестабилен и сразу растворяется из-за реакции (2).Этот случай называется электрохимическим травлением. Повышение температуры электролита выше температуры 11,5 ° C приводит к увеличению значения микротвердости слоя. Этот рост составляет в среднем 42,8%. Повышение температуры электролита приводит к значительному изменению проводимости электролита и даже при низком напряжении образуется стабильный слой. При плотности тока 3 А · дм −2 из-за повышения температуры электролита происходит снижение микротвердости слоя.Дальнейшее увеличение плотности тока до 5 А · дм −2 приводит к увеличению микротвердости слоя за счет повышения температуры. Этот рост во всем интервале экспериментально применяемых температур составляет около 17%. Напряжение 8,5 В на практике не используется. В статье он использовался только для сравнения возникающих изменений микротвердости слоев.
Увеличение напряжения до 10,5 В при анализе изменения микротвердости слоя из-за влияния температуры электролита показано на рисунке 11.При плотности тока 1 А · дм −2 во всем диапазоне применяемых температур электролита наблюдается увеличение значения микротвердости. Этот рост составляет около 73%. По сравнению с ходом зависимости микротвердости слоя от влияния температуры электролита при напряжении 8,5 В и температуре -1,78 ° С уменьшение значения микротвердости составляет 35%. При повышении температуры электролита до 48,78 ° С, при напряжении 10 ° С.5 В происходит увеличение значения микротвердости на 34% по сравнению с микротвердостью слоя при напряжении 8,5 В. При плотности тока 3 А · дм −2 наблюдается небольшое уменьшение значения микротвердость слоя за счет повышения температуры электролита на 8,4%. За счет увеличения напряжения на 2 В значение микротвердости слоя при температуре электролита -1,78 ° C увеличится на 10%, а при температуре электролита 48,78 ° C — почти на 94%.Увеличение плотности тока до 5 А · дм −2 приводит к увеличению значения микротвердости слоя в зависимости от температуры примерно на 15%.
Зависимость микротвердости слоя от температуры электролита при напряжении 13,5 В можно увидеть на рис. 12. При всех плотностях тока можно наблюдать увеличение микротвердости слоя вместе с повышением температуры электролита. Таким образом, величина напряжения достаточна для образования стабильного оксида независимо от плотности тока.На основании (1) и (2) курсы и пересекаются в некоторой точке. В этом случае, в зависимости от напряжения, прогрессию и можно разделить на три области с двумя критическими значениями. — приложенное напряжение, когда и — напряжение, при котором. При выполнении условия при анодном окислении в электролите присутствует стабильный оксидный слой, который анодным напряжением защищается от растворения в соответствии с химической реакцией (2). При плотности тока 1 А · дм −2 скорость роста значения микротвердости слоя по изменению температуры электролита во всем интервале составляет в среднем 83%.При увеличении плотности тока до 3 А · дм −2 скорость роста значения микротвердости слоя в зависимости от температуры падает примерно до 56%. В интервале температур более 36 ° С значение микротвердости слоя при 1 А · дм −2 выше, чем при плотности тока 3 А · дм −2 на 8%. При плотности тока 5 А · дм −2 микротвердость слоя достигает максимальных значений при повышении температуры электролита.Рост значений микротвердости 47%. Мы видим, что температура электролита оказывает существенное влияние на значения микротвердости при напряжении до 13,5 В.
4. Выводы
В работе показано влияние температуры электролита на изменение значений микротвердости слоя, образованного оценено анодное окисление алюминия. Электролит состоял из H 2 SO 4 и C 2 H 2 O 4 .Показано, что повышение температуры электролита приводит к росту значения микротвердости слоя при плотности тока 1 А · дм −2 . Однако при времени анодирования 48,78 мин можно определить критическую температуру, при которой изменение температуры электролита влияет на значения микротвердости слоя. Средний рост значений микротвердости слоя в зависимости от температуры при плотности тока 1 А · дм −2 составляет 66%.Однако с увеличением количества серной кислоты в электролите рост микротвердости слоя уменьшается примерно на 24%. Наряду с одновременным влиянием времени анодирования в интервале от 1,22 мин до 25 мин наблюдается рост значения микротвердости слоя в зависимости от температуры электролита на 5%. При увеличении времени анодного окисления до более чем 25 минут происходит снижение значения микротвердости слоя примерно на 4%. Повышение напряжения приводит к росту микротвердости слоя в зависимости от температуры электролита почти на 39%.При плотности тока 3 А · дм −2 микротвердость слоя уменьшается из-за температуры вместе с увеличением молярной концентрации серной кислоты. Рост значения микротвердости слоя наблюдался при времени анодирования 25 мин. Выше и ниже этого времени происходит снижение значения микротвердости слоя из-за температуры электролита. При плотности тока 5 А · дм −2 влияние температуры электролита на изменение значения микротвердости слоя незначительно.Рост значения микротвердости слоя происходит только при напряжении выше 10,5 В.
Процесс анодного окисления алюминия — сложный процесс. На изменение значения микротвердости слоя одновременно действует множество факторов. Поэтому необходимо учитывать влияние этих рабочих факторов при изучении изменений параметров пластов. Как показано, при различных условиях анодирования микротвердость слоя в зависимости от температуры и плотности тока изменялась по-разному.Исследуя эти зависимости, можно сгенерировать слои с необходимыми параметрами качества.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
Благодарности
Исследование было поддержано Проектом структурных фондов ЕС «Исследование и разработка интеллектуальных нетрадиционных приводов на основе искусственных мышц», код ITMS: 26220220103, а также грантом VEGA. 1/0738/14 «Исследование коррозионной стойкости стальных листов с покрытием для использования в автомобильной промышленности» Агентства научных грантов Министерства образования Словацкой Республики и Словацкой академии наук.
Расчет плотностей водных растворов электролитов при отрицательных температурах
Р. Дж. Спенсер, Н. Мёллер и Дж. Х. Уэр, Geochim. Космохим. Acta 54 , 575 (1990).
Артикул CAS Google Scholar
Г. М. Марион и С. А. Грант, FREZCHEM: Химико-термодинамическая модель водных растворов при отрицательных температурах (CRREL Spec.Представитель 94-18, Лаборатория исследований и разработки холодных регионов, Ганновер, Н. Х., 1994).
М. В. Мироненко, С. А. Грант, Г. М. Марион, FREZCHEM2: Химико-термодинамическая модель водных растворов при отрицательных температурах (отчет CRREL, в печати).
Y. C. Wu, J. Phys. Chem. 21 , 287 (1970).
Артикул Google Scholar
F. J. Millero, Geochim. Космохим. Acta 41 , 215 (1977).
Артикул CAS Google Scholar
Р. Х. Вуд, П. Дж. Рейли, Ann Rev. Phys. Chem. 21 , 287 (1970).
Артикул Google Scholar
Ф. Дж. Миллеро и А. Пуассон, Pure App.Chem. 57 , 1015 (1985).
Артикул CAS Google Scholar
Б.С. Крумгалз, Р. Погорельский, Я. A. Iosilevskii, A. Weiser, K. S. Pitzer, J. Solution Chem. 23 , 849 (1994).
Артикул CAS Google Scholar
A. Kumar, J. Chem. Англ.Данные 31 , 19 (1986).
Артикул CAS Google Scholar
A. Kumar, J. Chem. Англ. Данные 31 , 21 (1986).
Артикул CAS Google Scholar
К. Моннин, Геохим. Космохим. Acta 53 , 1177 (1989).
Артикул CAS Google Scholar
P. S. Z. Rogers, K. S. Pitzer, J. Phys. Chem. Ref. Данные 11 , 15 (1982).
CAS Google Scholar
K. S. Pitzer, Thermodynamics , 3rd. изд. (Макгроу-Хилл, Нью-Йорк, 1995).
Google Scholar
С. Т. А. Чен, Р. Т. Эммет и Ф. Дж. Миллеро, J. Chem. Англ. Данные 22 , 201 (1977).
Артикул CAS Google Scholar
D. E. Hare, C. M. Sorensen, J. Chem. Phys. 84 , 5085 (1986).
Артикул CAS Google Scholar
D. E.Hare and C.M.Sorensen, J. Chem. Phys. 87 , 4840 (1987).
Артикул CAS Google Scholar
D. G. Archer, P. Wang, J. Phys. Chem. Ref. Данные 19 , 371 (1990).
CAS Статья Google Scholar
G. S. Kell, J. Chem. Англ.Данные 12 , 66 (1967).
Артикул CAS Google Scholar
Национальный исследовательский совет, Международные критические таблицы численных данных, физика, химия и технология , Vol. 1 , (Макгроу-Хилл, Нью-Йорк, 1928).
Google Scholar
C. Monnin, J. Sol. Chem. 12 , 1035 (1987).
Артикул Google Scholar
J. C. Tanger IV и H. C. Helgeson, Amer. J. Sci. 288 , 19 (1988).
CAS Статья Google Scholar
Дж. У. Джонсон, Э. Х. Элкерс и Х. К. Хельгесон, Comp. Geosci. 18 , 899 (1992).
Артикул Google Scholar
J. Kestin, J. V. Sengers, B. Kamgar-Parsi и J. M. H. Levelt-Sengers, J. Phys. Chem. Ref. Данные 13 , 175 (1984).
CAS Статья Google Scholar
Хлорид кальция , Бюллетень Allied Chemical, Technical and Engineering Service, № 16 (Allied Chemical Corporation, 1958).
Основы Справочник ASHRAE. I-P Edition.(Американское общество инженеров по отоплению, охлаждению и кондиционированию воздуха, Inc., Атланта, 1993 г.).
Р. Коэн-Актад и Дж. Лоример, ред., Хлориды щелочных металлов и аммония в воде и тяжелой воде (бинарные системы), серия данных по растворимости , Vol. 47 (Пергамон, Оксфорд, 1991).
Google Scholar
Пельше А.Д., Справочник по растворимости солевых систем. 4 , (Госхимиздат, Москва-Ленинград, 1963). (На русском языке)
Google Scholar
Пельше А.Д., Справочник по растворимости солевых систем, , (Госхимиздат, Москва-Ленинград, 1967). (На русском языке)
Google Scholar
Бакштейн В. М., Валиашко М. Г., Пельше А. Д., Справочник экспериментальных данных по растворимости многокомпонентных водно-солевых систем. (Справочник экспериментальных данных по растворимости многокомпонентных водно-солевых систем. Том 1. Тройные системы), (Госхимиздат, Москва-Ленинград, 1953). (На русском языке)
Google Scholar
B. S. Krumgalz, R. Pogorelskii, K. S. Pitzer, J. Phys. Chem. Ref. Данные. 25 , 663 (1996).
Google Scholar
Пленки из твердого электролита с высокими эксплуатационными характеристиками для печати
ВВЕДЕНИЕ
Потребность в более безопасных перезаряжаемых батареях, в которых не используется горючий жидкий органический электролит, побудила к разработке твердотельных электролитов (SSE) ( 1 — 3 ), такие как оксинитрид фосфора лития (LiPON) ( 4 , 5 ) и керамические соединения на основе граната ( 5 — 7 ).Пленки SSE (<10 мкм) с высокой ионной проводимостью> 10 -4 См / см обычно необходимы для достижения высоких плотностей энергии и мощности. Однако современные методы производства таких SSE-пленок имеют серьезные проблемы. Например, процесс радиочастотного (РЧ) напыления в вакууме, используемый для нанесения LiPON в батареи, является непомерно дорогостоящим ( 8 — 10 ), что ограничивает его широкое применение. Аналогичным образом, другие методы на основе вакуума, используемые для изготовления различных керамических пленок SSE, такие как осаждение атомного слоя (ALD) ( 11 — 13 ), импульсное послойное осаждение (PLD) ( 14 , 15 ) и химическое осаждение из паровой фазы (CVD) ( 16 , 17 ) требует больше времени и менее масштабируемо по сравнению с процессом с рулона на рулон.Кроме того, керамические SSE, полученные этими методами, обычно демонстрируют низкую ионную проводимость от ~ 10 -8 до 10 -4 См / см ( 17 — 19 ) из-за осажденной аморфной структуры или высокой потери летучих ионов. (например, Ли и На).
Для устранения этих ограничений были разработаны более экономичные и масштабируемые методы на основе решений для синтеза керамических пленок SSE (например, граната), но с ограниченным успехом из-за огромных проблем при спекании пленок электролита ( 11 , 20 , 21 ).В этих процессах SSE необходимо спекать при высоких температурах (от 600 до 1100 ° C) в течение нескольких часов, чтобы получить кристаллическую структуру, необходимую для высокой ионной проводимости. Однако длительное спекание также вызывает серьезные потери Li и Na и соответствующую низкую ионную проводимость из-за летучести этих легких элементов при высокой температуре ( 22 — 25 ). В результате керамические пленки SSE обычно демонстрируют либо плохую кристалличность, либо заметные потери лития с максимальной зарегистрированной ионной проводимостью ~ 10 -6 См / см ( 26 , 27 ).Снижение температуры обработки для предотвращения серьезных потерь Li ( 2 ) или добавление избыточного Li для компенсации ( 11 ) было обычной стратегией в традиционных методах осаждения керамической пленки. Однако это приводит к плохому контролю состава и потенциально пористой структуре. Кроме того, эти низкотемпературные спеченные SSE имеют аморфную структуру, что приводит к ограниченному улучшению проводимости до 2,9 × 10 −5 См / см ( 2 ), что далеко от объемного значения (~ 10 −3 См / см) ( 28 ).Хотя твердотельные пленочные батареи с низкой плотностью тока от 50 до 800 мкА / см 2 были успешно коммерциализированы в электронике ( 17 , 29 ), этот успех невозможно перенести на крупномасштабные приложения ( например, электромобили), для которых требуется плотность тока от 3 до 10 мА / см 2 ( 30 ). В результате существует постоянная потребность в масштабируемом методе синтеза керамических SSE с превосходным контролем состава и кристалличностью для достижения необходимой высокой ионной проводимости.
В этой работе мы разработали нелогичный подход к синтезу керамических пленок SSE непосредственно из прекурсоров, в котором мы значительно увеличиваем температуру спекания (до 1500 ° C), но только на короткий период времени (~ 3 с). Такой быстрый нагрев позволяет формировать плотную поликристаллическую пленочную структуру, но с незначительными потерями летучих элементов из-за короткого времени спекания. Мы называем этот метод «печатью и радиационным нагревом» (PRH), основанный на растворе и пригодный для печати метод синтеза керамических SSE-пленок.В типичном процессе пленка-предшественник печатается на подложке с толщиной, точно настроенной путем контроля концентрации чернил и толщины во влажном состоянии. Затем высушенная на воздухе пленка прекурсора помещается в тесный контакт с полосой радиационного нагрева (обычно ~ 1500 ° C) для быстрого спекания в непосредственной близости (рис. 1A). Эта нагретая Джоуля полоса проходит через исходную пленку с зазором ~ 0,5 мм и общей продолжительностью нагрева несколько секунд для завершения процесса спекания, что потенциально позволяет производить обработку рулонов.Рисунок 1B и фиг. S1 представляет собой типичную керамическую SSE-пленку, спеченную методом PRH, Li 6,5 La 3 Zr 1,5 Ta 0,5 O 12 (LLZTO) на монокристаллической подложке MgO, которая имеет полупрозрачную и плотную структуру с шероховатость поверхности <1 мкм (рис. 1С). Этот метод также не зависит от материала и позволяет спекать целый ряд высокоэффективных твердотельных пленок.
Рис. 1 PRH процесс синтеза пленки.( A ) Схема методики печати на пленке, в которой используются чернила-предшественник керамики и процесс быстрого спекания, при котором материал нагревается до высокой температуры (1500 ° C) в течение ~ 3 секунд.( B ) Спеченная пленка граната LLZTO на монокристаллической подложке MgO. ( C ) Соответствующая профилометрическая кривая спеченной пленки. Фото: Вэйвэй Пинг, Мэрилендский университет, Колледж-Парк.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для демонстрации метода PRH мы синтезировали керамическую пленку LLZTO SSE (подробности см. В дополнительных материалах). Вкратце, мы смешали порошок прекурсора (Li 2 CO 3 , La 2 O 3 , ZrO 2 и Ta 2 O 5 ) с помощью шаровой мельницы с последующим диспергированием в этаноле. путем обработки ультразвуком для приготовления чернил-прекурсоров (рис.2А). Чернила-предшественник LLZTO демонстрируют хорошую текучесть и смачиваемость на различных подложках (рис. 2B), таких как стекло, металлическая фольга и керамика, что позволяет создавать многофункциональные устройства. Кроме того, концентрация и вязкость чернил-предшественников могут быть изменены для адаптации к различным методам печати, таким как нанесение покрытия распылением и метод ракельного ножа. Мы использовали распылительное покрытие для нанесения краски-прекурсора, чтобы (i) достичь широкого диапазона толщин спеченных пленок LLZTO (от 1 до 100 мкм) и (ii) создать узорчатые пленки с использованием теневой маски, которая позволяет генерировать различные электролиты электродные конструкции для изготовления будущих устройств (рис.2C и рис. S2). Для более толстых пленок без рисунка мы применили метод ракельного ножа для нанесения суспензии прекурсора на металлическую фольгу (30 см на 10 см) в окружающей среде (рис. 2D), создавая гладкую и однородную пленку (рис. 2Е и рис. S3).
Рис. 2 Оптимизация условий печати и спекания керамической пленки.( A ) Чернила-предшественник SSE, полученные диспергированием предшественников смешанных оксидов (Li 2 CO 3 , La 2 O 3 , ZrO 2 и Ta 2 O 5 ) в этаноле.( B ) Чернила SSE обладают хорошей текучестью. ( C ) Печать чернил-предшественников граната путем нанесения покрытия распылением через маску. ( D ) Печать чернил-предшественников SSE методом ракельного ножа. ( E ) Пленка SSE с печатью масштабируема и гибка. ( F — H ) Схематическое изображение и морфология поперечного сечения пленок граната LLZTO, спеченных при различных температурах и времени, при которых необходима адекватная температура спекания с соответствующим временем спекания для получения плотной пленки граната с ограниченными потерями Li и однородными гранулометрический состав.Рентгенограммы пленок LLZTO, спеченных при температурах от ( I ) от 800 ° до 1300 ° C и времени выдержки от 1 до 180 с и при ( J ) от 1400 ° до 1700 ° C и времени выдержки от 1 до 10 с. а.е., условные единицы. Фото: Вэйвэй Пинг, Мэрилендский университет, Колледж-Парк.
В типичном процессе PRH мы быстро спекали напечатанную пленку-предшественник в атмосфере аргона, перемещая нагретую Джоуля углеродную полосу по образцу в течение ~ 3 с (рис. S4).Чтобы продемонстрировать большую пленку на металлических подложках, мы изготовили гибкую композитную пленку LLZTO / LiBO 2 на фольге из нержавеющей стали размером 5 см на 2 см (рис. S5, A и B). LiBO 2 [30 мас.% (Мас.%)] Был добавлен для снижения температуры спекания композитной пленки SSE, чтобы подложка из нержавеющей стали не плавилась. Поверхность пленки LLZTO / LiBO 2 осталась конформной и плоской без каких-либо явных трещин или точечных отверстий при спекании, что демонстрирует превосходную однородность полученной большой пленки SSE (рис.S5, от C до E). Мы исследовали влияние температуры и времени спекания на полученные пленки LLZTO с помощью сканирующей электронной микроскопии (SEM) и дифракции рентгеновских лучей (XRD). При более низкой температуре спекания (~ 1000 ° C) полученная пленка имеет чистую фазу граната (рис. S6), но с пористой структурой даже при более продолжительном времени спекания, составляющем 10 с (рис. 2F). При более высокой температуре спекания (~ 1700 ° C) спеченная пленка показывает аномальный рост зерен (рис. 2H), значительную потерю Li (рис. S6) и побочную реакцию с подложкой (рис.S7), даже если время спекания ограничено всего 1 с. Однако мы обнаружили, что оптимизированное сочетание высокой температуры и короткого времени обработки (1500 ° C, 3 с) позволило получить плотную структуру граната с минимальными потерями Li и побочными реакциями (рис. 2G и рис. S6).
Чтобы лучше понять эволюцию пленки-предшественника LLZTO во время спекания PRH, мы спекали пленки при температурах от ~ 800 ° до 1700 ° C и временах от 1 до 180 с. Мы измерили дифрактограммы спеченных пленок, чтобы охарактеризовать потенциальные фазовые изменения, связанные с потерей лития (рис.2I). Согласно рентгенограммам, прекурсоры начинают реагировать и образовывать кубическую гранатовую фазу при низких температурах от 800 до 1000 ° C через ~ 30 с. Однако мы наблюдали, что низкотемпературные спеченные пленки оставались непрозрачно-белыми, что указывало на пористую структуру, что мы также подтвердили с помощью SEM (рис. S8). Пористая структура граната сохранялась даже при повышении температуры до ~ 1200 ° C и времени спекания до 180 с, где также наблюдалась небольшая потеря Li из-за появления небольшого количества La 2 Zr 2 O 7 пик (рис.2I). Однако при повышении температуры до 1300-1500 ° C напечатанные пленки-предшественники стали прозрачными, что указывает на плотную структуру. При дальнейшем повышении температуры скорость испарения Li также быстро увеличивалась, о чем свидетельствует заметный фазовый переход на La 2 Zr 2 O 7 из-за значительных потерь Li (рис. 2, I и J). .
На основе дополнительных экспериментов по спеканию и рентгеноструктурных исследований мы построили диаграмму квазивремя-температура-превращение (TTT), чтобы определить оптимальные условия спекания, которые будут определять будущий синтез (рис.S9). На квази-TTT-диаграмме есть четыре основных участка, указывающих на различные плотности и фазы спеченных пленок LLZTO. Согласно диаграмме квази-ТТТ, спекание от 3 до 10 с при температуре от 1300 до 1500 ° C является предпочтительным для получения прочной пленки с минимальными потерями Li и плотной структурой. Когда температура спекания ниже 1200 ° C, требуется длительное время спекания для достижения плотной структуры пленки. Однако повышенные потери Li во время такого длительного спекания приведут к образованию фазы La 2 Zr 2 O 7 , особенно для пленок граната, из-за низкого исходного содержания Li и более коротких расстояний диффузии.Следовательно, температура и время спекания должны быть хорошо оптимизированы для получения плотной пленки SSE с чистой фазой граната и минимальными потерями Li.
Как показано на СЭМ-изображении в поперечном сечении (рис. 3A), высокая температура 1500 ° C может обеспечить достаточно энергии для спекания пленки LLZTO и привести к однородной структуре без явных пор (рис. S10, A и B). . Даже при толщине всего ~ 1,5 мкм пленка все еще имеет плотную структуру без явных точечных отверстий на изломанной поверхности (рис. S10C). Рентгенограмма пленки LLZTO также соответствует стандартной кубической фазе граната (PDF № 01-080-4947; рис.S10D), что указывает на минимальные потери Li. Кроме того, в традиционных методах спекания Al 2 O 3 может легко легироваться в SSE на основе граната в процессе спекания ( 31 , 32 ), что может повлиять на ионную проводимость и химическую стабильность SSE. Картирование поперечного сечения энергодисперсионной рентгеновской спектроскопии (EDS) PRH-спеченного LLZTO (рис. 3B) показывает четкую границу раздела с подложкой Al 2 O 3 , что подтверждает отсутствие очевидного кроссоверного легирования между LLZTO. пленка и подложка.Отсутствие перекрестного легирования дополнительно демонстрирует преимущество сочетания высокой температуры и короткого времени спекания, которое стало возможным благодаря технологии PRH. Кроме того, быстрый процесс спекания предотвращает аномальный рост зерен при высокой температуре, что демонстрируется равномерным распределением зерен по размерам (~ 1,6 ± 0,7 мкм) на изображениях СЭМ вида сверху (рис. 3, C и D).
Рис. 3 Характеристики пленки LLZTO, спеченной методом PRH.( A ) СЭМ-изображение поперечного сечения и ( B ) EDS-отображение спеченной пленки LLZTO на подложке из Al 2 O 3 .( C ) Морфология поверхности спеченной пленки LLZTO на подложке из Al 2 O 3 . ( D ) Статистика гранулометрического состава спеченной пленки LLZTO. ( E ) Энергия активации спеченной с помощью PRH пленки LLZTO, согласованная с соотношением Аррениуса. ( F ) Профили напряжения и тока симметричной ячейки Li / LLZTO / Li с плоскими Li-электродами для испытания критической плотности тока. ( G ) Сравнение потерь Li в пленках, спеченных PRH и традиционными методами.( H ) Сравнение ионной проводимости при комнатной температуре пленок SSE, синтезированных методом PRH и другими известными методами ( 2 , 8 , 9 , 11 , 35 — 41 ) .
Мы оценили ионную проводимость пленок граната LLZTO, спеченных методом PRH, с помощью спектроскопии электрохимического импеданса (EIS) в диапазоне температур от 30 ° до 140 ° C (рис. S11) с использованием плоских Li-электродов (рис. S12). Энергия активации переноса лития, соответствующая аррениусовскому поведению литий-ионной проводимости, составляла 0.34 эВ (рис. 3E), аналогично массивному гранату, в то время как ионная проводимость при комнатной температуре достигала ~ 1.0 · 10 −3 См / см, что сопоставимо с проводимостью массивного граната ( 23 , 33 ). Мы также оценили критическую плотность тока пленки LLZTO, проводя осаждение / зачистку Li в плоскости пленки Li / LLZTO / симметричной ячейки Li. Симметричная ячейка подвергалась циклическому циклу при плотностях тока от 0,2 до 5 мА / см 2 с продолжительностью 10 мин (рис. 3F). Пленка LLZTO, спеченная с помощью PRH, показала плотность критического тока 5 мА / см 2 (рис.3F и рис. S12), что является одним из самых высоких заявленных значений даже для массивных гранатовых SSE ( 28 , 34 ). Чтобы лучше охарактеризовать устойчивость к циклированию пленки LLZTO, спеченной методом PRH, для симметричной ячейки Li / LLZTO пленка / Li также было проведено испытание на длительное циклирование (фиг. S13 и S14). Пленка Li / LLZTO / Li симметричная ячейка может успешно работать в течение более 140 часов при плотностях тока от 0,2 до 3 мА / см 2 , что указывает на превосходную стабильность при циклическом воздействии пленки LLZTO, спеченной методом PRH.
Мы приписываем отличные электрохимические свойства пленок LLZTO, спеченных методом PRH, благодаря строгому контролю содержания Li, плотной морфологии и высокой кристалличности, которые достигаются во время чрезвычайно высокотемпературного и сверхбыстрого процесса спекания. Напротив, обычные процессы спекания обычно занимают часы при температуре> 1000 ° C, что приводит к значительным потерям Li. Это особенно верно для пленок (например, толщиной ~ 1 мкм) по сравнению с обычными толстыми гранулами (например, ~ 1000 мкм), поскольку количество Li намного ниже, а удельная площадь поверхности намного выше, что приводит к большим потерям Li. в обычных процессах спекания (рис.3G). Однако высокая скорость метода PRH ограничивает потери Li в таких пленочных структурах, что позволяет нам получить пленку граната LLZTO, которая демонстрирует самую высокую ионную проводимость среди тонкопленочных SSE (рис. 3H) ( 2 , 8 , 9 , 11 , 35 — 41 ).
Метод спекания PRH основан на радиационном нагреве, который не зависит от материала и может применяться для спекания широкого диапазона составов. Чтобы продемонстрировать универсальность этой методики, мы успешно изготовили Li 0.3 La 0,567 TiO 3 (LLTO), Li 1,3 Al 0,3 Ti 1,7 (PO 4 ) 3 (LATP) и β-Al 2 O 3 пленки из растворов чернил-предшественников (рис. 4A), все из которых содержат летучие компоненты. LLTO, LATP и β-Al 2 O 3 — это высокоэффективные литий-ионные и Na-ионные проводники, пленки которых также сталкиваются с проблемой контроля потерь Li / Na во время синтеза ( 19 , 42 , 43 ).В нашем методе мы напечатали краски LLTO, LATP и β-Al 2 O 3 на подложке Al 2 O 3 путем нанесения покрытия распылением с последующим высокотемпературным (1500 ° C) спеканием. в течение ~ 3–5 с, что приводило к однородным и плотным пленкам толщиной от 5 до 10 мкм (рис. 4Б). Пленки LATP и LLTO спекались на воздухе, чтобы предотвратить возможное восстановление Ti 4+ . Как и в случае с пленкой LLZTO, в соответствии с картированием EDS не наблюдалось явного перекрестного легирования или побочных реакций между слоем SSE и подложкой (рис.4Б). Границы зерен спеченных пленок также хорошо сливались из-за эффекта плавления при высокой температуре спекания. Кроме того, благодаря быстрому процессу спекания в течение 3 с, потери Li / Na в SSE LATP, LLTO и β-Al 2 O 3 были минимизированы, что мы подтвердили по чистым фазам на рентгенограммах ( рис. S15 — S17).
Рис. 4 Другие пленки SSE, спеченные на PRH.( A ) Печатные краски на основе прекурсоров LLTO, LATP, β-Al 2 O 3 и LiBO 2 -LLZTO.( B ) Слева: морфология поперечного сечения и результаты элементарного картирования пленок LLTO, LATP, β-Al 2 O 3 , спеченных с помощью PRH. Справа: Схема сравнения потерь летучих элементов между PRH и традиционными методами спекания. ( C ) Слева: морфология поперечного сечения и результаты картирования пленки LiBO 2 -LLZTO, спеченной методом PRH. Справа: Схема сравнения контроля побочной реакции между PRH и традиционными методами. Фото: Вэйвэй Пинг, Мэрилендский университет, Колледж-Парк.
Помимо однокомпонентных пленок, нашу технологию PRH можно также использовать для быстрого спекания композитных пленок, так как короткое время спекания может эффективно предотвратить побочные реакции между материалами. Чтобы продемонстрировать эту способность, мы спекали композитную SSE-пленку LiBO 2 -LLZTO (рис. 4, A и C). Полученный материал содержал LiBO 2 , равномерно распределенный между зернами LLZTO с конформными поверхностями раздела и без явного совместного легирования, вероятно, из-за короткого времени спекания, составляющего 3 секунды, даже при высокой температуре спекания 1200 ° C.Напротив, когда мы спекали те же материалы в обычной печи в течение 1 часа, мы получили пористую структуру с крупными прореагировавшими зернами, а не плотный композит (рис. S18). Часовое спекание в обычной печи приводит к заметной перекрестной диффузии и побочным реакциям между компонентами, в то время как метод PRH позволяет избежать таких побочных реакций с образованием композитных структур (рис. 4C, справа). Эта способность производить широкий спектр как однокомпонентных, так и многокомпонентных компаундов указывает на универсальность нашего быстрого процесса печати и спекания для производства высококачественных керамических пленок.
Технология PRH также может применяться для изготовления твердотельных батарей со слоистой структурой посредством послойной печати и спекания. Раствор прекурсора LiCoO 2 (рис. S19) был напечатан на тонкой, быстро спеченной таблетке LLZTO с последующим спеканием PRH при ~ 800 ° C (из-за низкой температуры реакции) в течение ~ 3 с для синтеза LiCoO in situ. 2 катод. Затем мы покрыли металлический литий анод с другой стороны таблетки, чтобы сформировать твердотельную батарею LiCoO 2 / LLZTO / Li для езды на велосипеде (рис.5А). Получение изображений поперечного сечения SEM и картирование EDS (рис. 5, B и C) показывают, что катод LiCoO 2 был равномерно спечен на поверхности LLZTO с конформной и четкой границей раздела. LiCoO 2 , синтезированный с помощью PRH, также показывает пики XRD, хорошо соответствующие стандартной фазе LiCoO 2 без большого количества вторичной фазы, что указывает на успешный синтез в течение 3-секундного времени спекания (рис. S20). Из-за высокой температуры и короткого времени спекания спеченный LiCoO 2 имеет нанопористую структуру с размером зерна ~ 200 нм (рис.S21) и четко определенный конформный интерфейс без явного перекрестного легирования с гранатом LLZTO (рис. 5C). Чтобы облегчить перенос Li в пористом слое LiCoO 2 и избежать снижения емкости из-за изменения объема катода во время циклирования, мы использовали LiBO 2 в качестве твердотельного связующего, смешанного с катодом LiCoO 2 ( 44 ). Поскольку LiBO 2 может плавиться при ~ 850 ° C, мы непосредственно напечатали и спекали прекурсор LiBO 2 в течение 3 с в пористом слое LiCoO 2 с использованием технологии PRH, что привело к однородной структуре композита (рис.5, Г и Д). Затем мы охарактеризовали электрохимические характеристики полученной послойно напечатанной и спеченной твердотельной батареи LiBO 2 -LiCoO 2 / LLZTO / Li.
Рис. 5 Полностью твердотельный аккумулятор LiBO 2 -LiCoO 2 / LLZTO / Li, спеченный методом PRH.( A ) Процесс печати и спекания твердотельной батареи, изготовленной с помощью PRH. ( B ) SEM-изображение поперечного сечения и ( C ) EDS-отображение спеченного с помощью PRH катода LiCoO 2 на поверхности LLZTO.( D ) Поперечное сечение и ( E ) увеличенные SEM-изображения интерфейса LiBO 2 -LiCoO 2 / LLZTO. ( F ) Спектры ЭИС полностью твердотельной батареи (LiBO 2 -LiCoO 2 / LLZTO / Li) до цикла и после цикла 450 th . ( G ) Профили напряжения полностью твердотельной батареи, изготовленной на месте, при различных плотностях тока. ( H ) Циклические характеристики и кулоновская эффективность LiBO 2 -LiCoO 2 / LLZTO / Li твердотельный аккумулятор при 60 ° C.
Из-за конформных интерфейсов межфазное сопротивление этой PRH-спеченной батареи было всего лишь ~ 100 Ом · см 2 при 60 ° C (рис. 5F), что значительно меньше, чем у других спеченных спеченных материалов. твердотельные батареи ( 44 — 46 ). Профили напряжения напечатанной батареи демонстрируют типичные плато катода LiCoO 2 (рис. 5G), что дополнительно демонстрирует успешный синтез LiCoO 2 с помощью метода быстрого PRH.Кроме того, емкость аккумулятора и его характеристики при циклическом использовании демонстрируют хорошее сохранение емкости и отличную стабильность при циклическом использовании в течение ~ 450 циклов (рис. 5H). В частности, начальная удельная емкость составляла ~ 87 мА · час / г при плотности тока 30 мА / г, что лучше, чем в большинстве предыдущих отчетов с использованием совместно спеченного LiCoO 2 и граната ( 37 , 43 , 44 ). Емкость немного уменьшается с увеличением плотности тока, но мало изменяется за циклы при каждой плотности тока (рис.5H). После ~ 450 циклов межфазное сопротивление немного увеличилось до ~ 170 Ом · см 2 (рис. 5F), что дополнительно демонстрирует превосходную стабильность спеченного катода in situ и поверхности раздела, синтезированных методом PRH.
Благодарности: Мы выражаем признательность за поддержку наноцентру Мэриленда, включая его Центр анализа поверхности и AIMLab. Финансирование: Этот проект не финансируется напрямую. Вклад авторов: L.H., C.W. и W.П. разработал эксперименты. W.P. и R.W. проводили эксперименты. З.Л. и J.D. создали трехмерные иллюстрации. L.H., W.P., C.W., Q.D., A.H.B. и J.L. совместно написали статью. Все авторы прокомментировали окончательный вариант рукописи. Конкурирующие интересы: Авторы подали предварительную заявку на патент через Университет Мэриленда (предварительный патент США 62/849578). Авторы заявляют, что у них нет других конкурирующих интересов. Доступность данных и материалов: Все данные, необходимые для оценки выводов в статье, представлены в документе и / или дополнительных материалах.Дополнительные данные, относящиеся к этой статье, могут быть запрошены у авторов.
Конвекция электролита, вызываемая плавучестью — ScienceDaily
Водород можно производить с помощью возобновляемых источников энергии без ущерба для климата, и он может внести важный вклад в энергетическую систему будущего. Один из вариантов — использовать солнечный свет для электролитического расщепления воды, либо косвенно, путем соединения солнечного элемента с электролизером, либо непосредственно в фотоэлектрохимическом (PEC) элементе. Светопоглощающие полупроводники служат фотоэлектродами.Их погружают в раствор электролита, состоящий из воды, смешанной с сильными кислотами или основаниями, который содержит высокую концентрацию протонов или гидроксид-ионов, необходимую для эффективного электролиза.
Однако на крупномасштабном предприятии из соображений безопасности имеет смысл использовать раствор электролита с pH, близким к нейтральному. Такой раствор имеет низкую концентрацию протонов и гидроксид-ионов, что приводит к ограничениям массопереноса и плохим характеристикам. Понимание этих ограничений необходимо для разработки безопасного и масштабируемого устройства для разделения воды PEC.
Команда под руководством доктора Фатвы Абди из Института солнечного топлива HZB впервые исследовала, как жидкий электролит в ячейке ведет себя во время электролиза: с помощью фольги флуоресцентных датчиков pH, доктор Кейсуке Обата, a постдок в команде Абди, определил локальное значение pH в ячейках PEC между анодом и катодом во время электролиза. Ячейки PEC были заполнены электролитами с pH, близким к нейтральному. Ученые экспериментально визуализировали снижение pH в областях, близких к аноду, и увеличение pH в областях, близких к катоду.Интересно, что они наблюдали движение электролита по часовой стрелке во время электролиза. Наблюдение можно объяснить плавучестью из-за изменений плотности электролита во время электрохимической реакции, которая приводит к конвекции. «Было удивительно видеть, что крошечные изменения плотности электролита (~ 0,1%) вызывают этот эффект плавучести», — говорит Абди.
Параллельно Абди и его команда разработали мультифизическую модель для расчета конвекции, вызванной электрохимическими реакциями.«Мы тщательно протестировали эту модель и теперь можем предоставить мощный инструмент для предварительного моделирования естественной конвекции в электрохимической ячейке с различными электролитами», — говорит Абди.
Для этого проекта Абди построил «Завод солнечных топливных устройств» в HZB, который является частью завода по производству энергетических материалов имени Гельмгольца (HEMF), большой инфраструктуры, открытой и для других ученых. Это исследование также было выполнено в сотрудничестве с Берлинским университетом в рамках кластера передового опыта UniSysCat.
«Этой работой мы расширяем наши знания в области материаловедения за счет разработки фотоэлектрохимических реакторов, что является важным следующим шагом для расширения масштабов использования солнечных топливных устройств», — говорит профессор д-р Роэль ван де Крол, возглавляющий институт HZB. для солнечного топлива.
История Источник:
Материалы предоставлены Helmholtz-Zentrum Berlin für Materialien und Energie . Примечание. Содержимое можно редактировать по стилю и длине.
Удаление металлического лития под межфазной границей твердого электролита
Значение
В данном исследовании исследуется удаление литиевых анодов при различных плотностях тока и в различных системах жидких электролитов. Мы обнаружили образование нанопор между литием и межфазной границей твердого электролита (SEI). Поляризационное поведение лития систематически исследовалось с помощью трехэлектродной системы и ультрамикроэлектрода. Установлено, что диффузия и миграция катионов лития через SEI являются основными факторами перенапряжения отгонки.Предлагаются два режима зачистки, основанные на условии пассивации лития: зачистка пассивированного лития и точечная коррозия лития после разрушения слоя SEI. Настоящая работа дает механистическое объяснение спада кулоновской эффективности при высокой плотности зарядного тока. Мы также демонстрируем, что металлургические факторы значительно ускоряют локальное растворение лития.
Abstract
Удаление лития — важный процесс, связанный с осаждением лития во время циклирования металлических литиевых батарей.Осаждение лития широко изучалось, в то время как вскрытие как подземный процесс исследовалось редко. Здесь мы раскрываем фундаментальный механизм зачистки лития, визуализируя границу раздела между очищенным литием и межфазной границей твердого электролита (SEI). Мы наблюдали образование нанопор между литием и слоем SEI после зачистки, которое объясняется накоплением вакансий металлического лития. Высокоскоростное растворение лития вызывает интенсивный рост и последующую агрегацию пустот с последующим разрушением слоя SEI, т.е.э., питтинг. Мы систематически измеряли поведение поляризации лития во время зачистки и обнаружили, что диффузия катиона лития через слой SEI является определяющим этапом. Неоднородные участки на типичных поверхностях лития, такие как границы зерен и линии скольжения, значительно ускоряют локальное растворение лития. Более глубокое понимание этого процесса зачистки скрытой поверхности раздела дает полезные ключи к разгадке будущей конструкции литиевого анода и электролита.
Для коммерческого использования Li-S и Li-O 2 батарей (1⇓⇓ – 4), многочисленные исследования были посвящены повышению обратимости металлического Li (2, 5⇓⇓ – 8).Среди них основное внимание уделяется предотвращению роста дендритов лития (9⇓⇓⇓⇓ – 14), который включает только реакцию восстановления окислительно-восстановительного потенциала Li / Li + в процессе осаждения. Удаление лития — важный процесс, связанный с осаждением лития; однако он редко исследовался (15–17). Зачистка литий-металлических батарей — это анодное растворение лития. Электрохимическое окисление его поверхностных атомов приводит к выделению катионов в электролит.Он включает перенос заряда на границе раздела лития и твердого электролита (SEI), миграцию катиона лития через барьер SEI к границе раздела SEI / электролит и диффузию сольватированных ионов в электролит. Фактически, для большинства литий-металлических батарей с катодами, не содержащими литий, начальным циклом анода является зачистка, а не осаждение. Кроме того, морфология / структура литиевого анода после начальной зачистки может в значительной степени повлиять на последующий процесс осаждения (15).Таким образом, особенно важно исследовать широко игнорируемый процесс очистки от лития, уделяя особое внимание границе раздела Li – SEI.
Осаждение лития происходит на поверхности электрода и приводит к появлению видимых отложений, выступающих за пределы исходной поверхности, тогда как удаление лития — это подповерхностный процесс с особенностями, которые развиваются ниже границы раздела Li – SEI, что затрудняет зондирование и определение характеристик. Предыдущая литература в основном использовала морфологические характеристики, такие как оптическая микроскопия, сканирующая электронная микроскопия (SEM) или атомно-силовая микроскопия (AFM) для проверки процесса снятия изоляции (15–17).Хотя полезная информация может быть извлечена с помощью этих поверхностных методов, они не могут обеспечить глубокое представление о процессе вскрытия недр. Рентгеновская микротомография применялась для характеризации границ раздела в твердотельных литиевых батареях (18, 19), но этот метод не идеален для исследования зачистки на ранней стадии из-за своего ограниченного разрешения. Между тем, есть сообщения о том, что скорость очистки влияет на эффективность циклирования в различных электролитах (20). В некоторых литературах сообщалось, что более высокие токи зачистки могут привести к гладкой поверхности Li (15), в то время как в других наблюдалось растрескивание поверхности во время работы при высоких скоростях зарядки (16).Таким образом, очень важно выяснить механизм десорбции лития и выяснить факторы, которые на него влияют.
В данном исследовании основное внимание уделяется механизму удаления металлических литиевых анодов в различных условиях как в карбонатных, так и в электролитах на основе эфира. Мы проверяем влияние плотности тока зачистки на кулоновский КПД. Процесс удаления лития происходит под слоем SEI, что затрудняет наблюдение за деталями сверху. Здесь мы используем сфокусированный ионный пучок (FIB), чтобы вырезать свежие поперечные сечения очищенных литиевых электродов внутри камеры высокого вакуума (∼3E-9 бар).Мы охарактеризовали зачищенное поперечное сечение как в пассивной, так и в транспассивной областях; Наблюдались пустоты на границе раздела литий – SEI и питтинг на литии после разрушения слоя SEI. Перенапряжение снятия изоляции и потенциал питтинга лития были точно измерены с помощью трехэлектродных ячеек. Мы также исследовали влияние примесей, границ зерен и линий скольжения на процесс удаления лития. Настоящая работа обеспечивает фундаментальное понимание процесса удаления лития в сочетании с осаждением лития, которое будет определять конструкцию анодов из металлического лития в будущем.
Результаты и обсуждение
Влияние стриппинга на кулоновскую эффективность.
Высокая кулоновская эффективность (CE) является конечной целью для литиевых анодов в литиевых батареях. Однако до сих пор не ясно, как соотнести процесс зачистки с КЭ. Чтобы изолировать этот процесс, мы наносили литий 0,5 мАч⋅см -2 при фиксированном токе 0,2 мА 0.2см -2 , а затем удаляли осажденный литий при различных токах 0,1, 0,5, 1, 3 и 5 мА. ⋅см −2 .Здесь мы используем два разных метода для измерения CE. Первый метод — это часто упоминаемая установка Li || Cu (21). В этом методе медный электрод разряжен до 0 В относительно Li / Li + путем подачи тока 0,5 мА · см −2 , затем снова заряжен до 1 В при 0,5 мА · см −2 в течение 10 циклов до инициировать образование SEI и удалять поверхностные загрязнения без осаждения металлического Li. Как показано на рис. 1 A и B , циклирование лития как в EC / DEC, так и в DOL / DME / LiNO 3 демонстрирует тенденцию к более низкому CE с увеличением плотности тока снятия изоляции.Однако ток зачистки оказывает менее выраженное влияние на CE в электролите DOL / DME / LiNO 3 . Это может быть связано с сильным ростом дендритов на литиевой стороне электролита EC / DEC. Зашумленные точки данных при 5 мА · см −2 на рис. 1 A и B также связаны с этими эффектами. Чтобы уменьшить / устранить поляризацию и рост дендритов на литиевом противоэлектроде при высоких токах снятия изоляции, мы используем безлитиевый метод измерения CE.Чжан с соавторами (20) впервые сообщили об использовании ячейки Cu || LiFePO 4 для точного измерения CE. В качестве источника лития мы используем предварительно обработанный электрод из Li 4 Ti 5 O 12 (LTO). Первые три цикла LTO-лития / делитирования и протокола измерения CE показаны в Приложении SI , рис. S1, с более подробным описанием в Приложении SI , SI Материалы и методы . Из-за низкой поляризации (22) и высокой обратимости LTO как в электролитах EC / DEC, так и в DOL / DME / LiNO 3 элементы Cu || LTO имеют гораздо более стабильную тенденцию развития CE на рис.1 C и D . Даже после исключения факторов поляризации электрода и роста дендритов на противоэлектроде более высокие токи зачистки по-прежнему приводят к более бедным КЭ в электролите EC / DEC, в отличие от результатов от электролитов с высокой концентрацией (20, 23). Электролит DOL / DME / LiNO 3 показывает более стабильный КЭ с переменной плотностью тока. Профили потенциала – емкости, соответствующие рис. 1, были извлечены в приложении SI , рис. S2. Мы наблюдали очевидное увеличение перенапряжения снятия изоляции в обеих установках.Из-за ограничений двухэлектродной системы на абсолютное значение перенапряжения может влиять поляризация противоэлектрода. Чтобы выяснить роль реакции отрыва на обратимость лития в различных электролитах, мы исследуем механизм отрыва в следующих разделах.
Рис. 1.Зависимость кулоновской эффективности от плотности тока зачистки в различных электролитных системах. Установка Cu || Li для ( A ) EC / DEC 1M LiPF 6 и ( B ) DOL / DME 1M LiTFSI, 1% LiNO 3 .Установка без лития Cu || LTO для ( C ) EC / DEC 1M LiPF 6 и ( D ) DOL / DME 1M LiTFSI, 1% LiNO 3 . Для каждой установки мы наносили литий 0,5 мАч⋅см −2 при фиксированном токе 0,2 мА⋅см −2 и очищенный литий при токах 0,1, 0,5, 1, 3 и 5 мА⋅см −2 . Каждое условие повторяется более двух раз.
Удаление пассивированного лития.
Для металлов существуют различные механизмы анодного растворения в зависимости от диапазона приложенного потенциала относительно их состояния пассивации.Из-за низкого химического потенциала лития все электролиты будут реагировать с ним и вызывать спонтанный пассивирующий слой, то есть SEI. Сначала мы обсудим наиболее распространенный случай зачистки лития: зачистку с помощью SEI. Чтобы исключить какое-либо искусственное воздействие на границу раздела, мы создали литиевые электроды, у которых половина поверхности образца была зачищена, а другая половина была нетронутой. Таким образом, мы могли справедливо сравнить прореагировавшую и непрореагировавшую области. Более подробная информация о возможном повреждении ионным пучком содержится в Приложении SI , «Характеристика морфологии поперечного сечения» .Изготовленные на заказ полублокированные сепараторы использовались для покрытия и предотвращения электрохимической реакции части поверхности лития, как показано на рис. 2 A и B . Более подробная информация о сепараторе приведена в приложении SI , рис. S3. Как показано на фиг. 2 C , существует очевидный контраст между очищенными и непрореагировавшими областями на изображении иона Ga + ; этот контраст возникает из-за разницы в плотности под поверхностью. Однако на изображении вторичных электронов почти нет различий в морфологии поверхности между двумя областями ( SI Приложение , рис.S3 B ). Фиг.2 D и G показывают поперечное сечение литиевого электрода с полублокированным сепаратором до любого цикла; мы обнаруживаем, что на границе блокировки имеется однородная пленка, связанная с комбинацией SEI и остаточного электролита. Измерение ослабленного полного отражения в инфракрасном диапазоне с преобразованием Фурье было проведено для характеристики SEI (24⇓ – 26). В приложении SI , рис. S4, состав SEI на очищенном литии не показывает никаких различий по сравнению с составом на электроосажденном литии (27).Из-за разницы в электронной проводимости массивный литий можно отличить от указанной пленки на изображениях вторичных электронов. В конфигурации с круглой ячейкой большое механическое давление деформирует металлическую фольгу Li на сепараторе. Различная толщина сепаратора от заблокированной стороны (20 мкм) до незаблокированной стороны (25 мкм) приводит к разнице высот металлического лития по границе (~ 2,5 мкм). Рис.2 E , F , H и I и SI Приложение , Рис.S5, показывают границу раздела после очистки в DOL / DME 1 M LiTFSI, 1% LiNO 3 электролит при плотностях тока 0,5, 2 и 1 мА · см −2 . Мы наблюдаем цепочку постепенно образующихся пустот, расположенных между слоем SEI и чистым литием. Кроме того, более высокие плотности тока вызывают большие размеры пустот. Аналогичные тенденции наблюдаются в электролите EC / DEC 1 M LiPF 6 , как показано в приложении SI , рис. S6. Мы полагаем, что пустоты на границе раздела литий / SEI (рис.2 и SI Приложение , рис. S6) объясняются скоплением накопленных вакансий лития. Это согласуется с моделью точечных дефектов для растворения металла с пассивирующим слоем, разработанной Макдональдом и соавторами (28, 29). После миграции катионов лития через слой SEI металлические вакансии останутся на границе раздела между литием и слоем SEI. Эти вакансии металлического лития обычно имеют тенденцию погружаться в объем лития и, следовательно, исчезать с поверхности.Однако, когда скорость извлечения катионов выше, чем скорость погружения вакансий, эти вакансии накапливаются на границе раздела литий / SEI и приводят к локальной концентрации вакансий, то есть пустотам. Судьба этих пустот весьма критична для удаления лития, поскольку их агрегация может привести к образованию больших полостей на границе раздела литий / SEI, что отрицательно сказывается на прилипании / пассивности слоя SEI.
Рис. 2.Удаление лития в электролите DOL / DME 1M LiTFSI, 1% LiNO 3 .Схема полублокированного монетного элемента ( A ) до зарядки и ( B ) после первой зарядки; ( C ) Изображение иона Ga на границе между незащищенной и зачищенной областями; и вторичные электронные изображения поперечного сечения на литиевой фольге ( D и G ) без циклирования, ( E и H ) после снятия изоляции при 0,5 мА · см -2 и ( F и I ) после снятия изоляции при 2 мА · см −2 . Красные квадраты обозначают регионы с увеличенным масштабом.Все емкости для снятия изоляции составляют 1 мАч⋅см −2 . (Шкалы: C , 20 мкм; D — F , 5 мкм; G и I , 2,5 мкм; и H , 1,5 мкм.)
Точечная коррозия лития после разрушения слой SEI.
Высокоскоростное электрохимическое растворение лития может привести к сильному росту пустот, что вызывает локальный коллапс слоя SEI. Впоследствии место разрушения реагирует намного быстрее, чем другие участки на поверхности, что приводит к росту ямок.В этом разделе мы обсудим точечную коррозию лития после разрушения слоя SEI как второй тип зачистки. На рис. 3 показана питтинг лития в электролите EC / DEC 1 M LiPF 6 при различных плотностях тока. Из изображений вида сверху (Рис. 3 A , E и I ) общая площадь покрытия ямок увеличивается с увеличением плотности тока. Используя FIB для прямого наблюдения за поперечным сечением области питтинга (Рис.3 C , G и K ), мы обнаруживаем, что глубина ямок уменьшается с увеличением плотности тока (6.6 мкм для 1 мА · см −2 , 5,4 мкм для 5 мА · см −2 и 4,3 мкм для 10 мА · см −2 ). Это согласуется с сохранением объема, поскольку в каждом случае удаляется одна и та же емкость лития. Дополнительные результаты точечной коррозии из экспериментов с электролитом DOL / DME / LiNO 3 приведены в приложении SI , рис. S7. Мы обнаружили, что возникновение точечной коррозии практически не происходит, пока ток не достигнет 5 мА⋅см -2 в электролите DOL / DME LiNO 3 , что согласуется с его хорошим CE при высокой плотности тока на рис.1. Пустоты появляются на дне ямы, между границей раздела лития и слоя SEI (Рис. 3 D , H и L ), что аналогично пустотам на Рис. 2. Это подтверждает модель, согласно которой зарождение ямы вызвано обрушением накопленных пустот (28). Кроме того, уменьшение площади ямок с увеличением приложенной плотности тока может быть связано с кинетикой образования пустот. При большой плотности тока скорость образования пустот может быть очень высокой и доминировать над скоростью агломерации пустот, что приводит к более мелким ямкам.Эта тенденция верна для обоих типов электролита. Чтобы определить происхождение различных режимов обдирки лития, мы обсудим и сравним перенапряжение срыва и потенциал питтинга в следующих двух разделах.
Рис. 3.Точечная коррозия лития при различных плотностях тока в электролите EC / DEC 1M LiPF 6 . Зачистка при плотности тока ( A — D ) 1 мА⋅см -2 , ( E — H ) 5 мА 5см -2 и ( I — L ) 10 мА⋅см −2 .Все изображения поперечного сечения сделаны под углом наклона 52 °; зачищенная емкость составляет 1 мАч⋅см −2 . Красные квадраты обозначают регионы с увеличенным масштабом. (Масштабные линейки: A , E и I , 100 мкм; B , F и J , 20 мкм; C , G и K , 4 мкм и D , H и L , 1 мкм)
Перенапряжение отрыва.
Как показано в предыдущих результатах, разные плотности тока дают очень разные CE и морфологию интерфейса.Здесь мы проверяем поляризационное поведение обдирки лития. На рис. 4 A и B показана зачищающая поляризация в электролите EC / DEC и DOL / DME / LiNO 3 с трехэлектродной ячейкой. Для точного измерения потенциалов в различных системах электролит / SEI в качестве электрода сравнения используется предварительно обработанный LTO электрод (22). Толщина свежеобразованных слоев SEI на литии сильно изменится в течение первых нескольких часов (17). Чтобы выяснить влияние толщины SEI, каждую литиевую фольгу выдерживают в электролите более 10 часов.Более подробная информация об измерении поляризации приведена в Приложении SI , SI Материалы и методы . Мы наблюдаем гораздо большее перенапряжение при зачистке в электролите EC / DEC по сравнению с перенапряжением в DOL / DME с той же плотностью тока, что согласуется с литературными данными (17, 30). Перенапряжение отрыва в основном связано с переносом заряда, диффузией и падением iR (31). Мы используем быстрое поляризационное сканирование (скорость сканирования 200 мВ⋅с -1 ) с вольфрамовым микроэлектродом (диаметр 25 мкм) для исследования процесса переноса электрона на поверхности лития.Это быстрое потенциодинамическое измерение делает скорость осаждения Li намного выше, чем скорость литиевой коррозии, так что значительным является только вклад переноса электрона (27, 32). Более подробные экспериментальные данные изложены в Приложении SI , Измерение микроэлектрода . Фиг. 4 C показывает кривую поляризации, измеренную с помощью микроэлектрода и объемного литиевого электрода (предварительная обработка SEI, 10-часовое старение). Когда перенос электронов является этапом, определяющим скорость, реакция осаждения / удаления лития в электролите EC / DEC (красная линия) имеет более высокую плотность тока обмена и, следовательно, меньшую поляризацию по сравнению с таковой в электролите DOL / DME (черная линия).Однако стабилизированные перенапряжения отрыва литиевой фольги (взяты из рис. 4 A и B ) со слоем SEI показывают противоположную тенденцию (красные и черные точки). Следовательно, перенос электронов не является доминирующим фактором для перенапряжения срыва, когда поверхность лития покрыта слоем SEI.
Рис. 4.Поляризационное поведение лития при зачистке. Гальваностатические испытания при плотностях тока 0,1, 0,5, 1, 3 и 5 мА · см -2 дюйма ( A ) EC / DEC 1 M LiPF 6 и ( B ) DOL / DME 1 M LiTFSI , 1% LiNO 3 .( C ) Сравнение поляризации между микроэлектродным методом (линейные кривые), измеренным на литии без SEI, и гальваностатическим методом (точки), измеренным на литии с SEI при емкости 0,35 мАч⋅см -2 . ( D ) Анодные поляризационные кривые для литиевой фольги с SEI, скорость сканирования 1 мВ⋅с -1 . ( Вставка ) Увеличенный график поляризационной кривой в области низкого перенапряжения. Красные линии / точки указывают измерения в EC / DEC 1 M LiPF 6 , а черные линии / точки указывают измерения в DOL / DME 1 M LiTFSI, 1% LiNO 3 .Чтобы сформировать стабильную пленку SEI на литии, к каждому литиевому электроду в объеме 10 часов прикладывают процесс покоя.
Во время зачистки и после этапа переноса электрона катионы лития должны мигрировать через барьер SEI к границе раздела SEI / электролит. Когда транспортировка катионов через SEI является этапом, определяющим скорость, градиент концентрации Li + будет формироваться через слой SEI. Быстрое растворение металла при больших перенапряжениях вызовет насыщение и осаждение соли на границе раздела литий / SEI (33).Перенапряжение от ограниченного диффузией тока в SEI можно рассчитать с помощью следующего уравнения, где c s — концентрация насыщения, а d N — толщина диффузионного слоя Нернста в перед электродом (33): ηD = RTnFln (iD + iiD); iD = nFDcsdN. Таким образом, ионная проводимость SEI и концентрация насыщения катионов лития внутри SEI определяют вклад диффузионного перенапряжения. Искусственный SEI с правильно спроектированными свойствами (т.(например, высокая ионная проводимость, высокая растворимость лития и однородность состава) могут в значительной степени подавить перенапряжение отрыва. Спектроскопия электрохимического импеданса (EIS) в приложении SI , рис. S8, показывает, что слой SEI в DOL / DME / LiNO 3 имеет гораздо меньший межфазный импеданс по сравнению с EC / DEC, что отражает более высокую ионную проводимость. SEI, сформированного в электролите DOL / DME / LiNO 3 . Это объясняет, почему литиевая фольга в DOL / DME / LiNO 3 менее поляризована и проявляется меньшее питтинг-поведение.Потенциал падения iR можно также извлечь из данных EIS ( SI Приложение , рис. S8). Отметим, что межфазный импеданс (1050 Ом для EC / DEC и 98 Ом для DOL / DME / LiNO 3 ) намного больше, чем сопротивление электролита (1,1 Ом для EC / DEC и 0,7 Ом для DOL / DME / LiNO 3 ), что указывает на то, что перенос ионов через SEI является доминирующим фактором перенапряжения отрыва.
Питтинговый потенциал.
Явление питтинга возникает, когда приложенный потенциал превышает критическое значение и плотность тока резко увеличивается.Этот критический потенциал называется питтинговым потенциалом, который различает растворение металла в пассивном состоянии или в состоянии питтинга (33). Чтобы определить потенциал начала питтинга, мы измеряли анодные поляризационные кривые литиевой фольги с помощью трехэлектродной ячейки при скорости сканирования 1 мВ⋅с -1 . Рис. 4 D показывает, что плотность тока снятия изоляции резко увеличивается во время положительного сканирования. Учитывая предыдущие результаты на рис. 3 и 4 A и B и SI Приложение , рис.S7, мы определили, что начальный потенциал точечной коррозии составляет около 0,1 В по сравнению с Li / Li + как в электролите EC / DEC, так и в электролите DOL / DME. Из-за большой поляризационной характеристики лития в электролите EC / DEC перенапряжение отрыва достигает потенциала питтинга при плотности тока 1 мА · см −2 (рис. 3 A — D ). В электролите DOL / DME / LiNO 3 перенапряжение отрыва лития не превышает точечного потенциала до 5 мА · см −2 , что объясняет падение CE при 5 мА на рис.1 Д . Таким образом, сравнивая перенапряжение снятия изоляции и потенциал точечной коррозии, мы можем легко определить, возникнет ли точечная коррозия, что имеет жизненно важное значение для идентификации режимов отслаивания.
Металлургические факторы, влияющие на процесс очистки от лития.
Примеси.
При характеризации чистой литиевой фольги мы наблюдали примесные кристаллы, внедренные внутрь ее объема. Результат FIB – энергодисперсионного рентгеновского излучения показывает, что основным составом примеси является кислород, хотя он не может обнаружить литий из-за низкого Z.Таким образом, мы идентифицируем примесь как Li 2 O ( SI Приложение , рис. S9), как сообщается в литературе (12). Однако, в отличие от процесса очистки в случае твердого электролита, мы не наблюдали какого-либо ускоренного образования пустот под частицей примеси в жидком электролите, как показано на рис. 5 A и B . Это можно объяснить плохой проводимостью как электронов, так и ионов внутри такой крупной примесной частицы (∼10 мкм), которая препятствует проникновению через нее любого реакционного потока электронов / ионов.Среда с более высокой ионной проводимостью в системе жидкого электролита может легче перераспределять поток ионов лития, чем в твердом электролите. Таким образом, кислородсодержащая примесь от производства играет менее важную роль, чем ожидалось.
Рис. 5.Влияние металлургической неоднородности на отгонку лития. ( A и B ) Литиевая фольга с примесным кристаллом после очистки в DOL / DME / LiNO 3 при плотности тока 10 мА · см −2 .( C и D ) Литиевая фольга с границей зерен после зачистки в EC / DEC 1 M LiPF 6 при плотности тока 0,5 мА · см −2 . ( E и F ) Литиевая фольга с линиями скольжения после зачистки в EC / DEC 1M LiPF 6 при плотности тока 10 мА · см −2 . Красные квадраты обозначают регионы с увеличенным масштабом. (Масштабные линейки: A , 10 мкм; B и C , 5 мкм; D , 1 мкм; E , 200 мкм; и F , 50 мкм.)
Границы зерен.
Металлы обычно являются кристаллическими материалами, и их структура оказывает сильное влияние на реакцию растворения. Мы знаем, что коммерческая литиевая фольга имеет прочную текстуру вдоль плоскости (100), и, следовательно, зерна с одинаковой ориентацией на литии будут иметь одинаковую скорость растворения (27). Решеточная диффузия представляет собой наиболее серьезное ограничение для миграции атомов, которое приводит к плохой диффузии атомов. Коэффициент диффузии атомов лития ( 7 Li) в твердом металлическом литии ( 7 Li) при 25 ° C имеет низкое значение 5.5E-11 см 2 ⋅s −1 (34). Напротив, границы зерен обеспечивают быструю диффузию атомов лития, поскольку они имеют менее плотно упакованную структуру. Более того, молекулы растворителя также могут диффундировать в эти границы и образовывать слои SEI. Диффузия иона лития в SEI обычно происходит быстрее, чем диффузия атома лития через его решетку. Модель SEI (Li 2 CO 3 ) имеет коэффициент диффузии до 1,1E-7 см 2 ⋅s −1 (35). Таким образом, эти границы зерен обеспечивают наиболее заметные пути с высокой диффузией как для атомов лития, так и для ионов лития.На рис. 5 C и D показана граница зерен в литиевой фольге после циклирования в EC / DEC 1 M LiPF 6 при плотности тока 0,5 мА⋅см -2 . Вдоль границы зерен наблюдается цепочка пустот, которая находится намного ниже границы раздела в объеме (∼2 мкм). Наличие такой границы зерен в значительной степени влияет на границу расхода ионов лития, что влияет на однородность процесса очистки.
Линии скольжения.
Металлические поверхности неоднородны.Помимо границ зерен, существуют атомные поверхностные структуры со ступеньками, перегибами и площадками на террасе. Во время активного растворения атомы удаляются из кристаллической решетки и переходят в раствор в виде сольватированных ионов. Этот процесс не происходит равномерно по всей поверхности, а вместо этого происходит на энергетически выгодных участках, таких как поверхности с низким показателем преломления или участки перегиба (33). При валковом прессовании на литиевой фольге обычно образуются линии скольжения ( SI Приложение , рис. S10 A ). После зачистки мы обнаружили, что точечная коррозия преимущественно происходит вдоль этих линий скольжения (рис.5 E и F ). В предыдущей литературе также описывалось подобное явление, но они описывали линии скольжения как «потрескавшиеся поверхности» и обсуждали их как границы зерен (15). Однако в наших результатах мы обнаружили, что линии скольжения не похожи ни на поверхностные трещины, ни на границы зерен. Характеристики поперечного сечения участков линии скольжения ( SI Приложение , рис. S10 B — D ) показывают, что на линии скольжения имеется равномерно распределенный слой пассивирования.Нет никаких признаков поверхностных трещин или швовидных структур, подобных тем, что на границах зерен. Обработка роликовым прессованием фактически создает ступени и изгибы на кристаллических зернах поверхности лития. Разница в высоте ступеньки вдоль линий скольжения составляет около 500 нм ( SI Приложение , рис. S10 D ), а пассивирующий слой на участках перегиба немного толще, чем у ступеньки. Следовательно, мы полагаем, что преимущественное срывание вдоль линий скольжения связано с высокой скоростью реакции атомов лития в местах перегиба на этих линиях.Это объясняет, почему поверхность лития не реагирует однородно, а вместо этого происходит преимущественное растворение некоторых центров.
Обзор механизма зачистки.
Мы обсудили два типа зачистки: зачистку пассивированного лития и точечную коррозию лития после разрушения слоя SEI (рис. 6). Удаление обычно начинается с первого режима, т.е. зачистки из-под неповрежденного пассивирующего слоя. Во время начальной зачистки катионы лития мигрируют через пассивный слой к электролиту.Оставшиеся металлические вакансии накапливаются на границе раздела металл – пассивирующий слой и в конечном итоге приводят к локальной пустоте. При высокоскоростном электрохимическом растворении интенсивный рост пустот вызывает локальный коллапс слоя SEI. Разрушение слоя SEI знаменует переход к другому режиму зачистки — питтингу. Сравнивая перенапряжение зачистки и потенциал точечной коррозии, мы можем определить режим зачистки. Перенапряжение отгонки в основном вызвано транспортировкой катиона лития через SEI.Ионная проводимость и концентрация насыщения катионов лития внутри SEI могут влиять на скорость образования вакансий и, следовательно, на толщину пустотного слоя на границе раздела литий / SEI.
Рис. 6.Эволюция литиевого электрода при различных условиях снятия изоляции.
Заключение
В данной работе исследуется механизм снятия изоляции на литиевом аноде в различных условиях как в карбонатных, так и в простых электролитах на основе эфира. Мы визуализировали образование пустот на границе раздела литий / SEI после очистки в каждой системе жидкого электролита.При высоких скоростях заряда быстрое накопление пустот на границе раздела литий / SEI приводит к коллапсу слоя SEI, который отмечает начало его питтинга. Мы систематически измеряли статическую и быструю потенциодинамическую поляризацию как на массивном литиевом, так и на вольфрамовом микроэлектроде, обнаружив, что диффузия катиона лития через слой SEI является основной причиной различий в перенапряжениях отрыва. Также исследовалось влияние металлургической неоднородности на зачистку.Мы оценили эффекты от примесей, границ зерен и линий скольжения. И границы зерен, и линии скольжения будут в значительной степени усугублять неравномерность зачистки на поверхности лития. Настоящий механистический анализ будет направлять дальнейшую оптимизацию литиевого анода, включая минимизацию межфазных пустот, повышение ионной проводимости в слое SEI и улучшение процесса производства литиевых анодов для лучшей металлургической однородности.
Материалы и методы
Материалы.
Круглые ячейки типа 2032 с рабочими электродами из меди или нержавеющей стали и электродами сравнения / сравнения из литиевой фольги (Alfa Aesar) были собраны в перчаточном ящике, заполненном аргоном (MB-200B; Mbraun). Между двумя электродами использовали двухъярусный промышленный сепаратор (2325; Celgard), и в каждую ячейку добавляли 30 мкл электролита. Электролит представлял собой 1 M LiPF 6 / этиленкарбонат (EC): диэтилкарбонат (DEC) (1: 1 об. / Об.) (Novolyte Technologies, BASF). 1,3-диоксолан / 1,2-диметоксиэтан (DOL / DME, 1: 1 об. / Об.) (Sigma-Aldrich) с 1 М бис (трифторметилсульфонил) имидом лития (LiTFSI) (Solvay S.A.) с 1 мас.% LiNO 3 (Sigma-Aldrich) в качестве добавки использовали в качестве электролита. Соли электролитов сушили при 100 ° C более 24 ч в атмосфере Ar. Диметилкарбонат (DMC) (Aldrich, 99,9 +%, чистота для ВЭЖХ) использовали в качестве растворителя для промывки.
Ячейка Swagelok с тремя электродами.
Трехэлектродная ячейка Swagelok использовалась для экспериментов по поляризации. Литиевая фольга используется как рабочий и противоэлектрод. Чтобы устранить дрейф потенциала Li / Li + в различных системах электролитов и нормализовать сравнение поляризации, электрод сравнения представляет собой предварительно обработанный Li 4 Ti 5 O 12 электрод со скоростью C / 5 ( SI Приложение , рис.S1 A ). Из-за реакционной способности лития ко всем литиевым электродам применяется 10-часовой процесс покоя. Это время старения было выбрано на основании зависимой от времени импедансной спектроскопии ( SI Приложение , рис. S5).
Определение морфологии поперечных сечений.
После электрохимической обработки образцы лития были осторожно промыты в DMC или DOL для удаления остаточного электролита. Затем образцы были перенесены в двухлучевой сканирующий электронный микроскоп с FIB (Helios NanoLab 600i, FEI) для визуализации.Образцы загружают на предметный столик и запечатывают в мешочек, заполненный аргоном, перед переносом в вакуумную камеру. Ускоряющее напряжение для источника ионов Ga + составляет 30 кВ, ток измельчения — 2,5 нА. СЭМ-изображения получены при ускоряющем напряжении 5 кВ.
Благодарности
Работа была поддержана помощником секретаря по энергоэффективности и возобновляемым источникам энергии Управления автомобильных технологий Министерства энергетики США в рамках программы исследования материалов для батарей и программы Консорциума Battery 500.A.P. выражает признательность за поддержку со стороны Stanford Graduate Fellowship. X.Z. выражает признательность Национальным научным фондам Китая (контракт 51472044) и Программе выдающихся талантов нового века в университетах (контракт NCET-12-0098).
Сноски
Авторы: F.S. спланированное исследование; F.S., A.P., D.T.B., J.X.

 В зимнее время эту задачу приходится выполнять чаще, так как плотность АКБ при отрицательной температуре быстрее снижается.
В зимнее время эту задачу приходится выполнять чаще, так как плотность АКБ при отрицательной температуре быстрее снижается. При достаточной степени заряженности аккумуляторной батареи шарик всплывает, и его цвет (обычно зеленый) приводит к изменению света, отражаемого призмой в сторону окошка индикатора, — оно темнеет
При достаточной степени заряженности аккумуляторной батареи шарик всплывает, и его цвет (обычно зеленый) приводит к изменению света, отражаемого призмой в сторону окошка индикатора, — оно темнеет 43
43