Зависимость изменения плотности электролита от его температуры
Таблица 1
Температура электролита,0С!! | Поправка к показанию денсиметра,г/см3 |
+60 +45 +30 +15 0 -15 -30 -40 | +0,03 +0,02 +0,01 0,09 -0,01 -0,02 -0,03 -0,04 |
17
Допускается
установка на автомобиль сухозаряженной
батареи после 20-минутной пропитки
ее электролитом, если батарея находилась
на хранении не больше 1 года, а температура
заливаемого электролита не превышает
15 °С.
Хранение и заряд.
Новые, не залитые электролитом, аккумуляторные батареи рекомендуется хранить в неотапливаемых помещениях при температуре до —50 °С. Батареи устанавливают крышками вверх. При этом должны быть плотно ввинчены пробки с приливами, установлены герметизирующие детали (уплотнительные диски), наклеены герметизирующие пленки. Перед началом эксплуатации проверяют состояние мастики на батареях обычной конструкции. Трещины удаляют, оплавляя мастику слабым пламенем газовой горелки или электрическим паяльником.
Батареи, снятые с
автомобилей после непродолжительной
эксплуатации, перед постановкой на
хранение полностью заряжают. Плотность
электролита доводят до нормы,
соответствующей данному климатическому
району. В период бездействия при
положительной температуре воздуха
батарею нужно ежемесячно подзаряжать.
При отрицательной температуре воздуха
можно ограничиться ежемесячной
проверкой плотности электролита, и
подзаряжать батарею только в тех
случаях, когда плотность электролита
снижается более чем на 0,04 г/см 3. В таком состоянии батареи могут храниться
не более 1,5 лет при отрицательной
температуре воздуха и не более 9 месяцев
(в пределах гарантийного срока
эксплуатации) при положительной
температуре.
В таком состоянии батареи могут храниться
не более 1,5 лет при отрицательной
температуре воздуха и не более 9 месяцев
(в пределах гарантийного срока
эксплуатации) при положительной
температуре.
Батареи, снятые с
автомобилей после длительной эксплуатации,
следует полностью зарядить и, доведя
плотность электролита до нормы,
подвергнуть тренировочному разряду
током 10-часового режима при температуре
электролита 18—27 °С. Батареи не
рекомендуется ставить на длительное
хранение, если длительность разряда
оказывается меньше 7,5; 6,5 и 5,5 ч при
плотности электролита соответственно
1,28; 1,26 и 1,24 г/см
При транспортировании
не залитых электролитом аккумуляторных
батарей необходимо обеспечить защиту
их от механических повреждений,
атмосферных осадков и попадания прямых
солнечных лучей.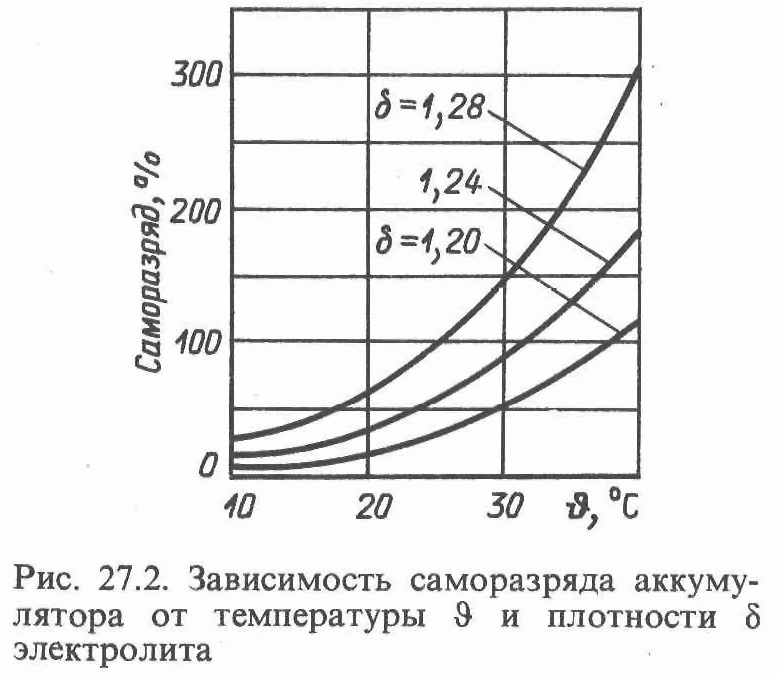
Уход.
Уход за аккумуляторной батареей на автомобиле сводится к поддержанию в чистоте ее поверхности, периодической проверке состояния и зарядных режимов. Наличие на поверхности батареи электропроводного слоя пыли, смоченной водой или раствором серной кислоты, приводит к постепенному разряду батареи и коррозии металлических деталей крепления. Электролит с поверхности батареи удаляют чистой ветошью, смоченной в 1 %-ном растворе кальцинированной соды или в растворе нашатырного спирта. Не реже 2 раз в месяц следует проверять надежность крепления батареи, плотность контакта наконечников проводов с полюсными выводами и чистоту вентиляционных
18
отверстий пробок.
Выводы батареи и наконечники проводов рекомендуется смазывать техническим вазелином.
Вследствие
газовыделения и испарения воды постепенно
понижается уровень электролита. Для
его восстановления добавляют
дистиллированную воду. Электролит той
же плотности доливают в том случае, если
точно установлено выплескивание
электролита из аккумулятора.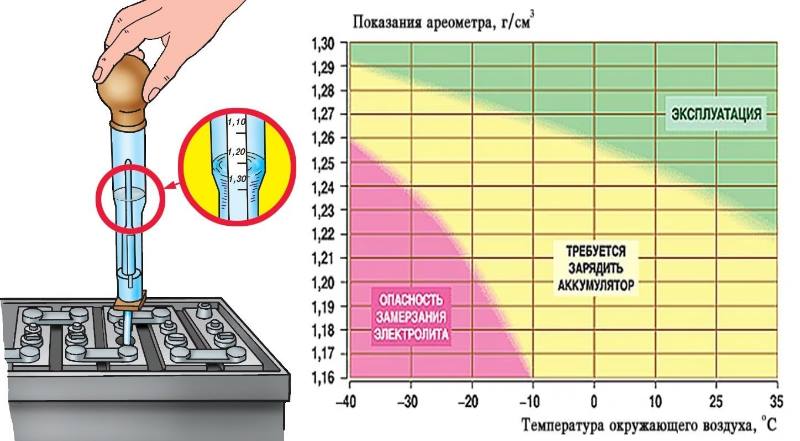 Причиной
выплескивания электролита на
поверхность крышки и быстрого уменьшения
его уровня может быть систематический
перезаряд батареи.
Причиной
выплескивания электролита на
поверхность крышки и быстрого уменьшения
его уровня может быть систематический
перезаряд батареи.
Уровень электролита определяют стеклянной трубкой диаметром 6—8 мм и длиной 100—120 мм. Трубку опускают в заливное отверстие до упора в предохранительный щиток. Верхний конец трубки закрывают пальцем и вытаскивают ее из аккумулятора. Высота столбика электролита в трубке соответствует уровню электролита в аккумуляторе над предохранительным щитком. Нормальным считается уровень в пределах 10—15 мм. В аккумуляторных батареях с прозрачными пластмассовыми моноблоками уровень электролита в каждом аккумуляторе контролируют через стенки моноблока.
Заряженные и
исправные аккумуляторные батареи теряют
емкость при длительном бездействии.
Потеря емкости при разомкнутой
внешней цепи обусловлена саморазрядом
вследствие недостаточной чистоты
активной массы и неравномерной плотности
электролита по высоте. Саморазряд связан
также с переходом сурьмы в раствор
серной кислоты в результате коррозии
решеток положительных электродов.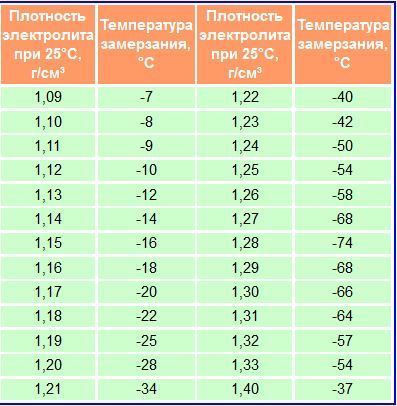
Саморазряд заряженной батареи, кроме необслуживаемой, после бездействия в течение 14 суток при температуре окружающего воздуха (20 ± 5) °С не должен превышать 10 % номинальной емкости, а после бездействия в течение 28 суток 20 %. Саморазряд необслуживаемой батареи (например, 6СТ-55АЗ) после ее бездействия в течение 90 суток не должен превышать 10 % номинальной емкости, а после бездействия в течение года 40 %.
19
Один раз в три месяца и при снижении надежности пуска двигателя следует проверять степень разреженности батареи по плотности электролита. Плотность электролита измеряют денсиметром 3, помещенным в стеклянную пипетку 2 (рис. 8 а) или плотномером (рис. 8,б).
При измерении
плотности денсиметром со шкалой,
имеющей цену деления 0,01 г/см3,
и пределами измерения 1,1
—1,3 г/см3 рукой
сжимают резиновую грушу 1 и наконечник 5 пипетки 2 погружают в
электролит. При отпускании груши
полость пипетки заполняется электролитом.
Плотность электролита определяют
по делению шкалы денсиметра,
которая устанавливается на уровне
мениска электролита. Во время
отсчета показаний денсиметра уровень
электролита в пипетке должен совпадать
с уровнем глаз. Чтобы учесть
температурную поправку, одновременно
с плотностью измеряют температуру
электролита. В прозрачном
пластмассовом корпусе 6 плотномера
(см. рис. 8 б) размещены
поплавки 7, имеющие различную
массу. При измерении полость
плотномера заполняют электролитом.
Плотность определяют по тому из всплывших
поплавков, против которого
на прозрачном корпусе выполнена надпись
с большим значением
плотности. Для повышения точности
измерений необходимо
отвести определенное время на выравнивание
температуры электролита и
поплавков
При отпускании груши
полость пипетки заполняется электролитом.
Плотность электролита определяют
по делению шкалы денсиметра,
которая устанавливается на уровне
мениска электролита. Во время
отсчета показаний денсиметра уровень
электролита в пипетке должен совпадать
с уровнем глаз. Чтобы учесть
температурную поправку, одновременно
с плотностью измеряют температуру
электролита. В прозрачном
пластмассовом корпусе 6 плотномера
(см. рис. 8 б) размещены
поплавки 7, имеющие различную
массу. При измерении полость
плотномера заполняют электролитом.
Плотность определяют по тому из всплывших
поплавков, против которого
на прозрачном корпусе выполнена надпись
с большим значением
плотности. Для повышения точности
измерений необходимо
отвести определенное время на выравнивание
температуры электролита и
поплавков
20
после заполнения плотномера электролитом.
Разреженность
батареи по величине измеренной плотности
определяют
с учетом начальной плотности электролита
полностью
заряженной батареи в соответствии с
климатическим районом
эксплуатации (табл.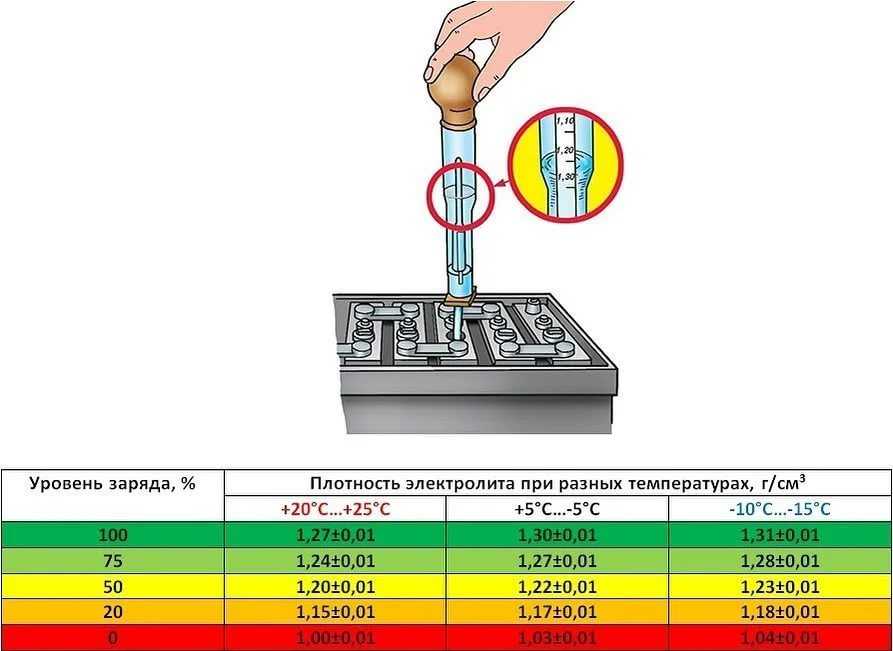 2).
2).
Причины образования льда в аккумуляторе по плотности электролита
Аккумуляторы
Auto
В процессе эксплуатации на автомобиле (чаще всего в зимнее время) аккумуляторная батарея может оказаться в состоянии глубокого разряда. В этом случае она имеет всегда пониженные показатели напряжения и плотности электролита.
Причины образования льда в автомобильном аккумуляторе, температура замерзания электролита, показатели напряжения и плотности электролита, что делать с аккумулятором у которого лед в банках.
При переходе от заряженного состояния в разряженное, показатели напряжения и плотности электролита меняются в определенных пределах.
Напряжение на полюсах автомобильного аккумулятора:
— В заряженном состоянии составляет: 12,7-12,9 В.
— В разряженном состоянии составляет: 11,5-12,0 В.
При неисправностях электрооборудования разряд может приводить к тому, что напряжение на выводах может иметь значение 6,0-8,0 В. При этом плотность электролита от своего первоначального значения в заряженном состоянии снижается пропорционально разряду и уменьшению содержания серной кислоты. На электродах образуется сульфат свинца. В составе электролита снижается количество серной кислоты.
При этом плотность электролита от своего первоначального значения в заряженном состоянии снижается пропорционально разряду и уменьшению содержания серной кислоты. На электродах образуется сульфат свинца. В составе электролита снижается количество серной кислоты.
Чем глубже происходит разряд, тем ниже плотность электролита. При изготовлении на электродах заложено такое количество активного материала, которое необходимо для получения заявленных электрических характеристик этой аккумуляторной батареи. Соответственно, в объеме электролита содержится количество серной кислоты, необходимое для полного использования активного вещества пластин.
В конце разряда аккумуляторной батареи серной кислоты в электролите остается очень мало. При чрезмерно глубоком разряде плотность электролита достигает значения близкого к плотности воды.
Установлено, что электролит замерзает и превращается в лед:
— С плотностью 1,28 г/см3 замерзает при температуре -64 °С.
— С плотностью 1,21 г/см3 замерзает при температуре -34 °С.
— А с плотностью 1,07 г/см3 замерзает при температуре -5 °С.
Соотношение количества кислоты, воды и концентрированного электролита, необходимых для получения 1 литра электролита требуемой плотности.
Изготовители считают недопустимым использование в зимнее время аккумуляторных батарей с заряженностью менее 75 %. Плотность электролита 1,24 г/см3. Это вызвано необходимостью:
— Поддерживать работоспособность аккумуляторной батареи.
— Исключить возможность ее размораживания.
— Уменьшить вредное воздействие глубокого разряда при зимней эксплуатации на ресурс аккумулятора, связанное с оплыванием активного вещества в шлам.
Если произошло замерзание электролита и образование льда внутри аккумуляторной батареи, значит она была глубоко разряжена в процессе работы. Ниже допустимого предела по условиям работы. Либо при хранении автомобиля.
На практике необходимо различать случаи, когда лед образуется только в одной банке, а в остальных банках плотность электролита имеет нормальные значения в пределах от 1,26 до 1,30 г/см3.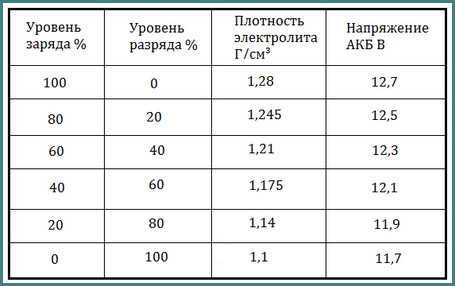 В этом случае лед в банке образовался по причине дефекта производственного характера (короткое замыкание). Такое явление также может иметь место в конце срока службы аккумуляторной батареи. При чрезмерном короблении и «росте» решеток электродов от перегрева и перезаряда.
В этом случае лед в банке образовался по причине дефекта производственного характера (короткое замыкание). Такое явление также может иметь место в конце срока службы аккумуляторной батареи. При чрезмерном короблении и «росте» решеток электродов от перегрева и перезаряда.
Характер дефекта может быть установлен только в результате вскрытия и осмотра конкретной банки. Образование льда в банках на всю глубину практически выводит аккумуляторную батарею из строя.
Что делать с аккумулятором у которого лед в банках.
Аккумуляторную батарею со льдом в банках необходимо снять с автомобиля и осмотреть ее корпус. При наличии трещин на корпусе необходимо принять меры к тому, чтобы после оттаивания электролит, вытекая из корпуса, не причинил вреда лакокрасочному покрытию и металлическим деталям. Если корпус не имеет повреждений — аккумуляторную батарею необходимо занести в теплое помещение для оттаивания и заряда. При заряде плотность электролита может восстановиться до первоначального значения, и аккумулятор может сохранить работоспособность.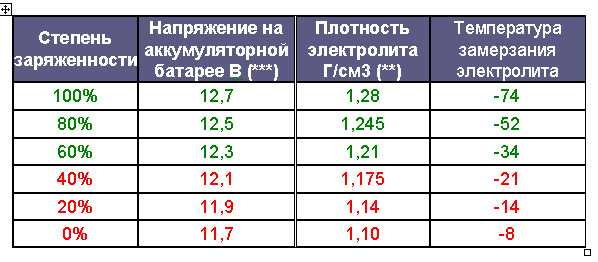
По материалам справочника «Аккумуляторные батареи».
Курзуков Н. И., Ягнятинский В. М.
Статьи о классических внедорожниках УАЗ, ГАЗ, автомобили повышенной проходимости, SUV, кроссоверы, вездеходы, эксплуатация, ремонт, запчасти
Негорючий электролит для сверхвысоковольтных (класс 4,8 В) элементов Li||NCM811 с широким диапазоном температур до 100 °C
Негорючий электролит для сверхвысоковольтных (класс 4,8 В) элементов Li||NCM811 с широким диапазоном температур до 100 °C†
Пэйтао
Сяо, аб Юн
Чжао, с Чжихун
Пяо,
Принадлежности автора
* Соответствующие авторы
и Shenzhen Geim Graphene Center, Шэньчжэньский институт Цинхуа-Беркли и Цинхуа, Шэньчжэньская международная аспирантура, Университет Цинхуа, Шэньчжэнь 518055, КНР
Электронная почта: guangminzhou@sz.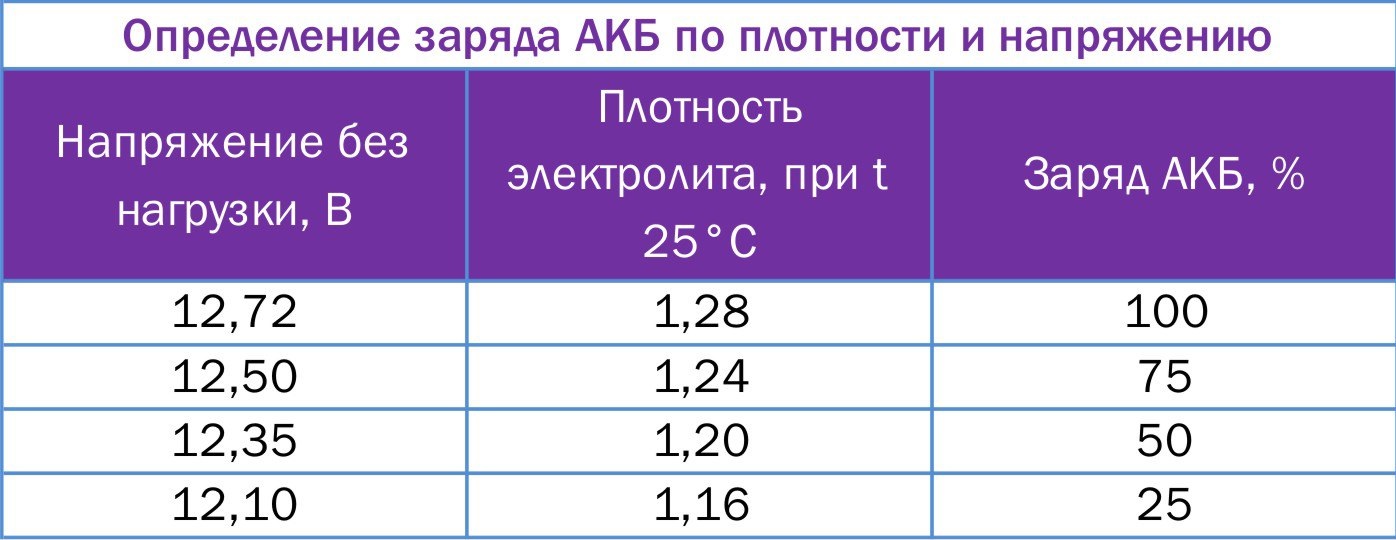
б Колледж аэрокосмической науки и техники, Национальный университет оборонных технологий, Чанша 410073, Китай
с Шэньчжэньская ключевая лаборатория по безопасности силовых аккумуляторов и Шэньчжэньский центр графена Гейма, Международная аспирантура Цинхуа Шэньчжэнь (SIGS), Шэньчжэнь 518055, Китай
д Технологический институт углеродной нейтральности, Шэньчжэньский институт передовых технологий, Китайская академия наук, Шэньчжэнь 518055, КНР
и Шэньянская национальная лаборатория материаловедения, Институт исследования металлов Китайской академии наук, Шэньян 110016, Китай
Аннотация
rsc.org/schema/rscart38″> Разработка сверхвысоковольтных литий-металлических аккумуляторов является одним из наиболее перспективных направлений повышения плотности энергии. Однако коммерческие электролиты на основе этиленкарбоната (ЭК) плохо совместимы как с литий-металлическими анодами, так и с катодами при сверхвысоких напряжениях. Мы сообщаем о стойком к высоким напряжениям электролите (электролите высокого напряжения), полученном фторированием коммерческих растворителей с руководством теоретическими расчетами. Эти разработанные растворители с низкими уровнями энергии самой нижней незанятой молекулярной орбитали (НСМО) могут предпочтительно восстанавливаться на металлическом литиевом аноде, подавляя рост литиевых дендритов из-за образования богатой LiF межфазной фазы твердого электролита (SEI). Фторирование также снижает энергетические уровни самой высокой занятой молекулярной орбитали (ВЗМО), что приводит к улучшению анодной стабильности при сверхвысоких напряжениях. Низкие энергии связи между фторированными растворителями в электролите ВВ и Li + ускоряют десольватацию Li + , что приводит к превосходной электрохимической кинетике. В результате Li || lini 0,8 CO 0,1 MN 0,1 O 2 (NCM811), которые могут работать в широкой эксплуатационной температуре. °C, имеют сохранение емкости 95,1 % после 160 циклов и 85,7 % после 100 циклов при сверхвысоких напряжениях отсечки 4,7 и 4,8 В соответственно. Были сконструированы элементы Li||NCM811 с тонким (50 мкм) литий-металлическим анодом и обедненным электролитом, и их емкость сохранялась на уровне 890,2% после 150 циклов, демонстрируя высокий потенциал при практическом использовании в качестве аккумуляторов с высокой плотностью энергии.
В результате Li || lini 0,8 CO 0,1 MN 0,1 O 2 (NCM811), которые могут работать в широкой эксплуатационной температуре. °C, имеют сохранение емкости 95,1 % после 160 циклов и 85,7 % после 100 циклов при сверхвысоких напряжениях отсечки 4,7 и 4,8 В соответственно. Были сконструированы элементы Li||NCM811 с тонким (50 мкм) литий-металлическим анодом и обедненным электролитом, и их емкость сохранялась на уровне 890,2% после 150 циклов, демонстрируя высокий потенциал при практическом использовании в качестве аккумуляторов с высокой плотностью энергии.Международный журнал химических и физических наук
Вода известна как наиболее полезная, структурно наиболее сложная и аномальная жидкость, известная людям. Он играет важную роль в жизненных процессах и является неотъемлемой частью животных клеток и тканей растений. Две неподеленные пары электронов на атоме кислорода заставляют два связанных атома водорода придавать характерную V-образную форму с валентным углом 104,5 °. Эта полярность дает обширные водородные связи между молекулами воды, которые ответственны за многие аномальные свойства воды.
Две неподеленные пары электронов на атоме кислорода заставляют два связанных атома водорода придавать характерную V-образную форму с валентным углом 104,5 °. Эта полярность дает обширные водородные связи между молекулами воды, которые ответственны за многие аномальные свойства воды.
Некоторыми важными и хорошо известными аномалиями воды являются чрезвычайно высокие температуры плавления (0 °C) и кипения (100 °C). Особенно важным аномальным свойством воды является температура максимальной плотности (TMD) на уровне 3,98 °C. Томас Чарльз Хоуп1 — первый ученый, зафиксировавший TMD воды в 1805 году, измерив характер конвекции воды в сборке из цилиндра, снабженного двумя термометрами и металлическим резервуаром, который известен как прибор Хоупа . Существование TMD чистой воды было подтверждено серией экспериментов Хоупа, основанных на наблюдении за температурной инверсией из-за естественной конвекции, а не объемных изменений объема воды.
Сопоставимые вещества, такие как Nh4, Ch5, HF и h3S, ведут себя иначе, чем вода.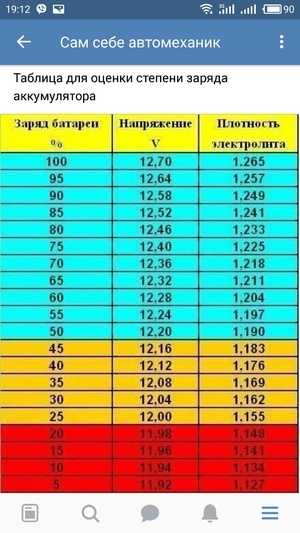 Вода проявляет характерные свойства ассоциированной жидкости более заметные, чем гидриды элементов группы VIA. Температуры плавления и кипения этих гидридов упорядоченно уменьшаются с уменьшением молекулярной массы от h3Te, h3Se до h3S, однако вода имеет удивительно высокие значения, указывающие на наличие сильного взаимодействия, известного как водородная связь. Из-за этого вода существует в виде мономеров, димеров, полимеров, клеточных кластеров и многих сложных структур, но полости в структуре приводят к более низкой плотности.
Вода проявляет характерные свойства ассоциированной жидкости более заметные, чем гидриды элементов группы VIA. Температуры плавления и кипения этих гидридов упорядоченно уменьшаются с уменьшением молекулярной массы от h3Te, h3Se до h3S, однако вода имеет удивительно высокие значения, указывающие на наличие сильного взаимодействия, известного как водородная связь. Из-за этого вода существует в виде мономеров, димеров, полимеров, клеточных кластеров и многих сложных структур, но полости в структуре приводят к более низкой плотности.
Conway2 определил концепцию Структура в жидкой воде следующим образом: Способность растворенных веществ создавать/разрушать структуру воды может быть определена с точки зрения влияния на время молекулярной переориентации (10-11 с), в результате чего либо от вращательной или поступательной диффузии. Если растворенное вещество заметно удлиняет этот период, его называют структурообразователем/промотором. И наоборот, если растворенное вещество сокращает этот период, это называется разрушением структуры.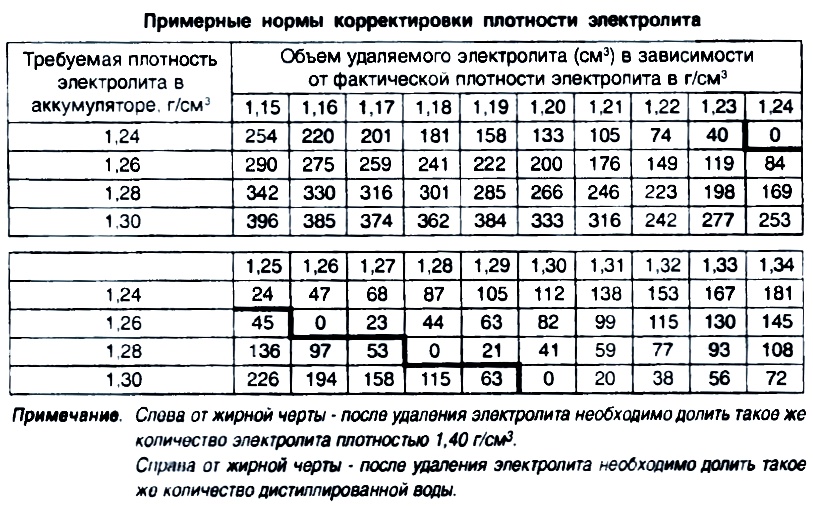
При температуре 3,98 °C вода достигает максимальной плотности из-за разрыва сети водородных связей, что позволяет разрыхленным молекулам воды заполнять пустоты в открытой структуре, что приводит к сокращению объема и увеличению плотности. Таким образом, TMD регулируется критическим равновесием между мономерами или димерами и молекулами воды, связанными водородными связями. При растворении растворенного вещества в воде вышеуказанное равновесие нарушается. Если растворенное вещество усиливает водородные связи (например, t-BuOH), то TMD увеличивается, а если растворенное вещество имеет тенденцию разрушать водородные связи (например, большинство электролитов), то TMD уменьшается.
Видимый прямолинейный график смещения TMD (Dqobs) в зависимости от «m» называется правилом Деспреца3, уравнение (1).
Dqobs = m. км или Dqobs = x. KD … (1)
Константы Km (oC/моль/кг)4-6 или KD (oC)7, известные как константа Деспреца, являются характерными для электролитов. «m» и «x» — моляльность и молярная доля растворенного вещества соответственно.
«m» и «x» — моляльность и молярная доля растворенного вещества соответственно.
Rosetti8,9 проанализировал ранние работы по сдвигу TMD воды путем добавления растворенного вещества для нескольких простых солей. Значительная часть этой работы принадлежит Despretz3. Большая часть ранних работ по TMD водных растворов проводилась с использованием методов измерения плотности при более высоких концентрациях.
Далее, Розетти8,9 пытался связать сдвиг ТМД воды с понижением температуры ее замерзания за счет добавления того же растворенного вещества, но ему не удалось сформулировать какой-либо общей закономерности между этими двумя явлениями, так как понижение температура замерзания связана с осмотическим давлением раствора и, таким образом, зависит только от концентрации. Однако сдвиг TMD характерен для растворенного вещества, т.е. его взаимодействия с Н-связью и концентрацией растворенного вещества.
Райт10 изучал снижение TMD воды для некоторых солей. Его выводы удовлетворительно согласуются с законом Депреца. Далее он обнаружил, что высокоионизированные соли органических кислот ведут себя нормально, как сильные электролиты и минеральные кислоты. Coppet4 и Wright10 измерили сдвиг TMD только при 2–3 концентрациях, которых было недостаточно для надежной оценки константы Деспреца. Тем не менее, данные TMD более поздних исследователей для некоторых электролитов при концентрациях 6–7 приведены в Международных критических таблицах11, которые были использованы Pokale12 для графического расчета константы Деспреца с использованием метода наименьших квадратов. Он заметил, что значения Km для простых электролитов всегда отрицательны. Из этих данных также видно сильное влияние валентности и размера иона.
Далее он обнаружил, что высокоионизированные соли органических кислот ведут себя нормально, как сильные электролиты и минеральные кислоты. Coppet4 и Wright10 измерили сдвиг TMD только при 2–3 концентрациях, которых было недостаточно для надежной оценки константы Деспреца. Тем не менее, данные TMD более поздних исследователей для некоторых электролитов при концентрациях 6–7 приведены в Международных критических таблицах11, которые были использованы Pokale12 для графического расчета константы Деспреца с использованием метода наименьших квадратов. Он заметил, что значения Km для простых электролитов всегда отрицательны. Из этих данных также видно сильное влияние валентности и размера иона.
Bernal & Fowler13 продемонстрировали применимость принципа аддитивности к парциальным молярным объемам (V ) электролитов при бесконечном разбавлении. Вирт24 разделил V электролитов на их ионные компоненты, предполагая, что V = V, учитывая, что радиусы кристаллов K+ и F- почти одинаковы. Эта аддитивность парциального молярного объема электролитов при бесконечном разведении в воде также была адекватно продемонстрирована рядом исследователей (Bernal & Fowler13, Horne15, Millero16, Scoot17, Desnoyers et al18, Couture & Laidler19). ). Было обнаружено, что это правило аддитивности распространяется до умеренных концентраций, при которых ионное спаривание невелико.
). Было обнаружено, что это правило аддитивности распространяется до умеренных концентраций, при которых ионное спаривание невелико.
Многие другие электролитические свойства, такие как коэффициент вязкости B, ионные радиусы, проводимость и т. д., также подчиняются правилу аддитивности. Каминский20 показал аддитивность коэффициентов вязкости В для водных растворов электролитов при различных температурах. Он предположил, что BK+ = BCl-, основываясь на почти одинаковых числах переноса катионов и анионов для KCl при всех температурах, и рассчитал ионные B-значения для нескольких ионов, которые хорошо согласовывались с данными, полученными другими исследователями.
Применимость правила аддитивности к поведению TMD сильных электролитов наблюдалась Райтом10 с использованием данных TMD Coppet4, Wada & Miura7, Rosetti8,9. Coppet4, Wada & Miura7, Rosetti8,9 также продемонстрировали справедливость правила аддитивности для поведения TMD некоторых галогенидов щелочных металлов, используя данные TMD, представленные в литературе. (ИКТ11).
(ИКТ11).
Lilley & Murphy5, вывели уравнение (2) выражая ∂V /∂T через постоянную Деспреца Km, как указано ниже:
– ∂V /∂T = Km / 64,1 (2)
Где V обозначает парциальный молярный объем электролита при бесконечном разбавлении.
Видно хорошее соответствие между значениями Km, полученными из измерений плотности с использованием уравнения. (2) со значениями Km, полученными при измерении TMD (Wright10 и ICT11). Однако данные, используемые для измерений TMD и плотности, имеют высокую концентрацию, что не может дать надежных значений. Следовательно, значения Km, сообщаемые ими, необходимо изменить с использованием измерений TMD и плотности при достаточно низких концентрациях, где теория Дебая – Хюккеля для взаимодействия ионов с водой будет справедливой.
[1]. TC Hope, Trans. Королевский соц. Эдинбург, 9 , 5 , 1805, 379-405.
[2]. BE Conway, Ионная гидратация в химии и биофизике, Elsevier Sc.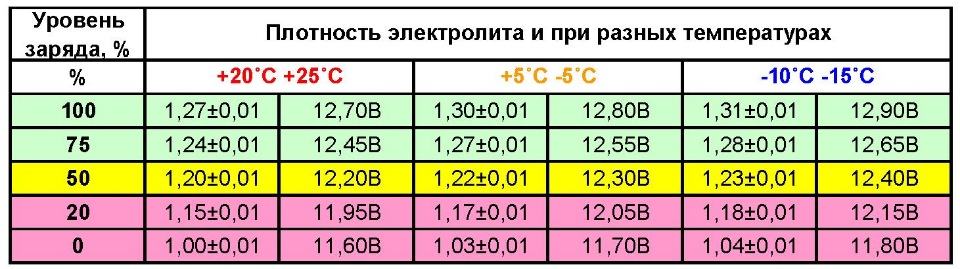 Издательская компания 12 , 1981
Издательская компания 12 , 1981
[3].M. К. Депрец, Ann. Чим. физ. , 70, 1839, 49; 73, 1840, 296.
[4]. Коппет Энн. Чим. Phys ., 1894, 246; 1899, 1559; 1900, 178; 1901, 1218.
[5]. Т. Х. Лилли и С. Мерфи J Хим. Термодинамика 5 , 1973, 467.
[6]. Т. Вакабаяши и К. Такайзуми, Bull. хим. соц. Япония. 55 , 1982, 3072.
[7]. Г. Вада и М. Миура, Bull. хим. соц. Япония. 42 , 1969, 2498.
[8]. MF Rosetti, Annales de Chimie et de Physique , 10 , 1867, 461-473.
[9]. М.Ф. Розетти, Annales de Chimie et de Physique , 17 , 1869, 370-384.
[10]. Р. Райт, J Chem. соц. 115 ,1919,119
[11]. Международные критические таблицы числовых данных, физики, химии и технологии, Национальный исследовательский совет
, III , 1928, 107-111.
[12]. В. К. Покале, доктор философии Диссертация, Нагпурский университет, Индия, 1991.
[13]. J.D.Bernal & R.H.Fowler, J Chem Phys, 1 , 1933, 515
[14]. HE Wirth, J Marine Res. , 3 , 1940, 230
[15]. Р. А. Хорн, Вода и водные растворы, Wiley Inter Sc. Нью-Йорк 1971
[16]. FJ Millero, Chem. , 71 , 1971, 147
[17]. AF Scoot, J Phys. хим. 35 , 1931, 2315, 3379
[18]. Дж. Э. Деснойерс, М. Arel, G. Perron & C. Joliceur, J Phys. хим. 73 , 1969, 3346
[19]. A.M.Couture & K.J.Laidler, Can J Chem. 34 , 1956, 1209
[20]. М. Каминский, Дис. Фарадей Сок. 24 , 1957, 171
[21]. K. Nakanishi, N. Kato, Maruyama, J. Phys Chem , 71 , 1967, 814
[22]. G. Wada, S. Umeda, Bull Chem Soc Jpn , 35 , 1962, 646
[23].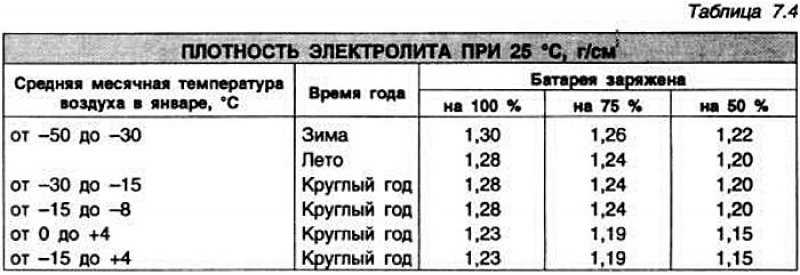 G. Wada, S. Umeda, Bull Chem Soc Jpn , 35 , 1962, 1797
G. Wada, S. Umeda, Bull Chem Soc Jpn , 35 , 1962, 1797
[24]. Ф. Франкс, Б. Уотсон, Trans Faraday Soc , 63 , 1967, 329
[25]. AJ Darnel, J Greyson, J Phys Chem , 72 , 1968, 3021, 3032
[26]. D.D.Macdonald, M.D.Smith, J.B.Hyne, Can J Chem , 49 , 1971, 2817
[27]. M.V.Kaulgud, WK Pokale, J. Chem Soc Faraday Trans , 91(6), 1995, 999
[28]. Г. А. Боттомли, Л. Г. Глоссоп, В. П. Стонтон, , Австралия. J. Chem, 32, 1979, 699
[29]. M.V.Kaulgud, V.S.Bhagde, S.S.Dhondge, Ind. J Chem. 24А, 1985, 373-378
[30]. JL Kavanan, Water & Solute Water Interactions, Holdenday Inc., Сан-Франциско, Калифорния, 1964
[31]. Дж. Грейсон, J Phys. хим. 71 , 1967, 2210
[32]. Дж. Р. Купперс, J Phy. хим. 78 , 1974, 1041; 79 , 1975, 2105
[33].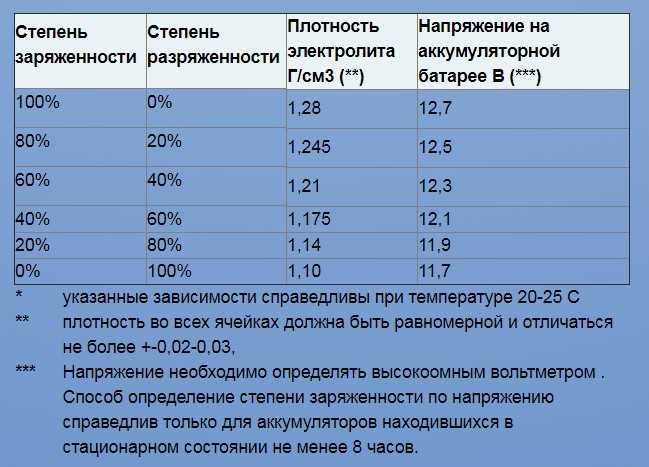 Р. А. Робинсон и Р. Х. Стоукс, Электролитные растворы, Баттерворт, Лондон, 2ndedn, 19.59
Р. А. Робинсон и Р. Х. Стоукс, Электролитные растворы, Баттерворт, Лондон, 2ndedn, 19.59
[34]. R. Zana and E. Yeager, 90–130 J Phys. хим. , 71, 1967, 52
[35]. Э. Дж. Кинг, J Phys. Хим , 74, 1970, 4590
[36]. Г. Вада, Э. Нагао, Н. Кавамура и К. Кинумото, Bull. хим. соц. яп. 51 , 1978, 1937
[37]. FJ Millero, J. Phys. Chem., 72 , 1968, 4589
[38]. J. V. Leyendekkers, J. Chem. Soc., Faraday Trans. 1, 76 , 1980, 1206
[39]. J.V.Leyendekkers, J. Chem. Soc., Faraday Trans. 1 , 77 , 1981 , 1529
[40]. J.V.Leyendekkers, J. Chem. Soc., Faraday Trans. 1 , 78 , 1982, 357
[41]. J.V.Leyendekkers, J. Chem. Soc., Faraday Trans. 1 , 78 , 1982, 3383
[42]. J.V.Leyendekkers, J. Chem. Soc., Faraday Trans. 1 , 79, 1983, 1109
J.V.Leyendekkers, J. Chem. Soc., Faraday Trans. 1 , 79, 1983, 1109
[43]. J.V.Leyendekkers, J. Chem. Soc., Faraday Trans. 1 , 79 , 1983, 1123
[44]. BE Conway & RE Verral, J Phys. Chem, 70 , 1966, 3952
[45]. J. Padova & I. Abrahamer, J Phys. Chem, 70 , 1966, 3961
[46]. F. Franks & HT Smith, Trans Faraday Soc. 63 , 1967, 2586
[47]. Дж. Э. Деснойерс и М. Арел, Кан. Дж. Хим. 45 , 1967, 359
[48]. Ф. Дж. Миллеро и В. Дрост-Хансен, J Phy. Химия . 72 , 1968, 1758
[49]. И. Ли и Дж. Б. Хайн, 90 130, Кан. J Chem . 46 , 1968, 2333
[50]. R.L.Kay, T.Vituccio, C.Zawoyski&D.F.Evans, J Phy. Chem, 70 , 1966, 2366.
[51]. Д. Ф. Эванс, Г. П. Каннингем и Р. Л. Кей, J Phy Chem , 70 , 1966, 2974.
Л. Кей, J Phy Chem , 70 , 1966, 2974.
[52]. R. A. Horne & R. P. Young, J Phy Chem , 72 , 1968, 1763.
[53]. R. H. Wood, H. L. Anderson, J. D. Beck, J. R. France, W. R. De Vry & L. J. Soltzberg, J Phy Chem ,
71 , 1967, 2149
[54]. F. Franks & D.L. Clarke, J Phy Chem, 71 , 1967, 1155
[55]. HE Worth & A.L. Surdo, J Phy Chem, 72 , 1968, 751
[56]. K.W.Bunzl, J Phy Chem, 71 , 1967, 1358
[57]. H. E. Worth J Phy Chem, 71 , 1967, 2922
[58]. P.R.Daneai, F.Orlandini&G.Scibona, J InorgNucl Chem , 30 , 1968, 2513
[59]. Т. С. Шарма, Р. К. Моханти и Дж. К. Ахлувалия, Trans. Фарадей Сок. 65 , 1969, 2333
[60]. JD Worley & I.M. Klotz, J Chem Phys., 45, 1966, 2868
[61]. И. М. Клотц, Федеральная прокуратура. , 24 , 1965, с 24
И. М. Клотц, Федеральная прокуратура. , 24 , 1965, с 24
[62]. M. M. MarciaqRousselot, A. Trobriand & M. Lucas, J Phy Chem , 76 , 1972, 1455
[63]. G.P.Kreishman & L.Leifer, J Sol Chem , 7 , 1978, 239
[64]. G. Perron, N.Desrosier & J.E.Desnoyers, Can J Chem, 54 , 1976, 2163
[65]. К. Такайзуми, Т. Вакабаяси, Bull Chem Soc Jpn , 55 , 1982, 2239
[66]. S. Subramanian & J. C. Ahluwalia, J Phy Chem , 72 , 1968, 2525.
[67]. Т. С. Шарма и Дж. К. Ахлувалия, J Phy Chem , 74 , 1970, 3547
[68]. А. М. Дешпанде, к.т.н. Диссертация, Нагпурский университет, 1997
[69]. А. М. Дешпанде, В. К. Покале, А. В. Покале , J Res & Dev Multidis Int Ref, 2020, 389-395
[70]. Справочник по химии и физике, Химическая резина Co .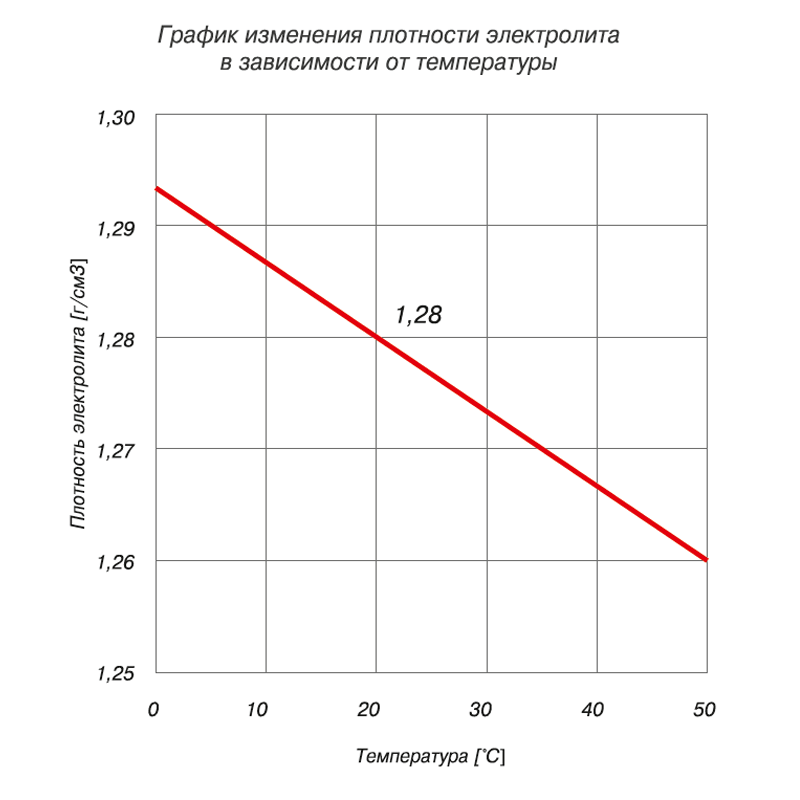 Кливленд, Огайо, 1968, , 48-е изд. .
Кливленд, Огайо, 1968, , 48-е изд. .
[71]. M.V.Kaulgud, K.S.M.Rao, Indian J Chem , 27A , 1988, 12-17
[72]. В. С. Бхагаде – кандидат философских наук. Диссертация, Нагпурский университет, 1984
[73]. MV Kaulgud, GH Pandya, Indian J Chem , 14A , 1976, 91-93
[74]. SeigfriedLindenbaum, J Chem Thermodyn, 3 , 1971, 625-629
[75]. К. А. (младший) Хартман, 9 лет0130 J Phys Chem , 70 , 1960, 270
[76]. Diamond, J Phys Chem , 67 , 1963, 2513
[77]. J. C. Ahluwalia, B. Chawala, J Soln Chem , 6 , 1975, 383
[78]. G. Wada, S. Umeda, Bull ChemSocJpn , 42 , 1969, 2498
[79]. G. M. Watson & Felsing, J Am Chem Soc , 63 , 1941, 410
[80]. М. В. Каулгуд, А. Шривастава и М. Р. Аводе, Indian J Chem , 29 A , 1990, 439-444
[81]. M. Tariq, JMSS Esperança, MRC Soromenho, LPN Rebelo & JN Canongia Lopes,
M. Tariq, JMSS Esperança, MRC Soromenho, LPN Rebelo & JN Canongia Lopes,
Royal Society of Chemistry, J. Phys. хим. хим. физ. , 15 , 2013, 10960-10970
[82] S. Thirumran & P Inbam, Ind J Pure & App Phy, 49 , 2011, 451-459,
[83]. , Salgado & L. Romani?, J of Chemical &Engg Data , 2019
[84]. К. Р. Фостер и Э. Д. Финч Дж. физ. Chem., 78 (22) ,1974 , 2305–2306
[85]. М.Ф. Коули, Д. МакГлинн, П.А. Mooney, International Journal of Heat and Mass Transfer, 49 , 2006, 1763–1772
[86]. Джерард Коттер, доктор философии. Диссертация, Национальный университет Ирландии, округ Мейнут, Килдэр, 23 сентября 2010 г.
[87]. А. Брэдшоу, К.Е. Шлейхер, Deep-Sea Res. , 17 , 1970, 691-706.
[88]. C.T.Chen, F.J Millero, Deep-Sea Res ., 23 , 1976, 595-612.
