Уровень электролита в автомобильном аккумуляторе, сила тока, мощность и иные характеристики АКБ
20.04.2023 2 404 0 Аккумуляторная батарея
Автор: Виктор
Уровень электролита в автомобильном аккумуляторе является одним из основных параметров, которые влияют на функциональность батареи в целом. Помимо него, существуют и другие параметры, о которых должен знать каждый автовладелец. Именно о них мы расскажем в этой статье.
Содержание
- 1
Разновидности батарей
- 2
Что нужно знать о характеристиках АКБ?
- 2.1
Вес
- 2.2
Сила тока
- 2.3
Емкость
- 2.4
Фотогалерея «Готовим электролит»
- 2.5
Напряжение
- 2.1
- 3
Как поменять электролит в АКБ: возможно ли это?
- 4
Видео «Как правильно произвести замер электролита в банках АКБ?»
Открытьполное содержание
[ Скрыть]
Разновидности батарей
Какие выдвигаются технические требования к аккумуляторным батареям, какими должны быть сила тока, сопротивление и плотность АКБ, как узнать и проверить эти параметры?
Прежде чем ознакомить вас с основными техническими особенностями, разберем типы АКБ:
- Сухозаряженные устройства, отличительной их характеристикой является отсутствие рабочей жидкости, то есть раствора электролита в банках.
 Достоинством такого типа батарей считается возможность их хранения на протяжении длительного времени. В данном случае долгое хранение батареи на складе или в гараже после покупки не повлияет на их функциональность. Но перед тем, как начать полноценно использовать АКБ, его нужно будет заправить электролитом.
Достоинством такого типа батарей считается возможность их хранения на протяжении длительного времени. В данном случае долгое хранение батареи на складе или в гараже после покупки не повлияет на их функциональность. Но перед тем, как начать полноценно использовать АКБ, его нужно будет заправить электролитом. - Заряженные АКБ, которые изначально поставляются заполненными электролитом. Эта разновидность АКБ не нуждается в подготовке перед использованием, поскольку такие устройства изначально поставляются в рабочем состоянии. Но прежде чем установить такую батарею на свое авто, нужно удостовериться в том, что в ней имеется необходимый объем жидкости.
Что нужно знать о характеристиках АКБ?
Теперь перейдем к вопросу технических характеристик. Можно ли приготовить электролит для АКБ своего автомобиля, сколько нужно его заливать, чем чреваты утечки жидкости и сколько АКБ должна выдавать вольт? Ознакомьтесь с основными характеристиками.
Вес
Масса устройства, а также его размеры — это один из параметров изделия.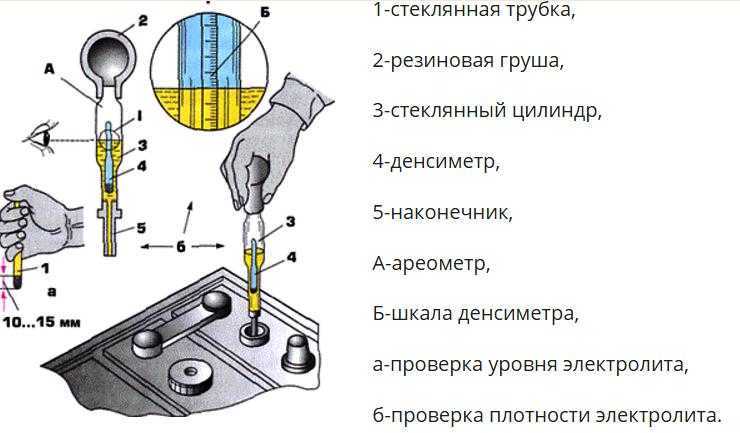 Необходимо учитывать, что вес устройства — это неточный параметр, он может быть разными в зависимости от модели и производителя. Что касается размеров, то они могут отличаться в зависимости от конкретного транспортного средства, но в целом изделия имеют похожие габариты.
Необходимо учитывать, что вес устройства — это неточный параметр, он может быть разными в зависимости от модели и производителя. Что касается размеров, то они могут отличаться в зависимости от конкретного транспортного средства, но в целом изделия имеют похожие габариты.
Вес также может быть разным, в данном случае все зависит от степени разрушения внутренних пластин, выполненных из свинца. Обычно это происходит в результате длительной эксплуатации изделий, в результате разрушения свинец начнет взаимодействовать с рабочим раствором. Поэтому в принципе, небольшое расхождение характерно для многих аккумуляторов, в данном случае допускается разница около 0.5 кг по сравнению с нормой.
Сила тока
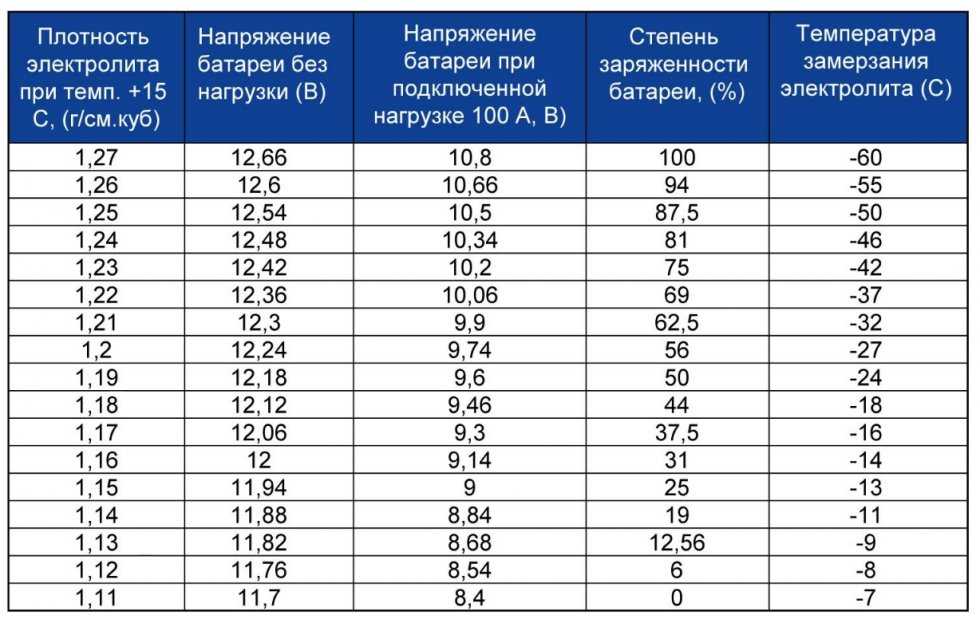
Такой параметр, как сила тока, считается более важным для изделия, поэтому на данную характеристику следует смотреть в первую очередь при покупке изделия. Параметр силы тока замеряется при температуре окружающей среды 18 градусов мороза и должен соответствовать тому значению, которое указано на корпусе батареи или в технической документации.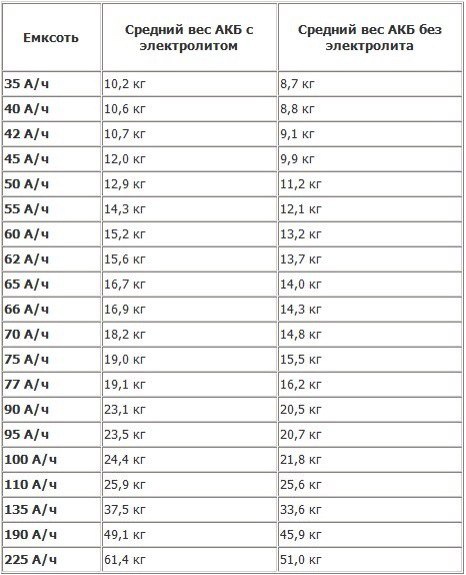 В том случае, если батарея является полностью заряженной, то она должна выдавать не менее 125 ампер. Чтобы точно удостовериться в том, что аккумулятор, установленный на вашем авто, соответствует нормированным параметрам, необходимо произвести измерение.
В том случае, если батарея является полностью заряженной, то она должна выдавать не менее 125 ампер. Чтобы точно удостовериться в том, что аккумулятор, установленный на вашем авто, соответствует нормированным параметрам, необходимо произвести измерение.
- В первую очередь следует выключить все потребители напряжения в авто, в частности, печку, оптику, акустику, регистратор и GPS-навигатор, если они имеются, а также прочее оборудование.
- Затем открывается капот авто и отсоединяется клемма с батареи. При помощи тестера следует произвести замер параметра прохождения тока по электросети, для этого установите контакты тестера между щупом и клеммой.
- Минимальное значение прохождения тока должно быть около 15 мА, максимальное — 70 мА.Если диагностика показала, что полученные показания несильно отличаются, к примеру, на 0.02-0.05 А, это, в принципе, неплохо, такая утечка считается незначительной.
 Но если значения, которые вы получили, сильно отличаются от номинальных, то скорей всего, в изделии происходит сильная утечка. Соответственно, автовладелец должен проверить батарею на предмет выявления утечки.
Но если значения, которые вы получили, сильно отличаются от номинальных, то скорей всего, в изделии происходит сильная утечка. Соответственно, автовладелец должен проверить батарею на предмет выявления утечки. - Если утечка была выявлена, то вам нужно будет по очереди извлечь каждое реле и предохранитель из монтажного блока, при этом следя за значениями на дисплее тестера. В том случае, если после извлечения очередного предохранительного элемента вы заметили, что показания на дисплее тестера уменьшились до оптимальных, это говорит о том, что вы обнаружили утечку. Теперь вам остается только произвести прозвонку электроцепи и определить место обрыва, после чего произвести замену поврежденного провода.
Емкость
Емкость изделия измеряется в ампер часах и также считается одним из основных параметров, данное значение указывает на длительность работы аккумулятора или объем тока, который он может отдать. Необходимо учитывать, что емкость батареи определяется многими факторами, а именно, конструктивными характеристиками, температурой окружающей среды, силе тока заряда, а также уровнем рабочей жидкости.
В том случае, если в ходе диагностики вы зафиксировали снижение объема раствора электролита в банках АКБ, то должны учитывать, что это может привести к снижению емкости и разряду устройства. Поэтому для того, чтобы не допустить быстрого разряда батареи и повысить ее мощность, в банки конструкции надо будет долить электролитический раствор. Но перед этим его надо будет правильно приготовить. Многие автовладельцы поступают проще — они просто заливают в банке обычную дистиллированную воду. В принципе, это правильно, но не совсем, поскольку электролитический раствор должен содержать в своем составе и серную кислоту.
Электролит можно купить уже готовый, а можно и приготовить в гаражных условиях!
Чтобы приготовить жидкость своими руками, выполните следующие действия:
- Для начала следует подготовить емкость, в которой будет делаться раствор.
 Учтите, что подготовленный резервуар должен быть не только чистым, но и кислотоустойчивым.
Учтите, что подготовленный резервуар должен быть не только чистым, но и кислотоустойчивым. - Далее, налейте в резервуар дистиллированную воду.
- Сделав это, осторожно, небольшой струйкой в дистиллят следует добавить серную кислоту, параллельно перемешивая ее с водой. Используйте перчатки, чтобы не допустить попадания серной кислоты на кожу, а чтобы смешать раствор, используйте стеклянную палочку. Серная кислота должна добавляться в дистиллят минимальными порциями, при этом ее необходимо размешать как можно более равномерно.
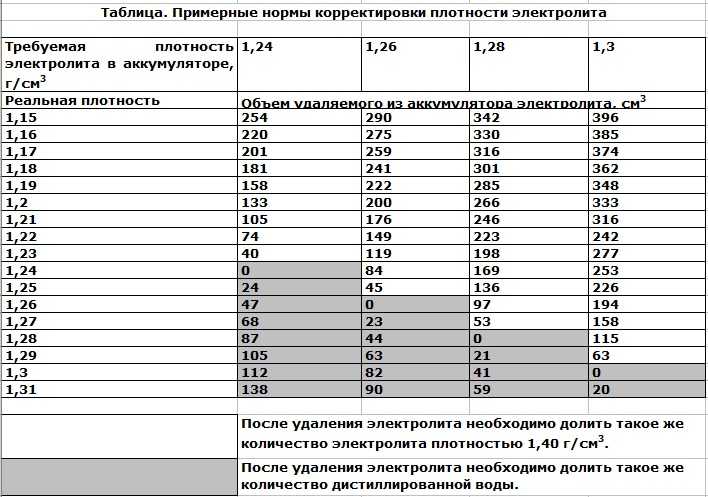
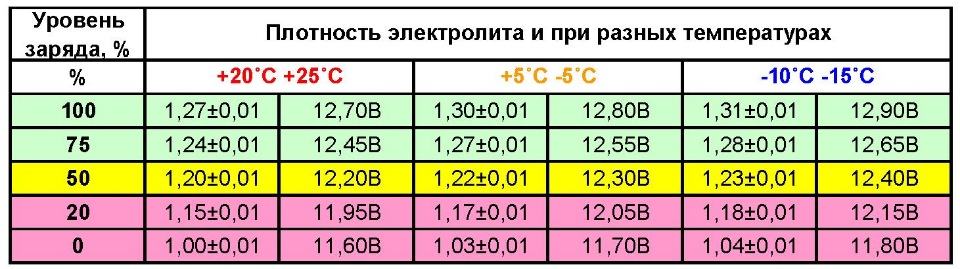
- При добавлении серной кислоты и перемешивании ее с водой регулярно проверяйте плотность получаемого раствора, для измерения плотности используется ареометр. Помните о том, что значение плотности раствора может быть разным, в данном случае многое зависит от условий использования АКБ, а также температуры окружающей среды. Как правило, значение плотности должно быть около 1.21-1.31 г/см3.
Фотогалерея «Готовим электролит»
- 1.
 Залейте дистиллят в емкость.
Залейте дистиллят в емкость.
- 2. Добавьте серную кислоту.
- 3. Проверьте плотность.
- 4. Залейте электролит в АКБ.
Напряжение
Один из самых важных параметров батареи — это напряжение устройства. С учетом напряжения автовладелец также может определить и возможные неисправности в работе изделия. Естественно, если уровень напряжения и мощности будут соответствовать норме, это может свидетельствовать о нормальной работе аккумулятора. Если изделие будет полностью работоспособным, оно будет выдавать напряжение до 12.6 вольт, допустимым вариантом является значение в районе 12.2 вольт.
Каждая отдельная банка изделия при это должна выдавать около 2-2.1 вольт, этот показатель считается нормированным. Значение напряжения определяет возможность подключения к бортовой сети различных потребителей энергии, в частности, зарядных устройств для телефонов, видеорегистраторов, навигаторов и т.д. Чем больше аккумулятор садиться, тем ниже будет напряжение на его клеммах (автор видео о самостоятельной диагностике автомобильного аккумулятора — канал Советы автолюбителю).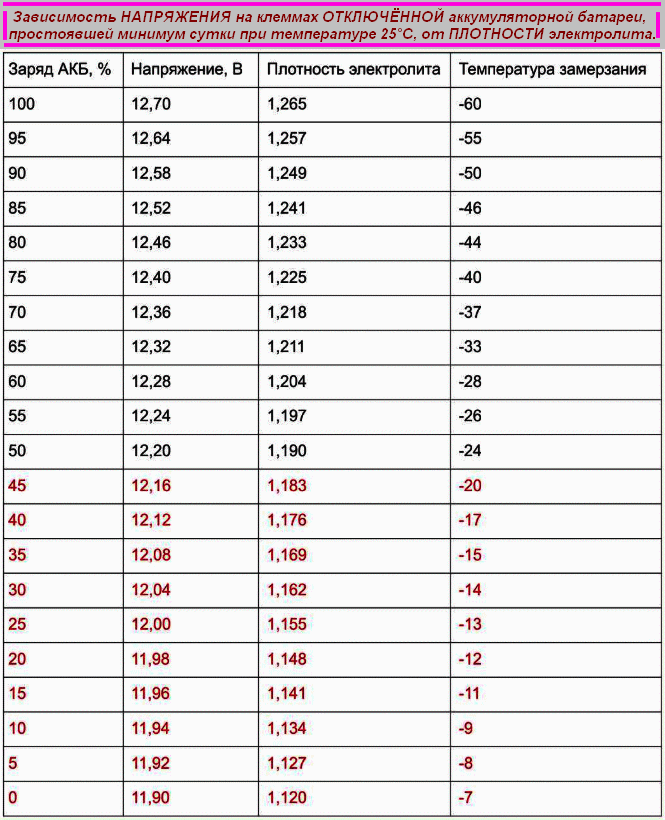
Как поменять электролит в АКБ: возможно ли это?
О том, как изготовить электролит, мы уже рассказали, а теперь поговорим о том, как заменить раствор своими руками. Сразу же скажем, замена электролита — это крайняя мера, на которую нужно идти в исключительных случаях.
Процедура замены выполняется следующим образом:
- Сначала необходимо отключить изделие от клемм, после чего демонтировать его, сняв крепление и поставить на ровную поверхность.
- Если есть защитная полоска, то ее нужно снять, если нет, то сразу выкручивайте пробки.
- Далее, необходимо избавиться от старого электролита, для этого используйте резиновую грушу. Не спеша высосите весь электролит. Если раствор случайно попал на руки, промойте воду с мылом.
- Когда жидкость будет высосана, банки необходимо будет промыть дистиллятом, это позволит удалить остатки старого раствора.

- Далее, необходимо просушить банки.
- После этого производится заправка изделия новым электролитом. В процессе добавления необходимо контролировать плотность жидкости, как сказано выше, это делается с помощью ареометра. Раствор заливается по уровню пластиковых фишек в банках.
- Когда эти действия будут выполнены, нужно произвести заряд аккумулятора. Для этого лучше всего использовать пуско-зарядный прибор, процедура восстановления плотности осуществляется путем повторения нескольких циклов зарядки и разрядки. Учтите, что при этом параметр силы тока должен составлять около 0.1 ампера. Процедуру зарядки можно считать завершенной тогда, когда напряжение в каждой секции будет составлять около 2.4 вольт. Либо же общее напряжение АКБ на выводах составит примерно 14 вольт.
Загрузка …
Видео «Как правильно произвести замер электролита в банках АКБ?»
Наглядная инструкция на тему измерения значения электролита в секциях автомобильного аккумулятора с описанием основных нюансов и особенностей этого процесса приведена в ролике ниже (автор видео — Виктор Мошковский).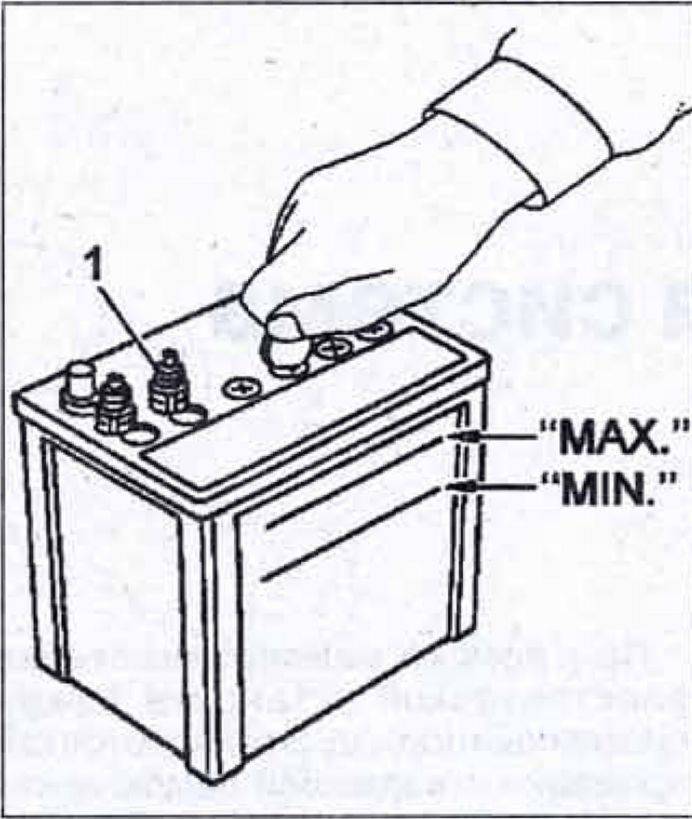
У Вас остались вопросы? Специалисты и читатели сайта AVTOKLEMA помогут вам, задать вопрос
Поддержите проект — поделитесь ссылкой, спасибо!
Оценить пользу статьи:
Загрузка…
Обсудить статью: 0
2023 год
Подготовка аккумуляторных батарей КАмаЗа к работе
Категория:
Ремонт автомобилей КАмаЗ
Публикация:
Подготовка аккумуляторных батарей КАмаЗа к работе
Читать далее:
Зарядка аккумуляторных батарей КАмаЗ
Подготовка аккумуляторных батарей КАмаЗа к работе
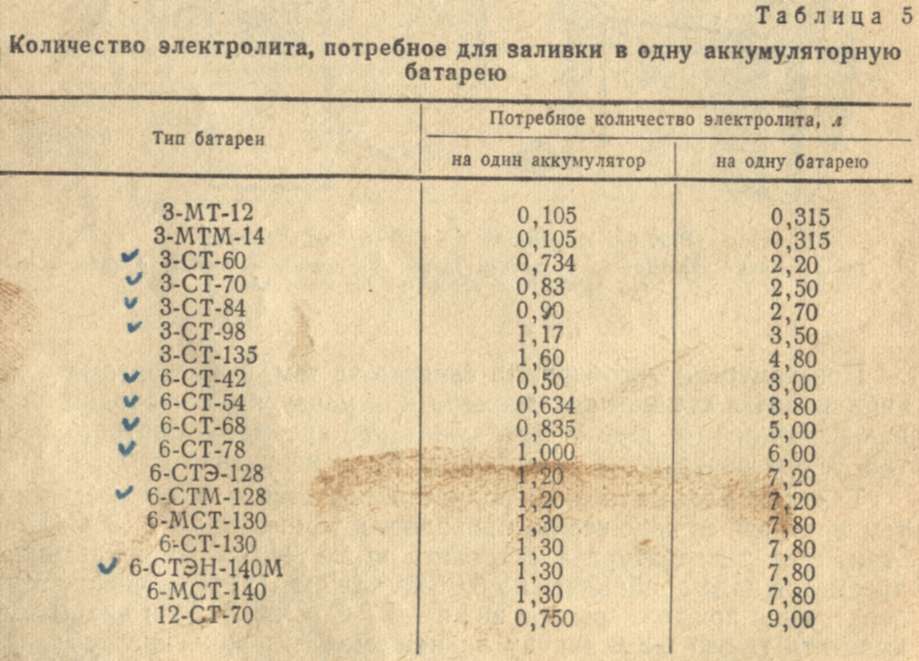
После сборки аккумуляторные батареи подготавливают к работе. Подготовка аккумуляторных батарей к работе после ремонта заключается в приготовлении электролита, заправке его в батареи аккумулятора и зарядке.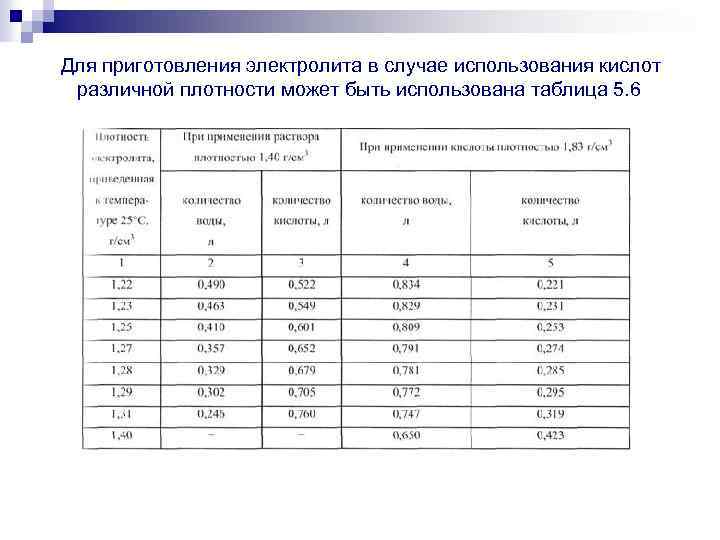
Электролит требуемой плотности для эксплуатации автомобилей в различных районах с разным температурным диапазоном приготавливают непосредственно из химически чистой серной кислоты плотностью 1,83—1,84 г/см3. Учитывая сильный разогрев раствора (до 80 °С и выше), более удобно готовить электролит требуемой плотности из заранее приготовленного раствора серной кислоты плотностью 1,40 г/см3 при 15 °С.
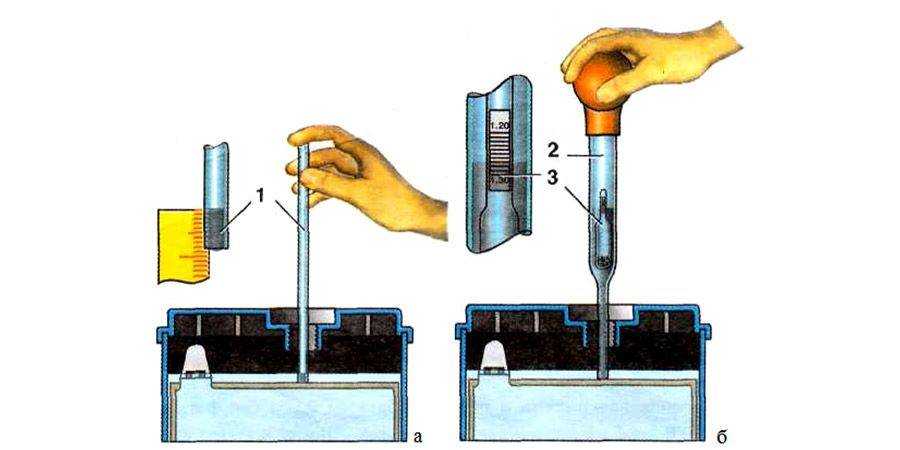
Плотность электролита проверяют кислотомером, как показано на рис. 88. Резиновую группу кислотомера сжимают, его наконечник опускают в заливное отверстие аккумулятора. При разжимании во внутреннюю полость стеклянного цилиндра набирается необходимое количество электролита, до всплытия ареометра, и по делениям на его трубке определяют плотность электролита.
Рекламные предложения на основе ваших интересов:
Дополнительные материалы по теме:
Плотность электролита зависит от температуры, поэтому перед измерением плотности следует предварительно измерить его температуру. Для того чтобы получить сопоставимые результаты во всех расчетах, плотность электролита- принято приводить к температуре 15 °С.
Для того чтобы получить сопоставимые результаты во всех расчетах, плотность электролита- принято приводить к температуре 15 °С.
Температура электролита, заливаемого в аккумуляторы, должна быть не выше 25 °С в условиях умеренного климата и не выше 30 °С в районах с жарким климатом.
Порядок заливки электролита следующий; выворачиваются пробки из заливных горловин и электролит заливается до тех пор, пока поверхность его не коснется нижнего торца тубуса заливной горловины.
Не ранее чем через 20 мин и не позднее чем через 2 ч после заливки электролита проверяют его плотность и уровень.
Уровень электролита проверяется, как показано на рис. 2.
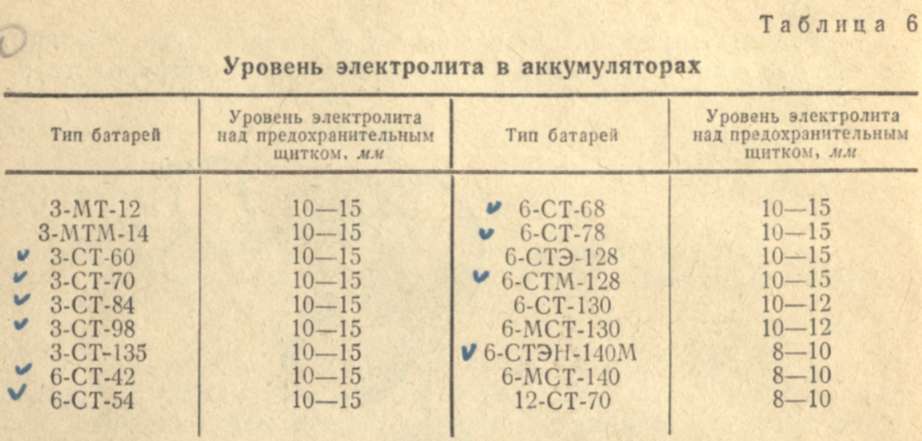
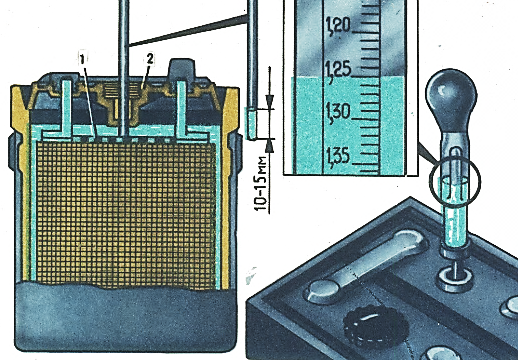
Электролит должен касаться нижнего торца тубуса заливной горловины. Уровень электролита можно проверить с помощью стеклянной трубки диаметром 5—6 мм. Для этого надо опустить трубку в заливную горловину аккумулятора до упора в предохранительную сетку, закрыть верхний конец трубки большим пальцем, затем вынуть ее и определить высоту столбика электролита в трубке. Уровень электролита должен быть на 10—15 мм выше предохранительной сетки. Если уровень окажется ниже, необходимо довести его до нормы доливкой дистиллированной воды при помощи резиновой груши.
Уровень электролита должен быть на 10—15 мм выше предохранительной сетки. Если уровень окажется ниже, необходимо довести его до нормы доливкой дистиллированной воды при помощи резиновой груши.
Рис. 1. Проверка плотности электролита в аккумуляторной батарее:
1 — стеклянный цилиндр для забора электролита; 2 — заливная горловина крышки аккумулятора; 3 — электролит; 4 — показания плотности электролита на шкале поплавка ареометра
Рис. 2. Проверка уровня электролита в аккумуляторе:
1 — крышка аккумулятора; 2 — воздушное пространство под крышкой; 3 — уровень эллектролнта; 4— верхний край пластин (предохранительная сетка)
Рис. 3. Определение напряжения аккумулятора нагрузочной вилкой:
а—установка нагрузочной вилки на штыри аккумулятора (нагрузочное сопротивление не включено): 1 — положительный штырь; 2 — отрицательный штырь; 3 — контакт цепи вольтметра; 4 — пружина; 5 — вольтметр; 6 — рукоятка нагрузочной вилки; 7 — направление установки нагрузочной вилки; б— определение напряжения аккумулятора под нагрузкой: 1 — направление действия силы руки при сжатии пружин для включения нагрузочного сопротивления; 2 — нагрузочное сопротивление; 3 — контакт нагрузочного сопротивления со штырем аккумулятора
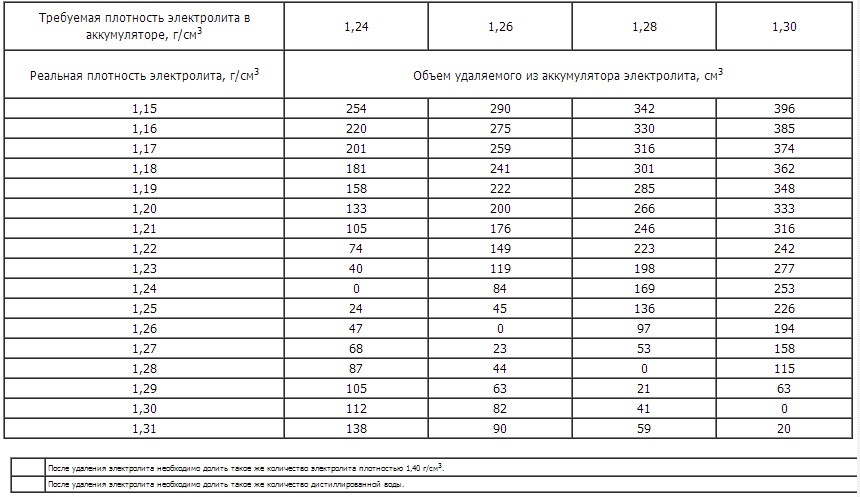
Плотность электролита между банками в аккумуляторах батареи не должна отличаться более чем на 0,02 г/см3. При необходимости плотность электролита выравнивают доливкой электролита плотностью 1,4 г/см3 или дистиллированной водой.
При необходимости плотность электролита выравнивают доливкой электролита плотностью 1,4 г/см3 или дистиллированной водой.
Состояние аккумуляторной батареи можно проверить по напряжению аккумуляторов под нагрузкой. Для этого необходимо установить нагрузочную вилку на штыри аккумулятора, как показано на рис. 4, а. После этого следует нажать на рукоятку нагрузочной вилки, как показано на рис. 4, б, удерживая ее в прижатом состоянии. Напряжение определяют по вольтметру. Так же определяют напряжение и на остальных аккумуляторах. Во всех аккумуляторах напряжение должно быть не ниже 1,7 В.
Важные факторы для надежного и воспроизводимого приготовления неводных растворов электролитов для литиевых батарей
Литиевые (Li) батареи, технология, которая положила начало революции в области накопления энергии и получила Нобелевскую премию по химии 2019 г., претерпели быстрое развитие в течение последние десятилетия 1,2 . Основываясь на успехе ионно-литиевых аккумуляторов (LIB) и постоянно растущем спросе на аккумуляторы с улучшенными характеристиками (например, с высокой плотностью энергии/мощности, возможностью быстрой зарядки, длительным циклическим/календарным сроком службы и низкой стоимостью), были проведены интенсивные исследования.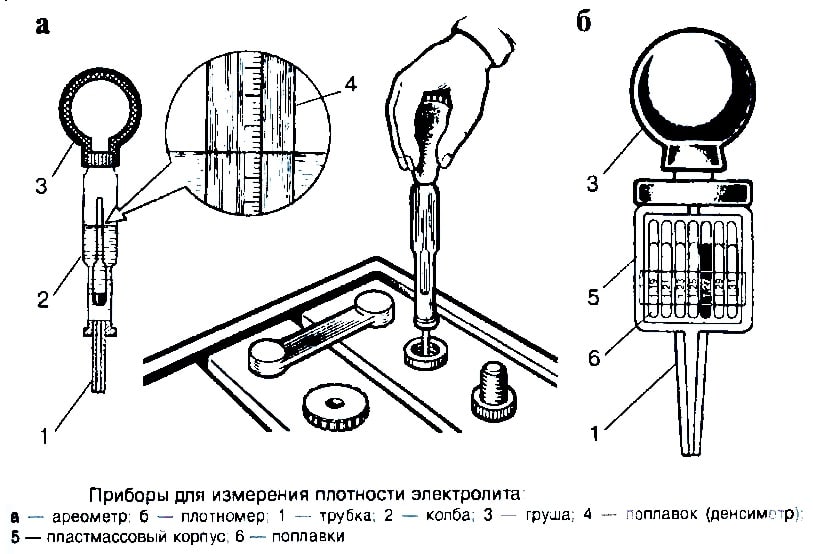 посвящен изучению новых химических элементов аккумуляторов и материалов 3 . В последние годы электролит, который является сокращением от электролитного раствора в области аккумуляторов и в просторечии относится ко всем компонентам электролитного раствора, все чаще признается важным в качестве электродных материалов 4 . В то время как материалы электродов определяют выход энергии, межфазные реакции между электродами и электролитами чрезвычайно чувствительны к электролиту 5,6,7 .
посвящен изучению новых химических элементов аккумуляторов и материалов 3 . В последние годы электролит, который является сокращением от электролитного раствора в области аккумуляторов и в просторечии относится ко всем компонентам электролитного раствора, все чаще признается важным в качестве электродных материалов 4 . В то время как материалы электродов определяют выход энергии, межфазные реакции между электродами и электролитами чрезвычайно чувствительны к электролиту 5,6,7 .
Во многих случаях межфазная фаза твердого электролита (SEI) или межфазная фаза катодного электролита (CEI), полученная в результате химического и электрохимического разложения электролита, имеет кинетику, ограничивающую скорость, которая контролирует скорость массового потока внутри элемента батареи. и определяет обратимость катода/анода по изменению побочных реакций 6,8 . Чтобы использовать весь потенциал передовых электродных материалов, электролит и связанные с ним SEI/CEI должны быть адаптированы к конкретным приложениям, таким как улучшение анодной стабильности электролита для высоковольтных катодов 9 , повышение стабильности лития для литий-металлических аккумуляторов (LMBs). ) 10 , подавление растворимости полисульфида для серных катодов 11 и т. д. Таким образом, множество публикаций по электролитам было объединено в область накопления энергии 10,12 . Однако подробное описание компонентов электролита и/или строгое изложение процесса приготовления электролита по-прежнему часто отсутствуют, например, отсутствие информации о поставщике, чистоте, примесях, сухости исходных химикатов, порядке смешивания растворов, внешнем виде. свежеприготовленного электролита, материала контейнера, температуры и атмосферы, используемых для хранения электролита, и других определенных мер предосторожности для некоторых конкретных электролитных систем. Эти ограничения поднимают барьер на пути к воспроизведению одних интересных результатов другими. Кроме того, ложная или вводящая в заблуждение информация может быть результатом непреднамеренных неточностей в процессе приготовления электролита. Поэтому описания приготовления электролитов, упрощенные до такой степени, что основная информация затемняется, не подходят для реальных приложений и публикаций.
) 10 , подавление растворимости полисульфида для серных катодов 11 и т. д. Таким образом, множество публикаций по электролитам было объединено в область накопления энергии 10,12 . Однако подробное описание компонентов электролита и/или строгое изложение процесса приготовления электролита по-прежнему часто отсутствуют, например, отсутствие информации о поставщике, чистоте, примесях, сухости исходных химикатов, порядке смешивания растворов, внешнем виде. свежеприготовленного электролита, материала контейнера, температуры и атмосферы, используемых для хранения электролита, и других определенных мер предосторожности для некоторых конкретных электролитных систем. Эти ограничения поднимают барьер на пути к воспроизведению одних интересных результатов другими. Кроме того, ложная или вводящая в заблуждение информация может быть результатом непреднамеренных неточностей в процессе приготовления электролита. Поэтому описания приготовления электролитов, упрощенные до такой степени, что основная информация затемняется, не подходят для реальных приложений и публикаций.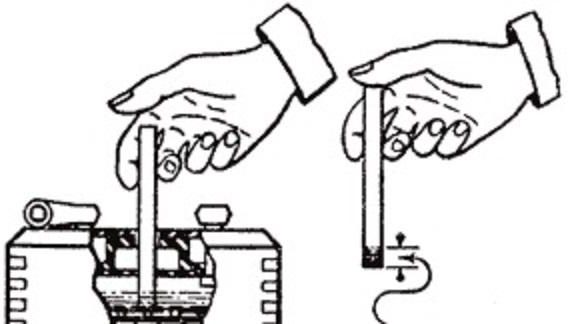
Недавно несколько журналов ( Joule , ACS Energy Letters и Journal of Power Sources ) инициировали стандартные контрольные списки для точных отчетов о химическом составе батарей, чтобы свести к минимуму потенциальное искажение и неправильное понимание характеристик батарей 13,14,15 . Эти контрольные списки имеют схожие критерии в отчетах, включая тип и конфигурацию элемента, тип электрода, нагрузку на электродную емкость (количество лития/толщина для LMB), отношение емкости анод/катод (N/P) и количество электролита (электролит/емкость [E/ отношение С]).
Для обеспечения надежной публикации результатов электролита и воспроизводимой подготовки электролита в этой статье обобщаются несколько важных факторов, влияющих на качество электролита, и предлагаются соответствующие меры контроля для подготовки электролита и стандартизированная отчетность.
Контроль влажности
Содержание влаги является одним из наиболее важных факторов, влияющих на качество электролита, даже следы воды в электролите могут привести к значительным колебаниям производительности аккумуляторов 16,17,18,19,20 . Влага вызывает нежелательные химические и электрохимические побочные реакции в аккумуляторе (как показано на рис. 1a) и ускоряет распад элемента за счет разрушения катода, анода и самого электролита. Например, гидролиз LiPF 6 является одной из самых больших проблем, поскольку он приводит к образованию фторида лития (LiF), фосфорилфторида (POF 3 ) и фтористого водорода (HF) (уравнение 1) 18,21. ,22,23,24,25 .
Влага вызывает нежелательные химические и электрохимические побочные реакции в аккумуляторе (как показано на рис. 1a) и ускоряет распад элемента за счет разрушения катода, анода и самого электролита. Например, гидролиз LiPF 6 является одной из самых больших проблем, поскольку он приводит к образованию фторида лития (LiF), фосфорилфторида (POF 3 ) и фтористого водорода (HF) (уравнение 1) 18,21. ,22,23,24,25 .
$${{{{{{\rm{LiPF}}}}}}}}_{6}+{{{{{{\rm{H}}}}}}}}_{2}{{{ {{\rm{O}}}}}}\to {{{{{\rm{LiF}}}}}}+{{{{{{\rm{POF}}}}}}}}_{3 }+2{{{{{\rm{HF}}}}}}$$
(1)
Рис. 1: Влияние содержания воды на электролиты. a Схематическое описание влияния воды на электролиты. b Изменение внутреннего сопротивления (∆ R ) литий-ионных аккумуляторов до и после зарядки водосодержащих (WC) и безводных (WF) аккумуляторов. c Изменение напряжения (∆ В ) литий-ионных аккумуляторов для батарей WC и WF после старения в течение 168 часов при высоком напряжении 4,2 В. d Начальная емкость и характеристики циклов (100 циклов и 300 циклов, 0,5°C зарядка/разрядка 0,5 C) аккумуляторов содержали разные дозировки воды. Воспроизведено с разрешения из ссылки 17 , авторское право (Springer Nature, 2014).
d Начальная емкость и характеристики циклов (100 циклов и 300 циклов, 0,5°C зарядка/разрядка 0,5 C) аккумуляторов содержали разные дозировки воды. Воспроизведено с разрешения из ссылки 17 , авторское право (Springer Nature, 2014).
Полноразмерное изображение
Хотя LiF, образующийся при гидролизе LiPF 6 , играет положительную роль в SEI в нескольких исследованиях 26 , HF обычно играет подавляющую отрицательную роль из-за его высокой коррозионной природы, которая инициирует переходные растворение металла (TM) из материала катода, что приводит к деградации катода 25 . Кроме того, ионы ТМ могли мигрировать от катода к аноду через электролит и отравлять анод. 9{-}+1/2\,{{{{{{\rm{H}}}}}}}_{2}$$
(2)
Эти продукты, а также остаток H 2 O может повлиять на производительность во время хранения и эксплуатации батареи. На рис. 1б–д 17 . Электролит, содержащий воду, приводит к повышенному внутреннему сопротивлению, уменьшению начальной емкости, быстрому спаду напряжения при хранении и быстрой деградации при циклировании по сравнению с безводными электролитами 17 . Следовательно, для продления срока службы батарей требуется строгая спецификация содержания H 2 O. В настоящее время в аккумуляторной промышленности обычно используется эмпирический и строгий контроль содержания воды H 2 O < 20 частей на миллион или даже 10 частей на миллион.
Следовательно, для продления срока службы батарей требуется строгая спецификация содержания H 2 O. В настоящее время в аккумуляторной промышленности обычно используется эмпирический и строгий контроль содержания воды H 2 O < 20 частей на миллион или даже 10 частей на миллион.
Чтобы обеспечить надежную публикацию препарата электролита в академической сфере, исследователям рекомендуется указывать содержание воды в электролите. Для новых подходов к электролиту рекомендуется H 2 O ≤ 20 частей на миллион, чтобы свести к минимуму колебания электролита, вызванные содержанием воды. Безводные химикаты для аккумуляторных батарей (включая проводящие соли, растворители и добавки) необходимы для приготовления электролита, а предварительная сушка становится важной для содержащих воду химикатов. Любые контейнеры или материалы, которые будут контактировать с химическими веществами электролита (например, бумага для взвешивания, наконечники пипеток, мешалки и т. д.) в процессе приготовления, должны быть высушены перед использованием, чтобы избежать попадания воды в электролит. Для исследования влияния концентрации воды в электролитах или стратегий смягчения характеристик воды в электролитах 29 , ограничений по содержанию воды нет, если указано содержание воды. Для достижения этой цели необходимо определение содержания воды. Метод титрования Карла Фишера является высокоточным для обнаружения следовых количеств воды и рекомендуется для определения содержания воды и составления отчетов 30 . Кроме того, для публикации также предлагается связанное содержание HF, которое можно определить с помощью 19 F ядерного магнитного резонанса (ЯМР) или зонда, селективного к ионам F. 31 .
д.) в процессе приготовления, должны быть высушены перед использованием, чтобы избежать попадания воды в электролит. Для исследования влияния концентрации воды в электролитах или стратегий смягчения характеристик воды в электролитах 29 , ограничений по содержанию воды нет, если указано содержание воды. Для достижения этой цели необходимо определение содержания воды. Метод титрования Карла Фишера является высокоточным для обнаружения следовых количеств воды и рекомендуется для определения содержания воды и составления отчетов 30 . Кроме того, для публикации также предлагается связанное содержание HF, которое можно определить с помощью 19 F ядерного магнитного резонанса (ЯМР) или зонда, селективного к ионам F. 31 .
Контроль чистоты
Помимо воды, присутствие следов примесей (остатки в процессе производства соли и растворителя) также может сильно повлиять на работу батареи 32,33,34 . Этот вопрос имеет большое значение для ученых и инженеров в этой области. Хотя в диверсифицированных электролитных системах существует огромное количество потенциальных примесей и связанных с ними побочных реакций, наиболее неблагоприятные реакции в основном относятся к следующим категориям. (1) Реакции с солями: протонные примеси, такие как спирты и кислоты, которые часто являются остатками при производстве электролитных растворителей, реагируют с LiPF 9.0041 6 и приводят к образованию HF (подобно реакции между LiPF 6 и водой) и сильно влияют на качество электролита 32 . (2) Электрохимические реакции на электродах – восстановление/окисление происходит, когда неизвестная примесь имеет плохую восстановительную/окислительную стабильность на аноде/катоде, что приводит к образованию газа и образованию SEI/CEI 34 . Как упоминалось ранее, производительность батареи очень чувствительна к качеству SEI и CEI из-за межфазных электрохимических реакций батарей 9.0003 6 . Во многих публикациях добавки SEI/CEI, даже при низких концентрациях 1%, 0,5% и 0,1%, могут значительно изменить работу ячейки 35,36 .
Хотя в диверсифицированных электролитных системах существует огромное количество потенциальных примесей и связанных с ними побочных реакций, наиболее неблагоприятные реакции в основном относятся к следующим категориям. (1) Реакции с солями: протонные примеси, такие как спирты и кислоты, которые часто являются остатками при производстве электролитных растворителей, реагируют с LiPF 9.0041 6 и приводят к образованию HF (подобно реакции между LiPF 6 и водой) и сильно влияют на качество электролита 32 . (2) Электрохимические реакции на электродах – восстановление/окисление происходит, когда неизвестная примесь имеет плохую восстановительную/окислительную стабильность на аноде/катоде, что приводит к образованию газа и образованию SEI/CEI 34 . Как упоминалось ранее, производительность батареи очень чувствительна к качеству SEI и CEI из-за межфазных электрохимических реакций батарей 9.0003 6 . Во многих публикациях добавки SEI/CEI, даже при низких концентрациях 1%, 0,5% и 0,1%, могут значительно изменить работу ячейки 35,36 . Следовательно, примесь ведет себя как добавка SEI или CEI и может значительно изменить химию, структуру и кинетику SEI/CEI. Остатки ионов металлов в электролите также являются примером этих примесей, которые могут восстанавливаться на стороне анода и отравлять SEI. (3) Химические реакции с электродами: коррозия электродов начинается, когда примесь вступает в реакцию с компонентом электрода. Коррозия лития под действием примесей (таких как органические кислоты, спирты, альдегиды, кетоны, амины и нитрилы), особенно в LMB, в которых в качестве анода используется металлический литий 37 может вызывать большие опасения из-за высокой реакционной способности металлического Li 38 . Как следствие, такие примеси могут значительно изменить обратимость катода/анода.
Следовательно, примесь ведет себя как добавка SEI или CEI и может значительно изменить химию, структуру и кинетику SEI/CEI. Остатки ионов металлов в электролите также являются примером этих примесей, которые могут восстанавливаться на стороне анода и отравлять SEI. (3) Химические реакции с электродами: коррозия электродов начинается, когда примесь вступает в реакцию с компонентом электрода. Коррозия лития под действием примесей (таких как органические кислоты, спирты, альдегиды, кетоны, амины и нитрилы), особенно в LMB, в которых в качестве анода используется металлический литий 37 может вызывать большие опасения из-за высокой реакционной способности металлического Li 38 . Как следствие, такие примеси могут значительно изменить обратимость катода/анода.
Чтобы свести к минимуму возможность получения невоспроизводимых результатов разными исследователями, при приготовлении электролита решающую роль играет контроль чистоты химических веществ. В публикациях требуется чистота химических веществ (вместе с информацией о поставщике/поставщике), также важны идентификация примесей и химическая очистка. Аналитические методы, такие как 9Для определения примеси в большинстве химических веществ, используемых в электролитах 39 . Обычные методы, включая перегонку, кристаллизацию, экстракцию, хроматографию, электрофорез и др., могут применяться для дальнейшей очистки в зависимости от физико-химических свойств реагента и примесей 40 . Откровенно говоря, нецелесообразно проводить фиксированную линию чистоты из-за сложности химического состава батареи и потенциального разнообразия примесей. Однако, чтобы привлечь внимание исследователей к важности химической чистоты и свести к минимуму различия между исследовательскими подходами, эмпирически рекомендуется степень чистоты батареи или чистота выше 99% (чем выше, тем лучше).
Аналитические методы, такие как 9Для определения примеси в большинстве химических веществ, используемых в электролитах 39 . Обычные методы, включая перегонку, кристаллизацию, экстракцию, хроматографию, электрофорез и др., могут применяться для дальнейшей очистки в зависимости от физико-химических свойств реагента и примесей 40 . Откровенно говоря, нецелесообразно проводить фиксированную линию чистоты из-за сложности химического состава батареи и потенциального разнообразия примесей. Однако, чтобы привлечь внимание исследователей к важности химической чистоты и свести к минимуму различия между исследовательскими подходами, эмпирически рекомендуется степень чистоты батареи или чистота выше 99% (чем выше, тем лучше).
Выбор контейнера
Выбор контейнера также важен для приготовления электролита. В исследовании Winter, M. et al. контейнеры, изготовленные из разных материалов, по-разному влияют на термическое разложение электролита 41 .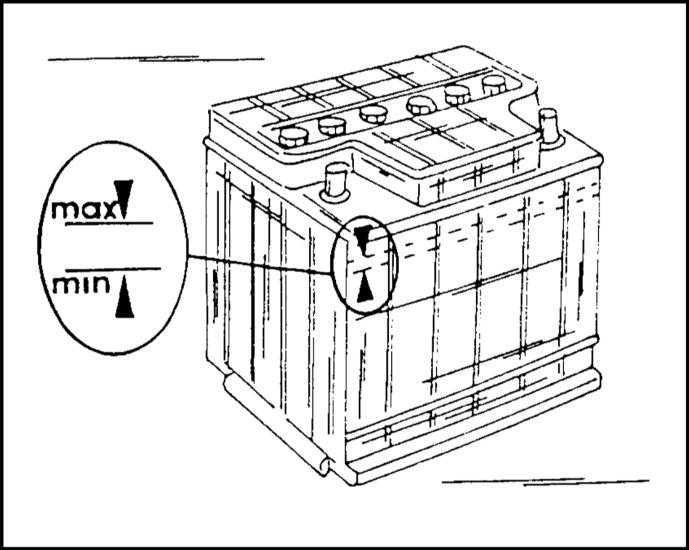 Стеклянный контейнер ускоряет разложение LiPF 6 , что приводит к большему количеству неионных (диметилфторфосфат [DMFP] и диэтилфторфосфат [DEFP], рис. 2a) и ионных (метилфторфосфат [MFP], этилфторфосфат [EFP] и этилен фосфат [ЭП], рис. 2б) накопление органического фосфата в классическом электролите 1 M LiPF 6 в этиленкарбонате (ЭК)/этилметилкарбонате (ЭМК) (50/50 мас.%). Только 0,43 M LiPF 6 остается после 5 дней выдержки при 85 °C в стеклянной таре 41 . Основной причиной этого являются реакции между продуктом гидролиза LiPF 6 HF и стеклянными материалами (например, бура, SiO 2 ), в результате которых образуется вода, которая может еще больше ускорить разложение LiPF 6 41 . Чтобы избежать этого, контейнер должен быть инертным ко всем химическим веществам, которые в нем хранятся, а такие материалы, как полипропилен (ПП), полиэтилен (ПЭ) или алюминий, могут подходить для контейнеров с электролитом 41 .
Стеклянный контейнер ускоряет разложение LiPF 6 , что приводит к большему количеству неионных (диметилфторфосфат [DMFP] и диэтилфторфосфат [DEFP], рис. 2a) и ионных (метилфторфосфат [MFP], этилфторфосфат [EFP] и этилен фосфат [ЭП], рис. 2б) накопление органического фосфата в классическом электролите 1 M LiPF 6 в этиленкарбонате (ЭК)/этилметилкарбонате (ЭМК) (50/50 мас.%). Только 0,43 M LiPF 6 остается после 5 дней выдержки при 85 °C в стеклянной таре 41 . Основной причиной этого являются реакции между продуктом гидролиза LiPF 6 HF и стеклянными материалами (например, бура, SiO 2 ), в результате которых образуется вода, которая может еще больше ускорить разложение LiPF 6 41 . Чтобы избежать этого, контейнер должен быть инертным ко всем химическим веществам, которые в нем хранятся, а такие материалы, как полипропилен (ПП), полиэтилен (ПЭ) или алюминий, могут подходить для контейнеров с электролитом 41 . Также стоит отметить, что контейнеры должны быть герметичными, чтобы избежать любого загрязнения из окружающей атмосферы, а светонепроницаемые контейнеры подходят для тех электролитов, которые содержат светочувствительные соединения.
Также стоит отметить, что контейнеры должны быть герметичными, чтобы избежать любого загрязнения из окружающей атмосферы, а светонепроницаемые контейнеры подходят для тех электролитов, которые содержат светочувствительные соединения.
Анализ образования органических фосфатов (диметилфторфосфата [DMFP], диэтилфторфосфата [DEFP], метилфторфосфата [MFP], этилфторфосфата [EFP] и этиленфосфата [EP]) посредством ( a ) ГХ-МС и ( b ) IC-ESI-MS в 10 мл алюминиевых и стеклянных флаконах после старения при 85 °C в течение 5 дней (значения ГХ-МС образцов электролита, хранящихся в стеклянных флаконах, разделены из-за лучшей ясности, обеспечивают с использованием коэффициента 10). Воспроизведено с разрешения из ссылки 41 , авторское право (Королевское химическое общество, 2015 г.). c Схема приготовления электролита. d Пять распространенных смесей, которые нежелательны.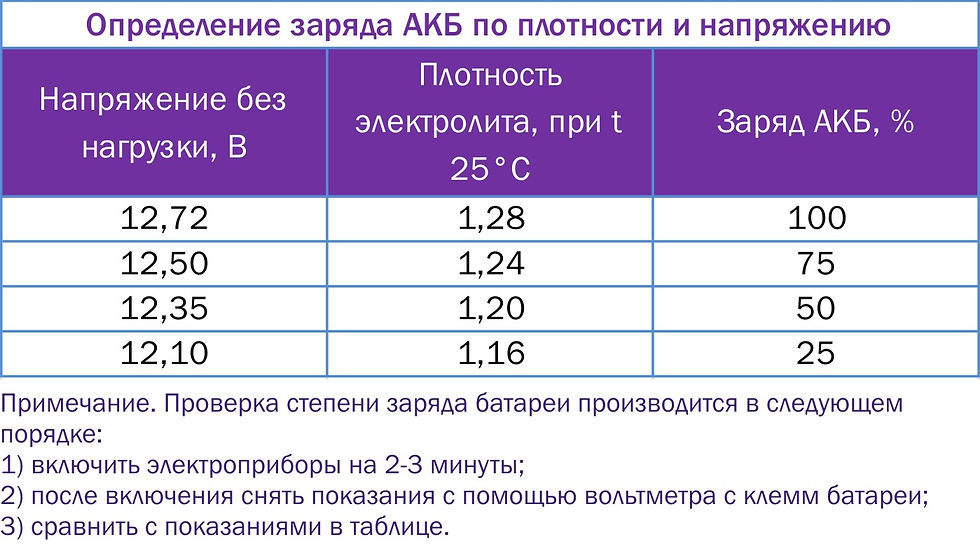 e Максимальные температуры, обнаруженные во время приготовления 1 мл электролита в круглых бутылях WHEATON® LDPE объемом 7 мл при температуре окружающей среды 20 °C. Схематическое изображение ( f ) экзотермического и ( g ) эндотермического образования раствора. ч Энтальпии перехода NaI из воды в смеси вода-сорастворитель при 298.15 К. Воспроизведено с разрешения по ссылке 45 , авторское право (Springer Nature, 2012).
e Максимальные температуры, обнаруженные во время приготовления 1 мл электролита в круглых бутылях WHEATON® LDPE объемом 7 мл при температуре окружающей среды 20 °C. Схематическое изображение ( f ) экзотермического и ( g ) эндотермического образования раствора. ч Энтальпии перехода NaI из воды в смеси вода-сорастворитель при 298.15 К. Воспроизведено с разрешения по ссылке 45 , авторское право (Springer Nature, 2012).
Увеличить
Электролит и контроль температуры при приготовлении
В химии неводный электролит представляет собой раствор особого типа, в котором проводящая соль(и) (и функциональные добавки) растворены в органическом растворителе (с) 5,35 . При растворении эти соль(и) и добавка(и) равномерно диспергируются в растворителе(ах), образуя гомогенную смесь электролитов, как показано на рис. 2c. Поскольку в процесс смешивания вовлечены эффекты химической полярности, в некоторых случаях образуются неидеальные смеси помимо раствора, как показано на рис.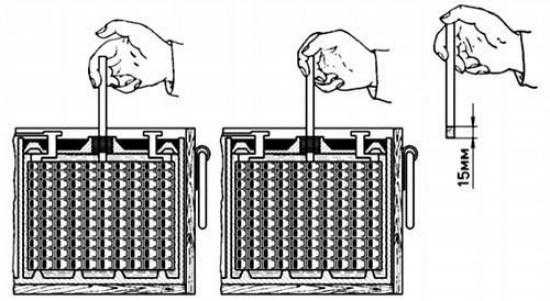 2d, включая: (1) нерастворенный остаток проводящей соли (солей)/добавки (добавок), (2) эмульсия, (3) суспензия или (4) фазовое разделение исходных материалов и (5) осаждение/перекристаллизация соли в перенасыщенном растворе после выдержки. Неосторожность при проверке состояния раствора может привести к неудачной подготовке электролита.
2d, включая: (1) нерастворенный остаток проводящей соли (солей)/добавки (добавок), (2) эмульсия, (3) суспензия или (4) фазовое разделение исходных материалов и (5) осаждение/перекристаллизация соли в перенасыщенном растворе после выдержки. Неосторожность при проверке состояния раствора может привести к неудачной подготовке электролита.
Также важно уделять пристальное внимание тепловым эффектам в процессе смешивания. Например, на рис. 2e показаны максимальные температуры, обнаруженные во время приготовления 1 мл электролита для четырех электролитов с одной солью (LiPF 6 или LiFSI) и одним растворителем (DMC или DME) в круглой бутылке WHEATON® LDPE объемом 7 мл. Измерение температуры начинали в начале процесса смешивания (при температуре окружающей среды 20 °C) и заканчивали после полного растворения соли. Очень разные максимальные температуры были обнаружены путем изменения растворителей, солей и концентраций солей. Максимальная температура 23 °С была зафиксирована при приготовлении 1 М LiPF 9. 0041 6 в DMC, изменение до 27 °C с 1 M LiPF 6 в DME, 28 °C в 1 M LiFSI в DME и 47 °C в 4 M LiFSI в DME. Это повышение температуры вызвано теплом, выделяющимся при сольватации.
0041 6 в DMC, изменение до 27 °C с 1 M LiPF 6 в DME, 28 °C в 1 M LiFSI в DME и 47 °C в 4 M LiFSI в DME. Это повышение температуры вызвано теплом, выделяющимся при сольватации.
Как показано на рис. 2f и g, сольватация может быть либо эндотермической, либо экзотермической, при которой тепло первоначально поглощается во время разрыва связей в исходной соли(ях) (электростатическое притяжение между двумя ионами) и растворителе(ях) (межмолекулярное притяжение между молекулами растворителя) и высвобождается при образовании новых притягивающих связей ион-растворитель 42 . Суммарная теплота сольватации представляет собой разницу между относительным теплом, необходимым для разрыва связи, и теплотой, выделяемой при реформировании 42 . В нескольких исследованиях сообщалось о результатах калориметрических исследований при приготовлении электролита для литиевых аккумуляторов. Однако существует долгая история изучения термохимии смешения растворов, особенно водных растворов 43,44,45 . На рис. 2h в качестве примера показано влияние растворителя на сольватацию NaI. Различные растворители приводят к разным энтальпиям сольватации NaI. В дополнение к общему теплу от сольватации на самую высокую температуру во время приготовления электролита также могут влиять многие другие факторы, такие как скорость растворения, количество электролита, материал и размер/форма контейнера, которые влияют на рассеивание тепла.
На рис. 2h в качестве примера показано влияние растворителя на сольватацию NaI. Различные растворители приводят к разным энтальпиям сольватации NaI. В дополнение к общему теплу от сольватации на самую высокую температуру во время приготовления электролита также могут влиять многие другие факторы, такие как скорость растворения, количество электролита, материал и размер/форма контейнера, которые влияют на рассеивание тепла.
Высокие температуры в процессе приготовления электролита могут влиять на растворимость солей, что приводит к перенасыщению электролитов, что вызывает осаждение солей, когда температура падает до комнатной 46 . Повышенные температуры также могут ускорить испарение и разложение электролита 41 . Поэтому важно следить за температурой во время приготовления электролита, особенно при приготовлении большого количества электролита, для которого рассеивание тепла происходит относительно медленно. Для процесса смешивания, при котором выделяется значительное количество тепла, процесс сольватации можно разделить на несколько этапов путем постепенного добавления соли в растворитель до полного растворения соли при контролируемой температуре.
Склад электролита
Склад электролита является продолжением подготовки электролита. Окружающая среда, включая влажность, свет, тип контейнера и температуру, имеет решающее значение для хранения электролита. Как обсуждалось в предыдущих разделах, неправильная тара, высокое содержание воды и свет могут ускорить порчу электролита. Результаты на рис. 3а, б показывают быструю деградацию электролита при повышенных температурах. Большое количество LiPF 6 и продуктов разложения растворителя накапливается при температурах 60 и 80 °C по сравнению с 20 и 40 °C 41 . Таким образом, для обеспечения надежной работы батареи важно хранить электролиты в благоприятной для электролита среде с регулируемой влажностью (например, в перчаточном ящике или в сухом помещении) при умеренных температурах (без замерзания и перегрева) и использовать светонепроницаемые контейнеры для светочувствительных образцов.
Рис. 3: Хранение электролитов при различных температурах.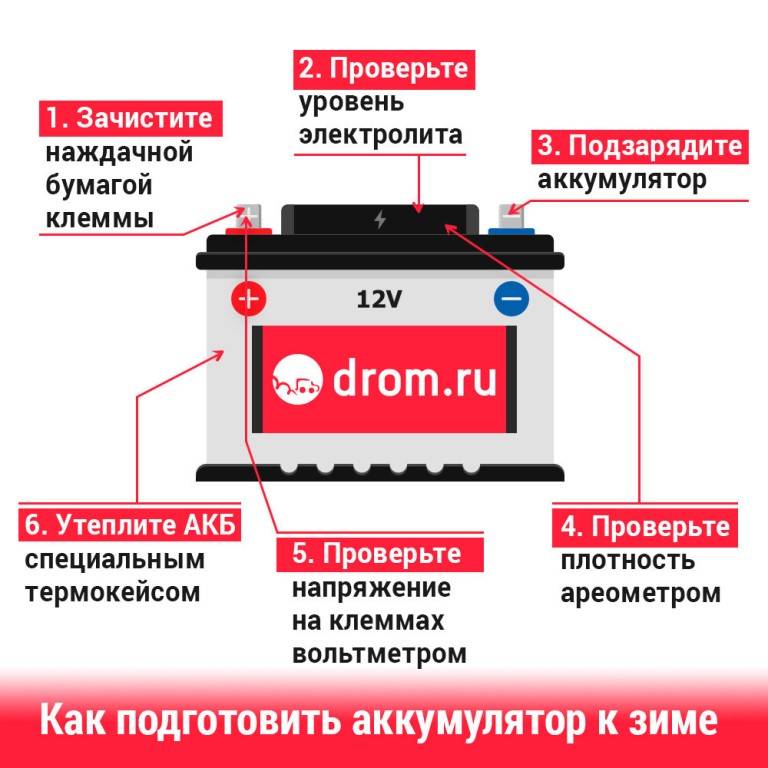
Анализ образования органических фосфатов (диметилфторфосфата [DMFP], диэтилфторфосфата [DEFP], метилфторфосфата [MFP], этилфторфосфата [EFP] и этиленфосфата [EP]) с помощью ( a ) GC-MS и ( b ) IC-ESI-MS в 10-мл алюминиевых флаконах после старения при различных температурах в течение 21 дня. Воспроизведено с разрешения по ссылке 41 , авторское право (Royal Society of Chemistry, 2015).
Изображение с полным размером
В то время как окружающая среда является внешним фактором, влияющим на стабильность электролита при хранении, химическая стабильность компонентов электролита также играет внутреннюю роль. Например, фторэтиленкарбонат (ФЭК), широко используемый растворитель/добавка для обычных электролитов, может значительно ухудшить стабильность при хранении LiPF 9.0041 6 карбонатный электролит из-за взаимодействия между LiPF 6 и FEC, которые ускоряют накопление HF и запускают полимеризацию электролита 47 .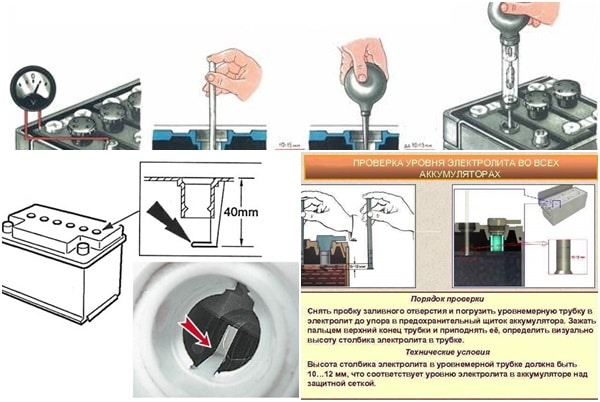 Рекомендуется проверять качество электролита перед использованием, особенно электролитов, которые хранились в течение длительного времени. В состаренном электролите продукты разложения соли, растворителя и добавок становятся дополнительными примесями по сравнению с исходным электролитом 22,31 . Проверка электролита должна включать, помимо прочего, идентификацию содержания воды, определение концентрации кислоты и проверку чистоты с использованием методов анализа, описанных в предыдущих разделах.
Рекомендуется проверять качество электролита перед использованием, особенно электролитов, которые хранились в течение длительного времени. В состаренном электролите продукты разложения соли, растворителя и добавок становятся дополнительными примесями по сравнению с исходным электролитом 22,31 . Проверка электролита должна включать, помимо прочего, идентификацию содержания воды, определение концентрации кислоты и проверку чистоты с использованием методов анализа, описанных в предыдущих разделах.
Перспективы
LIB останутся ключевой технологией в долгосрочной перспективе из-за их вездесущности в бытовой электронике, электромобилях и электрических сетях. В связи с рыночным спросом на превосходную производительность для различных приложений, к существующим ЛИА предъявляются все более строгие требования, и появляются различные исследовательские электрохимические системы помимо ЛИА, такие как LMB, натриевые батареи, калиевые батареи и цинковые батареи. Инновации имеют решающее значение для разработки передовых электролитов, чтобы поддерживать эти желаемые технологические траектории.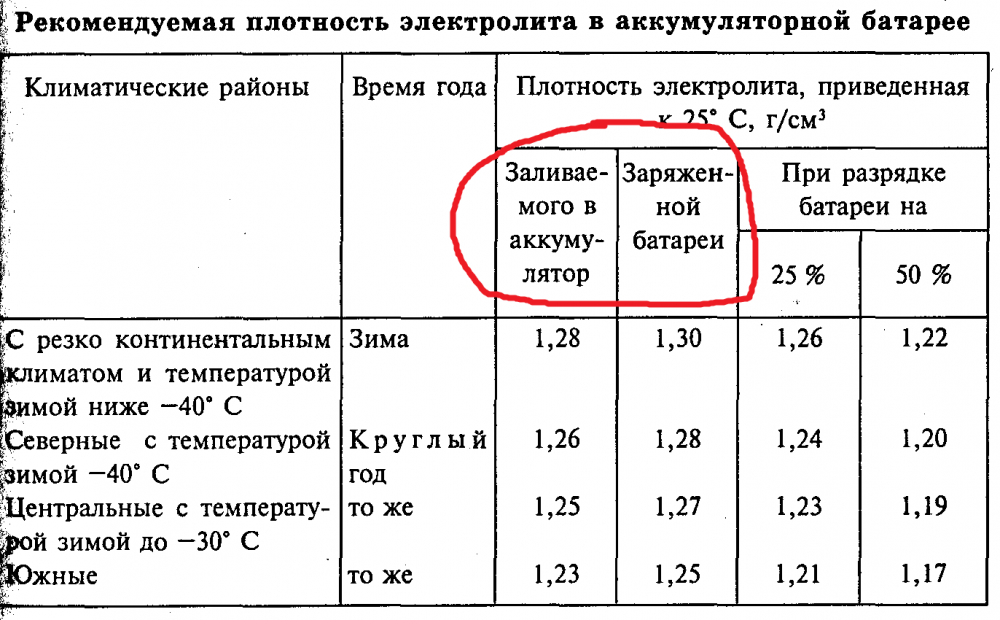
Как упоминалось ранее, небольшие изменения в электролите могут привести к значительному изменению электрохимических характеристик из-за присущей поверхностно-электрохимической природе процессов зарядки/разрядки батареи. Таким образом, в дополнение к контрольным спискам, выпущенным для сборки элементов и отчетности 13,14,15 , для сообщества крайне важно согласовать набор критериев, которые также могут быть реализованы при подготовке электролита. В таблице 1 предлагается контрольный список экспериментальных деталей подготовки электролита для отчетности. Простая публикация «инновационного» электролита без предоставления информации о контроле качества может затруднить воспроизведение результатов другими и создать проблемы, которые препятствуют промышленному масштабированию для практических применений. Этот контрольный список может быть полезен и важен при внедрении новых концепций электролита в батареи, которые могут эффективно повысить надежность и воспроизводимость электролита в реальных приложениях.
Полноразмерная таблица
Основные сведения об электролите литиевой батареи
Перейти к содержимому Основы электролита литиевой батареи Литиевые батареиявляются наиболее распространенным типом перезаряжаемых батарей, используемых сегодня в электронике.
Они известны своей высокой плотностью энергии, длительным сроком службы и т. д. Эти качества делают их идеальными для использования в портативной электронике, такой как телефоны, ноутбуки и планшеты.
Для достижения этих характеристик литиевые батареи должны содержать особый тип электролита, способный выдерживать многократные заряды без разрушения или утечки. Поскольку этот электролит не виден невооруженным глазом, важно понимать, как он работает, чтобы предотвратить возникновение каких-либо проблем!
-
Как работают литиевые батареи?
-
Что такое аккумуляторный электролит?
-
Основные требования к электролитам литий-ионных аккумуляторов
-
Из чего состоит электролит литий-ионного аккумулятора?
-
Типы электролита литий-ионного аккумулятора
-
Какое влияние оказывает электролит литий-ионного аккумулятора на работу аккумулятора?
-
Критерии электролита идеальной литиевой батареи В ионно-ионных батареях используются заряженные ионы лития для создания электрического потенциала между клеммами анода и катода.
 Тонкий слой изоляционного материала, называемый «сепаратором», находится в растворе электролита между двумя сторонами батареи. Сепаратор позволяет ионам лития проходить, блокируя электроны и разделяя два электрода. Во время зарядки ионы лития перемещаются через сепаратор с положительной стороны на отрицательную. Разряжаясь, ионы движутся в противоположном направлении.
Тонкий слой изоляционного материала, называемый «сепаратором», находится в растворе электролита между двумя сторонами батареи. Сепаратор позволяет ионам лития проходить, блокируя электроны и разделяя два электрода. Во время зарядки ионы лития перемещаются через сепаратор с положительной стороны на отрицательную. Разряжаясь, ионы движутся в противоположном направлении.Движение ионов лития создает разность электрических потенциалов, называемую «напряжением». Когда вы подключаете свои электронные устройства к батарее, электроны (не литий-ионы) проходят через ваше устройство и питают его.
Что такое электролит литиевой батареи?
Аккумулятор состоит из трех основных компонентов: катода, анода и электролита, разделяющего эти две клеммы. Электролит литиевой батареи представляет собой химическое вещество, позволяющее электрическому заряду проходить между двумя клеммами. Электролит помещает химические вещества, необходимые для реакции, в контакт с анодом и катодом, тем самым преобразуя накопленную энергию в пригодную для использования электрическую энергию.

Электролит литиевых батарей является своего рода носителем для передачи ионов в литиевых батареях. Основными компонентами являются соли лития и органические растворы. С электролитом между положительным и отрицательным электродами литиевой батареи существует ионная проводимость, и происходит явление зарядки и разрядки. Практически в литиевых батареях используется жидкий электролит с содержанием LiPF6, LiBF4 или LiClO4. Добавляя жидкий электролит, в основном существует 3 вида электролита для литиевых батарей, которые классифицируются по своему физическому состоянию. Все они имеют одинаковые функции:
Функция
1. Электролит обеспечивает часть активных ионов лития, которые используются в качестве проводящих ионов в процессе зарядки и разрядки.
2 электролит обеспечивает ионный канал или носитель, в котором ионы лития могут свободно перемещаться.
Эта реакция обеспечивает питание подключенного устройства, будь то свет, пылесос или электромобиль.

Основные требования к электролитам для литий-ионных аккумуляторов
Электролиты, используемые в литий-ионных батареях, должны соответствовать следующим основным требованиям. Это факторы, которые необходимо учитывать при измерении характеристик электролитов, а также важные предпосылки для реализации высоких характеристик, низкого внутреннего сопротивления, низкой цены, длительного срока службы и безопасности литий-ионных аккумуляторов.
- Ионная проводимость высока в широком диапазоне температур, а число миграций ионов лития велико, что снижает концентрационную поляризацию батареи во время заряда и разряда.
- Хорошая термическая стабильность, обеспечивающая работу батареи в подходящем диапазоне температур.
- Электрохимическое окно широкое, и лучше всего иметь окно электрохимической стабильности 0 ~ 5 В, чтобы гарантировать, что электролит не подвергается значительным побочным реакциям на полюсах, и чтобы соответствовать сингулярности электродных реакций в электрохимическом процессе.

- При использовании вместо диафрагмы он также должен иметь хорошие механические свойства и технологичность.
- Низкая цена и стоимость.
- Хорошая безопасность, высокая температура вспышки или отсутствие горения.
- Нетоксичен и не наносит вреда окружающей среде.
Из чего состоит электролит литий-ионного аккумулятора?
Электролиты обычно изготавливаются из
1. органических растворов высокой чистоты, C3h5O3, C4H6O3, C3H6O3, PF5 и т.д.
2. электролитные соли лития:
3. необходимые добавки
4. прочее сырье
Прежде всего при определенных условиях и в определенных пропорциях.
В разных типах батарей используются разные типы химических реакций и разные электролиты.
Например,
Гексафторфосфат лития (LiPF6) представляет собой раствор соли лития, который является наиболее распространенным электролитом в литиевых батареях. Гидроксид калия является электролитом в обычных бытовых щелочных батареях.
 В свинцово-кислотном аккумуляторе обычно используется серная кислота для создания предполагаемой реакции. Воздушно-цинковые батареи основаны на окислении цинка кислородом для реакции.
В свинцово-кислотном аккумуляторе обычно используется серная кислота для создания предполагаемой реакции. Воздушно-цинковые батареи основаны на окислении цинка кислородом для реакции.Типы электролита литий-ионного аккумулятора
Существует три вида электролита литий-ионного аккумулятора. В зависимости от состояния электролитов электролиты литиевых батарей можно разделить на жидкие электролиты, твердые электролиты и твердожидкие композитные электролиты.
Жидкие электролиты включают органические жидкие электролиты и ионные жидкие электролиты при комнатной температуре
твердые электролиты включают твердые полимерные электролиты и неорганические твердые электролиты
твердые и жидкие композитные электролиты представляют собой гелевые электролиты, состоящие из твердого полимера и жидких электролитов.
Ниже приводится подробное описание этих пяти видов электролитов для ионно-литиевых аккумуляторов.
Органический жидкий электролит: Электролит, полученный растворением электролита на основе литиевой соли в полярном апротонном органическом растворителе
Преимущества:
1. Органический жидкий электролит обладает хорошей электрохимической стабильностью,
Органический жидкий электролит обладает хорошей электрохимической стабильностью,
2. Органический жидкий электролит имеет низкую температуру замерзания и высокую точка кипения
3. Органический жидкий электролит можно использовать в широком диапазоне температур.недостатки:
1.Органические растворители органического жидкого электролита имеют небольшую диэлектрическую проницаемость
2.Органические растворители органического жидкого электролита имеют высокую вязкость
3.Органический жидкий электролит имеет плохую способность растворять неорганические солевые электролиты
4.Органическая жидкость электролит имеет низкую электропроводность
5. Органический жидкий электролит особенно чувствителен к следовым количествам воды.
6. Органические жидкие литиевые батареи склонны к утечке.
7. Продукт должен иметь прочный металлический корпус, модель корпуса и размер фиксированы, что не обеспечивает гибкости.
8. Низкая безопасность из-за воспламеняемости органических растворителей. Таким образом, меры защиты батареи должны быть очень совершенными.
Таким образом, меры защиты батареи должны быть очень совершенными.Ионный жидкий электролит при комнатной температуре: Функциональный материал или среда, состоящая из определенных катионов и анионов, которые являются жидкими при комнатной температуре или близкой к ней.
преимущества:
1. Ионный жидкий электролит комнатной температуры имеет выдающиеся преимущества, такие как высокая проводимость
2. Ионный жидкий электролит комнатной температуры имеет низкое давление паров
3. Ионный жидкий электролит комнатной температуры имеет широкий диапазон жидкостей
4. Ионная жидкость комнатной температуры электролит обладает хорошей химической и электрохимической стабильностью
5. Ионный жидкий электролит комнатной температуры не загрязняет окружающую среду
6. Ионный жидкий электролит комнатной температуры легко восстанавливается
7. Совершенная безопасность:
Расплавленная соль комнатной температуры используется в качестве электролита для литий-ионных аккумуляторов, чтобы повысить безопасность аккумуляторов при высокой плотности мощности и полностью устранить опасности, связанные с аккумуляторами.
твердый электролит для литий-ионных аккумуляторов
Преимущества:
1. Твердый электролит негорюч
2. Твердый электролит имеет низкую реакционную способность с материалом электрода
3. Твердый электролит обладает хорошей гибкостью
вышеуказанные недостатки жидкостных литий-ионных аккумуляторов и позволяют изменять объем электродного материала при разряде
5. Твердый электролит более устойчив к ударам, вибрации и деформации, чем жидкие электролиты.
6. Его легко обрабатывать и формовать, и аккумулятору можно придать различные формы в соответствии с различными потребностями.Гелевый электролит: Жидкие пластификаторы, такие как PC, EC и т. д., притягиваются к полимерной матрице для получения твердо-жидкого композиционного гелеобразного электролита.
преимущества: этот тройной электролит, состоящий из полимерных соединений, солей лития и полярных органических растворителей, обладает свойствами как твердых электролитов, так и жидких электролитов.

Неорганические твердые электролиты: Твердые материалы с высокой ионной проводимостью. Неорганические твердые электролиты, используемые в полностью твердых литий-ионных батареях, делятся на стеклянные электролиты и керамические электролиты.
Преимущества:
1. Твердые электролиты могут играть роль электролитов и заменять диафрагму в аккумуляторе.
2. Нет проблем с утечкой
3. Батарея может быть миниатюризирована и миниатюризирована, хотя количество миграций ионов лития в этом типе материала великоНедостатки:
1. Электропроводность самого электролита намного меньше, чем у жидких электролитов.
2. Импеданс поверхности раздела между электролитом и материалом высок, когда такие материалы используются в литий-ионных батареях
3. Хрупкость неорганических твердых электролитов велика
4. Сейсмостойкость литий-ионных батарей как электролитов низкая .Органический жидкий электролит Ионный жидкий электролит комнатной температуры Гелевый электролит Неорганический твердый электролит Гелевый электролит состояния жидкость жидкость Коллоид Твердый Коллоид Место Li+ нефиксированный нефиксированный Относительно фиксированный фиксированный Относительно фиксированный Концентрация Li+ низкий высокий низкий Очень высокая низкий Проводимость высокий Немного высоковат Немного высоковат Немного низкий Немного высоковат безопасность легковоспламеняющийся отлично Довольно хорошо отлично Довольно хорошо цена Дороговато Очень дорого Дороговато дешевый Дороговато Хотите получить более подробную информацию: Загрузите нашу электронную книгу по дизайну аккумуляторов.

Дизайн литиевой батареи Дизайн Электронная книга Скачать (2M, 20 страниц, PDF)
Какое влияние оказывает электролит литий-ионной батареи на работу батареи?
Влияние электролитов литий-ионных аккумуляторов на макроскопические электрохимические свойства аккумуляторов включает следующие аспекты:
Разберем их по порядку
1.
Влияние на емкость аккумулятораВо-первых, хотя материал электрода является необходимым условием для определения удельной емкости литий-ионных аккумуляторов, электролит также влияет на обратимую емкость аккумулятора. электродный материал в значительной степени.
То есть
Потому что процесс заливки, делития и процесс циркуляции электродного материала — это всегда процесс взаимодействия с электролитом. Это взаимодействие оказывает существенное влияние на состояние поверхности раздела электродного материала и изменения внутренней структуры.
Во-вторых, в рабочем процессе литий-ионных аккумуляторов, кроме окислительно-восстановительных реакций, протекающих на положительном и отрицательном электродах при внедрении и удалении ионов лития, также имеет место большое количество побочных реакций.

Такие как
- окисление и восстановление разложения электролитов на поверхности положительных и отрицательных электродов,
- поверхностная пассивация электродно-активными веществами,
- высокий импеданс интерфейса между электродом и интерфейсом электролита….
Эти факторы влияют на способность электродного материала к внедрению и удалению лития.
Вот почему некоторые электролитные системы могут придать материалу электрода отличную способность к внедрению и удалению лития, в то время как некоторые электролитные системы очень разрушают материал электрода.
2.Влияние на внутреннее сопротивление батареи и увеличение характеристик заряда и разрядаКаково внутреннее сопротивление литий-ионных батарей?
Внутреннее сопротивление относится к сопротивлению току, когда он проходит через батарею. В него входят омическое внутреннее сопротивление и поляризационное сопротивление электрода при электрохимическом процессе.
 Для литий-ионных аккумуляторов оно должно включать сопротивление поверхности раздела между электродом и электролитом.
Для литий-ионных аккумуляторов оно должно включать сопротивление поверхности раздела между электродом и электролитом.Таким образом, сумма омического внутреннего сопротивления, сопротивления границы электрод/электролит и внутреннего поляризационного сопротивления представляет собой общее внутреннее сопротивление литий-ионных аккумуляторов.
Это важный показатель для измерения производительности химических источников питания, который напрямую влияет на рабочее напряжение батареи, рабочий ток, выходную энергию и мощность.
Почему электролит влияет на внутреннее сопротивление батареи?
Внутреннее омическое сопротивление батареи в основном обусловлено проводимостью электролита и должно также включать сопротивление материала электрода и диафрагмы.
Механизмом проводимости электролитической части является ионная проводимость, и сопротивление во время процесса проводимости обычно намного больше, чем у электронной проводящей части.

Сопротивление границы между электродом и электролитом имеет большое значение в литий-ионных батареях.
Чем больше сопротивление ионов лития при прохождении через интерфейс, тем выше внутреннее сопротивление аккумулятора. В нормальных условиях сопротивление интерфейса значительно выше внутреннего сопротивления в омах.
Почему электролит влияет на характеристики увеличительного заряда и разряда?Определение скорости разряда и заряда:
Увеличение характеристик заряда и разряда является важным показателем для измерения способности сохранения емкости литий-ионных аккумуляторов в условиях быстрой зарядки и разрядки.
Причины, по которым электролит влияет на увеличение заряда и разряда:Увеличение заряда и разряда аккумулятора определяются
1.подвижность ионов лития в материале электрода,
2.проводимость электролита,
3.подвижность ионов лития на границе раздела фаз электрода или электролита.

Последние два тесно связаны с составом и свойствами электролита.
3.Влияние на диапазон рабочих температур батареиИз-за большой температурной зависимости электродной реакции, происходящей на границе между электродом и фазой электролита, среди всех факторов окружающей среды температура оказывает наиболее очевидное влияние на батарею производительность.
- В условиях низких температур скорость электродной реакции снижается, и даже реакция прекращается, а производительность батареи значительно снижается или даже не может нормально использоваться.
- При повышении температуры электродная реакция усиливается, но одновременно усиливаются и побочные реакции на границе раздела фаз электрода или электролита. Эти побочные реакции часто очень разрушительны для батареи и влияют на ее производительность.
Таким образом, оптимальной температурой для работы батареи должна быть температура, наиболее благоприятная для электродной реакции без явных побочных реакций.

Например,
- диапазон рабочих температур жидких литий-ионных аккумуляторов обычно составляет -10-45℃;
- минимальная рабочая температура обычно не ниже -20 ℃,
- максимальная рабочая температура обычно не превышает 60℃.
1.расширить ассортимент жидкости электролита
2.улучшить проводимость электролита в условиях низких температур
3.улучшить стабильность электролита в условиях высоких температур.
Для твердых электролитов, чтобы расширить диапазон их рабочих температур,
- , чтобы попытаться увеличить проводимость электролита при комнатной температуре или даже при низкой температуре,
- уменьшает импеданс интерфейса между ним и материалом электрода.
Хотите узнать больше: загрузите нашу электронную книгу по дизайну аккумуляторов.

Lithium Battery Design Design Электронная книга Скачать (2M, 20 страниц, PDF)
4. Влияние на хранение и срок службы батареиСрок хранения:
Старение литий-ионных батарей при длительном хранении ключ к влиянию на характеристики хранения батарей. Даже если коммерческий литий-ионный аккумулятор никогда не используется, срок его хранения составляет всего около 3 лет.
Существует множество причин старения батареи. основные причины:Коррозия электрода коллекторной жидкости
Потеря электрохимической активности электрода активным веществом из коллекторной жидкости
Природа электролита тесно связана с коррозией коллектора жидкостью и стабильностью электродного материала в ней. Поэтому электролит в значительной степени влияет и даже определяет срок хранения батареи.
Для срока службы:
Срок службы является важным показателем для оценки достоинств вторичных батарей.
Существует множество факторов, влияющих на срок службы литий-ионных аккумуляторов, в том числе Обычно измеряется количеством циклов, когда емкость батареи снижается до определенного значения.
Обычно измеряется количеством циклов, когда емкость батареи снижается до определенного значения.1. стабильность материала электрода,
2. стабильность электролита,
3. скорость заряда и разряда ,
4. Глубина заряда и разряда
5.температура. Для литий-ионных аккумуляторов
6. Правильное использование и техническое обслуживание,
основными дополнительными причинами короткого срока службы аккумулятора являются следующие:- Активная удельная поверхность активного вещества электрода во время зарядки и Процесс разряда продолжает уменьшаться, истинная плотность тока батареи при работе увеличивается, а внутреннее сопротивление батареи постепенно увеличивается.
- Активное вещество коллектора электродов отваливается или переносится, теряя должную электрохимическую активность
- Во время работы батареи некоторые материалы в электролите стареют или подвергаются коррозии
- Мембрана повреждена или частично закрыта
- Из-за реакции окисления или восстановления электролита на границе раздела электродов количество примесей в электролите увеличивается
Из-за влияния вышеперечисленных факторов нормальный срок службы литий-ионных аккумуляторов в настоящее время составляет около 2-3 лет, причем большинство из вышеперечисленных факторов имеют определенную связь с характером электролита.
5. Влияние на безопасность батареи
Литий-ионные батареи заменяют растворение и отложение металлического лития в традиционных литиевых вторичных батареях с механизмом хранения лития внутри решетки, устраняя рост дендритного лития на поверхности отрицательного электрода и уменьшая вероятность короткого замыкания батареи, но это не устраняет принципиально риски безопасности батареи.
Например, жидкие литий-ионные батареи также будут осаждать металлический литий на поверхности отрицательного электрода в условиях перезарядки, в то время как поверхность положительного электрода будет окисляться и разлагать электролит в условиях высокого потенциала, и внутри будет происходить ряд небезопасных побочных реакций. батарея.
Кроме того, большое количество тепла, выделяемого аккумулятором в условиях сильноточной зарядки и разрядки, не может быть потеряно во времени, что приводит к быстрому повышению температуры аккумулятора, что также создает значительные проблемы с безопасностью для батарея.
Все мы знаем, что основными факторами, влияющими на безопасность литий-ионных аккумуляторов, являются следующие:
- стабильность материала электрода,
- Состав электролита,
- производственный процесс
- условия работы самой батареи
Тем не менее,
основной причиной проблемы безопасности жидких литий-ионных аккумуляторов является летучесть и высокая воспламеняемость самого органического жидкого электролита.
Таким образом, чтобы полностью устранить риски безопасности, связанные с батареями, необходимо исключить воспламеняемость органических растворителей.
Хотите узнать больше: загрузите нашу электронную книгу по дизайну аккумуляторов.
Lithium Battery Design Design Электронная книга Скачать (2M, 20 страниц, PDF)
6. Влияние на характеристики саморазряда батареи Скорость саморазряда литий-ионных батарей определяется:- тип и структура электродного материала,
- свойства интерфейса электрод/электролит,
- состав электролита
- производственный процесс батареи.

- Саморазряд отрицательного электрода.
Саморазряд отрицательного электрода происходит в основном из-за выпадения лития из отрицательного электрода или попадания в электролит в виде Li+.
Скорость зависит от состояния поверхности и поверхностной каталитической активности отрицательного электрода. Состояние поверхности отрицательного электрода, очевидно, зависит от электролита, поэтому оптимизация состава электролита может снизить плотность саморазряда батареи.
- Саморазряд положительного электрода:
Это относится к ионам лития в электролите, внедренным в решетку материала положительного электрода, что вызывает саморазряд положительного электрода. Его скорость зависит от кинетических факторов в положительном электроде, залитом Li+, в основном от свойств поверхности раздела положительного электрода или электролита.
Кроме того, появление примесей в электролите также является немаловажной причиной саморазряда аккумулятора.

Это связано с тем, что потенциал окисления примесей обычно ниже, чем потенциал положительного электрода литий-ионных аккумуляторов, который легко окисляется на поверхности положительного электрода, а оксид будет восстанавливаться на отрицательном электроде, таким образом, непрерывно потребляя активные вещества материалов положительных и отрицательных электродов, вызывая саморазряд.
Поэтому к литий-ионным аккумуляторам предъявляются высокие требования к составу и чистоте электролитов.
7. Влияние на перезарядку и переразряд батареиПоскольку электролит литий-ионной батареи не может обеспечить защиту от перезарядки или чрезмерной разрядки, когда батарея работает нормально, способность батареи сопротивляться перезарядке и чрезмерной разрядке снижается. очень бедный.
При некоторых условиях практического применения:Когда несколько литий-ионных аккумуляторов используются последовательно для получения более высокого напряжения, часто возникает значительное несоответствие емкости.

Когда аккумулятор заряжен, отдельные аккумуляторы всегда будут перезаряжены,
При разрядке отдельные аккумуляторы также будут переразряжены.
Этот аспект приводит к необратимому повреждению аккумуляторной батареи и влияет на срок службы аккумуляторной батареи; в то же время это также создает очевидные риски для безопасности батареи.
Почему электролит литиевых батарей влияет на перезарядку и чрезмерную разрядку?Модификация и модификация электролитов является важным способом предотвращения перезарядки и разрядки аккумуляторов.
Органический жидкий электролит имеет встроенный механизм защиты от перезарядки и разрядки.
Например, в электролит добавляют некоторые наркотические вещества. В условиях перезарядки вещество окисляется на положительном электроде, а окислитель восстанавливается на поверхности отрицательного электрода
, что позволяет избежать постоянного повышения напряжения батареи.
(1) Он должен быть хорошим ионным проводником и электронным изолятором, чтобы перенос ионов (Li+) был легким, а саморазряд сводился к минимуму;
(2) Должен иметь широкое электрохимическое окно, чтобы не происходила деградация электролита в диапазоне рабочих потенциалов как катода, так и анода;
(3) Он также должен быть инертным по отношению к другим компонентам элементов, таким как сепараторы элементов, подложки электродов и материалы для упаковки элементов;
(4) Должен быть термически стабильным, для жидких электролитов точки плавления и кипения должны быть намного выше рабочих температур;
(5) Он должен иметь низкую токсичность и соответствовать другим мерам ограниченной опасности для окружающей среды;
(6) Он должен быть основан на устойчивой химии, что означает, что элементы в изобилии, а процессы синтеза являются как можно менее вредными, и
(7) он должен иметь как можно более низкую общую стоимость, материалы и производство.

Какой электролит используется в литий-ионных батареях?
Большинство электролитов, используемых в коммерческих литий-ионных батареях, представляют собой неводные растворы. И соль гексафторфосфата лития (LiPF 6 ), растворенная в органических карбонатах. Гексафторфосфат лития (LiPF6) представляет собой раствор соли лития, который является наиболее распространенным электролитом в литиевых батареях.
Из чего состоит электролит батареи?
Электролит в большинстве бытовых аккумуляторов (и многих промышленных) состоит из двух частей: воды и гидроксида калия (КОН). Когда эти два компонента объединяются друг с другом, они образуют раствор, который позволяет электричеству свободно течь между электродами внутри элемента батареи — это известно как «электролиз» или «электролитическое действие».
Безопасен ли электролит литиевой батареи?
Да.
Литиевые батареи более безопасны, чем большинство других типов батарей, поскольку они не содержат тяжелых металлов или токсичных химических веществ.


 Достоинством такого типа батарей считается возможность их хранения на протяжении длительного времени. В данном случае долгое хранение батареи на складе или в гараже после покупки не повлияет на их функциональность. Но перед тем, как начать полноценно использовать АКБ, его нужно будет заправить электролитом.
Достоинством такого типа батарей считается возможность их хранения на протяжении длительного времени. В данном случае долгое хранение батареи на складе или в гараже после покупки не повлияет на их функциональность. Но перед тем, как начать полноценно использовать АКБ, его нужно будет заправить электролитом.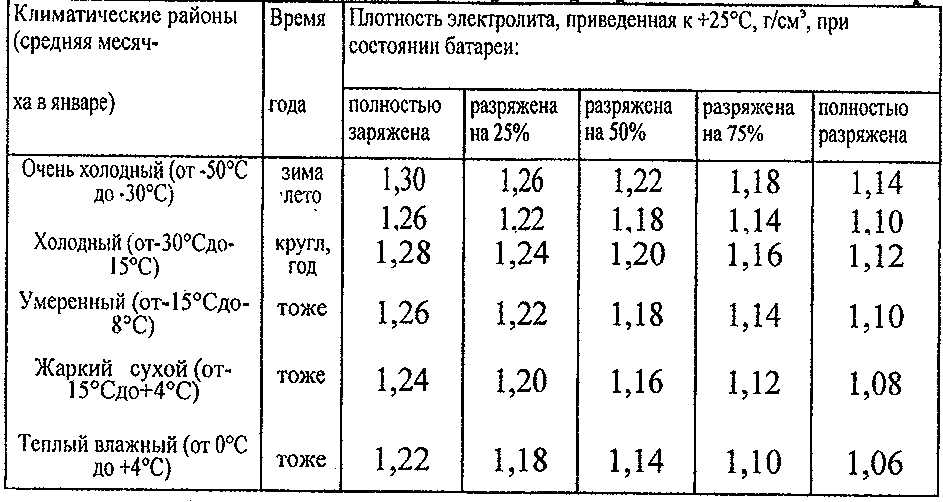 Но если значения, которые вы получили, сильно отличаются от номинальных, то скорей всего, в изделии происходит сильная утечка. Соответственно, автовладелец должен проверить батарею на предмет выявления утечки.
Но если значения, которые вы получили, сильно отличаются от номинальных, то скорей всего, в изделии происходит сильная утечка. Соответственно, автовладелец должен проверить батарею на предмет выявления утечки.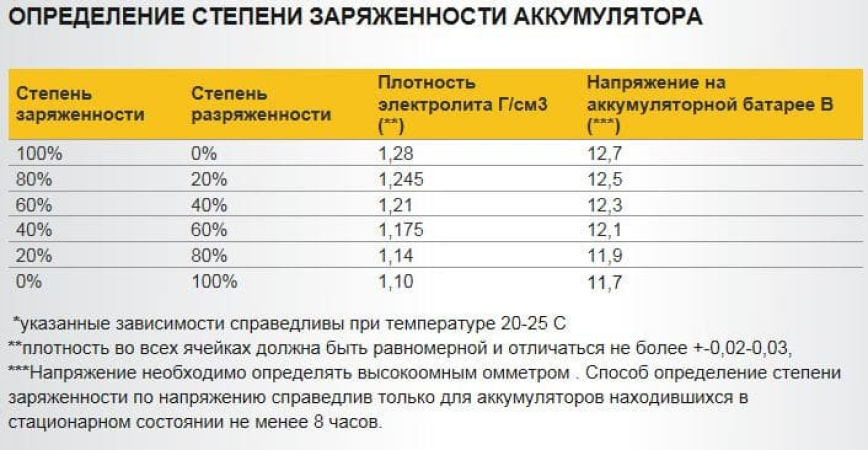 Учтите, что подготовленный резервуар должен быть не только чистым, но и кислотоустойчивым.
Учтите, что подготовленный резервуар должен быть не только чистым, но и кислотоустойчивым. Залейте дистиллят в емкость.
Залейте дистиллят в емкость.
 Тонкий слой изоляционного материала, называемый «сепаратором», находится в растворе электролита между двумя сторонами батареи. Сепаратор позволяет ионам лития проходить, блокируя электроны и разделяя два электрода. Во время зарядки ионы лития перемещаются через сепаратор с положительной стороны на отрицательную. Разряжаясь, ионы движутся в противоположном направлении.
Тонкий слой изоляционного материала, называемый «сепаратором», находится в растворе электролита между двумя сторонами батареи. Сепаратор позволяет ионам лития проходить, блокируя электроны и разделяя два электрода. Во время зарядки ионы лития перемещаются через сепаратор с положительной стороны на отрицательную. Разряжаясь, ионы движутся в противоположном направлении.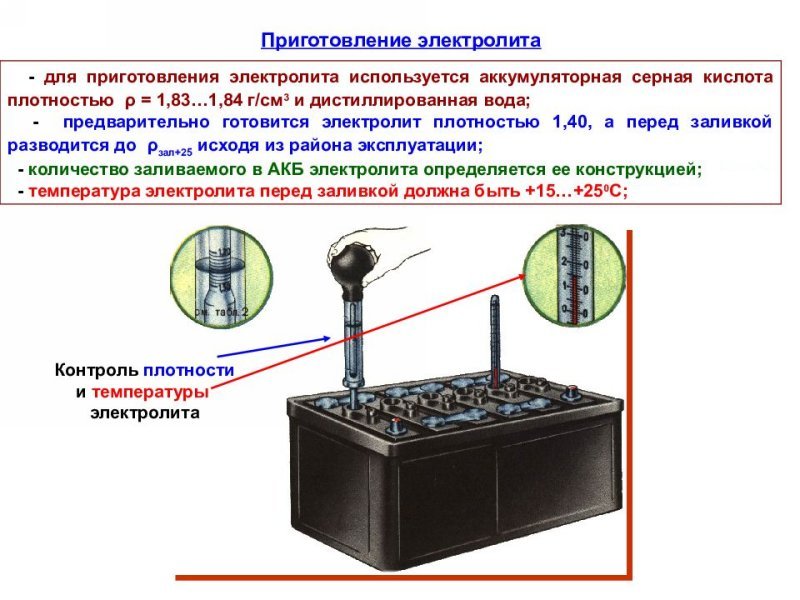


 В свинцово-кислотном аккумуляторе обычно используется серная кислота для создания предполагаемой реакции. Воздушно-цинковые батареи основаны на окислении цинка кислородом для реакции.
В свинцово-кислотном аккумуляторе обычно используется серная кислота для создания предполагаемой реакции. Воздушно-цинковые батареи основаны на окислении цинка кислородом для реакции. Органический жидкий электролит обладает хорошей электрохимической стабильностью,
Органический жидкий электролит обладает хорошей электрохимической стабильностью, 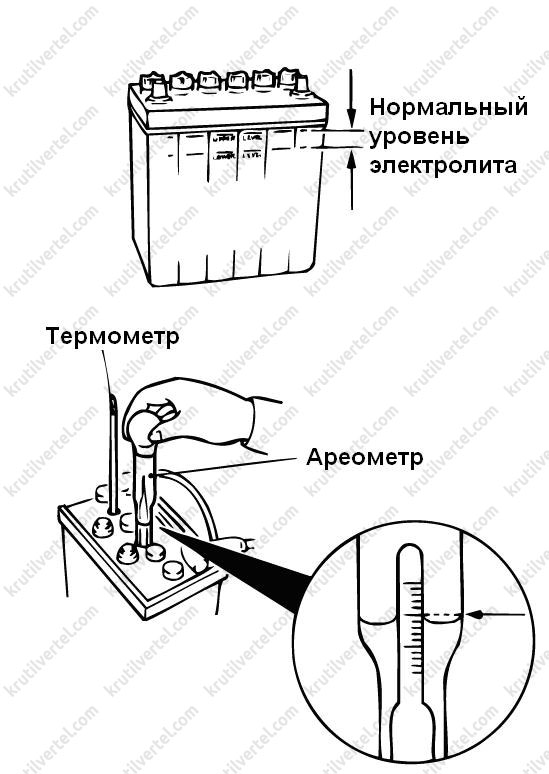 Таким образом, меры защиты батареи должны быть очень совершенными.
Таким образом, меры защиты батареи должны быть очень совершенными.


 Для литий-ионных аккумуляторов оно должно включать сопротивление поверхности раздела между электродом и электролитом.
Для литий-ионных аккумуляторов оно должно включать сопротивление поверхности раздела между электродом и электролитом.
 Обычно измеряется количеством циклов, когда емкость батареи снижается до определенного значения.
Обычно измеряется количеством циклов, когда емкость батареи снижается до определенного значения.