Зависимость изменения плотности электролита от его температуры
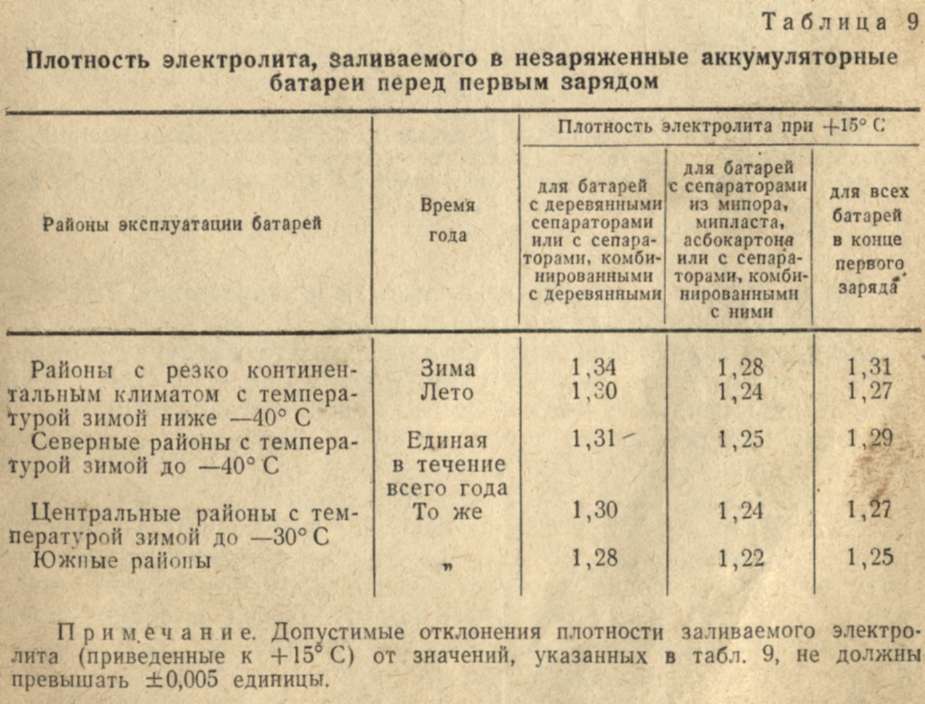
Таблица 1
Температура электролита,0С!! | Поправка к показанию денсиметра,г/см3 |
+60 +45 +30 +15 0 -15 -30 -40 | +0,03 +0,02 +0,01 0,09 -0,01 -0,02 -0,03 -0,04 |
17
Допускается
установка на автомобиль сухозаряженной
батареи после 20-минутной пропитки
ее электролитом, если батарея находилась
на хранении не больше 1 года, а температура
заливаемого электролита не превышает
15 °С.
Хранение и заряд.
Новые, не залитые электролитом, аккумуляторные батареи рекомендуется хранить в неотапливаемых помещениях при температуре до —50 °С. Батареи устанавливают крышками вверх. При этом должны быть плотно ввинчены пробки с приливами, установлены герметизирующие детали (уплотнительные диски), наклеены герметизирующие пленки. Перед началом эксплуатации проверяют состояние мастики на батареях обычной конструкции. Трещины удаляют, оплавляя мастику слабым пламенем газовой горелки или электрическим паяльником.
Батареи, снятые с
автомобилей после непродолжительной
эксплуатации, перед постановкой на
хранение полностью заряжают. Плотность
электролита доводят до нормы,
соответствующей данному климатическому
району. В период бездействия при
положительной температуре воздуха
батарею нужно ежемесячно подзаряжать.
При отрицательной температуре воздуха
можно ограничиться ежемесячной
проверкой плотности электролита, и
подзаряжать батарею только в тех
случаях, когда плотность электролита
снижается более чем на 0,04 г/см 3. В таком состоянии батареи могут храниться
не более 1,5 лет при отрицательной
температуре воздуха и не более 9 месяцев
(в пределах гарантийного срока
эксплуатации) при положительной
температуре.
В таком состоянии батареи могут храниться
не более 1,5 лет при отрицательной
температуре воздуха и не более 9 месяцев
(в пределах гарантийного срока
эксплуатации) при положительной
температуре.
Батареи, снятые с
автомобилей после длительной эксплуатации,
следует полностью зарядить и, доведя
плотность электролита до нормы,
подвергнуть тренировочному разряду
током 10-часового режима при температуре
электролита 18—27 °С. Батареи не
рекомендуется ставить на длительное
хранение, если длительность разряда
оказывается меньше 7,5; 6,5 и 5,5 ч при
плотности электролита соответственно
1,28; 1,26 и 1,24 г/см
При транспортировании
не залитых электролитом аккумуляторных
батарей необходимо обеспечить защиту
их от механических повреждений,
атмосферных осадков и попадания прямых
солнечных лучей.
Уход.
Уход за аккумуляторной батареей на автомобиле сводится к поддержанию в чистоте ее поверхности, периодической проверке состояния и зарядных режимов. Наличие на поверхности батареи электропроводного слоя пыли, смоченной водой или раствором серной кислоты, приводит к постепенному разряду батареи и коррозии металлических деталей крепления. Электролит с поверхности батареи удаляют чистой ветошью, смоченной в 1 %-ном растворе кальцинированной соды или в растворе нашатырного спирта. Не реже 2 раз в месяц следует проверять надежность крепления батареи, плотность контакта наконечников проводов с полюсными выводами и чистоту вентиляционных
18
отверстий пробок.
Выводы батареи и наконечники проводов рекомендуется смазывать техническим вазелином.
Вследствие
газовыделения и испарения воды постепенно
понижается уровень электролита. Для
его восстановления добавляют
дистиллированную воду. Электролит той
же плотности доливают в том случае, если
точно установлено выплескивание
электролита из аккумулятора. Причиной
выплескивания электролита на
поверхность крышки и быстрого уменьшения
его уровня может быть систематический
перезаряд батареи.
Причиной
выплескивания электролита на
поверхность крышки и быстрого уменьшения
его уровня может быть систематический
перезаряд батареи.
Уровень электролита определяют стеклянной трубкой диаметром 6—8 мм и длиной 100—120 мм. Трубку опускают в заливное отверстие до упора в предохранительный щиток. Верхний конец трубки закрывают пальцем и вытаскивают ее из аккумулятора. Высота столбика электролита в трубке соответствует уровню электролита в аккумуляторе над предохранительным щитком. Нормальным считается уровень в пределах 10—15 мм. В аккумуляторных батареях с прозрачными пластмассовыми моноблоками уровень электролита в каждом аккумуляторе контролируют через стенки моноблока.
Заряженные и
исправные аккумуляторные батареи теряют
емкость при длительном бездействии.
Потеря емкости при разомкнутой
внешней цепи обусловлена саморазрядом
вследствие недостаточной чистоты
активной массы и неравномерной плотности
электролита по высоте. Саморазряд связан
также с переходом сурьмы в раствор
серной кислоты в результате коррозии
решеток положительных электродов.
Саморазряд заряженной батареи, кроме необслуживаемой, после бездействия в течение 14 суток при температуре окружающего воздуха (20 ± 5) °С не должен превышать 10 % номинальной емкости, а после бездействия в течение 28 суток 20 %. Саморазряд необслуживаемой батареи (например, 6СТ-55АЗ) после ее бездействия в течение 90 суток не должен превышать 10 % номинальной емкости, а после бездействия в течение года 40 %.
19
Один раз в три месяца и при снижении надежности пуска двигателя следует проверять степень разреженности батареи по плотности электролита. Плотность электролита измеряют денсиметром 3, помещенным в стеклянную пипетку 2 (рис. 8 а) или плотномером (рис. 8,б).
 При отпускании груши
полость пипетки заполняется электролитом.
Плотность электролита определяют
по делению шкалы денсиметра,
которая устанавливается на уровне
мениска электролита. Во время
отсчета показаний денсиметра уровень
электролита в пипетке должен совпадать
с уровнем глаз. Чтобы учесть
температурную поправку, одновременно
с плотностью измеряют температуру
электролита. В прозрачном
пластмассовом корпусе 6 плотномера
(см. рис. 8 б) размещены
поплавки 7, имеющие различную
массу. При измерении полость
плотномера заполняют электролитом.
Плотность определяют по тому из всплывших
поплавков, против которого
на прозрачном корпусе выполнена надпись
с большим значением
плотности. Для повышения точности
измерений необходимо
отвести определенное время на выравнивание
температуры электролита и
поплавков
При отпускании груши
полость пипетки заполняется электролитом.
Плотность электролита определяют
по делению шкалы денсиметра,
которая устанавливается на уровне
мениска электролита. Во время
отсчета показаний денсиметра уровень
электролита в пипетке должен совпадать
с уровнем глаз. Чтобы учесть
температурную поправку, одновременно
с плотностью измеряют температуру
электролита. В прозрачном
пластмассовом корпусе 6 плотномера
(см. рис. 8 б) размещены
поплавки 7, имеющие различную
массу. При измерении полость
плотномера заполняют электролитом.
Плотность определяют по тому из всплывших
поплавков, против которого
на прозрачном корпусе выполнена надпись
с большим значением
плотности. Для повышения точности
измерений необходимо
отвести определенное время на выравнивание
температуры электролита и
поплавков 20
после заполнения плотномера электролитом.
Разреженность
батареи по величине измеренной плотности
определяют
с учетом начальной плотности электролита
полностью
заряженной батареи в соответствии с
климатическим районом
эксплуатации (табл. 2).
2).
Таблица заряда аккумулятора аккумулятора автомобиля на 12 вольт по напряжению
Автор Акум Эксперт На чтение 6 мин Просмотров 30к. Опубликовано Обновлено
Из-за разряженной батареи автомобиль может не завестись в нужный момент. Поэтому автолюбитель должен уметь определять степень заряженности аккумулятора. Самый простой способ – измерить разность потенциалов на клеммах. Для этого нужны вольтметр и таблица заряда аккумулятора автомобиля по напряжению. Можно также оценить количество запасенной энергии по плотности электролита, но этот метод подходит не для всех батарей.
Содержание
- Таблица для определения степени заряда автомобильного АКБ по напряжению
- Определяем по плотности электролита
- Как измерить напряжение на батарее
- До какого напряжения нужно заряжать аккумулятор и как правильно это делать
Таблица для определения степени заряда автомобильного АКБ по напряжению
Определить степень разряженности автомобильного аккумулятора можно по таблице заряда аккумулятора.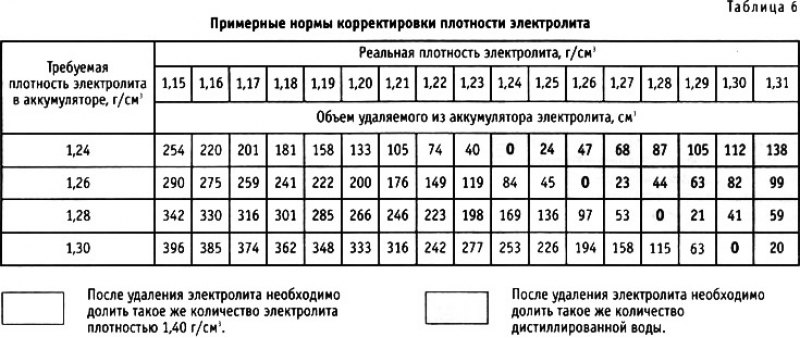 Для этого нужно измерить разность потенциалов на клеммах и посмотреть уровень заряда в процентах по приведенной ниже таблице.
Для этого нужно измерить разность потенциалов на клеммах и посмотреть уровень заряда в процентах по приведенной ниже таблице.
Определяем по плотности электролита
В состав электролита входит серная кислота и дистиллированная вода. Чистая серная кислота растворяет металлы. Поэтому, чтобы она не смогла повредить свинцовым пластинкам, ее разбавляют водой. Но если воды будет слишком много, протекание химических реакций затруднится.
Так как плотность воды и кислоты разные, то по плотности можно оценить соотношение компонентов в электролите. Если она выше нормы, значит, кислоты больше чем требуется. Соответственно, разложение свинцовых пластин идет быстрее. Оптимальной считается плотность 1,27 г/мл.
Плотность электролита зависит от температуры. Чем ниже температура, тем ниже плотность.
Зависимость плотности электролита от температурыАвтомобиль не будет постоянно эксплуатироваться в идеальных условиях. Он может использоваться для поездок на короткие дистанции. При этом двигатель часто запускается, а восстановить заряд не успевает. В таком случае будет идти ускоренная сульфатация свинцовых пластин, в результате чего плотность электролита снизится.
При этом двигатель часто запускается, а восстановить заряд не успевает. В таком случае будет идти ускоренная сульфатация свинцовых пластин, в результате чего плотность электролита снизится.
Если постоянно ездить на машине на большие расстояния, может произойти перезаряд аккумулятора. В результате этого электролит закипит, концентрация воды в нем уменьшится, а плотность увеличится.
В каждом из этих случаев напряжение на АКБ не будет соответствовать уровню заряда батареи. Поэтому, чтобы полностью контролировать состояние батареи, нужно регулярно измерять плотность электролита по методике .
Как измерить напряжение на батарее
Проще всего определить степень заряда аккумулятора по напряжению. Однако при этом нужно придерживаться правил:
- проводить измерения можно через 4-5 часов после заряда, чтобы параметры успели стабилизироваться;
- АКБ должен быть отключен от нагрузки;
- Если все условия выполнены нужно выставить на приборе необходимый предел измерения и подключить его к клеммам батареи.

О том, как пользоваться мультиметром и проверить с его помощью аккумулятор, можно .
До какого напряжения нужно заряжать аккумулятор и как правильно это делать
Сначала разберемся как правильно заряжать аккумулятор. Существует два способа:
- постоянным током;
- постоянным напряжением.
Зарядка постоянным током включает в себя три этапа:
- Сначала нужно установить величину тока. Она должна равняться 10% от емкости батареи. Например, для АКБ емкостью 80 Ач нужно, чтобы зарядный ток был равен 8 А. Разность потенциалов на клеммах начнет постепенно увеличиваться.
- Когда разность потенциалов достигнет уровня 14,4 В, начнется процесс электролиза воды. В результате этого вода разлагается на кислород и водород и электролит «закипает». Чтобы его замедлить, нужно уменьшить зарядный ток в 3 раза. Если он у нас был 8 А, то нужно снизить его до 3 А.
- Когда на клеммах напряжение станет равным 15 В, нужно еще раз уменьшить зарядный ток в два раза.
 В нашем случае он должен стать равным 1,5 А. На этом этапе нужно проверять показания приборов не реже 1 раза в 2 часа. Когда разность потенциалов и ток стабилизируются, то есть текущие показания мультиметра будут идентичны измеренным на один или два часа раньше, аккумулятор можно считать заряженным.
В нашем случае он должен стать равным 1,5 А. На этом этапе нужно проверять показания приборов не реже 1 раза в 2 часа. Когда разность потенциалов и ток стабилизируются, то есть текущие показания мультиметра будут идентичны измеренным на один или два часа раньше, аккумулятор можно считать заряженным.
Мнение эксперта
Алексей Бартош
Специалист по ремонту, обслуживанию электрооборудования и промышленной электроники.
Задать вопросНедостатком этого метода зарядки является необходимость постоянно контролировать параметры зарядки.
График процесса зарядки постоянным токомПроцесс зарядки постоянным напряжением заключается в поддержании постоянной разности потенциалов на выводах аккумулятора. Данную схему удобно использовать при использовании зарядки которая оснащена автоматической системой регулировки параметров зарядки.
По мере зарядки ток снижается. Когда он уменьшится до величины 0,2 А, АКБ будет считаться заряженным. При этом следует также обращать внимание на зарядный ток – он должен быть на уровне 10% от емкости.![]() Если он больше 20%, то нужно временно уменьшить напряжение на батарее. Иначе она может выйти из строя.
Если он больше 20%, то нужно временно уменьшить напряжение на батарее. Иначе она может выйти из строя.
При восстановлении АКБ после глубокого разряда ток не должен быть выше 5% от емкости. При этом начальная разность потенциалов обычно находится в диапазоне от 12 до 13 В.
При использовании данного способа пополнения энергии время заряда зависит от величины напряжения:
- если заряжать постоянным напряжением 14,4 В, то через 24 часа уровень энергии будет равен 80%;
- если установить показания вольтметра на уровне 15 В, то через 24 часа уровень заряда достигнет величины 90%;
- используя напряжение величиной 16 В можно зарядить батарею за сутки.
График заряда постоянным напряжениемВажно! Заряжать аккумулятор напряжением более 15,6 В небезопасно. А при глубокой разрядке на восстановление может потребоваться несколько суток.
После зарядки желательно определить уровень запасенной энергии. Для начала измерим разность потенциалов на клеммах. У полностью заряженной батареи оно должно быть равно 12,7 В. Если используется нестандартный АКБ разность потенциалов может достигать от 13 до 13,3 В.
У полностью заряженной батареи оно должно быть равно 12,7 В. Если используется нестандартный АКБ разность потенциалов может достигать от 13 до 13,3 В.
Чтобы полнее оценить состояние батареи рекомендуется провести тестирование под нагрузкой. Для этого нам потребуется лампочка мощностью 40 Вт. Подключаем лампочку к выводам аккумулятора и измеряем разность потенциалов. Напряжение должно просесть на небольшую величину. Если оно уменьшится больше, чем на 0,5 В при незначительной нагрузке, то такой АКБ скоро выйдет из строя и его необходимо менять.
Для тестирования можно также воспользоваться нагрузочной вилкой. Здесь батарея нагружается большим током. Чтобы оценить состояние АКБ, нужно воспользоваться следующей таблицей.
Определение состояния с помощью нагрузочной вилкиРекомендуется также проверить напряжение на аккумуляторе при запущенном двигателе. Для этого нужно запустить двигатель и дать ему поработать в течение 15 минут. Обычно в этом случае показания приборов находятся в диапазоне от 13,5 до 14 В. Если они ниже (от 13 до 13,4 В), то батарея заряжена не полностью. Тогда энергия, получаемая от генератора, расходуется на зарядку батареи.
Если они ниже (от 13 до 13,4 В), то батарея заряжена не полностью. Тогда энергия, получаемая от генератора, расходуется на зарядку батареи.
На втором этапе включаем имеющиеся электроприборы: отопительную систему, дальний свет, аудиоустройства и другие. В результате разность потенциалов должна просесть не более чем на 0,2 … 0,3 В. При большем падении нужно проверить генератор и реле.
О том, какое напряжение должно быть на заряженном АКБ .
Если аккумулятор относится к категории обслуживаемых, то желательно также измерить плотность электролита. Она должна быть равна 1,27 г/см3.
Сейчас читают:Исследование совместимости галогенидных твердотельных электролитов в твердотельных батареях в зависимости от температуры
1 Введение
В качестве накопителей энергии литий-ионные батареи широко применялись в портативных электронных устройствах и электромобилях после десятилетий быстрого развития. Однако коммерческие литий-ионные батареи имеют очевидные недостатки из-за воспламеняемости и утечки органических жидких электролитов, что может привести к серьезным проблемам с безопасностью (Li et al. , 2018). Безопасность батареи можно было бы повысить за счет разработки полностью твердотельной литиевой батареи, в которой жидкий электролит заменен твердотельными электролитами (Wang et al., 2012; Manthiram et al., 2017). Будучи наиболее важным компонентом полностью твердотельной литиевой батареи, твердотельные электролиты (SSE) требуют не только высокой ионной проводимости и широкого электрохимического диапазона, но и хорошей межфазной совместимости с другими материалами батареи для формирования стабильных границ раздела в полностью твердотельных электролитах. государственные литиевые батареи (АСЛБ) (зима 2009 г.). Тем не менее, создание стабильного интерфейса остается огромной проблемой; использование простых и эффективных приборов для изучения совместимости электродов и электролитов облегчит построение стабильных интерфейсов. Недавно Седер и соавт. предложил методологию, сочетающую расчеты теории функционала плотности и простые экспериментальные методы для изучения межфазной совместимости между многочисленными электролитами и электродами, и отсеял более 20 различных пар электрод/электролит с хорошей совместимостью для твердотельных натриевых батарей (Tian et al.
, 2018). Безопасность батареи можно было бы повысить за счет разработки полностью твердотельной литиевой батареи, в которой жидкий электролит заменен твердотельными электролитами (Wang et al., 2012; Manthiram et al., 2017). Будучи наиболее важным компонентом полностью твердотельной литиевой батареи, твердотельные электролиты (SSE) требуют не только высокой ионной проводимости и широкого электрохимического диапазона, но и хорошей межфазной совместимости с другими материалами батареи для формирования стабильных границ раздела в полностью твердотельных электролитах. государственные литиевые батареи (АСЛБ) (зима 2009 г.). Тем не менее, создание стабильного интерфейса остается огромной проблемой; использование простых и эффективных приборов для изучения совместимости электродов и электролитов облегчит построение стабильных интерфейсов. Недавно Седер и соавт. предложил методологию, сочетающую расчеты теории функционала плотности и простые экспериментальные методы для изучения межфазной совместимости между многочисленными электролитами и электродами, и отсеял более 20 различных пар электрод/электролит с хорошей совместимостью для твердотельных натриевых батарей (Tian et al. , 2017). ).
, 2017). ).
За последние несколько десятилетий были использованы многочисленные ССЭ, которые в основном можно разделить на полимеры, оксиды, сульфиды и галогениды (Gao et al., 2018). Среди них галогенидные SSE являются многообещающими кандидатами для крупномасштабного строительства ASSLB из-за их высокой ионной проводимости, относительно хорошей межфазной совместимости и простоты подготовки с помощью механического измельчения в шаровой мельнице и низкотемпературного спекания (Li et al., 2020) . Каменная соль типа Li 3 MCl 6 (M = In, Y, Sc) и антиперовскитового типа Li 3- x OH x X (X = Cl, Br) представляют собой два типичных галогенидных SSE. С точки зрения совместимости интерфейсов между ними действительно большая разница. Например, Li 3 YCl 6 показал хорошую устойчивость к электрохимическому окислению. Защищенный LiCoO 2 с использованием Li 3 YCl 6 продемонстрировал высокую начальную кулоновскую эффективность 94,8 %, что резко контрастирует с 84,0 % с использованием Li 3 9.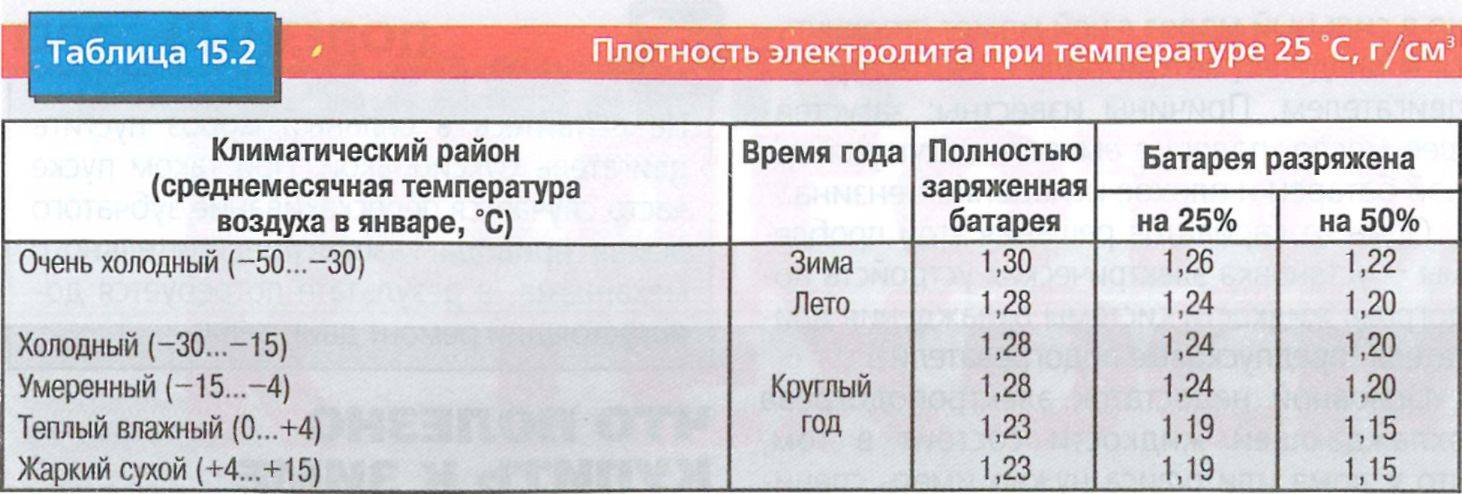 0008 PS 4 (Асано и др., 2018). Однако Li 3 MCl 6 показали плохую стабильность к электрохимическому восстановлению, что препятствовало их применению в металлическом литиевом аноде. Риггер и др. (2021) сообщили о нестабильности Li 3 InCl 6 (Li 3 YCl 6 ) с металлическим литием и образовали пассивирующий слой с высоким межфазным сопротивлением с помощью in situ рентгеновской спектроскопии и спектра импеданса. Напротив, Li 2 OHX (X = Cl, Br) продемонстрировал хорошую устойчивость к электрохимическому восстановлению и хорошую устойчивость к аноду из металлического лития (Hood et al., 2016). Несмотря на то, что исследований по этим двум классам материалов довольно много, вопросы межфазной поверхности до сих пор не исследованы всесторонне и систематически.
0008 PS 4 (Асано и др., 2018). Однако Li 3 MCl 6 показали плохую стабильность к электрохимическому восстановлению, что препятствовало их применению в металлическом литиевом аноде. Риггер и др. (2021) сообщили о нестабильности Li 3 InCl 6 (Li 3 YCl 6 ) с металлическим литием и образовали пассивирующий слой с высоким межфазным сопротивлением с помощью in situ рентгеновской спектроскопии и спектра импеданса. Напротив, Li 2 OHX (X = Cl, Br) продемонстрировал хорошую устойчивость к электрохимическому восстановлению и хорошую устойчивость к аноду из металлического лития (Hood et al., 2016). Несмотря на то, что исследований по этим двум классам материалов довольно много, вопросы межфазной поверхности до сих пор не исследованы всесторонне и систематически.
ASSLB часто требуют высокой плотности для достижения высокой плотности энергии и хорошего межфазного контакта с большими площадями контакта за счет внешнего давления и термообработки.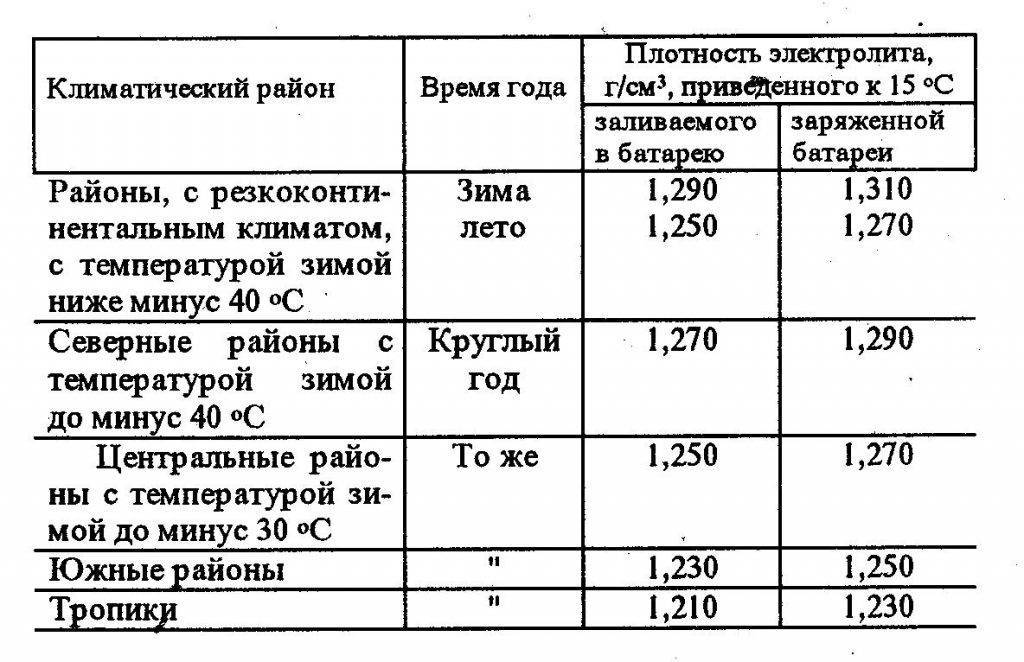 Однако этот процесс обычно ускоряет взаимную диффузию элементов на границе раздела, приводя к реакции разложения. В данной работе изучена температурно-зависимая межфазная совместимость галогенидных ЭСЭ (Li 3 InCl 6 (LIC), Li 2 OHCl (LOHC)) с катодом (LiCoO 2 (LCO), LiFePO 4 (LFP), LiMn 2 O 4 (LMO), Li-rich, LiNi 0,8 Co 0,1 Mn 0,1 900 08 O 2 (ЛНМО), LiNi 0,5 Mn 1,5 O 4 (LNMO)), анод (графит, Si-C, Li 4 Ti 5 O 12 (LTO) и ССЭ (Li 1,3 Ал 0,3 Ti 1.7 (PO 4 ) 3 (LATP), Li 10 GeP 2 S 12 (LGPS)) исследованы термическим анализом методом одновременной термогравиметрии метрии и дифференциальной сканирующей калориметрии (ТГ–ДСК ) и рентгеновской дифракции (XRD).Результаты показали, что Li 2 OHCl имеет высокую химическую активность после плавления, в то время как межфазная совместимость Li 3 InCl 6 относительно хорошая.
Однако этот процесс обычно ускоряет взаимную диффузию элементов на границе раздела, приводя к реакции разложения. В данной работе изучена температурно-зависимая межфазная совместимость галогенидных ЭСЭ (Li 3 InCl 6 (LIC), Li 2 OHCl (LOHC)) с катодом (LiCoO 2 (LCO), LiFePO 4 (LFP), LiMn 2 O 4 (LMO), Li-rich, LiNi 0,8 Co 0,1 Mn 0,1 900 08 O 2 (ЛНМО), LiNi 0,5 Mn 1,5 O 4 (LNMO)), анод (графит, Si-C, Li 4 Ti 5 O 12 (LTO) и ССЭ (Li 1,3 Ал 0,3 Ti 1.7 (PO 4 ) 3 (LATP), Li 10 GeP 2 S 12 (LGPS)) исследованы термическим анализом методом одновременной термогравиметрии метрии и дифференциальной сканирующей калориметрии (ТГ–ДСК ) и рентгеновской дифракции (XRD).Результаты показали, что Li 2 OHCl имеет высокую химическую активность после плавления, в то время как межфазная совместимость Li 3 InCl 6 относительно хорошая. Эта работа дала представление о выборе подходящих материалов для батарей с хорошей совместимостью для ASSLB.
Эта работа дала представление о выборе подходящих материалов для батарей с хорошей совместимостью для ASSLB.
2 Эксперимент
2.1 Подготовка материала
Порошки LOHC были приготовлены с использованием твердофазной реакции. (Дэн и др., 2020). Молярное соотношение составляло 1,05:1 для LiOH (99% масс., Aladdin) и LiCl (99% масс., Aladdin). Во-первых, LiOH (99% масс., Aladdin) и LiCl (99% масс., Aladdin) взвешивали с молярным соотношением 1,05:1, растирали и смешивали в ступке. Затем смесь помещали в никелевый тигель, нагревали до 400°С, выдерживали 4 ч и охлаждали естественным путем. Наконец, продукт измельчали в мелкий порошок. Другие материалы для аккумуляторов, включая катодные материалы LCO, LFP, LMO, Li-rich, NCM811 и LNMO; анодные материалы из графита, Si-C и LTO; SSE LIC, LATP и LGPS имеются в продаже. Каждый материал батареи был смешан либо с LIC, либо с LOHC, соответственно, в массовом соотношении 1:1. Спекание порошка замеса проводили в никелевом тигле при 170 и 320°С соответственно. Время выдержки при каждой температуре составляло 4 часа, скорость нагрева составляла 5 К/мин, а режим охлаждения был естественным охлаждением. После термообработки спеченные образцы растирали в ступке в порошок для последующей характеристики.
Время выдержки при каждой температуре составляло 4 часа, скорость нагрева составляла 5 К/мин, а режим охлаждения был естественным охлаждением. После термообработки спеченные образцы растирали в ступке в порошок для последующей характеристики.
2.2 Характеристика
Кристалличность образцов измеряли с помощью PANalytical Diffraction System с излучением Cu Kα. Порошки защищали от влаги воздуха с помощью полиимидной пленки. Фазовый анализ проводили с использованием базы данных файлов порошковой дифракции (PDF) (PDF, ссылочные номера перечислены в дополнительной таблице S1). Одновременный термический анализ проводился с использованием NETZSCH STA 449F3 в атмосфере N 2 при температуре от комнатной до 350°C при скорости нагрева и охлаждения 5 К/мин.
3 Результаты и обсуждение
Как показано на рисунке 1A и дополнительном рисунке S1A, все кривые ТГ-ДСК исследованных катодов, включая LNMO, NCM811, Li-rich, LMO, LCO и LFP, не показывают явного пика, что свидетельствует о хорошем термическая стабильность при температуре ниже 350°C. На дополнительном рисунке S2 показаны кривые ТГ-ДСК LOHC и LIC. Эндотермический пик около 45°С в процессе нагрева LOHC указывает на фазовый переход из орторомбической в кубическую антиперовскитную фазу, а последующая пара эндотермических и экзотермических пиков соответствует процессу плавления и затвердевания LOHC. Хотя на рисунке 1B нет других значимых пиков, рентгенограммы, показанные на рисунке 2 и дополнительном рисунке S3, демонстрируют очевидные химические реакции смесей NCM811/LNMO/LFP + LOHC после термообработки при 320 °C. Смеси NCM811 + LOHC указывают на LiCoO 2 и Li x NiO 2 отражения, смеси LNMO + LOHC показывают LiMnO 2 и Li x NiO 2 отражений, а смеси LFP + LOHC указывают на отражения LiCl. Перекрытие эндотермической реакции и эндотермики плавления является результатом химической реакции этих смесей после плавления LOHC. Подтверждено также, что рентгенограммы этих смесей после термообработки при 170°С не демонстрируют явного пика примесей, что указывает на их термическую стабильность при относительно низких температурах.
На дополнительном рисунке S2 показаны кривые ТГ-ДСК LOHC и LIC. Эндотермический пик около 45°С в процессе нагрева LOHC указывает на фазовый переход из орторомбической в кубическую антиперовскитную фазу, а последующая пара эндотермических и экзотермических пиков соответствует процессу плавления и затвердевания LOHC. Хотя на рисунке 1B нет других значимых пиков, рентгенограммы, показанные на рисунке 2 и дополнительном рисунке S3, демонстрируют очевидные химические реакции смесей NCM811/LNMO/LFP + LOHC после термообработки при 320 °C. Смеси NCM811 + LOHC указывают на LiCoO 2 и Li x NiO 2 отражения, смеси LNMO + LOHC показывают LiMnO 2 и Li x NiO 2 отражений, а смеси LFP + LOHC указывают на отражения LiCl. Перекрытие эндотермической реакции и эндотермики плавления является результатом химической реакции этих смесей после плавления LOHC. Подтверждено также, что рентгенограммы этих смесей после термообработки при 170°С не демонстрируют явного пика примесей, что указывает на их термическую стабильность при относительно низких температурах.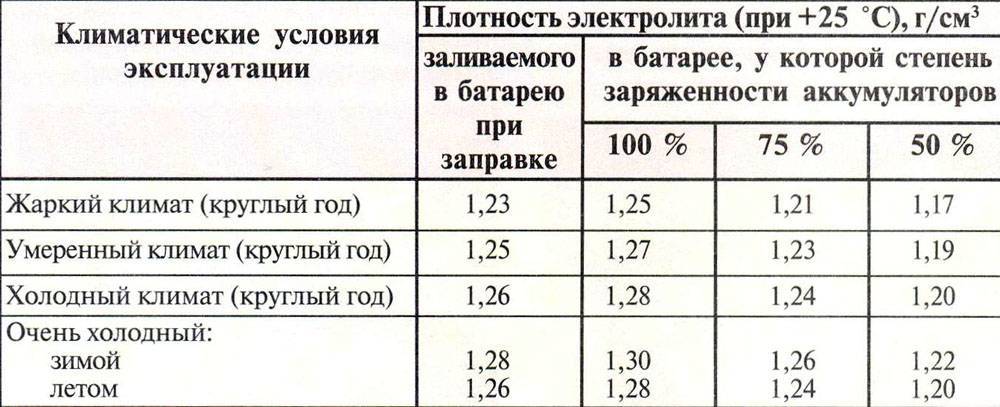 Это связано с тем, что расплавленный LOHC имеет свободные радикалы гидроксида и Cl — , обладающий более высокой реакционной способностью, чем твердая фаза. Напротив, катоды с высоким содержанием лития, LCO и LMO имеют более высокую совместимость с расплавленным LOHC.
Это связано с тем, что расплавленный LOHC имеет свободные радикалы гидроксида и Cl — , обладающий более высокой реакционной способностью, чем твердая фаза. Напротив, катоды с высоким содержанием лития, LCO и LMO имеют более высокую совместимость с расплавленным LOHC.
РИСУНОК 1 . Результаты ДСК и ТГ катода (A) , смесей катод/LOHC (B) и смесей катод/LIC (C) . Вставка Ⅰ представляет собой увеличение отмеченных областей. Смещение сигнала DSC: 1 единица (для NCM811) и 2 единицы (для LNMO). Смещение сигнала TG: 2 единицы (для NCM811) и 4 единицы (для LNMO).
РИСУНОК 2 . Рентгенограммы Li-rich/LOHC (A) , NCM811/LOHC (B) , LNMO/LOHC (C) , Li-rich/LIC (D) , NCM811/LIC (E) и LNMO/LIC (F) , которые были спечены при 170 и 320°C, и смешаны порошки при комнатной температуре. В дополнительной таблице S1 перечислены рекомендуемые эталонные шаблоны.
В дополнительной таблице S1 перечислены рекомендуемые эталонные шаблоны.
По сравнению с LOHC, LIC имеет более высокую температуру плавления и хорошую совместимость с такими катодными материалами, как LNMO, LCO, LFP и LMO. Как кривые ТГ-ДСК, так и рентгенограммы не показывают очевидной химической реакции их смесей с LIC после отжига при 320 ° C (показаны на рисунках 1 и 2 и дополнительных рисунках S1 и S3). Однако катоды NCM811 и Li-rich демонстрируют плохую термическую стабильность при LIC. Значительно необратимый эндотермический пик около 170°C наблюдался на кривой ДСК смесей NCM811 + LIC, что соответствует образованию большого количества примесей InOCl и LiCl, как показано на рисунке 2E. Для сравнения, кривая ДСК смеси Li-rich + LIC показывает относительно более слабые экзотермические пики при более высоких температурах (показаны на рисунке 1C) и меньшее количество примесей InOCl и LiCl (показаны на рисунке 2D). Это указывает на плохую межфазную совместимость LIC с катодными материалами NCM811/Li-rich.
Графит, Si-C и LTO, как три распространенных материала анода, выбраны здесь для изучения совместимости анода с галогенидными SSE. Как показано на рисунке 3A, графит, Si-C и Li 4 Ti 5 O 12 демонстрируют хорошую термическую стабильность, а кривые ТГ-ДСК не выявили каких-либо существенных признаков ниже 350°C. Подобно кривым ТГ-ДСК смесей катод + LOHC, на рисунке 3B не показана другая термическая реакция смесей анод + LOHC, за исключением эндотермических и экзотермических пиков в LOHC. Однако на рис. 4В показано образование примесей LiCl после отжига при 320°C. Это указывает на то, что LOHC термически неустойчив с анодом Si-C и что Si может окисляться щелочным веществом при нагревании с образованием силиката и выделением водорода, массой которого можно пренебречь, и, таким образом, изменение массы в ТГ не очевидно. кривая (рис. 3B). LTO и графит, естественно, довольно стабильны. Следовательно, графит и анодные материалы LTO сравнительно стабильны при ожидаемом LOHC.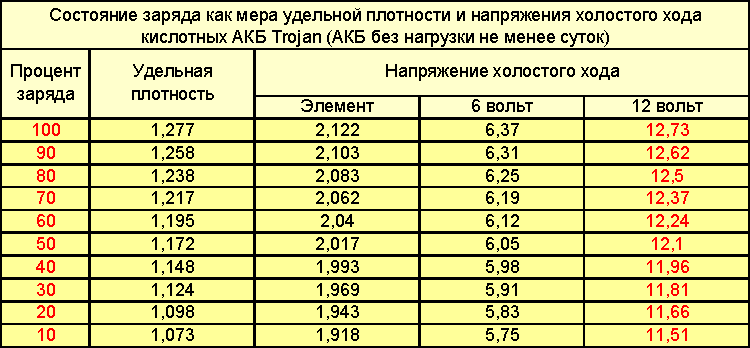 Как показано на рисунках 3 и 4, на диаграммах TD-DSC и XRD для смесей LTO-LOHC и графит-LOHC нет очевидных признаков реакции. Другим положительным результатом является то, что как кривые ТГ-ДСК, так и рентгенограммы смесей анод + LIC также не показывают видимых изменений, что указывает на хорошую термическую совместимость этих материалов анода с LIC.
Как показано на рисунках 3 и 4, на диаграммах TD-DSC и XRD для смесей LTO-LOHC и графит-LOHC нет очевидных признаков реакции. Другим положительным результатом является то, что как кривые ТГ-ДСК, так и рентгенограммы смесей анод + LIC также не показывают видимых изменений, что указывает на хорошую термическую совместимость этих материалов анода с LIC.
РИСУНОК 3 . Результаты ДСК и ТГ для анода (A) , смесей анод/LOHC (B) и смесей анод/LIC (C) . Смещение сигнала ЦИВ: 1 единица (для Si-C) и 2 единицы (для LTO). Смещение сигнала TG: 2 единицы (для Si-C) и 4 единицы (для LTO).
РИСУНОК 4 . Рентгенограммы графита/LOHC (A) , Si-C/LOHC (B) , LTO/LOHC (C) , графита/LIC (D) , Si-C/LIC € , и LTO/LIC (F) смеси, которые были спечены при 170 и 320°C и смешанные порошки при комнатной температуре. В дополнительной таблице S1 перечислены рекомендуемые эталонные шаблоны.
В дополнительной таблице S1 перечислены рекомендуемые эталонные шаблоны.
Для решения межфазных проблем также было предложено смешивать различные электролиты, чтобы объединить их соответствующие преимущества. (Чжао и др., 2016; Ван и др., 2022). Следовательно, межфазная совместимость между электролитами также нуждается в дальнейшем изучении. На рис. 5 показаны результаты ТГ-ДСК ССЭ и смесей ССЭ с LOHC или LIC. Кривая ДСК на рисунке 5A показывает, что LGPS и LATP являются термически стабильными в измеренном диапазоне температур, без значительной эндо- или экзотермической реакции и без очевидного изменения массы. Термические характеристики трех смесей SSE + LOHC показаны на рисунке 5B после начального фазового перехода LOHC при температуре около 45°C и процесса плавления LOHC при 297°C, экзотермическая реакция наблюдалась при 299°C для смесей LATP + LOHC и LGPS + LOHC. Кроме того, применительно к этим трем смесям в этом процессе наблюдается значительная потеря массы, что означает протекание реакции разложения в смесях ССЭ + LOHC, сопровождающееся выделением H 2 O. Рентгенограммы ССЭ + LOHC смесей показаны на рис. 6. В соответствии с результатами термического анализа для смесей LATP + LOHC и LGPS + LOHC наблюдаемая дифрактограмма образца, спеченного при 170°C, такая же, как у неспеченного смешанного порошка, и пики могут индексироваться с помощью SSE, Li 2 OHCl или Li 3 InCl 6 . После спекания при 320°С смеси LIC + LOHC образуют примеси LiCl и In 2 O 3 . Смеси LATP + LOHC образуют примесь LiCl, а смеси LGPS + LOHC — примеси LiCl и Li 2 S. Как показано на рисунке 5C, смеси LGPS + LIC имеют экзотермическую реакцию при 190°C без явного изменения массы во всем измеренном диапазоне температур. Смеси LGPS + LIC образуют примесь LiCl. Напротив, смеси LATP + LIC проявляют стабильность при 350°C без термической реакции и изменений XRD, как показано на рисунке 5C и рисунках 6D и E.
Рентгенограммы ССЭ + LOHC смесей показаны на рис. 6. В соответствии с результатами термического анализа для смесей LATP + LOHC и LGPS + LOHC наблюдаемая дифрактограмма образца, спеченного при 170°C, такая же, как у неспеченного смешанного порошка, и пики могут индексироваться с помощью SSE, Li 2 OHCl или Li 3 InCl 6 . После спекания при 320°С смеси LIC + LOHC образуют примеси LiCl и In 2 O 3 . Смеси LATP + LOHC образуют примесь LiCl, а смеси LGPS + LOHC — примеси LiCl и Li 2 S. Как показано на рисунке 5C, смеси LGPS + LIC имеют экзотермическую реакцию при 190°C без явного изменения массы во всем измеренном диапазоне температур. Смеси LGPS + LIC образуют примесь LiCl. Напротив, смеси LATP + LIC проявляют стабильность при 350°C без термической реакции и изменений XRD, как показано на рисунке 5C и рисунках 6D и E.
РИСУНОК 5 . Результаты ДСК и ТГ SSE (A) , смесей SSE/LOHC (B) и смесей SSE/LIC (C) . Смещение сигнала DSC: 1 единица (для LATP) и 2 единицы (для LGPS). Смещение сигнала TG: 2 единицы (для LATP) и 4 единицы (для LGPS).
Смещение сигнала DSC: 1 единица (для LATP) и 2 единицы (для LGPS). Смещение сигнала TG: 2 единицы (для LATP) и 4 единицы (для LGPS).
РИСУНОК 6 . Рентгенограммы смесей LIC/LOHC (A) , LATP/LOHC (B) , LGPS/LOHC (C) , LATP/LIC (D) и LGPS/LIC (E) , которые спекали при 170 и 320°С и смешивали порошки при комнатной температуре. В дополнительной таблице S1 перечислены рекомендуемые эталонные шаблоны.
Галогенидные электролиты LOHC и LIC демонстрируют сопоставимое поведение в процессе совместного спекания в твердотельных аккумуляторных системах. Все смеси оставались стабильными после спекания при 170°С. Однако несколько смесей прореагировали с образованием некоторой примеси после спекания при 320°С. Как показано в таблице 1, NCM811 и LNMO демонстрируют сопоставимое поведение. После совместного спекания с LOHC при 320°C NCM811 и LNMO разлагаются на оксидный катод Li x NiO 2 , LiCoO 2, и LiMnO 2 . Процесс фазового перехода может быть связан с процессом делитирования и перемешивания катионов при температуре нагрева 320°C (Maleki KheimehHu et al., 2013; Noh et al., 2013; Sari, Li, 2019). LOHC разлагается на LiCl в процессе совместного спекания при 320°C с катодом LFP, анодом Si-C, LIC, LGPS и LATP SSE, что сопровождается выделением паров H 2 O. Продукты разложения, такие как LiCl, обычно имеют низкую ионную проводимость, что приводит к большому межфазному сопротивлению для Li 9.0139 + проводимость. Относительно высокая реакционная способность LOHC при 320°C в основном обусловлена наличием свободных гидроксидных радикалов и Cl — в расплавленном LOHC. Следовательно, соединения, устойчивые к щелочным соединениям, имеют относительно хорошую термическую совместимость с LOHC, например, обогащенный литием, LCO и LMO катод, графит и LTO-анод. Напротив, LIC, как один из типов металлогалогенидных ССЭ, имеет более высокую температуру плавления, выходящую за рамки исследованного в данной работе диапазона температур.
Процесс фазового перехода может быть связан с процессом делитирования и перемешивания катионов при температуре нагрева 320°C (Maleki KheimehHu et al., 2013; Noh et al., 2013; Sari, Li, 2019). LOHC разлагается на LiCl в процессе совместного спекания при 320°C с катодом LFP, анодом Si-C, LIC, LGPS и LATP SSE, что сопровождается выделением паров H 2 O. Продукты разложения, такие как LiCl, обычно имеют низкую ионную проводимость, что приводит к большому межфазному сопротивлению для Li 9.0139 + проводимость. Относительно высокая реакционная способность LOHC при 320°C в основном обусловлена наличием свободных гидроксидных радикалов и Cl — в расплавленном LOHC. Следовательно, соединения, устойчивые к щелочным соединениям, имеют относительно хорошую термическую совместимость с LOHC, например, обогащенный литием, LCO и LMO катод, графит и LTO-анод. Напротив, LIC, как один из типов металлогалогенидных ССЭ, имеет более высокую температуру плавления, выходящую за рамки исследованного в данной работе диапазона температур. Однако относительно слабая связь In-Cl также может быть разорвана элементом с более высокой электроотрицательностью, таким как кислород или гидроксид. Как и ожидалось, LIC реагирует с литий-богатым катодом и катодом NCM811, LOHC и LGPS SSE и образует примеси, такие как LiCl, InOCl и In 9.0007 2 О 3 .
Однако относительно слабая связь In-Cl также может быть разорвана элементом с более высокой электроотрицательностью, таким как кислород или гидроксид. Как и ожидалось, LIC реагирует с литий-богатым катодом и катодом NCM811, LOHC и LGPS SSE и образует примеси, такие как LiCl, InOCl и In 9.0007 2 О 3 .
ТАБЛИЦА 1 . Материалы аккумуляторов с LOHC и материалы аккумуляторов с LIC, спеченные при 320°C, и фазы, обнаруженные в XRD. Красные фазы образуются после спекания.
4 Заключение
Таким образом, мы исследуем температурно-зависимую межфазную совместимость галогенидных SSE в твердотельных батареях, чтобы найти подходящих кандидатов для разработки ASSLB. Наши результаты показывают, что как антиперовскитные LOHC, так и галогенидные SSE LIC типа каменной соли совместимы с другими материалами аккумуляторов, включая некоторые распространенные материалы катода, анода и SSE, при относительно низкой температуре, например 170 °C. Однако при повышении температуры выше 300°C свободные гидроксидные радикалы в расплавленном LOHC и более слабой связи In-Cl обладают более высокой химической реакционной способностью, чем некоторые другие соединения. Реакции с LOHC обычно сопровождаются образованием водяного пара, что соответствует потере массы на кривых ТГ. Напротив, в реакциях с LIC обычно образуются оксиды на основе In, такие как InOCl и In 9.0007 2 O 3 без потери массы. Кроме того, LiCl является обычной примесью в качестве продукта реакции. Однако следует отметить, что эти продукты разложения, как правило, являются электронными изоляторами, которые могут препятствовать дальнейшей межфазной реакции в ASSLB. Эта работа дает представление о выборе подходящих материалов для аккумуляторов с хорошей совместимостью в ASSLB, что имеет большое значение для будущих исследований твердотельных аккумуляторов.
Реакции с LOHC обычно сопровождаются образованием водяного пара, что соответствует потере массы на кривых ТГ. Напротив, в реакциях с LIC обычно образуются оксиды на основе In, такие как InOCl и In 9.0007 2 O 3 без потери массы. Кроме того, LiCl является обычной примесью в качестве продукта реакции. Однако следует отметить, что эти продукты разложения, как правило, являются электронными изоляторами, которые могут препятствовать дальнейшей межфазной реакции в ASSLB. Эта работа дает представление о выборе подходящих материалов для аккумуляторов с хорошей совместимостью в ASSLB, что имеет большое значение для будущих исследований твердотельных аккумуляторов.
Заявление о наличии данных
Первоначальные материалы, представленные в исследовании, включены в статью/дополнительный материал; дальнейшие запросы можно направлять соответствующим авторам.
Участие авторов
GJ и ZD провели эксперименты и написали рукопись. DN, ZJ, DC и XZ вели обсуждение и помогали в экспериментах.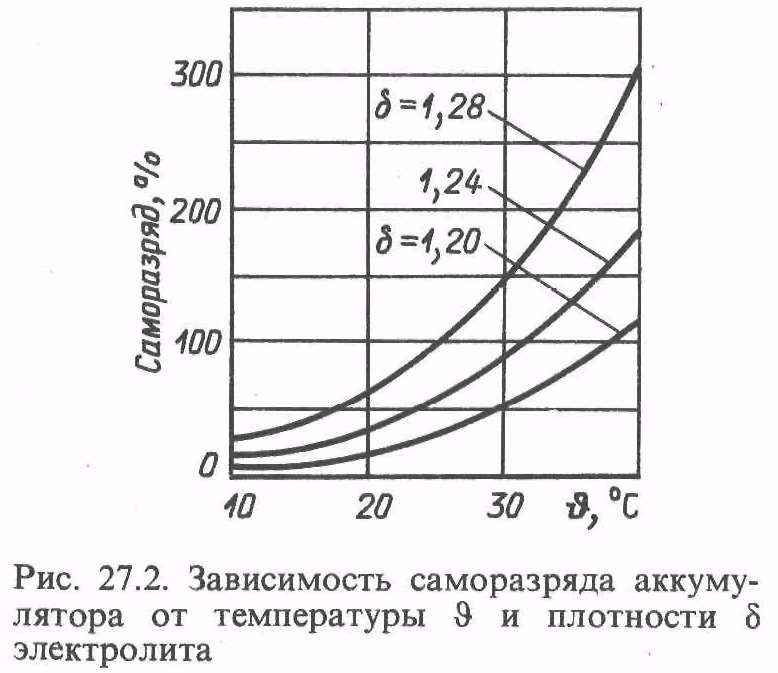 SL отвечал за просмотр и редактирование рукописи вместе с TW и YZ. SL руководил исследованием, а YZ получил финансирование.
SL отвечал за просмотр и редактирование рукописи вместе с TW и YZ. SL руководил исследованием, а YZ получил финансирование.
Финансирование
Эта работа финансировалась Открытым исследовательским фондом Лаборатории материалов озера Суншань (№ 2021SLABFN07), Ключевой программой Национального фонда естественных наук Китая (№ 51732005), Гуандунским фондом фундаментальных и прикладных фундаментальных исследований. (№ 2021A1515011784), Шэньчжэньская научно-техническая программа (№ KQTD20200820113047086), Инновационная лаборатория 21C, Contemporary Amperex Technology Ltd. (проект № C-ND-21C LAB-210044-1.0) и Гуандун-Хонг Совместная лаборатория Конг-Макао по науке и технологиям рассеяния нейтронов. Авторы заявляют, что это исследование получило финансирование от Лаборатории инноваций 21C, Contemporary Amperex Technology Ltd. Спонсор не участвовал в разработке исследования, сборе, анализе, интерпретации данных, написании этой статьи или решении представить ее для публикации.
Конфликт интересов
XZ работал в Лаборатории инноваций, Contemporary Amperex Technology Ltd. (CATL).
(CATL).
Остальные авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Примечание издателя
Все претензии, изложенные в этой статье, принадлежат исключительно авторам и не обязательно представляют претензии их дочерних организаций или издателя, редакторов и рецензентов. Любой продукт, который может быть оценен в этой статье, или претензии, которые могут быть сделаны его производителем, не гарантируются и не поддерживаются издателем.
Дополнительный материал
Дополнительный материал к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fchem.2022.952875/full#supplementary-material
Ссылки
Asano, Т. , Сакаи А., Оучи С., Сакаида М., Миядзаки А., Хасегава С. и др. (2018). Твердые галогенидные электролиты с высокой литий-ионной проводимостью для применения в полностью твердотельных батареях объемного типа класса 4 В.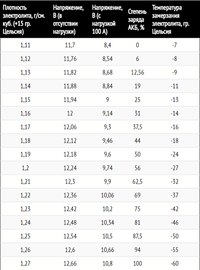 Доп. Мат. 30 (44), е1803075. doi:10.1002/adma.201803075
Доп. Мат. 30 (44), е1803075. doi:10.1002/adma.201803075
Полнотекстовая перекрестная ссылка | Google Scholar
Дэн З., Оу М. Ю., Ван Дж., Ли С., Ли Ю. Ю., Чжан Ю. П. и др. (2020). Локальные структурные изменения и индуктивные эффекты на ионную проводимость в антиперовскитных твердых электролитах. Хим. Мат. 32 (20), 8827–8835. doi:10.1021/acs.chemmater.0c02173
Полный текст CrossRef | Google Scholar
Гао З. Х., Сунь Х. Б., Фу Л., Е Ф. Л., Чжан Ю., Луо В. и др. (2018). Перспективы, проблемы и недавний прогресс в области неорганических твердотельных электролитов для полностью твердотельных литиевых батарей. Доп. Мат. 30 (17), 1705702. doi:10.1002/adma.201705702
CrossRef Полный текст | Google Scholar
Худ, З. Д., Ван, Х., Самутира Пандиан, А., Кеум, Дж. К., и Лян, К. (2016). Li 2 Кристаллический электролит OHCl для стабильных металлических литиевых анодов. Дж. Ам. хим. соц. 138 (6), 1768–1771. doi:10.1021/jacs.5b11851
doi:10.1021/jacs.5b11851
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Hu, E., Bak, S.-M., Liu, J., Yu, X., Zhou, Y., Ehrlich, S.N., et al. (2013). Термическая стабильность, связанная с выделением кислорода, и пути разложения Li x Ni 0,5 Mn 1,5 O 4 катодные материалы. Хим. Мат. 26 (2), 1108–1118. doi:10.1021/cm403400y
CrossRef Full Text | Google Scholar
Ли М., Лу Дж., Чен З. и Амин К. (2018). 30 лет литий-ионным аккумуляторам. Доп. Мат. 30 (33), 1800561. doi:10.1002/adma.201800561
CrossRef Полный текст | Google Scholar
Li, X., Liang, J., Yang, X., Adair, K.R., Wang, C., Zhao, F., et al. (2020). Прогресс и перспективы создания галогенидных литиевых проводников для полностью твердотельных литиевых аккумуляторов. Энергетика Окружающая среда. науч. 13 (5), 1429–1461. doi:10.1039/c9ee03828k
Полный текст CrossRef | Google Scholar
Малеки Хейме Сари, Х.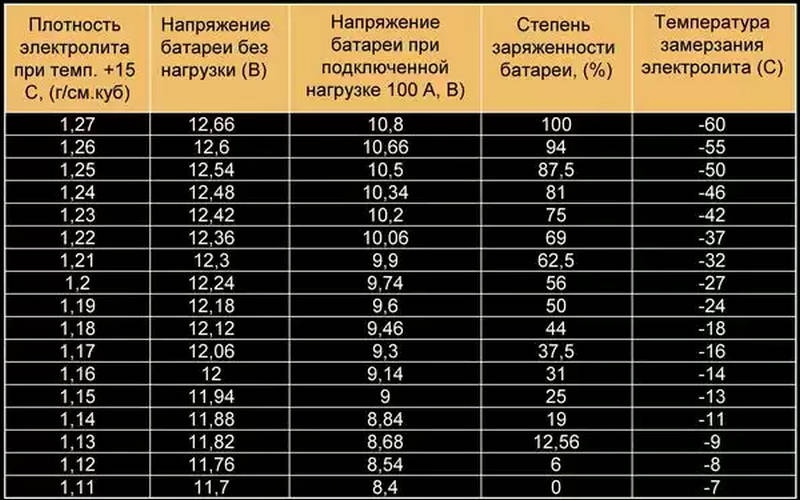 , и Ли, X. (2019). Контролируемый интерфейс катод-электролит Li[Ni 0,8 Co 0,1 Mn 0,1 ]O 2 для литий-ионных аккумуляторов: обзор. Доп. Энергетический мат. 9 (39), 17. doi:10.1002/aenm.2017
, и Ли, X. (2019). Контролируемый интерфейс катод-электролит Li[Ni 0,8 Co 0,1 Mn 0,1 ]O 2 для литий-ионных аккумуляторов: обзор. Доп. Энергетический мат. 9 (39), 17. doi:10.1002/aenm.2017
CrossRef Полный текст | Google Scholar
Мантирам А., Ю Х. и Ван С. (2017). Химический состав литиевых батарей благодаря твердотельным электролитам. Нац. Преподобный мат. 2 (4), 16103. doi:10.1038/natrevmats.2016.103
CrossRef Полный текст | Google Scholar
Но, Х.-Дж., Юн, С., Юн, К.С., и Сун, Ю.-К. (2013). Сравнение структурных и электрохимических свойств слоистых Li[Ni x Co y Mn z ]O 2 ( x = 1/3, 0,5, 0,6, 0,7, 0,8 и 0,8 5) катодный материал для литий-ионные аккумуляторы. Дж. Источники питания 233, 121–130. doi:10.1016/j.jpowsour.2013.01.063
Полнотекстовая перекрестная ссылка | Google Scholar
Риггер Л.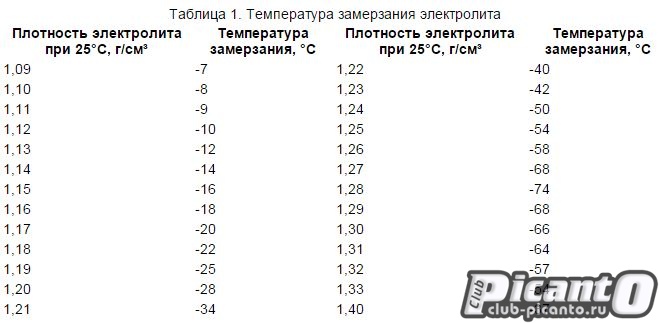 М., Шлем Р., Санн Дж., Зейер В. Г. и Янек Дж. (2021). Нестабильность литий-металлического анода суперионных галогенидных твердых электролитов и последствия для твердотельных батарей. Анжю. хим. Междунар. Эд. 60 (12), 6718–6723. doi:10.1002/anie.202015238
М., Шлем Р., Санн Дж., Зейер В. Г. и Янек Дж. (2021). Нестабильность литий-металлического анода суперионных галогенидных твердых электролитов и последствия для твердотельных батарей. Анжю. хим. Междунар. Эд. 60 (12), 6718–6723. doi:10.1002/anie.202015238
CrossRef Полный текст | Google Scholar
Тянь Ю., Ши Т., Ричардс В. Д., Ли Дж., Ким Дж. К., Бо С.-Х. и др. (2017). Проблемы совместимости между электродами и электролитами в твердотельных батареях. Энергетика Окружающая среда. науч. 10 (5), 1150–1166. doi:10.1039/c7ee00534b
Полный текст CrossRef | Google Scholar
Ван К., Пинг П., Чжао К., Чу Г., Сунь Дж., Чен К. и др. (2012). Тепловой разгон привел к возгоранию и взрыву литий-ионного аккумулятора. Дж. Источники питания 208, 210–224. doi:10.1016/j.jpowsour.2012.02.038
Полный текст CrossRef | Google Scholar
Ван Т., Дуань Дж., Чжан Б., Луо В., Цзи Х., Сюй Х. и др. (2022). Саморегулируемая градиентная интерфаза для твердотельных литиевых батарей без дендритов. Энергетика Окружающая среда. науч. 15, 1325–1333. doi:10.1039/D1EE03604A
Энергетика Окружающая среда. науч. 15, 1325–1333. doi:10.1039/D1EE03604A
CrossRef Полный текст | Google Scholar
Винтер, М. (2009). Межфазный слой твердого электролита – наиболее важный и наименее изученный твердый электролит в перезаряжаемых литиевых батареях. З. Физ. хим. (Н Ф). 223 (10-11), 1395–1406. doi:10.1524/zpch.2009.6086
Полный текст CrossRef | Google Scholar
Чжао Э., Ма Ф., Го Ю. и Цзинь Ю. (2016). Стабильный двухслойный твердый электролит LATP/LAGP, приготовленный простым методом сухого прессования для твердотельных литий-ионных аккумуляторов. РСК Доп. 6 (95), 92579–92585. doi:10.1039/C6RA19415J
CrossRef Полный текст | Google Scholar
11.4: Зависимость клеточного потенциала от концентрации
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
Цели обучения
- Связь потенциалов клеток с изменениями энергии Гиббса
- Использование уравнения Нернста для определения потенциалов клеток в нестандартных условиях
- Выполнение расчетов, включающих преобразование потенциалов клеток, изменений свободной энергии и констант равновесия
Уравнение Нернста позволяет определять клеточный потенциал в нестандартных условиях. Он связывает измеренный клеточный потенциал с коэффициентом реакции и позволяет точно определить константы равновесия (включая константы растворимости). 9\circ_\textrm{cell}-\left(\dfrac{RT}{nF}\right)\ln Q \label{Eq3} \]
Он связывает измеренный клеточный потенциал с коэффициентом реакции и позволяет точно определить константы равновесия (включая константы растворимости). 9\circ_\textrm{cell}-\left(\dfrac{RT}{nF}\right)\ln Q \label{Eq3} \]
Уравнение \(\ref{Eq3}\) называется уравнением Нернста , в честь немецкого физика и химика Вальтера Нернста (1864–1941), который первым его вывел. Уравнение Нернста, пожалуй, самое важное соотношение в электрохимии. Когда окислительно-восстановительная реакция находится в равновесии (\(ΔG = 0\)), то уравнение \(\ref{Eq3}\) сводится к уравнению \(\ref{Eq31}\) и \(\ref{Eq32}\) потому что \(Q = K\), и нет чистого переноса электронов (т. е. E 9\circ_\textrm{cell}-\left(\dfrac{\textrm{0,0591 V}}{n}\right)\log Q \label{Eq4} \]
Мощность уравнения Нернста
Уравнение Нернста (\(\ref{Eq3}\)) можно использовать для определения значения E ячейки и, следовательно, направления спонтанной реакции для любой окислительно-восстановительной реакции в любых условиях.
Уравнение \(\ref{Eq4}\) позволяет нам рассчитать потенциал, связанный с любой электрохимической ячейкой при 298 K для любой комбинации концентраций реагента и продукта при любых условиях. Таким образом, мы можем определить самопроизвольное направление любой окислительно-восстановительной реакции при любых условиях, если у нас есть табличные значения соответствующих стандартных электродных потенциалов. Обратите внимание, что в уравнении \(\ref{Eq4}\) потенциал клетки изменяется на 0,059.°_{cell} = 0,25\, V \nonumber \]
Рассчитайте \(E_{cell}\) для этой реакции при следующих нестандартных условиях и определите, будет ли она протекать самопроизвольно: [Ce 4 + ] = 0,013 М, [Ce 3 + ] = 0,60 М, [Cl — ] = 0,0030 М, \(P_\mathrm{Cl_2}\) = 1,0 атм, T = 25°C.
Дано: сбалансированная окислительно-восстановительная реакция, стандартный клеточный потенциал и нестандартные условия
Запрошено: клеточный потенциал
Стратегия:
Определите количество электронов, переданных в ходе окислительно-восстановительного процесса. Затем используйте уравнение Нернста, чтобы найти потенциал клетки в нестандартных условиях.
Затем используйте уравнение Нернста, чтобы найти потенциал клетки в нестандартных условиях.
Решение
Мы можем использовать предоставленную информацию и уравнение Нернста для расчета ячейки E . Кроме того, поскольку температура составляет 25°C (298 K), мы можем использовать уравнение \(\ref{Eq4}\) вместо уравнения \(\ref{Eq3}\). Общая реакция включает чистый перенос двух электронов: 9{−}4(водн.) + 2h3O(ж)} \;\;\; E°_{ячейка} = −0,20\; V\nonumber \]
Рассчитайте \(E_{cell}\) для реакции при следующих нестандартных условиях и решите, будет ли реакция протекать самопроизвольно: pH 10, \(P_\mathrm{O_2}\)= 0,20 атм, [MNO 4 − ] = 1,0 × 10 −4 М, T = 25°C.
- Ответить
E ячейка = -0,22 В; реакция не будет происходить самопроизвольно.
Таким образом, начальное напряжение больше E°, поскольку \(Q<1\). По мере протекания реакции [Zn 2 + ] в анодном отделении увеличивается по мере растворения цинкового электрода, тогда как [Cu 2 + ] в катодном отделении уменьшается по мере осаждения металлической меди на электроде. Во время этого процесса отношение Q = [Zn 2 + ]/[Cu 2 + ] неуклонно увеличивается, и поэтому напряжение на ячейке неуклонно снижается. В конце концов, [Zn 2 + ] = [Cu 2 + ], поэтому Q = 1 и E ячейка = E° ячейка . За пределами этой точки [Zn 2 + ] будет продолжать увеличиваться в анодной камере, а [Cu 2 + ] будет продолжать уменьшаться в катодной камере. Таким образом, значение Q будет увеличиваться дальше, что приведет к дальнейшему уменьшению в ячейке E . Когда концентрации в двух отсеках противоположны исходным концентрациям (т. е.
По мере протекания реакции [Zn 2 + ] в анодном отделении увеличивается по мере растворения цинкового электрода, тогда как [Cu 2 + ] в катодном отделении уменьшается по мере осаждения металлической меди на электроде. Во время этого процесса отношение Q = [Zn 2 + ]/[Cu 2 + ] неуклонно увеличивается, и поэтому напряжение на ячейке неуклонно снижается. В конце концов, [Zn 2 + ] = [Cu 2 + ], поэтому Q = 1 и E ячейка = E° ячейка . За пределами этой точки [Zn 2 + ] будет продолжать увеличиваться в анодной камере, а [Cu 2 + ] будет продолжать уменьшаться в катодной камере. Таким образом, значение Q будет увеличиваться дальше, что приведет к дальнейшему уменьшению в ячейке E . Когда концентрации в двух отсеках противоположны исходным концентрациям (т. е. 1,0 М Zn 2 + и 1,0 × 10 −6 M Cu 2 + ), Q = 1,0 × 10 6 , и потенциал ячейки снизится до 0,92 В.
1,0 М Zn 2 + и 1,0 × 10 −6 M Cu 2 + ), Q = 1,0 × 10 6 , и потенциал ячейки снизится до 0,92 В.
Изменение ячейки E с \(\log{Q}\) в этом диапазоне является линейным с наклоном -0,0591/n, как показано на рисунке \(\PageIndex{1}\). По мере дальнейшего протекания реакции \(Q\) продолжает расти, и Е 9{37}\end{align} \label{Eq7} \]
Напомним, что в состоянии равновесия \(Q = K\). Таким образом, константа равновесия реакции металлического Zn с Cu 2 + с образованием металлической Cu и Zn 2 + составляет 1,7 × 10 37 при 25°C.
Таким образом, константа равновесия реакции металлического Zn с Cu 2 + с образованием металлической Cu и Zn 2 + составляет 1,7 × 10 37 при 25°C.
Уравнение Нернста: Уравнение Нернста (opens in new window) [youtu.be]
Концентрационные ячейки
Напряжение также можно генерировать путем создания электрохимической ячейки, в которой каждое отделение содержит один и тот же окислительно-восстановительный активный раствор, но в разных концентрациях. Напряжение возникает, когда концентрации уравновешиваются. Предположим, например, что у нас есть ячейка с 0,010 М AgNO 9\circ_\textrm{ячейка}-\left(\dfrac{\textrm{0,0591 В}}{n}\right)\log Q \\[4pt] &=0-\left(\dfrac{\textrm{0,0591 В} }}{1}\right)\log\left(\dfrac{0.010}{1.0}\right) \\[4pt] &=\textrm{0.12 V} \end{align*} \nonumber \]
An Электрохимическая ячейка этого типа, в которой анодное и катодное отделения идентичны, за исключением концентрации реагента, называется концентрационной ячейкой . По мере протекания реакции разница между концентрациями Ag + в двух отсеках будет уменьшаться, как и E ячейка . Наконец, когда концентрация Ag + одинакова в обоих отсеках, будет достигнуто равновесие, и измеренная разность потенциалов между двумя отсеками будет равна нулю (E , ячейка = 0).
По мере протекания реакции разница между концентрациями Ag + в двух отсеках будет уменьшаться, как и E ячейка . Наконец, когда концентрация Ag + одинакова в обоих отсеках, будет достигнуто равновесие, и измеренная разность потенциалов между двумя отсеками будет равна нулю (E , ячейка = 0).
Пример \(\PageIndex{2}\)
Рассчитайте напряжение в гальваническом элементе, который содержит марганцевый электрод, погруженный в 2,0 М раствор MnCl 2 в качестве катода, и марганцевый электрод, погруженный в 5,2 × 10 −2 М раствор MnSO 4 в качестве анода (Т = 25°С).
Дано: гальванический элемент, типы электродов и концентрации раствора
Запрошено: напряжение
Стратегия:
- Напишите общую реакцию, происходящую в элементе.
- Определите количество переданных электронов. Подставьте это значение в уравнение Нернста, чтобы рассчитать напряжение.

Раствор
А 9{-2}}{2.0}\right) \\[4pt] &=\textrm{0,047 В}\end{align*} \nonumber \]
Таким образом, марганец растворится с электрода в отсеке, в котором находится более разбавленным раствором и будет осаждаться на электроде в отсеке, где находится более концентрированный раствор.
Упражнение \(\PageIndex{2}\)
Предположим, мы построили гальванический элемент, поместив два одинаковых платиновых электрода в два стакана, соединенных соляным мостиком. Один стакан содержит 1,0 М HCl, а другой 0,010 М раствор Na 9{−} \rightarrow 2h3O(l)} \nonumber \]
Каким будет потенциал, когда цепь замкнута?
- Ответить
0,41 В
Использование клеточных потенциалов для измерения продуктов растворимости
Поскольку напряжения относительно легко точно измерить с помощью вольтметра, электрохимические методы обеспечивают удобный способ определения концентрации очень разбавленных растворов и продуктов растворимости (\(K_{sp}\) ) труднорастворимых веществ. Как вы узнали ранее, произведения растворимости могут быть очень маленькими, со значениями меньше или равными 10 −30 . Константы равновесия такой величины практически невозможно точно измерить прямыми методами, поэтому мы должны использовать более чувствительные альтернативные методы, такие как электрохимические методы.
Как вы узнали ранее, произведения растворимости могут быть очень маленькими, со значениями меньше или равными 10 −30 . Константы равновесия такой величины практически невозможно точно измерить прямыми методами, поэтому мы должны использовать более чувствительные альтернативные методы, такие как электрохимические методы.
В одном отделении ячейка содержит серебряную проволоку, введенную в 1,0 М раствор Ag + ; в другом отсеке находится серебряная проволока, вставленная в 1,0 М раствор Cl —, насыщенный AgCl. В этой системе концентрация ионов Ag + в первом отсеке равна K sp . Мы можем увидеть это, разделив обе части уравнения для K sp на [Cl − ] и подставив:
\[\begin{align*}[\ce{Ag^{+}}] &= \ dfrac{K_{sp}}{[\ce{Cl^{-}}]} \\[4pt] &= \dfrac{K_{sp}}{1.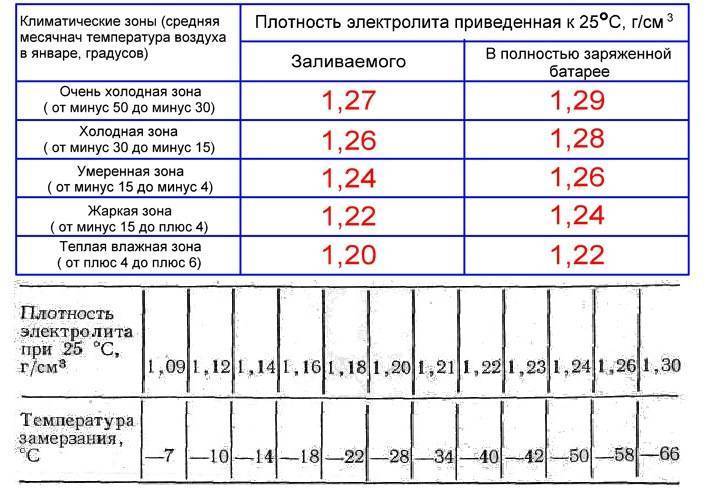 0} = K_{sp}. \end{align*} \nonumber \] 9+}]_\textrm{concentrated}}\right) \nonumber \\[4pt] &= -\textrm{0,0591 V } \log\left(\dfrac{K_{\textrm{sp}}}{1.0}\ справа) \nonumber \\[4pt] &=-\textrm{0,0591 V }\log K_{\textrm{sp}} \label{Eq122} \end{align} \]
0} = K_{sp}. \end{align*} \nonumber \] 9+}]_\textrm{concentrated}}\right) \nonumber \\[4pt] &= -\textrm{0,0591 V } \log\left(\dfrac{K_{\textrm{sp}}}{1.0}\ справа) \nonumber \\[4pt] &=-\textrm{0,0591 V }\log K_{\textrm{sp}} \label{Eq122} \end{align} \]
Замкнув цепь, мы можем измерить потенциал, вызванный разницей [Ag+] в двух клетках. В этом случае экспериментально измеренное напряжение концентрационной ячейки при 25°C составляет 0,580 В. Решение уравнения \(\ref{Eq122}\) для \(K_{sp}\),
\[\begin{align* }\log K_\textrm{sp} & =\dfrac{-E_\textrm{cell}}{\textrm{0,059{-10}\end{align*} \nonumber \]
Таким образом, одно измерение потенциала может предоставить информацию, необходимую для определения значения произведения растворимости малорастворимой соли.
Пример \(\PageIndex{3}\): растворимость сульфата свинца(II)
тот, что показан на рисунке \(\PageIndex{1}\), который содержит 1,0 М раствор хорошо растворимого Pb 2 + соль [тригидрат ацетата свинца(II)] в одном отделении, соединенном солевым мостиком с 1,0 М раствором Na 2 SO 4 , насыщенным PbSO 4 , в другом. Затем вы вставляете электрод Pb в каждое отделение и замыкаете цепь. Ваш вольтметр показывает напряжение 230 мВ. Что такое K sp для PbSO 4 ? Сообщите свой ответ до двух значащих цифр.
Затем вы вставляете электрод Pb в каждое отделение и замыкаете цепь. Ваш вольтметр показывает напряжение 230 мВ. Что такое K sp для PbSO 4 ? Сообщите свой ответ до двух значащих цифр.
Дано: гальванический элемент, концентрации раствора, электроды и напряжение
Запрошено: K sp
Стратегия:
- Из предоставленной информации напишите уравнение для K sp . Выразите это уравнение через концентрацию Pb 2 + .
- Определите количество электронов, переданных в результате электрохимической реакции. Подставьте соответствующие значения в уравнение \(\ref{Eq12}\) и найдите K sp .
Раствор
А 9{-8} & =K_\textrm{sp}\end{align*} \nonumber \]
Упражнение \(\PageIndex{3}\)
Ячейка концентрации, подобная описанной в примере \(\PageIndex {3}\) содержит 1,0 М раствор нитрата лантана [La(NO 3 ) 3 ] в одном отделении и 1,0 М раствор фторида натрия, насыщенного LaF 3 , в другом. В каждое отделение вставляется металлическая полоска La, и цепь замыкается. Измеренный потенциал 0,32 В. Что такое К sp для LaF 3 ? Сообщите свой ответ до двух значащих цифр.
В каждое отделение вставляется металлическая полоска La, и цепь замыкается. Измеренный потенциал 0,32 В. Что такое К sp для LaF 3 ? Сообщите свой ответ до двух значащих цифр.
- Ответить
5,7 × 10 −17
Использование клеточных потенциалов для измерения концентраций
Еще одно применение уравнения Нернста — расчет концентрации видов с учетом измеренного потенциала и концентраций всех других видов. Мы видели пример этого в примере \(\PageIndex{3}\), в котором условия эксперимента были определены таким образом, что концентрация иона металла была равна K сп . Потенциальные измерения могут быть использованы для получения концентраций растворенных частиц и в других условиях, что объясняет широкое использование электрохимических ячеек во многих аналитических устройствах. Возможно, наиболее распространенным применением является определение [H + ] с помощью рН-метра, как показано ниже.
Пример \(\PageIndex{4}\): измерение pH
Предположим, что гальванический элемент состоит из стандартной пары Zn/Zn 2 + в одном отсеке и модифицированного водородного электрода во втором отсеке. Давление газообразного водорода составляет 1,0 атм, но [H 9{+}} (вода, ?\, М)| \ce{h3} (г, 1,0\, атм)| Pt(s) \nonumber \]
Чему равен pH раствора во втором отсеке, если измеренный потенциал в ячейке составляет 0,26 В при 25°C?
Дано: гальванический элемент, схема ячейки и потенциал ячейки
Запрошено: pH раствора
Стратегия:
- Запишите общую реакцию клетки.
- Подставьте соответствующие значения в уравнение Нернста и найдите −log[H + ] для получения рН.
Раствор
A В стандартных условиях происходит общая реакция восстановления протонов цинком с образованием H 2 (обратите внимание, что Zn находится ниже H 2 в таблице P2):
Zn(s) ) + 2H 2 + (водн. ) → Zn 2 + (водн.) + H 2 (г) E°=0,76 В
) → Zn 2 + (водн.) + H 2 (г) E°=0,76 В
B 9 0144 Путем подстановки данных значений в упрощенную формулу Нернста уравнения (Equation \(\ref{Eq4}\)), мы можем вычислить [H 9+}] \\
8.5 &=\mathrm{pH}\end{align*} \nonumber \]
Таким образом, потенциал гальванического элемента можно использовать для измерения pH раствора.
Упражнение \(\PageIndex{4}\)
Предположим, вы работаете в экологической лаборатории и хотите использовать электрохимический метод для измерения концентрации Pb 2 + в грунтовых водах. Вы конструируете гальванический элемент, используя стандартный кислородный электрод в одном отсеке (Е° катод = 1,23 В). В другом отсеке находится полоска свинца в образце грунтовых вод, к которому вы добавили достаточное количество уксусной кислоты, слабой органической кислоты, чтобы обеспечить электрическую проводимость. Схема ячеек выглядит следующим образом: 9{−9}\; м\)
Резюме
Уравнение Нернста можно использовать для определения направления самопроизвольной реакции любой окислительно-восстановительной реакции в водном растворе.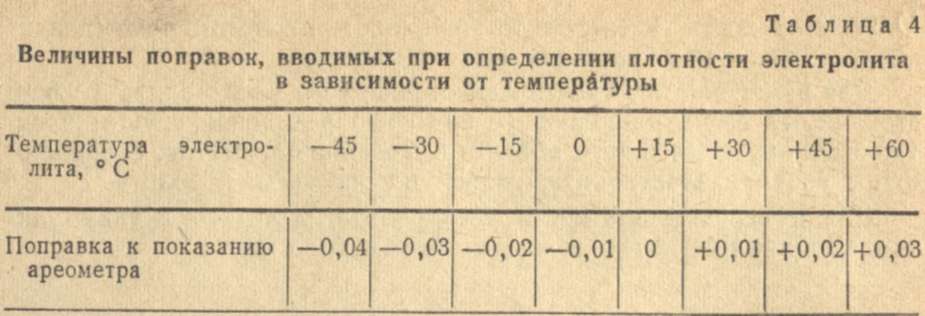


 В нашем случае он должен стать равным 1,5 А. На этом этапе нужно проверять показания приборов не реже 1 раза в 2 часа. Когда разность потенциалов и ток стабилизируются, то есть текущие показания мультиметра будут идентичны измеренным на один или два часа раньше, аккумулятор можно считать заряженным.
В нашем случае он должен стать равным 1,5 А. На этом этапе нужно проверять показания приборов не реже 1 раза в 2 часа. Когда разность потенциалов и ток стабилизируются, то есть текущие показания мультиметра будут идентичны измеренным на один или два часа раньше, аккумулятор можно считать заряженным.