Приготовление электролита для аккумуляторов своими руками
В настоящее время выбор аккумуляторных батарей огромен — в продаже можно найти уже готовые к использованию источники питания, а также сухозаряженные батареи, которые требуют осуществить приготовление электролита и его заливку до начала эксплуатации. Дальнейшее обслуживание аккумуляторов многие часто осуществляют в сервисах. По разным причинам может возникнуть необходимость самостоятельно приготовить раствор. Чтобы это мероприятие увенчалось успехом, следует знать, как сделать электролит в домашних условиях.
Содержание:
- 1 Что такое электролит?
- 2 Концентрация серной кислоты в АКБ
- 3 Отличия электролитов для разных типов аккумуляторов
- 3.1 Щелочные АКБ
- 3.2 Кислотные АКБ
- 4 Другие виды АКБ: можно ли приготовить электролит для них самостоятельно?
- 4.1 Кадмиевоникелевые и железоникелевые аккумуляторы
- 5 Как правильно приготовить электролит в домашних условиях: техника безопасности
- 5.
 1 Оборудование
1 Оборудование - 5.2 Последовательность процесса: делаем электролит для кислотно-свинцового источника питания
- 5.
- 6 Способ развести электролит для щелочного источника питания
Что такое электролит?
Электролит — электропроводящий раствор, содержащий в своём составе дистиллированную воду и серную кислоту, едкий калий или натрий в зависимости от типа источника питания.
Концентрация серной кислоты в АКБ
Этот показатель кислотности напрямую зависит от необходимой плотности электролита. Изначально средняя концентрация этого раствора в автомобильном аккумуляторе — около 40% в зависимости от температуры и климата, в которых используется источник питания. Во время эксплуатации концентрация кислоты падает до 10–20%, что сказывается на работоспособности АКБ.
Вместе с тем стоит понимать, что аккумуляторная серная составляющая — наичистейшая жидкость, которая на 93% состоит непосредственно из кислоты остальные 7% — примеси. На территории России производство этого химиката строго регламентировано — продукция должна соответствовать требованиям ГОСТ.
Отличия электролитов для разных типов аккумуляторов
Несмотря на то что принцип работы раствора одинаков для разных источников питания, следует знать о некоторых различиях составов. В зависимости от состава принято выделять щелочной и кислотный электролиты.
Щелочные АКБ
Этот вид источников питания характеризуется наличием гидроокиси никеля, окиси бария и графита. Электролит в этом виде аккумуляторов представляет собой 20% раствор едкого калия. Традиционно используется добавка моногидрата лития, которая позволяет продлить срок эксплуатации АКБ.
Щелочные источники питания отличаются отсутствием взаимодействия калийного раствора с веществами, образуемыми во время работы аккумулятора, что способствует аксимальному уменьшению расхода.
Кислотные АКБ
Этот вид источников питания является одним из самых традиционных, поэтому и раствор в них знаком многим — смесь дистиллированной воды и серного раствора. Концентрат электролита для свинцово-кислотных аккумуляторов дешёво стоит и характеризуется способностью проводить ток большой величины. Плотность жидкости должна соответствовать климатическим показателям.
Плотность жидкости должна соответствовать климатическим показателям.
Таблица 1. Рекомендуемая плотность электролита
Другие виды АКБ: можно ли приготовить электролит для них самостоятельно?
Отдельно хотелось бы обратить внимание на современные свинцово-кислотные источники питания — гелевые и AGM. Они также могут быть заправлены собственноручно приготовленным раствором, который в них находится в специфической форме — в виде геля или внутри сепараторов. Для заправки гелевых аккумуляторов понадобится ещё один химический компонент — силикагель, который загустит кислотный раствор.
Кадмиевоникелевые и железоникелевые аккумуляторы
В отличие от свинцовых источников питания, кадмиево- и железоникелевые заливаются щелочным растовром, который является смесью дистиллированной воды и едкого калия или натрия. Гидроксид лития, входящий в состав этого раствора для определённых температурных режимов, позволяет увеличить срок службы АКБ.
Таблица 2.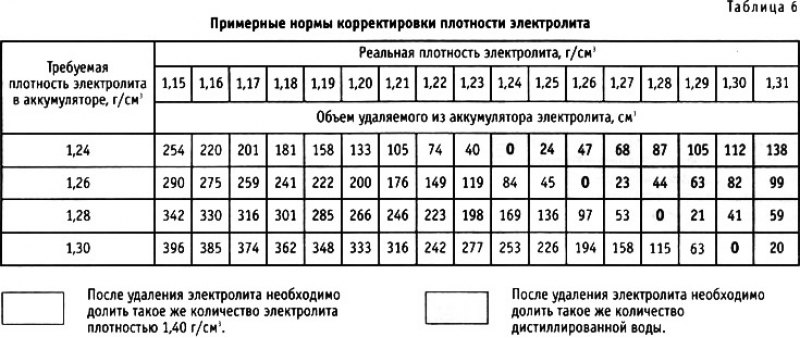 Состав и плотность электролита для кадмиево- и железоникелевых и аккумуляторов.
Состав и плотность электролита для кадмиево- и железоникелевых и аккумуляторов.
Железоникелевые источники питания рекомендуется эксплуатировать в тех же условиях, что и кадмиево-никелевые. Однако стоит отметить, что они более восприимчивы к низким температурам. Поэтому их следует использовать до минус 20 градусов.
Как правильно приготовить электролит в домашних условиях: техника безопасности
Приготовление раствора — работа с кислотами и щелочами, поэтому соблюдение мер предосторожности необходимо для самых опытных людей. Перед началом действия подготовьте средства защиты:
- резиновые перчатки
- одежду и фартук, устойчивый химическим веществам;
- защитные очки;
- нашатырный спирт, кальцинированную соду или борный раствор, чтобы нейтрализовать кислоту и щёлочь.
Оборудование
Для приготовления аккумуляторного электролита помимо самого источника питания потребуются следующие предметы:
- ёмкость и палочка, устойчивые к воздействию кислот и щелочей;
- дистиллированная вода;
- инструменты для измерения уровня, плотности и температуры раствора;
- аккумуляторная серная жидкость — для кислотной АКБ, твёрдые или жидкие щелочи, литий — для соответствующих видов АКБ, силикагель — для гелевых аккумуляторов.

Последовательность процесса: делаем электролит для кислотно-свинцового источника питания
Перед началом работ ознакомьтесь с информацией, приведённой в таблице 3. Она позволит выбрать необходимый объем жидкостей. В аккумуляторах залито от 2,6 до 3,7 литра кислотного раствора. Мы рекомендуем разводить примерно 4л электролита.
Таблица 3. Пропорции воды и серной кислоты.
- В ёмкость, устойчивую к едким веществам, налейте нужный объем воды.
- Разбавлять воду кислотой следует постепенно.
- По окончании процесса вливания замеряйте плотность получившегося электролита с помощью ареометра.
- Дайте составу отстояться около 12 часов.
Таблица 4. Плотность электролита для разных климатов.
Концентрация кислотного раствора должна соотноситься с минимальной температурой, при которой эксплуатируется аккумулятор. Если жидкость получилась слишком концентрированной, её необходимо разбавить дистиллированной водой.
Смотрите видео, как измерить плотность электролита.
Внимание! Вливать воду в кислоту нельзя! В результате этой химической реакции может возникнуть закипание состава, что приведёт к его расплескиванию и возможности получить кислотные ожоги!
Обращаем ваше внимание, что во время смешивания компонентов выделяется тепло. В подготовленный аккумулятор следует заливать остывший раствор.
Способ развести электролит для щелочного источника питания
Плотность и количество электролита в таких аккумуляторах указана в инструкции по эксплуатации источника питания или на сайте компании-производителя.
Необходимая плотность раствора | Количество твёрдой щелочи равняется количеству электролита, разделенному на |
1,17–1,19 г/см³ | 5 |
1,19–1,21 г/см³ | 3 |
1,25–1,27 г/см³ | 2 |
- Влейте в посуду дистиллированную воду.

- Добавьте щелочь.
- Смешайте раствор, герметично его закройте и дайте настояться в течение 6 часов.
- По истечении времени слейте образовавшийся светлый раствор — электролит готов.
При появлении осадка следует его перемешивать. Если к концу отстаивания он остаётся, слейте электролит так, чтобы осадок не попал в аккумулятор — это приведёт к уменьшению срока его эксплуатации.
Внимание! Во время работ температура щелочного раствора не должна превышать 25 градусов по Цельсию. Если жидкость чрезмерно нагревается, охладите её.
После приведения раствора к комнатной температуре и его заливке в аккумулятор, источник питания необходимо полностью зарядить током, составляющим 10% от ёмкости АКБ (60Ач — 6А).
Как видите, приготовление раствора электролита не такое сложное дело. Главное, следует чётко определиться с необходимым количеством ингредиентов и помнить о безопасности. Вы пробовали развести электролит своими руками? Поделитесь опытом с нашими читателями в комментариях.
Что такое щелочной электролит? Как произвести замену щелочного электролита?
Щелочной электролит – одна из основных составляющих щелочных аккумуляторов. Он имеет массу плюсов перед другими видами токопроводящих веществ.
Что же такое щелочной электролит, какими свойствами он обладает и как с ним работать, придется разобраться.
В первую очередь, это химическое соединение, которое активно участвует в накоплении аккумулятором электроэнергии. Щелочной электролит может многократно участвовать в восстановительно-окислительных реакциях без потери качества, благодаря своим свойствам.
Щелочной электролит встречается разного состава:
- Калиево-литиевый
- Натриевый
- Никель-кадмиевый
- Никель-металлогидридный
Натриевые электролиты обладают большим сроком эксплуатации, но обладают значительным минусом – невозможность использования при отрицательной температуре воздуха.
У калиево-литиевых обратная ситуация, они морозостойки, но непригодны для работы в жарких условиях, так как эксплуатационная температура у них ограничена до 35°С.
Никель-кадмиевые аккумуляторы обладают эффектом памяти, что налагает на их использование определенные ограничения.
У никель-металлогидридных аккумуляторов отсутствует эффект памяти, они способны работать как при низких, так и высоких температурах, но обладают высокой стоимостью, что препятствует их широкому распространению как портативного источника энергии.
Каждое из соединений, будь то калий, литий, натрий или едкий калий разбавляется с дистиллированной водой в нужной концентрации, в итоге, получается раствор-электролит для щелочи. По консистенции он жидкий и похож на обычную воду.
Щелочные электролиты считаются наиболее надежными и долговечными составляющими аккумуляторных батарей, но и минус у них есть – отсутствие возможности выдавать стартовый ток. В связи с этим в автомобильных аккумуляторах чаще встречаются именно кислотные электролиты.
Продлеваем срок службы щелочного электролита и аккумулятора!
Стоит помнить про факторы, которые уменьшают срок службы щелочных электролитов:
- Неполная зарядка аккумулятора
- Меньшее количество электролита в сепараторе, чем необходимо
- Долгое использование электролита при высоких температурах
- Высокие температуры жидкости
Если стараться следить за этими моментами, то можно продлить срок службы аккумуляторной батареи в разы.
Для аккумуляторных батарей есть возможность замены щелочного электролита. Чаще всего необходимость замены возникает если аккумулятор перестает держать зарядку.
Порядок замены щелочного электролита следующий:
- Демонтируйте аккумуляторную батарею
- Поставьте ее в удобном для работы месть, без доступа для детей, сторонних лиц.
- Проводить замену щелочного электролита необходимо в защитной одежде, иметь при себе инструмент, для открытия крышки аккумулятора и щелочной электролит для залива, который можно приготовить и в домашних условиях.
- Произвести демонтаж крышки АКБ, залить электролит до необходимого уровня.
- Собрать аккумулятор в первоначальный вид, установить в оборудование.
- После смены электролита в щелочном аккумуляторе его необходимо зарядить в усиленном режиме.
Для аккумуляторной батареи существуют базовые правила зарядки, на которые всегда стоит ориентироваться, если вы хотите продлить срок его службы.
Щелочная аккумуляторная батарея – не требует слишком частого внимания. Если обеспечить её в полной мере, то можно она будет радовать бесперебойной работой в течении долгих лет и полностью оправдает свою цену.
Компания ООО «Курс» располагает широким ассортиментом щелочных аккумуляторов от таких производителей как «ВАЗ «Импульс» и «Завод автономных источников тока». Наши менеджеры проконсультируют Вас и помогут подобрать необходимые аккумуляторы и аккумуляторные батареи. Связаться с нами можно по бесплатному номеру 8 800 200 60 10.
Как сделать электролит
••• Ablestock.com/AbleStock.com/Getty Images
Обновлено 24 апреля 2017 г.
Автор: Шон Ланкастер
Батареи состоят из двух полуэлементных реакций, соединенных солевым мостиком и поддерживаемых раствором электролита. Обычный аккумулятор — это свинцово-кислотный аккумулятор, который питает ваш автомобиль. Два полуэлемента, которые работают в этих батареях, — это свинцовый и водородный полуэлементы. Один электрод сделан из диоксида свинца, и когда свинец переходит в раствор, электроны перетекают от этого электрода к другому электроду, где молекулы диоксида свинца принимают электроны и превращаются в газообразный кислород. Оба электрода находятся в растворе электролита, способном поддерживать электрический поток между электродами. Требования к электролиту: высокая диссоциативность в растворе и способность служить носителем заряда. В свинцово-кислотном аккумуляторе электролитом являются серная кислота и вода. Он также поставляет ионы сульфата, необходимые для высвобождения молекул кислорода в раствор.
Один электрод сделан из диоксида свинца, и когда свинец переходит в раствор, электроны перетекают от этого электрода к другому электроду, где молекулы диоксида свинца принимают электроны и превращаются в газообразный кислород. Оба электрода находятся в растворе электролита, способном поддерживать электрический поток между электродами. Требования к электролиту: высокая диссоциативность в растворе и способность служить носителем заряда. В свинцово-кислотном аккумуляторе электролитом являются серная кислота и вода. Он также поставляет ионы сульфата, необходимые для высвобождения молекул кислорода в раствор.
- Химический стакан
- Сильная кислота, щелочь или соль
- Вода
- Стержень для перемешивания
Наполните стакан водой наполовину. Для раствора электролита лучше всего подходит дистиллированная вода. Это сведет к минимуму возможные загрязнения в растворе. Некоторые загрязнения могут вызвать реакцию с ионами электролита. Например, если вы смешиваете раствор NaCl, а вода содержит небольшое количество свинца, вы получите осадок, выходящий из раствора. Удаление части ионов из раствора изменяет его прочность.
Выберите электролит, который лучше всего подходит для данной области применения. Для аккумуляторов следует выбирать электролит, в состав которого входит элемент, используемый в одном или обоих полуэлементах. Например, если одна из полуэлементных реакций протекает с медью, хорошим выбором электролита является CuCO3 или CuCl2. Оба они будут поддерживать полуэлемент, обеспечивая наличие ионов Cu2+ в растворе. Вы должны выбрать сильную кислоту, сильное основание или соль одного из них. Высокая степень диссоциации этих соединений повышает способность раствора электролита переносить заряд.
Отмерьте достаточное количество сильной кислоты, сильного основания или соли, чтобы получить раствор электролита достаточной концентрации для поддержки требований электрохимической ячейки. Если концентрация электролита слишком мала, это может затормозить работу гальванического элемента. Концентрация электролита должна быть в пределах 1M. Следовательно, сильные кислоты, основания и соли работают лучше, чем слабые кислоты и основания из-за более высокой степени диссоциации.
Добавьте отмеренное количество электролита в воду в стакане. Перемешайте, чтобы обеспечить полное смешивание.
Вещи, которые вам понадобятся
Связанные статьи
Об авторе
Шон Ланкастер работает писателем-фрилансером с 2007 года. Он писал для Writers Research Group, Alexis Writing и Торговой палаты Ливана. Ланкастер имеет степень доктора философии по химии Вашингтонского университета.
Авторы фотографий
Ablestock.com/AbleStock.com/Getty Images
Литий-ионные аккумуляторы — Curious
Эксперты-рецензенты
Доктор Ананд Бхатт
Руководитель исследовательской группы, Advanced Energy Storage Technologies
CSIRO
Профессор Рэй Уизерс FAA
Химическая исследовательская школа
Австралийский национальный университет
Профессор Госю Ван
Директор Центра экологически чистых энергетических технологий
Технологический университет Сиднея
Основы
- Литий-ионные аккумуляторы повсеместно используются в нашей повседневной жизни — большинство из нас носит их с собой в телефоне.

- Существует несколько типов литий-ионных аккумуляторов. Основное различие между ними заключается в химическом составе катода.
- Разные типы литий-ионных аккумуляторов предлагают разные функции с компромиссом между стоимостью, эффективностью и безопасностью.
Наш лучший друг в наши дни — литий-ионный аккумулятор. Это тот, который питает наши мобильные телефоны и ноутбуки, устройства, которые внесли огромный вклад в изменение того, как мы работаем и взаимодействуем с нашими друзьями, коллегами, продавцами и даже незнакомцами. Потребляемая мощность наших смартфонов способна разрядить никель-кадмиевую или никель-металлгидридную батарею менее чем за час, но благодаря эффективности литий-ионной химии мы можем болтать с мамой, смотреть видео, отправлять сообщения друзьям, слушать музыку, покупать пару обуви онлайн, получать инструкции по навигации и делать бесчисленное количество фотографий в течение всего дня.
Так что же такого особенного в литий-ионных батареях? Их главная фишка — плотность энергии — она примерно вдвое больше, чем у никель-кадмиевой батареи, а это означает, что батарея вдвое меньшего размера будет давать такое же количество энергии. Они легкие и компактные, что означает, что они лучше подходят для таких вещей, как портативная электроника, чем тяжелые свинцово-кислотные батареи, которые заводят наши бензиновые автомобили. Сегодня литий-ионные аккумуляторы
питают большинство портативных электронных устройств. Источник изображения: Edvvc/Flickr.Так что же такого в химическом составе литий-ионного элемента, что дает ему преимущество перед конкурентами?
Химия литий-ионных аккумуляторов
Как следует из названия, ионы лития (Li + ) участвуют в реакциях, приводящих в действие аккумулятор. Оба электрода в литий-ионном элементе изготовлены из материалов, которые могут интеркалировать или «поглощать» ионы лития (немного похоже на гидрид-ионы в NiMH батареях). Интеркаляция — это когда заряженные ионы элемента могут «удерживаться» внутри структуры материала-хозяина, не нарушая ее существенно. В случае литий-ионной батареи ионы лития «привязаны» к электрону внутри структуры анода. Когда батарея разряжается, интеркалированные ионы лития высвобождаются из анода, а затем проходят через раствор электролита, чтобы поглощаться (интеркалироваться) катодом.
Интеркаляция — это когда заряженные ионы элемента могут «удерживаться» внутри структуры материала-хозяина, не нарушая ее существенно. В случае литий-ионной батареи ионы лития «привязаны» к электрону внутри структуры анода. Когда батарея разряжается, интеркалированные ионы лития высвобождаются из анода, а затем проходят через раствор электролита, чтобы поглощаться (интеркалироваться) катодом.
Литий-ионный аккумулятор начинает свою жизнь в состоянии полной разрядки: все его ионы лития интеркалированы внутри катода, а его химический состав еще не способен производить электричество. Прежде чем вы сможете использовать аккумулятор, его необходимо зарядить. Когда аккумулятор заряжается, на катоде происходит реакция окисления, а это означает, что он теряет часть отрицательно заряженных электронов. Для поддержания баланса зарядов на катоде в раствор электролита растворяют равное количество положительно заряженных интеркалированных ионов лития. Они перемещаются к аноду, где внедряются в графит. Эта реакция интеркаляции также откладывает электроны в графитовый анод, чтобы «связать» ион лития.
Эта реакция интеркаляции также откладывает электроны в графитовый анод, чтобы «связать» ион лития.
Показывать метки во время анимации Начать анимацию
Во время разряда ионы лития деинтеркалируются с анода и возвращаются через электролит к катоду. Это также высвобождает электроны, которые привязывали их к аноду, и они текут по внешнему проводу, обеспечивая электрический ток, который мы использовали для выполнения работы. Именно соединение внешнего провода позволяет протекать реакции — когда электроны могут свободно перемещаться, то и положительно заряженные ионы лития уравновешивают движение своего отрицательного заряда.
Когда катод заполняется ионами лития, реакция прекращается и батарея разряжается. Затем мы снова перезаряжаем наши литий-ионные батареи, и внешний электрический заряд, который мы прикладываем, выталкивает ионы лития обратно в анод от катода.
Показывать метки во время анимации Начать анимацию
Электролит в литий-ионном элементе обычно представляет собой раствор солей лития в смеси растворителей (таких как диметилкарбонат или диэтилкарбонат), разработанный для улучшения характеристик батареи. Наличие солей лития, растворенных в электролите, означает, что раствор содержит ионы лития. Это означает, что отдельные ионы лития не должны совершать полный путь от анода к катоду, чтобы замкнуть цепь. По мере того, как ионы выбиваются из анода, другие, которые уже находятся в электролите, вблизи поверхности электрода, могут легко поглощаться (встраиваться) в катод. Обратное происходит во время перезарядки.
Наличие солей лития, растворенных в электролите, означает, что раствор содержит ионы лития. Это означает, что отдельные ионы лития не должны совершать полный путь от анода к катоду, чтобы замкнуть цепь. По мере того, как ионы выбиваются из анода, другие, которые уже находятся в электролите, вблизи поверхности электрода, могут легко поглощаться (встраиваться) в катод. Обратное происходит во время перезарядки.
Будучи маленьким и легким, большое количество лития может храниться (интеркалироваться) в обоих электродах. Именно это придает литий-ионным батареям высокую плотность энергии. Например, один ион лития может храниться на каждые шесть атомов углерода в графите, и чем больше ионов лития приходится на путешествие от анода к катоду (и обратно во время циклов перезарядки), тем больше электронов приходится на балансировку их движения и обеспечение электрического тока.
Перенос ионов лития между электродами происходит при гораздо более высоком напряжении, чем в батареях других типов, и, поскольку они должны быть уравновешены равным количеством электронов, один ионно-литиевый элемент может производить напряжение 3,6 В или выше, в зависимости от материалов катода. Типичный щелочной элемент выдает всего около 1,5 вольт. Для стандартного свинцово-кислотного автомобильного аккумулятора требуется шесть 2-вольтовых элементов, соединенных вместе, чтобы получить 12 вольт.
Типичный щелочной элемент выдает всего около 1,5 вольт. Для стандартного свинцово-кислотного автомобильного аккумулятора требуется шесть 2-вольтовых элементов, соединенных вместе, чтобы получить 12 вольт.
Из-за их высокой плотности энергии и относительной легкости установка большого количества литий-ионных элементов вместе в одном месте позволяет получить аккумуляторный блок, который намного легче и компактнее, чем стек из других типов аккумуляторов. Если мы сложим вместе достаточное количество литий-ионных элементов, мы сможем достичь довольно высокого напряжения, например, необходимого для запуска электромобиля. Конечно, во всех наших автомобилях уже есть аккумуляторы, но они нужны только для того, чтобы запустить бензиновый или дизельный двигатель, тогда всю работу делает топливо. Аккумулятор электромобиля — это его источник энергии и то, что дает ему возможность подняться на крутой холм. Таким образом, он обычно будет иметь 96 вольт или даже больше, что даже при высоком напряжении литий-ионного элемента требует довольно много элементов, сложенных вместе.
Анод обычно графитовый. Однако многократное введение ионов лития в стандартную графитовую структуру типичной литий-ионной батареи в конечном итоге разрушает графит. Это снижает производительность батареи, и графитовый анод в конечном итоге сломается, и батарея перестанет работать. Исследователи работают над разработкой вариантов использования графена (листов углерода толщиной в один атом) вместо графита. Вы узнаете больше о графене и о том, чем он хорош, в следующей теме Nova.
Что касается материала, из которого изготавливается катод, существует довольно много вариаций — обычно из комбинации лития, кислорода и какого-либо металла.
Катоды, используемые в литий-ионных батареях
Оксид лития-кобальта (LiCoO
2 ) Наиболее распространенные литий-ионные элементы имеют анод из углерода (C) и катод из оксида лития-кобальта (LiCoO 2 ). Фактически, литий-кобальт-оксидный аккумулятор был первым литий-ионным аккумулятором, который был разработан на основе новаторских работ Р. Язами и Дж. Гуденафа и продан Sony в 1919 г.91. Кобальт и кислород соединяются вместе, образуя слои октаэдрических структур оксида кобальта, разделенные листами лития. Важно, что эта структура позволяет ионам кобальта менять свои валентные состояния между Co +3 и Co +4 (терять и приобретать отрицательно заряженный электрон) при зарядке и разрядке.
Фактически, литий-кобальт-оксидный аккумулятор был первым литий-ионным аккумулятором, который был разработан на основе новаторских работ Р. Язами и Дж. Гуденафа и продан Sony в 1919 г.91. Кобальт и кислород соединяются вместе, образуя слои октаэдрических структур оксида кобальта, разделенные листами лития. Важно, что эта структура позволяет ионам кобальта менять свои валентные состояния между Co +3 и Co +4 (терять и приобретать отрицательно заряженный электрон) при зарядке и разрядке.
Из всех различных литий-ионных аккумуляторов эти ребята имеют наибольшую плотность энергии, поэтому в настоящее время они используются в наших телефонах, цифровых камерах и ноутбуках. Их недостатком является термическая нестабильность. Их аноды могут перегреваться, а при высоких температурах катод из оксида кобальта может разлагаться с образованием кислорода. Если вы объедините кислород и тепло, у вас есть довольно хорошие шансы начать пожар, и, поскольку химические вещества, иногда используемые в растворе электролита, такие как диэтилкарбонат, легко воспламеняются, с этой батареей могут возникнуть некоторые проблемы с безопасностью.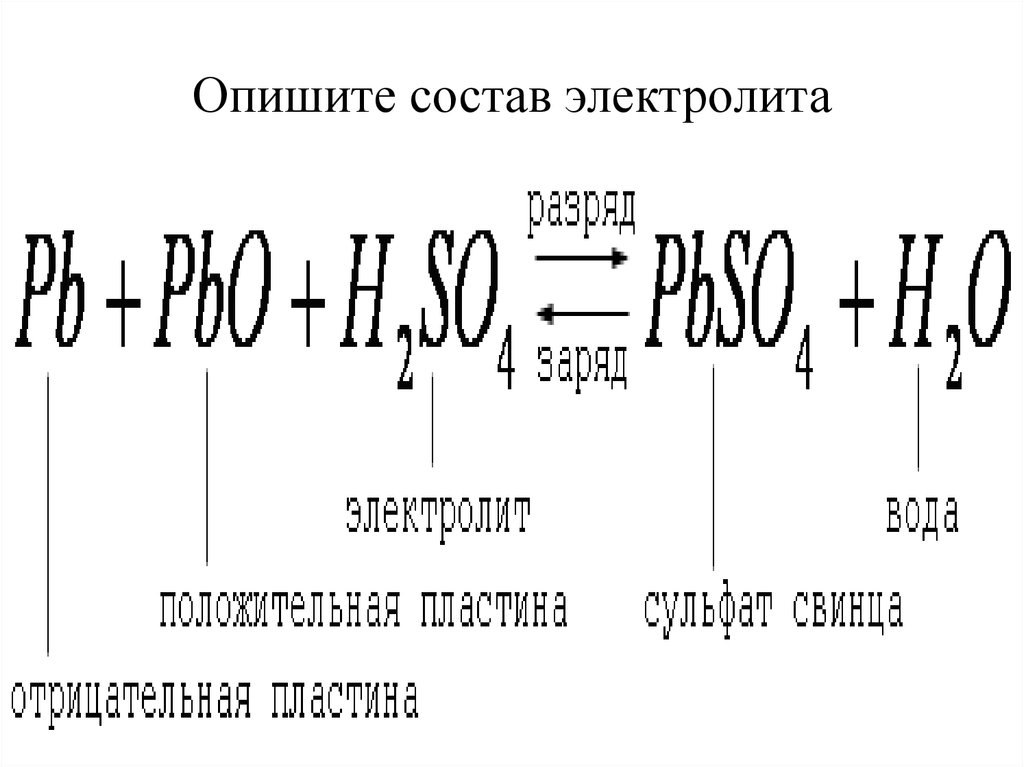
Литий-ионные аккумуляторы имеют встроенную защиту для предотвращения перегрева и полного разряда аккумулятора, что также может привести к повреждению. Кроме того, эти схемы защиты иногда можно использовать для предотвращения перезарядки литий-ионных аккумуляторов, что может иметь серьезные последствия. Литий-ионные батареи бывают самых разных форм и размеров, а некоторые из них содержат встроенные защитные устройства, такие как вентиляционные крышки, для повышения безопасности.
Литий-фосфат железа (LiFePO
4 ) Этот элемент имеет высокую скорость разряда, а поскольку фосфат (PO 4 ) может выдерживать высокие температуры, батарея обладает хорошей термической стабильностью, что повышает ее безопасность. Это делает его хорошим выбором для таких вещей, как электромобили и электроинструменты, а также для хранения энергии на электростанциях. Он также имеет длительный срок службы, что означает, что его можно разряжать и заряжать много раз. Однако он имеет более низкую плотность энергии, чем элемент из оксида лития-кобальта, и более высокую скорость саморазряда.
Литий-железо-фосфатный аккумулятор аналогичен литий-кобальт-оксидному элементу. Анод по-прежнему графитовый, и электролит почти такой же. Разница в том, что катод из диоксида лития-кобальта был заменен более стабильным фосфатом лития-железа. Фактически, в катоде из фосфата железа (FePO4) полностью заряженного элемента не остается ионов лития или железа. Ионы лития могут внедряться в катодный материал или из него через четко определенные туннели в его структуре без значительного изменения каркаса из фосфата железа.
Катод этого типа элементов изготовлен из отрицательно заряженного фосфата
анионы ГЛОССАРИЙ анионы Отрицательно заряженные ионы, особенно ионы, которые мигрируют к аноду при электролизе , связанный с положительно заряженным железом
катионы ГЛОССАРИЙ катионы Положительно заряженные ионы, то есть те, которые будут притягиваться к катоду при электролизе в структуре, способной хранить ионы лития в молекулах фосфата железа. Расположение связей в этой структуре означает, что атомы кислорода прочно связаны в структуру, что придает катоду его химическую стабильность.
Расположение связей в этой структуре означает, что атомы кислорода прочно связаны в структуру, что придает катоду его химическую стабильность.
Оксид лития-марганца (LiMn
2 O 4 )В этом типе литиевых батарей используется катод из литий-марганцевой шпинели (Li + Mn 3+ Mn 90 087 4+ О 4 ). Шпинель представляет собой тип минерала с характерной структурой AB 2 O 4 . Структура шпинели обладает очень хорошей термической стабильностью, повышая безопасность батареи. Это также способствует ионному потоку внутри электролита и уменьшает внутреннее сопротивление, которое со временем способствует потере мощности батареи.
Несмотря на то, что этот тип литиевых батарей обеспечивает высокую скорость разрядки и перезарядки (в том числе из-за шпинельной структуры катода), он имеет меньшую емкость и более короткий срок службы.
Оксид лития, никеля, марганца, кобальта (LiNiMnCoO
2 или NMC) Добавление никеля и кобальта обратно в смесь снова немного меняет ситуацию. Никель обеспечивает высокую удельную энергию и при добавлении к стабильной структуре марганцевой шпинели также приводит к получению батареи с преимуществами структуры марганцевой шпинели (низкое внутреннее сопротивление, высокая скорость зарядки, хорошая стабильность и безопасность).
Никель обеспечивает высокую удельную энергию и при добавлении к стабильной структуре марганцевой шпинели также приводит к получению батареи с преимуществами структуры марганцевой шпинели (низкое внутреннее сопротивление, высокая скорость зарядки, хорошая стабильность и безопасность).
Катод этих батарей обычно состоит из одной трети никеля, одной трети марганца и одной трети кобальта, но соотношение может варьироваться в зависимости от секретных формул производителей. Эти аккумуляторы используются в электроинструментах, электромобилях и медицинских приборах.
Литий-марганцевые батареи часто сочетаются с литий-никель-марганцево-кобальтовыми батареями, образуя комбинацию, которая используется во многих электромобилях. Высокие всплески энергии (для быстрого ускорения) обеспечиваются литий-марганцевым компонентом, а большой запас хода обеспечивается компонентом литий-никель-марганец-кобальт.
Литий-полимерный
Замена жидкого электролита в литий-ионном аккумуляторе твердым электролитом повышает безопасность аккумулятора и делает его легче. Поскольку сам полимер очень тонкий, он также обеспечивает большую гибкость с точки зрения формы и дизайна — его не нужно помещать в жесткий корпус, и его можно сделать чрезвычайно компактным.
Поскольку сам полимер очень тонкий, он также обеспечивает большую гибкость с точки зрения формы и дизайна — его не нужно помещать в жесткий корпус, и его можно сделать чрезвычайно компактным.
Полимерный электролит представляет собой непроводящий материал, который, тем не менее, допускает ионный обмен. В ранних конструкциях полимер был настолько плохим проводником, что не мог способствовать ионному обмену, если только не был нагрет примерно до 60 градусов по Цельсию, поэтому теперь добавляют небольшое количество геля, чтобы избежать этой проблемы.
Литий-полимерный аккумулятор может использовать любую комбинацию электродов, используемую в литий-ионных аккумуляторах; отличается просто электролит.
Точно так же, как батареи в целом бывают разных форм, размеров и химического состава, литий-ионные батареи тоже бывают. Их различные химические вещества и структуры предлагают различные функции, часто с компромиссом между эффективностью, стоимостью и безопасностью.
Литий-ионные аккумуляторы необходимы нам в повседневной жизни.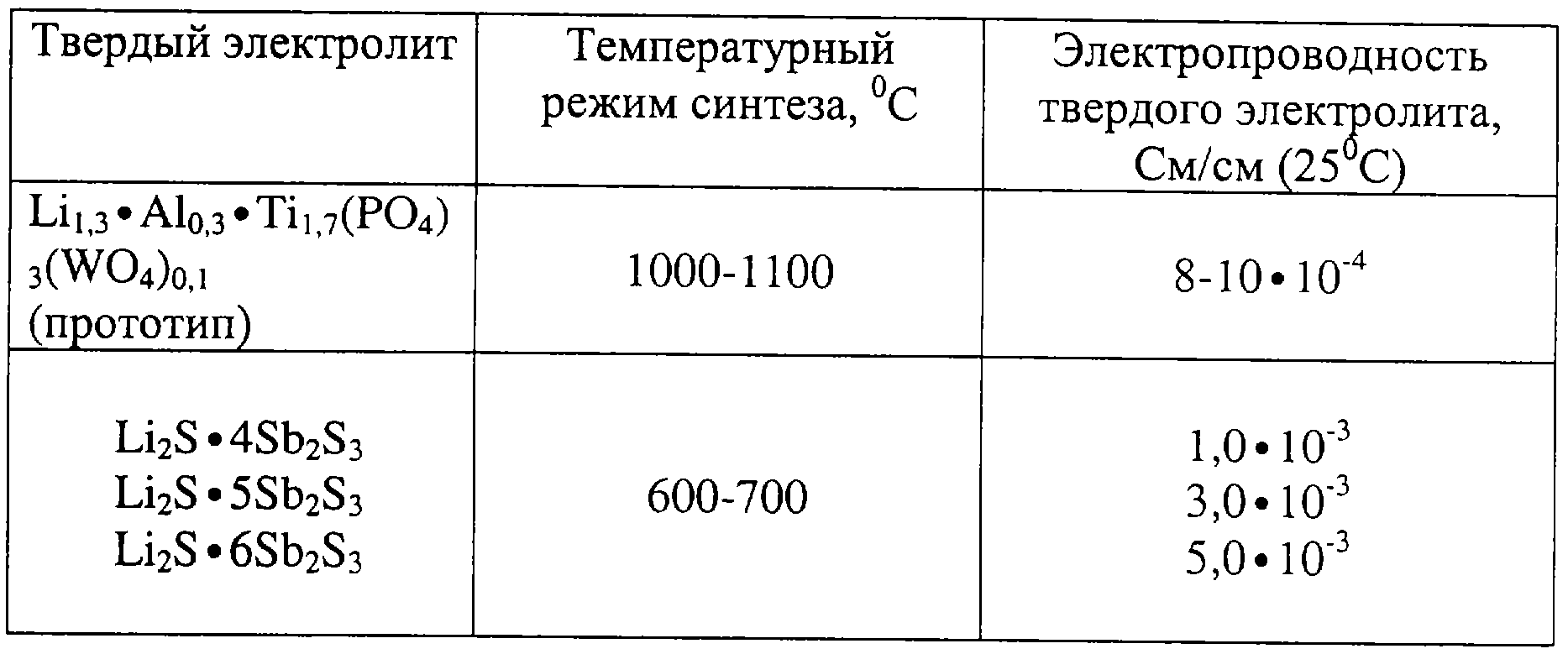

 1 Оборудование
1 Оборудование

