Ареометр для антифриза: проверять, а не доверять
17 сентября 2020
1026
Качественный антифриз отводит избытки тепла от двигателя; защищает систему от коррозии и кавитации; не замерзает на морозе и не кипит при температурах выше 100 °С. Провести качественный анализ антифриза своими силами не получится, для этого нужно отправлять пробу в лабораторию.
Денис Гудин
специалист
Службы поддержки
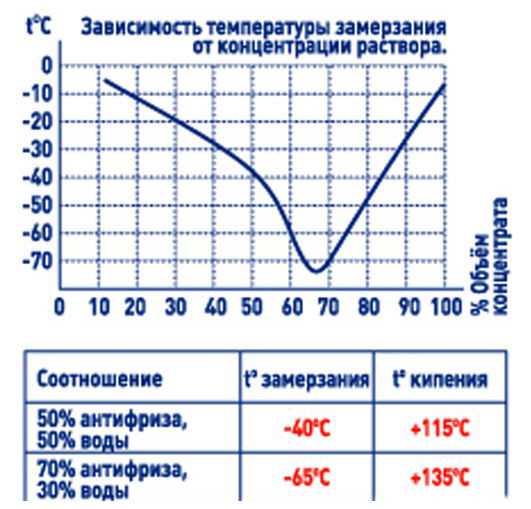
Однако приблизительную температуру замерзания антифриза можно узнать самостоятельно. Для этого нам потребуются приборы: рефрактометр или ареометр. Рефрактометр измеряет показатель преломления в среде. Ареометр определяет плотность жидкости.
Преломление и плотность — эта два косвенных показателя, по которым можно выяснить концентрацию антифриза (соотношение воды и гликоля). Именно от концентрации зависит поведение антифриза при низких и повышенных температурах.
В данной статье мы рассмотрим принцип работы ареометра для антифриза и ответим на вопрос, можно ли доверять этому прибору?
принцип работы
АРЕОМЕТРА ДЛЯ АНТИФРИЗА
Ареометр — это прибор, известный с древности. С его помощью можно определить плотность вещества. В классическом виде он представляет собой утяжеленный стеклянный поплавок с градуировочной шкалой. Поплавок опускают в жидкость, и, когда он фиксируется на определенном уровне, снимают показания по шкале плотности. Существует много типов ареометров, которые откалиброваны под разные жидкости: спиртометры, лактометры, солемеры и др.
С его помощью можно определить плотность вещества. В классическом виде он представляет собой утяжеленный стеклянный поплавок с градуировочной шкалой. Поплавок опускают в жидкость, и, когда он фиксируется на определенном уровне, снимают показания по шкале плотности. Существует много типов ареометров, которые откалиброваны под разные жидкости: спиртометры, лактометры, солемеры и др.
Главное достоинство ареометров для антифризов — их цена и доступность. В отличие от тех же рефрактометров, ареометры продаются практически в любом автомагазине и стоят копейки. Точность измерений, произведенных таким прибором, очень приблизительная. Показания измерения температуры замерзания варьируются в пределах 5–10 °C.
Как правило, ареометры для антифризов определяют температуру замерзания в пределах от −5 до −45 °С. Жидкости с более низкими температурами замерзания, предназначенные для полярных районов, проверить не получится.
Еще один недостаток: подавляющее большинство ареометров для антифризов откалиброваны для этиленгликолевых традиционных ОЖ с минеральным пакетом присадок (например, для классического ТОСОЛа). Современные составы антифризов с карбоксилатными присадками сильно отличаются от ТОСОЛа по плотности. Также отличаются по плоности пропиленгликолевые антифризы. И измерения будут неточными.
Современные составы антифризов с карбоксилатными присадками сильно отличаются от ТОСОЛа по плотности. Также отличаются по плоности пропиленгликолевые антифризы. И измерения будут неточными.
Таким образом, ни о каком серьезном анализе речи не идет, однако приблизительное представление о температуре начала кристаллизации антифриза получить можно.
5–10 °С
погрешность ареометра для антифриза
КАК ПОЛЬЗОВАТЬСЯ
АРЕОМЕТРОМ ДЛЯ АНТИФРИЗА
Автомобильные ареометры бывают разных модификаций. По умолчанию у них есть градуировка под температуру замерзания антифриза. Классические стеклянные ареометры, как правило, еще можно использовать для замеров плотности аккумуляторного электролита. Некоторые приборы имеют шкалу с температурами кипения антифриза.
Современный ареометр показывает температуры замерзания и кипения
Классический ареометр показывает плотность антифриза и электролита
Автомобильные ареометры любого типа спроектированы таким образом, чтобы токсичные жидкости случайно не попали на кожу или в глаза. С помощью резиновой груши (баллона для закачки) антифриз набирается в колбу или непосредственно в пластиковый корпус, в зависимости от типа прибора.
С помощью резиновой груши (баллона для закачки) антифриз набирается в колбу или непосредственно в пластиковый корпус, в зависимости от типа прибора.
Перед тем, как брать пробу на анализ, нужно убедиться в том, что ареометр для антифриза чистый и не содержит следов предыдущих испытаний. Если есть загрязнения, промываем прибор в мыльной воде и ждем высыхания 5–10 минут. После этого промываем ареометр исследуемой ОЖ, и после этого можно приступать к тестированию антифриза.
Для того, чтобы взять пробу, сжимаем грушу и опускаем резиновый наконечник пробки в охлаждающую жидкость. После этого разжимаем грушу, и антифриз заполняет колбу (корпус). Если вы используете традиционный ареометр со стеклянной колбой, то линия соприкосновения антифриза с поплавком показывает температуру замерзания. В современных ареометрах есть специальный подвижный указатель, который отмечает значения на шкале. Все готово, можно снимать показания. Сливаем охлаждающую жидкость и промываем ареометр.
Важно! Проводить имерения ареометром для антифриза необходимо при температуре воздуха 20 °С.
Факты об антифризах
Хорошая температура замерзания — еще не признак качественного антифриза
Температура замерзания — это одно из основных, но не первостепенное свойство антифриза. Гораздо важнее то, насколько эффективно ОЖ отводит избытки тепла от двигателя. Также немаловажны антикоррозионные и антикавитационные характеристики.
Однако многие автовладельцы ошибочно отождествляют качество антифриза с его низкотемпературными свойствами. Интернет завален статьями «экспертов», которые проверяют ОЖ самостоятельно, отмечают с помощью ареометров или рефрактометров хорошую температуру замерзания, бросают в пробу жидкости щепотку соды и в целях рекламы предлагают менять антифриз каждый год или не менять до второго пришествия…
Мы напоминаем: для того, чтобы на самом деле понять, отвечает антифриз заявленному производителем качеству, нужно отправлять пробы рабочей жидкости в сертифицированные лаборатории. Там антифриз протестируют по всем показателям и выдадут экспертное заключение.
Ареометр — дешевый и несложный прибор, с помощью которого можно получить приблизительное представление о температуре замерзания ОЖ. Сами по себе его показания не очень точные, однако его можно использовать в полевых условиях как дополнительный этап тестирования антифриза наряду с рефрактометром.
Как правильно проверить плотность антифриза?
Анализ
Промывка
- Промывка
- Промывка труб отопления
- Промывка кондиционера
- Промывка вентиляции
- Промывка пластинчатых теплообменников
- Промывка систем холодоснабжения
Утилизация
Замена
- Главная
- Блог (Новости)
- Как правильно проверить плотность антифриза?
Качество антифриза требует регулярной проверки, так же как и другие жидкости и механизмы в автомобиле. Делать это можно не часто, но обязательно, иначе вы рискуете спалить свой мотор. Маленькое упущение может грозить крупными неприятностями. Имейте в виду.
Делать это можно не часто, но обязательно, иначе вы рискуете спалить свой мотор. Маленькое упущение может грозить крупными неприятностями. Имейте в виду.
Контролируются такие параметры:
- уровень антифриза;
- цвет;
- наличие осадков;
- плотность антифриза.
Они указывают на способность охлаждающей жидкости продолжать выполнять свои функции и говорят, есть ли необходимость замены вещества.
Рекомендации по проведению проверки антифриза
Для бытового анализа охлаждающей жидкости обычно используют ареометр или более простой способ — заморозку. Второй вариант, кстати, эффективнее, поскольку зачастую приборы нещадно врут. Мало того, что вы деньги за ареометр заплатите, так еще и точных показаний не добьетесь. Опытные автомобилисты используют старый проверенный метод заморозки антифриза.
Второй вариант, кстати, эффективнее, поскольку зачастую приборы нещадно врут. Мало того, что вы деньги за ареометр заплатите, так еще и точных показаний не добьетесь. Опытные автомобилисты используют старый проверенный метод заморозки антифриза.
Отобранную пробу охлаждающей жидкости помещают в сжатую пластиковую бутылку и плотно закрывают. Продукт кладут примерно на час в морозилку.
Антифриз охлаждается примерно до -32 градусов (качественная концентрированная “антизамерзайка” должна выдерживать температуру до -65). После обозначенного времени вынимайте и любуйтесь результатами проверки.
Вы увидите, способен ли антифриз выдерживать положенную нагрузку и не кристаллизоваться при низкой температуре. Также благодаря опыту можно определить уровень прозрачности жидкости и наличие осадков.
Как поступить, если проверка показала, что антифриз требует замены?
Необходимо заменить охлаждающую жидкость, но не сразу, а в несколько этапов.
В первую очередь, слейте старый антифриз.
Затем прочистите систему специальной присадкой, рекомендованной автопроизводителем марки.
После этого залейте дистиллированную воду. Проедьтесь с ней. Слейте и залейте еще раз чистую дистиллированную воду. Так вы хорошо очистите систему двигателя.
И только после всех проведенных процедур смело заливайте новый антифриз.
Все просто. Главное — не забывать и не лениться контролировать качество охлаждающей жидкости в любимой машине.
Интересные статьи
Пропиленгликоль
Водный раствор пропиленгликоля
Механическая очистка теплообменников
Как измерить % антифриза в охлаждающей жидкости автомобиля? — Техническое обслуживание/ремонт
Сообщество автомобильного разговораЯансу
1
Я хотел бы сам заменить охлаждающую жидкость в своей машине, но слить радиатор не получится. Я хочу слить воду, снова наполнить водой, запустить двигатель, чтобы вода циркулировала, и повторить 5-6 раз. Затем слейте из радиатора (теперь в основном воду) и залейте достаточное количество антифриза, чтобы вернуть рекомендуемое соотношение вода:антифриз 1:1. Я думаю, я мог бы рассчитать, сколько антифриза нужно добавить, исходя из заявленного объема системы, но было бы точнее, если бы был другой способ анализа охлаждающей жидкости. Можно ли это сделать как для аккумуляторов? Проверяете плотность?
Я хочу слить воду, снова наполнить водой, запустить двигатель, чтобы вода циркулировала, и повторить 5-6 раз. Затем слейте из радиатора (теперь в основном воду) и залейте достаточное количество антифриза, чтобы вернуть рекомендуемое соотношение вода:антифриз 1:1. Я думаю, я мог бы рассчитать, сколько антифриза нужно добавить, исходя из заявленного объема системы, но было бы точнее, если бы был другой способ анализа охлаждающей жидкости. Можно ли это сделать как для аккумуляторов? Проверяете плотность?
Кстати, по какой причине я не мог ненадолго проехаться только с водой в системе охлаждения? Реально допустить хороший обмен с промывкой водой со старой охлаждающей жидкостью?
техасский
2
Хорошо, что ты хочешь быть тщательным. Если вы даете автомобилю полностью прогреться (вентилятор включается/выключается) и выполняете 5 (или даже 2 или 3) циклов слива/заполнения, нет необходимости ездить по кругу. Правильнее всего найти указанный объем вашей системы охлаждения, залить туда антифриза наполовину, а потом долить водой. Вы можете получить ареометры антифриза в автозапчастях, но они приблизительны. Тем не менее, хорошо, что нужно проверить позже, и они не большие $$.
Правильнее всего найти указанный объем вашей системы охлаждения, залить туда антифриза наполовину, а потом долить водой. Вы можете получить ареометры антифриза в автозапчастях, но они приблизительны. Тем не менее, хорошо, что нужно проверить позже, и они не большие $$.
Просто знайте, что это не критично, вам нужно примерно 50/50.
супердейв
3
Есть несколько вещей, которые вы можете сделать, и да, есть датчик, похожий на аккумуляторный гигрометр. Вы просто высасываете решение, и оно покажет рейтинг.
Конечно, вы можете ездить с водой в системе в течение короткого времени, если не происходит замерзания. Но я скажу, что антифриз (этиленгликоль) очень помогает в смазке и эмульгировании системы охлаждения и жидкости.
Большинство руководств по эксплуатации и бутылок с антифризом, тем не менее, советуют заменить смесью 50/50% (вода и антифриз). Это довольно просто и обычно дает вам защиту от 25 до 35 ниже (ноль).
Это довольно просто и обычно дает вам защиту от 25 до 35 ниже (ноль).
МайкИнНХ
4
Есть тестеры антифриза менее чем за 10 долларов, которые хорошо справляются со своей задачей. На основании их чтения скажут вам ваше соотношение.
Что касается езды только с водой… Не нужно. Как только автомобиль прогрет, это означает, что антифриз циркулирует и смешивается. Я обычно даю постоять минут 10-15. Если вы едете… не делайте этого дольше 10-15 минут.
олдскул
5
Существует инструмент, который используют профессионалы для проверки концентрации охлаждающей жидкости, и я доверял только ему, так как защита от замерзания была очень важна там, где я выполнял большую часть своей работы с охлаждающей жидкостью.
Я никогда не считал, что инструменты с плавающим шариком достаточно точны, но затем я должен был поставить свою подпись в том, насколько хороша охлаждающая жидкость, и если мне придется подписать что-то, вы можете поспорить, я позабочусь о том, чтобы то, что я подписываю, было точным.
the_same_mountainbike
6
Хотя я поддерживаю промывку системы пресной водой, а затем повторное наполнение, я пойду дальше, чем другие, и предложу вам НЕ использовать только воду. Охлаждающая жидкость также действует как смазка для водяного насоса, и на самом деле нет абсолютно никаких причин промывать ее и ездить таким образом.
Честно говоря, лучше всего слить воду из системы, ненадолго промыть ее водой из шланга, а затем снова заполнить соответствующей смесью 50/50, используя дистиллированную воду (продается в продуктовом магазине по цене 1 доллар США за галлон). Некоторые даже считают промывание водой из шланга излишним. Не забудьте срыгнуть систему, если она имеет клапан срыгивания в верхней точке.
яансу
7
Oldschool:
Готов поспорить, что вы использовали рефрактометр, что-то, что измеряет RI (показатель преломления). Это раньше использовалось в химии для измерения состава растворов до доступа к газовым хроматографам. Проблема в том, что он может отключаться из-за других примесей в растворе. Я химик, и я посмотрю, не смогу ли я одолжить один для моей работы над автомобилем. Должно быть просто составить несколько стандартных решений, измерить требуемый RI и затем сопоставить его.
Должно быть просто составить несколько стандартных решений, измерить требуемый RI и затем сопоставить его.
Я понимаю, что это перебор, так как 50/50 не критично, но мне нравится его технический аспект.
Рон-мэн
8
Если вы действительно хотите промыть систему, возможно, вам следует установить комплект для промывки и заполнения. С его помощью вы можете подключить садовый шланг и буквально промыть всю систему. Просто убедитесь, что вы сначала слили старую охлаждающую жидкость в соответствующую емкость, чтобы не загрязнять грунтовые воды в вашем районе.
реальный
9
не просто замораживание — смесь 50/50 не только замерзает при более низкой температуре, но и кипит при более высокой температуре, смазывает сам водяной насос и предотвращает ржавчину.
the_same_mountainbike
10
Круто! Среди нас есть химик!
Добро пожаловать. Ошиваться. Мы могли бы часто использовать ваш опыт.
водонос
11
На случай, если вы не знали, что доливать холодную воду в горячий двигатель, когда он не работает, — плохая идея.
vtcodger2
12
Существуют более классные гигрометры, чем гигрометры с плавающим шариком, но мой показался мне излишним, и я не расстроился, когда на него упало что-то тяжелое. Поскольку вы дотошны, вы можете включить нагреватель во время слива. Может быть, вы получите немного дополнительной жидкости.
Поскольку вы дотошны, вы можете включить нагреватель во время слива. Может быть, вы получите немного дополнительной жидкости.
На некоторых автомобилях помимо сливного отверстия в основании радиатора на двигателе должны быть сливные болты, но их часто трудно найти. Открытие их должно обеспечить полный слив, а также как-то решить проблему пузырьков воздуха, которые бывает трудно уговорить.
Если исходить из памяти (много десятилетий назад я получил степень по химии), 50 на 50 не так уж критично. Если вместо этого вы на самом деле получите 45-55, все будет в порядке.
Может быть, это только я, но мне кажется, что то, что раньше было простой и понятной работой, за последние два десятилетия стало более трудным. Может быть у кого-то есть какие-то соображения.
the_same_mountainbike
13
На обратной стороне флакона есть таблица, показывающая уровень защиты различных пропорций. Память не нужна.
Память не нужна.
олдскул
14
Это обычные инструменты, доступные на всех грузовиках с инструментами, вам нужно откалибровать инструмент (это очень просто сделать). Это европейский способ проверки уровня защиты охлаждающей жидкости от замерзания.
водяной мальчик
15
Это действительно становится слишком сложным, в руководстве по эксплуатации указан объем охлаждающей жидкости, если он составляет 6 галлонов, то 3 галлона должны быть не смешаны с антифризом. Иногда после полной промывки водой система может не принять столько антифриза, сколько требуется для смеси 50/50, поэтому обязательно слейте все как можно лучше, в том числе снимите нижний шланг радиатора и дайте ему стечь. Если количество антифриза, которое вы добавляете до тех пор, пока система не будет заполнена, и составляет менее 1/2 емкости, у вас есть проблема и вам нужен блок тестирования.
Если количество антифриза, которое вы добавляете до тех пор, пока система не будет заполнена, и составляет менее 1/2 емкости, у вас есть проблема и вам нужен блок тестирования.
Бусины и бусины
16
Некоторые сообщают, что вы можете получить немного больше жидкости из блока через выпускное отверстие охлаждающей жидкости (минус t-stat), используя магазинный пылесос. Я бы подумал, что это может работать дует или сосать.
водяной мальчик
17
Хорошая идея. Это новая для меня идея, но логичная, спасибо.
гонщик
18
Я только что подумал об этом со своим грузовиком… все 28 кварт! У меня вышло около 6 галлонов. У меня есть дешевый тестер Prestone. Долго искал хороший гидрометр. Любые предложения для DIY’er?
Я нашел это: http://www.drillspot.com/products/424756/Westward_1DXL8_Antifreeze_Hydrometer
the_same_mountainbike
19
Ага. Смешайте охлаждающую жидкость с дистиллированной водой в соответствии с соотношениями, указанными на обратной стороне бачка с охлаждающей жидкостью, и заполните систему. Ее вовсе не обязательно превращать в точную науку.
Если вы заливаете свежую охлаждающую жидкость каждые 3-4 года и смешиваете ее в бутылках, то нет необходимости в этом заморачиваться.
техасский
20
Я бы двигатель так микшировал. Слить, промыть, слить, залить рекомендуемое количество антифриза, долить водой.
следующая страница →
ChemTeam: расчеты моляльности, молярности, плотности, массовых процентов, мольных долей (задачи №11
ChemTeam: расчеты моляльности, молярности, плотности, массовых процентов, мольных долей (задачи №11–25) )Расчеты с моляльностью, молярностью, плотностью, массовым процентом, мольной долей
Задачи №11 — 25
Пятнадцать примеров
Проблемы 1 — 10
Вернуться в меню решений
Задача №11: Рассчитайте молярность и молярную долю ацетона в 2,28-молярном растворе ацетона (CH 3 COCH 3 ) в этаноле (C 2 H 5OH).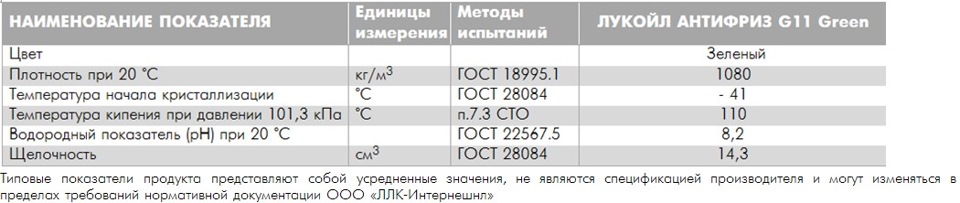 (Плотность ацетона = 0,788 г/см 3 ; плотность этанола = 0,789 г/см 3 .) Предположим, что объемы ацетона и этанола складываются.
(Плотность ацетона = 0,788 г/см 3 ; плотность этанола = 0,789 г/см 3 .) Предположим, что объемы ацетона и этанола складываются.
Раствор для молярности:
Помните, что 2,28-моляль означает 2,28 моль ацетона в 1,00 кг этанола.
1) Определить объемы ацетона и этанола, затем общий объем:
ацетон
2,28 моль x 58,0794 г/моль = 132,421 г132,421 г разделить на 0,788 г/см 3 = 168,047 см 3
этанол
1000 г разделить на 0,789 г/см 3 = 1267,427 см 3
общий объем
168,047 + 1267,427 = 1435,474 см 3
2) Определите молярность:
2,28 моль/1,435 л = 1,59 М
Раствор для мольной доли:
1) Определить количество молей этанола:
1000 г / 46,0684 г/моль = 21,71 моль
2) Определите мольную долю ацетона:
2,28 / (2,28 + 21,71) = 0,0950
Задача №12: Рассчитайте нормальность 4,0-молярного раствора серной кислоты с плотностью 1,2 г/мл.
Напоминания:
N = количество эквивалентов / л раствора
#эквивалентов = молекулярная масса / n (n = количество H + или OH¯, высвобождаемых при диссоциации.)
моляль = моль растворенного вещества / кг растворителя
Решение:
1) Определить граммы H 2 SO 4 в наличии:
4,0 моляля = 4,0 моля H 2 SO 4 / 1000 г раствора4,0 моль умножить на 98,09 г/моль = 392,32 г
2) Определить эквивалентный вес для H 2 СО 4 :
98,09 г/моль / 2 диссоциирующего водорода/моль = 49,05 г/эквивалент
3) Определить # эквивалентов в 392,32 г:
392,32 г раз (1 эквивалент / 49,05 г) = 8,0 эквивалента
4) Определить объем раствора:
392,32 г + 1000 г = 1392,32 г (общая масса раствора)1392,32 г / 1,2 г/мл = 1160,27 мл
5) Определить нормальность:
Н = 8,0 эквивалентов / 1,16027 Д = 6,9 Н
Задача № 13: Смесь автомобильного антифриза получают путем смешивания равных объемов этиленгликоля (d = 1,114 г/мл, молярная масса 62,07 г/моль) и воды (d = 1,000 г/мл) при 20,0 °C.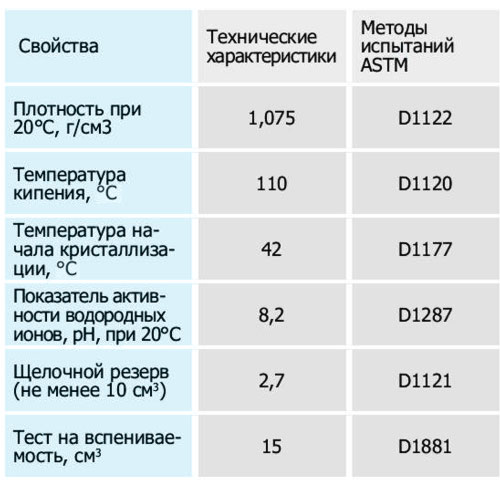 Плотность раствора 1,070 г/мл.
Плотность раствора 1,070 г/мл.
Выразите концентрацию этиленгликоля как:
(а) объемные проценты
(б) массовые проценты
(c) молярность
(г) моляльность
(e) мольная доля
Решение (а):
Поскольку объемы равны, объемный процент этиленгликоля составляет 50%
Решение (б):
1) Определить массы равных объемов (будем использовать 50,0 мл) двух веществ:
этиленгликоль: (50,0 мл) (1,114 г/мл) = 55,7 г
вода: (50,0 мл) (1,000 г/мл) = 50,0 г
2) Определить процентное содержание этиленгликоля:
55,7 г / 105,7 г = 52,7%
Решение (с):
1) Определить количество молей этиленгликоля:
55,7 г / 62,07 г/моль = 0,89737 моль
2) Определить объем раствора:
105,7 г / 1,070 г/мл = 98,785 мл
3) Определите молярность:
0,89737 моль/0,098785 л = 9,08 М
Решение (г):
0,89737 моль/0,050 кг = 17,9 мОбратите внимание на большую разницу между молярностью и моляльностью.
Решение (д):
1) Определить количество молей воды:
50,0 г / 18,0 г/моль = 2,77778
2) Определите мольную долю этиленгликоля:
0,89737 моль / 3,67515 моль = 0,244
Задача № 14: Какова массовая доля CsCl в 0,0711 М растворе CsCl с плотностью 1,09 г/мл?
Решение:
1) Определить массу растворенного CsCl:
Допустим, 100,0 мл раствора.МВ = граммы / молярная масса
(0,0711 моль/л) (0,100 л) = х / 168,363 г/моль
х = 1,197 г
2) Определите массу раствора:
1,09 г/мл умножить на 100,0 мл = 109 г
Определить массовую долю CsCl в растворе:
1,197 г / 109 г = 1,098%до трех знаков инжира: 1,10%
Задача №15: 8,77 М раствор кислоты HX имеет плотность 0,853 г/мл. Кислота HX имеет молярную массу 31,00 г/моль. Определите молярную концентрацию этого раствора, Χ HX (молярная доля HX) и % вес/вес (массовые проценты). Растворителем в этом растворе является вода, H 2 О.
Определите молярную концентрацию этого раствора, Χ HX (молярная доля HX) и % вес/вес (массовые проценты). Растворителем в этом растворе является вода, H 2 О.
Комментарий: Может ли 8,77 М раствор кислоты иметь плотность 0,853 г/мл? Какая разница? Мы просто решим проблему.
Решение:
Для решения задач такого типа есть хитрость: предположим, что имеется 1,00 л (или 1000 мл) раствора. (Другое место, где используется подобный трюк, — это определение эмпирических формул, где вы предполагаете, что присутствует 100 г вещества.)
1) Некоторые предварительные расчеты:
моль кислоты: 1,00 л x (8,77 моль/л) = 8,77 моль HX (используется в моляльности и молярной доле)масс. кислота: 8,77 моль x 31,00 г/моль = 272 г НХ (проценты по массе)
масса раствора: 1000 мл x 0,853 г/мл = 853 г раствора (в процентах по массе)
масса растворителя: 853 г минус 272 г = 581 г = 0,581 кг (моляльность)
молей растворителя: 581 г разделить на 18,015 г) = 32,25 (молярная доля)
2) Расчеты для ответа на вопросы:
моляльность = 8,77 моль / 0,581 кг = 15,1 ммольных долей = 8,77 / (8,77 + 32,25) = 0,214
% масс.
/масс. = (272 г / 853 г) x 100 = 31,9%
Задача №16: Раствор перекиси водорода, H 2 O 2 , составляет 30,0% по массе и имеет плотность 1,11 г/см 3 . Рассчитайте моляльность (а), молярность (б) и молярную долю (в).
Решение:
1) Масса 1 л раствора:
1,11 г/см 3 раз (1000 см 3 / л) = 1110 г/л
2) Масса двух компонентов раствора:
масса H 2 O 2 —> 30,0% от 1110 г = 333 г
масса H 2 O —> 70,0% от 1110 г = 777 г
3) Моль перекиси водорода:
333 г / 34,0138 г/моль = 9,79 моль
4) Моляльность:
9,79 моль/0,777 кг = 12,6 м
5) Молярность
9,79 моль/1,00 л = 9,79 М
6) Молярная доля
моль H 2 O 2 = 9,79
моль H 2 O = 43,13всего молей —> 9,79 + 43,13 = 52,92
мольная доля —> 9,79 / 52,92 = 0,185
Задача №17: Бытовая перекись водорода представляет собой водный раствор, содержащий 3,0% перекиси водорода по массе. Какова молярность этого раствора? (Примите плотность 1,01 г/мл.)
Какова молярность этого раствора? (Примите плотность 1,01 г/мл.)
Решение:
1) Имеем под рукой 1000 г раствора. По объему раствора:
1000 г разделить на 1,01 г/мл = 990,1 мл
2) Поскольку H 2 O 2 составляет 3% по массе, мы знаем, что в 1000 г раствора присутствует 30 грамм H 2 O 2 .
MV = масса / молярная масса(x) (0,9901 л) = 30 г / 34,0138 г/моль
х = 0,8
М
Цифры в два знака кажутся разумными, поэтому 0,89 M.
Задача № 18: 6,90 М раствор КОН в воде содержит 30% по весу КОН. Рассчитайте плотность раствора КОН.
Решение:
Предположим, у нас имеется 1,00 литр раствора. Это означает, что у нас есть 6,90 моль КОН. Определим массу КОН:6,90 моль умножить на 56,1049 г/моль = 387,124 г
387,124 г составляет 30% от общей массы раствора. (Вода составляет остальные 70%.
) Чтобы получить массу раствора, сделайте следующее:
387,124 г равно 0,3, так как x равно 1х = 1290 г
плотность раствора —> 1290 г/1000 мл = 1,29г/мл (до трех знаков инжира)
Задача №19: Водный раствор NaCl готовят из 138 г NaCl, разбавленного до общего объема раствора 1,30 л.
(A) Рассчитайте молярность раствора.
(B) Рассчитайте моляльность раствора. (Примите плотность раствора 1,08 г/мл.)
(C) Рассчитайте массовый процент раствора. (Примите плотность раствора 1,08 г/мл.)
Решение:
Часть А:
MV = масса / молярная масса(x) (1,30 л) = 138 г / 58,443 г/моль
х = 1,82 М
Часть Б:
моляльность растворенного вещества на кг растворителя. Я буду использовать 2,3613 моль (сохраняя несколько защитных цифр).Предположим, имеется 1000 мл раствора. Это говорит нам о том, что присутствует 2,3613 моль растворенного вещества (это 138 г NaCl).
1,08 г/мл умножить на 1000 мл = 1080 г 1080 г минус 138 г = 942 г 942 г = 0,942 кг
2,3613 моль/0,942 кг = 2,51 м
Часть С:
138 г растворенного вещества было растворено в 1080 г общего раствора(138 / 1080) умножить на 100 = 12,8% 100% минус 12,8% = 87,2% 2O
Другой тип вопросов в этой области состоит в том, чтобы попросить вас определить молярную долю каждого вещества. Для этого вам нужно знать количество молей воды:
942 г / 18,015 г/моль = 52,29 мольМолярная доля NaCl:
2,3613 моль / (2,3613 моль + 52,29 моль) = 0,0432
Молярная доля воды:
1 − 0,0432 = 0,9568
Задача № 20: Раствор готовят растворением 28,0 г глюкозы (C 6 H 12 O 6 ) в 350 г воды. Конечный объем раствора составляет 384 мл. Для этого решения вычислите каждое из следующих значений:
1) молярность; 2) моляльность; 3) проценты по массе; 4) мольная доля; 5) мольных процентов
Решение:
1) Молярность – это количество молей, деленное на объем растворителя в литрах.
28,0 г / 180 г/моль = 0,156 моль0,156 моль/0,384 л = 0,405 М
2) Моляльность – это количество молей, деленное на массу растворителя в килограммах.
0,156 моль/0,350 кг = 0,444 м
3) Процент по массе, как следует из названия, представляет собой массу растворенного вещества, деленную на общую массу, умноженную на 100%.
28,0 г / (350 г + 28 г) умножить на 100 = 7,41% C 6 H 12 O 6 по массе
4) Молярная доля – это количество молей растворенного вещества, деленное на общее количество молей.
350 г / 18,015 г/моль = 19,428 моль воды0,156 моль / (19,428 + 0,156) = 0,0080 молярная доля C 6 H 12 O 6
Мольная доля воды:
1 − 0,0080 = 0,992
5) Молярный процент – это мольная доля, умноженная на 100%.
0,0080 x 100 = 0,80 % C 6 H 12 O 6 в молях
Задача №21: Сколько граммов глюкозы надо растворить в 3 литрах воды, чтобы получить 40% раствор?
Решение:
Растворите x г глюкозы в 3 литрах воды, чтобы получить 40% раствор.вес глюкозы = х
вес воды = 3 литра = 3000 г (примите плотность воды равной 1,00 г/мл)
, значит, общий вес раствора = x + 3000 г.процент глюкозы —> х / (х + 3000) = 0,40 х = 0,4 (х + 3000)
х = 0,4 х + 1200
х — 0,4 х = 1200
0,6х = 1200
х = 2000 г
Проблема № 22: Уксус, продаваемый в продуктовых магазинах, описан как 5% (об./об.) уксусной кислоты. Какова молярность этого раствора (плотность 100% уксусной кислоты 1,05 г/мл)?
Решение:
1) 5% (об./об.) означает, что 5% объема приходится на уксусную кислоту. Таким образом, 1,00 л уксуса содержит 50 мл уксусной кислоты:
(0,05)(1000 мл) = 50 мл
2) Масса этой уксусной кислоты:
(1,05 г/мл) (50 мл) = 52,5 г
3) Для молярности используйте MV = масса / молярная масса
(x) (1,00 л) = 52,5 г / 60,0516 г/мольx = 0,874 M (до трех цифр)
Задача № 23: Путем титрования было определено, что молярность уксусной кислоты в уксусе составляет 0,870 М. Переведите это значение в % (об./об.). (Плотность уксусной кислоты 1,05 г/мл)
Переведите это значение в % (об./об.). (Плотность уксусной кислоты 1,05 г/мл)
Решение:
1) Предположим, что имеется 1,00 л раствора. Используйте MV = масса/молярная масса для определения массы присутствующей уксусной кислоты:
(0,870 моль/л) (1,00 л) = х / 60,0516 г/мольх = 52,245 г
2) Определите, какой это объем чистой уксусной кислоты:
52,245 г разделить на 1,05 г/мл = 49,757 мл
3) Определить %(об./об.):
(49,757 мл / 1000 мл) * 100 = 4,9757Округляя, это 4,98% (об./об.), обычно дается как 5% (об./об.).
Задача № 24: В водном растворе серной кислоты концентрация кислоты составляет 2,40 мольных процента, а плотность раствора составляет 1,079.г/мл. Рассчитайте (1) молярную концентрацию кислоты, (2) массовый процент кислоты и (3) молярность раствора.
Решение:
2,40 мольных процента кислоты означает 97,60 мольных процентов воды.Предположим, что имеется 100 моль раствора. Это означает, что 2,40 моля раствора составляют H 2 SO 4 , а 97,60 моль — вода.
(1) Для определения моляльности нам нужно знать кг воды —> 97,60 моль умножить на 18,015 г/моль = 1758,264 г = 1,758264 кг
моляльность —> 2,40 моль / 1,758264 кг = 1,365 м (от 1,36 м до трех сиг инжира)
(2) Для весовых процентов нам нужна масса H 2 SO 4 —> 2,40 моль умножить на 98,0768 г/моль = 235,38432 г
массовых процентов —> 235,38432 г / (235,38432 + 1758,264 г) = 0,118067 = 11,8% (три сиг фиги)
(3) Для молярности нам нужно знать объем раствора —> 1993,64832 г разделить на 1,079 г/мл = 1847,68 мл = 1,84768 л
Примечание: 1993,64832 г — общая масса раствора.
молярность —> 2,40 моль / 1,84768 л = 1,2989 М (от 1,30 М до трех сиг)
Кстати, мольные проценты — это мольные доли, записанные в процентах. Мольные доли в приведенной выше задаче равны 0,0240 и 0,9760.
Задача № 25: Рассчитайте моляльность, молярность и молярную долю FeCl 3 в 26,3% (вес/вес) растворе (плотность = 1,28 г/мл).
Решение:
Молярность:
Предположим, что имеется 100 г раствора.Присутствует 26,3 г FeCl 3 .
100 г разделить на 1,28 г/мл = 78,125 мл
Использование MV = масса / молярная масса
(х) (0,078125 л) = 26,3 г / 162,204 г/моль
x = 2,08 M (до трех знаков)
Моляльность
100 г − 26,3 г = моляльность 73,7 г —> (26,3 г / 162,204 г/моль) / 0,0737 кг = 2,20 м (до трех знаков инжира)
Мольная доля FeCl 3 :
моль FeCl 3 —> 26,3 г / 162,204 г/моль = 0,1621415 мольмолей воды —> 73,7 г / 18,015 г/моль = 4,0
моль
мольная доля —> [0,1621415 моль / (0,1621415 моль + 4,0
моль)] = 0,0381 (до трех знаков цифры)
Задача №26: Молярная доля Na 2 S в растворе равна 0,125. Рассчитайте массовое содержание (вес/вес) Na 2 S в этом растворе.
Рассчитайте массовое содержание (вес/вес) Na 2 S в этом растворе.
Решение:
Молярная доля Na 2 S составляет 0,125. Следовательно, мольная доля воды в растворе равна 0,875. МассаNa 2 S —> 0,125 моль умножить на 78,045 г/моль = 9,755625 г
масса воды —> 0,875 моль 18,015 г/моль = 15,763125 г % (мас./мас.) Na 2 S —> [9,755625 / (9,755625 + 15,763125) * 100] = 38,2% (до трех знаков фиг.)
Задача №27: В разбавленной азотной кислоте концентрация HNO 3 равна 6,00 М, а плотность этого раствора равна 1,19.г/мл. Используйте эту информацию для расчета массового процента и мольной доли HNO 3 в растворе.
Решение №1:
1) Предположим, имеется 1000 мл раствора. Некоторые предварительные расчеты:
1000 мл x 1,19 г/мл = 1190 г (это масса наших 1000 мл)6,00 моль/л x 1,00 л = 6,00 моль (это количество молей HNO 3 в наших 1000 мл)
6,00 моль x 63,012 г/моль = 378,072 г (масса HNO 3 в нашем 1000 мл)
1190 г минус 378,072 г = 811,928 г (масса воды в 1000 мл раствора)
2) Рассчитайте массовый процент HNO 3 :
378,072 г / 1190 г = 31,8% (до трех знаков инжира)
3) Рассчитайте мольную долю HNO 3 :
811,928 г / 18,015 г/моль = 45,07 моль H 2 O6,00 моль / (6,00 моль + 45,07 моль) = 0,118 (до трех цифр)
Решение №2:
1) Предположим, что имеется 1000 г раствора. Некоторые предварительные расчеты:
Некоторые предварительные расчеты:
1000 г / 1,19 г/мл = 840,336 мл (объем наших 1000 г раствора)6,00 моль/л x 0,840336 л = 5,042 моль (это количество молей HNO 3 в наших 840,336 мл)
5,042 моль x 63,012 г/моль = 317,7065 г (масса HNO 3 в нашем 840,336 мл)
1000 г минус 317,7065 г = 682,2935 г (масса воды в 1000 г раствора)
2) Рассчитайте массовый процент HNO 3 :
317,7065 г / 1000 г = 31,8% (до трех знаков инжира)
3) Рассчитайте мольную долю HNO 3 :
682,2935 г / 18,015 г/моль = 37,874 моль H 2 O5,042 моль / (5,042 моль + 37,874 моль) = 0,117 (до трех цифр)
Комментарий: В решении № 2 я получил 0,117485, что технически равно 0,117 (а не 0,118) при округлении до трех цифр.
Задача № 28: 0,100 М раствор NaOH будет приготовлен путем разбавления 50,0% (по массе) раствора NaOH.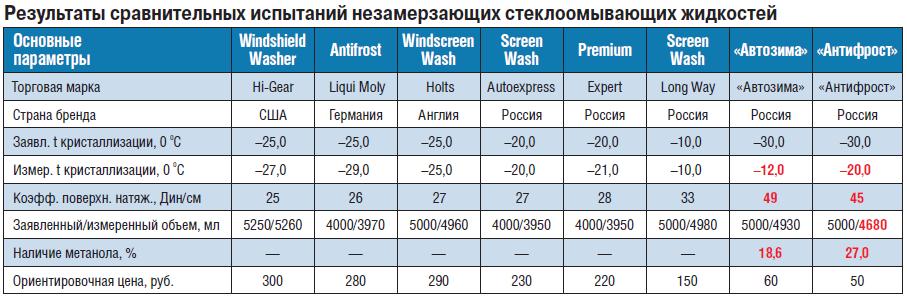 Этот раствор имеет плотность 1,53 г/мл. Вычислите объем этого раствора, необходимый для приготовления 1,00 x 10 3 мл 0,100 М NaOH.
Этот раствор имеет плотность 1,53 г/мл. Вычислите объем этого раствора, необходимый для приготовления 1,00 x 10 3 мл 0,100 М NaOH.
Решение:
1) Определите количество молей NaOH в 1,0 x 10 3 мл 0,10 М раствора:
МВ = моли(0,100 моль/л) (1,00 л) = 0,100 моль
2) Определить массу 0,100 моль NaOH
моль x молярная масса = грамм(0,100 моль) (40,00 г/моль) = 4,00 г
3) Масса 50,0% (вес/вес) раствора, содержащего 4,00 г NaOH:
использовать соотношение и пропорцию50 г соответствует 100 г, как 4 г соответствует x
х = 8,00 мл
4) Определите объем раствора, содержащего 8,00 г NaOH:
Люк, ууууууууууууууууууууууууууууууууузу сиву!8,00 г / 1,53 г/мл = 5,23 мл
Задача № 29: Какова молярность раствора NaOH плотностью 1,33 г/мл, приготовленного из 70,0 мл воды, если моляльность равна 10,7 моляль?
Решение:
1) Используйте моляльность, чтобы определить, сколько NaOH было использовано с 70,0 г воды:
10,7 моль = 10,7 моль растворенного вещества на кг растворителя10,7 моль/кг = х/0,0700 кг
х = 0,749 моль NaOH
2) Определить граммы NaOH:
(0,749 моль) (40,0 г/моль) = 29,96 г3) Общая масса раствора:
70,0 г + 30,0 г = 100,0 г4) Объем раствора:
100,0 г / 1,33 г/мл = 75,2 мл5) Молярность:
0,749 моль/0,0752 л = 9,96 МЗадача №30a: Сколько мл 3,78%-ного (вес/вес) раствора можно приготовить из 18,00 г сахарозы?
Решение:
3,78 соответствует 18, как 100 соответствует хx = 476,19 г 476,19 — 18,00 = 458,19 г.


 /масс. = (272 г / 853 г) x 100 = 31,9%
/масс. = (272 г / 853 г) x 100 = 31,9%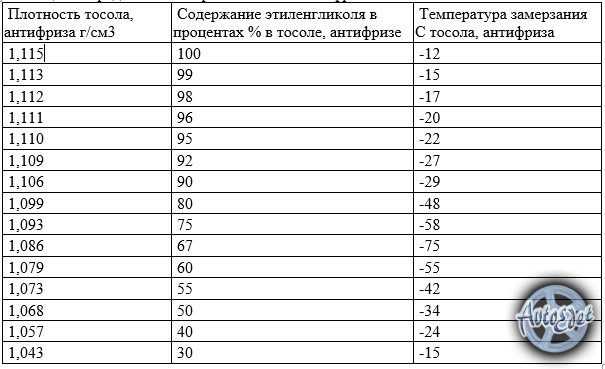 ) Чтобы получить массу раствора, сделайте следующее:
) Чтобы получить массу раствора, сделайте следующее: