Что нужно доливать в аккумулятор – воду или электролит
От качества и состояния аккумуляторной батареи автомобиля напрямую зависит процедура запуска двигателя при низких температурах воздуха. Ключевым материалом в конструкции кальциевых АКБ является электролит. Жидкость представляет собой водный раствор серной кислоты, который обеспечивает нормальную работу устройства при определённой плотности. В ходе эксплуатации автомобиля уровень электролита может опускаться, поэтому его требуется восстановить. Я проконсультировался с аккумуляторщиком и выяснил, как выполнить эту процедуру правильно.
Возможность восполнения уровня электролита предусмотрена на обслуживаемых аккумуляторах. В верхней части конструкции находятся пробки, которые откручиваются при помощи специального инструмента или обычной монетки. Отверстия позволяют получить доступ к жидкости и оценить её уровень.
Кальциевые автомобильные аккумуляторы предусматривают естественный расход воды при работе.
При нормальной работе аккумулятора водителям следует доливать дистиллированную воду. Для начала рекомендуется восполнить уровень электролита до минимальной отметки, а затем зарядить батарею при помощи специализированного устройства. На следующем этапе оценивается плотность жидкости в «банках» АКБ. Нормальный показатель составляет 1,27±0,01 г/см3. При превышении допустимой плотности следует долить ещё дистиллированной воды и достичь оптимальных значений.
Из-за особенностей работы кальциевых автомобильных аккумуляторов уровень электролита в крайних «банках» может быть немного ниже. Подобное явление считается нормальным из-за повышенной нагрузки на эти части батареи.
В некоторых ситуациях автолюбителям всё-таки приходится заливать в аккумулятор готовый электролит. Подобная процедура актуальна, например, при устранении последствий перезаряда батареи. Явление провоцирует быстрое выкипание электролита, поэтому его уровень может упасть до критических значений буквально за несколько недель эксплуатации автомобиля. В таком случае нужно ориентироваться на плотность, иногда для восстановления АКБ достаточно долить воду, но зачастую приходится использовать готовый состав. Перед установкой обслуженного аккумулятора важно устранить причину его перезаряда.
Подобная процедура актуальна, например, при устранении последствий перезаряда батареи. Явление провоцирует быстрое выкипание электролита, поэтому его уровень может упасть до критических значений буквально за несколько недель эксплуатации автомобиля. В таком случае нужно ориентироваться на плотность, иногда для восстановления АКБ достаточно долить воду, но зачастую приходится использовать готовый состав. Перед установкой обслуженного аккумулятора важно устранить причину его перезаряда.
Восполнять уровень электролита водным раствором серной кислоты придётся после механических повреждений батареи. В случае, когда жидкость была утрачена из-за дефекта или опрокидывания аккумулятора, заливать в «банки» нужно готовый состав. Регламент производителей АКБ вовсе предусматривает замену устройства при возникновении дефектов, но на практике многие автолюбители успешно их восстанавливают.
В рамках подготовки аккумулятора к зиме водителям рекомендуется проверить уровень электролита и, при необходимости, добавить дистиллированную воду. Не лишним будет принудительно зарядить батарею и проверить плотность жидкости ареометром. Качественное обслуживание АКБ перед зимой – основа для успешных запусков двигателя при низких температурах.
Не лишним будет принудительно зарядить батарею и проверить плотность жидкости ареометром. Качественное обслуживание АКБ перед зимой – основа для успешных запусков двигателя при низких температурах.
Теги: авто Советы Тюнинг ремонт автомобиль Россия автосалон машины вода авто и мото водителю на заметку автосамоделки АКБ аккумулятор автолюбитель
В аккумуляторе выкипел электролит
Причина?
Перезаряд.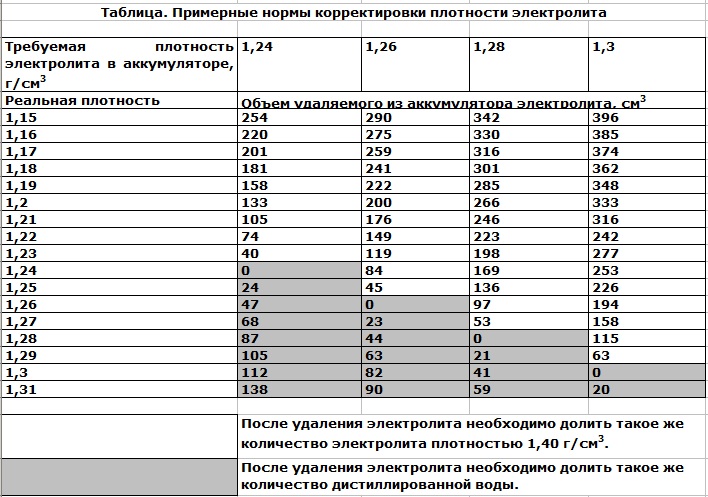 Скорее всего, это связано с неисправностью регулирующего реле у генератора, вследствие чего на аккумулятор подавался слишком большой ток. Чаще всего, аккумулятор выкипает до дна летом. Помимо всего прочего это связано еще и с температурной средой, в которой находится аккумулятор в это время года.
Скорее всего, это связано с неисправностью регулирующего реле у генератора, вследствие чего на аккумулятор подавался слишком большой ток. Чаще всего, аккумулятор выкипает до дна летом. Помимо всего прочего это связано еще и с температурной средой, в которой находится аккумулятор в это время года.
Проблема ремонта заключается в том, что выкипает не электролит, а вода, которая входит в его состав. А как мы все хорошо знаем, электролит в аккумулятор доливать нельзя. Однако в данном случае долить в аккумулятор воды и расслабиться не получится. Еще одна проблема, в связи с которой нельзя доливать электролит, это сам принцип действия аккумулятора.
Во время разряда активная масса пластин аккумулятора вбирает в себя кислоту из электролита, понижая тем самым его плотность, во время заряда происходит обратный процесс. Все это похоже на дыхание. Если долить электролит, который уже обладает плотностью, то выдыхать пластинам будет некуда.
Так уж получается, что при обозначенной проблеме, у нас аккумулятор полностью заряжен и кислоты в пластинах нет, нет ее и в электролите, которого в свою очередь тоже нет. Замкнутый круг.
Замкнутый круг.
На первый взгляд может показаться, что при данных условиях можно налить в аккумулятор электролит. Это не далеко от истины. Примерно так делают на заводе, но разница в том, что на заводе пластины высушивают специальным методом, а мы вследствие целостной конструкции не можем этого сделать.
Решение есть. Оно проверено, но скажу сразу. Есть риск потерять аккумулятор и времени этот процесс занимает от трех до пяти дней. Зависит от конкретного случая и степени выкипания, точнее того, как быстро вы заметили, что аккумулятор «высох».
Поскольку аккумулятор заряжен, то начнем мы с того, что полностью его разрядим. Для этого сначала надо налить во все банки аккумулятора дистиллированной воды. После того, как вода налита, подсоедините к аккумулятору какой либо потребитель, желательно не сильно мощный. Я обычно использовал 100 ватную лампочку.
Когда аккумулятор разрядится и лампа погаснет, можно поставить его на первый цикл зарядки. Да! С водой, которую налили ранее. Ставим мы его на малый ток, т.е. если рекомендуемый ток заряда 10% от емкости, мы ставим на 5%. Я обычно ставлю на 2 ампера. Автоматическое зарядное устройство может не подойти для этих процедур, т.к. оно будет отключаться, а нам это совершенно не надо.
Ставим мы его на малый ток, т.е. если рекомендуемый ток заряда 10% от емкости, мы ставим на 5%. Я обычно ставлю на 2 ампера. Автоматическое зарядное устройство может не подойти для этих процедур, т.к. оно будет отключаться, а нам это совершенно не надо.
В процессе зарядки аккумулятора с периодом в несколько часов проверяйте плотность – она будет расти и, в конце концов, остановится в пределах 1.15 – 1.20 тут главное дождаться пока рост не прекратиться, если кипение будет слишком бурным убавьте ток. Плотность может быть и меньше, что в общем-то хорошо. Кроме этого обращайте внимание на чистоту раствора, если он начнет сильно темнеть, то дальше можете не мучится.
Единственный раз я возился с выпадающим аккумулятором, тоже высушенным… недели не соврать полторы, но то был друг, и денег на новый аккумулятор у него не было. В последствии эта батарейка отработала 2 года и была продана вместе с машиной. К тому времени ее возраст составлял семь лет, т. е. инфаркт произошел в пять.
е. инфаркт произошел в пять.
Продолжим. Итак, плотность достигла своего возможного максимума. Теперь необходимо отобрать весь электролит из аккумулятора и снова залить его дистиллированной водой. После чего подключить к нему потребитель для второго полного разряда.
Вот к этому времени пройдет уже два дня, это при условии, что заряжаться и разряжаться аккумулятор будет практически круглосуточно.
Когда разряд достигнут – ставьте на зарядку и опять на малый ток. Следите за кипением, сейчас главное не перегнуть палку. Были случаи, что я и до 0.5 ампера доходил. Пузырьки должны быть слабенькие, как в бокале шампанского.
В самом идеальном случае плотность останется нулевой, по ареометру. С точки зрения контроля по времени. После закипания часа четыре будет достаточно, чтобы понять. Если плотность не начнет расти, то уже и не будет. Процесс, так или иначе, займет часов восемь.
Если плотность не растет, аккумулятор заряжен. Отключаем его от зарядного устройства.
Ареометром забираем из всех банок электролит, как можно лучше, после этого аккуратно и нежно переворачиваем аккумулятор вверх ногами и оставляем стекать. Около двадцати минут.
Да! Прием запрещенный. А что делать? По правилам нам следовало вообще новый аккумулятор купить, ибо выкипание электролита не допустимо! Можно пальцы скрестить.
После этой болезненной процедуры, нежно ставим АКБ как положено и заливаем новый электролит (именно электролит, тот самый который нельзя). После этого разряжаем аккумулятор снова.
Дальше все просто. Когда разряд достигнут, ставим на маленький ток заряжаться, начните с одного ампера. К моменту закипания смотрим электролит, если он наполнен рабочей массой и черного цвета, то три дня наших усилий псу под хвост. Если чего-то плавает, но в целом не плохо, то бог с ним. Заряжаем. Постепенно ток можно поднять до 5% от емкости.
В идеальном случае плотность во всех банках будет ровной 1. 25 или 1.27 не так уж важно. Просто надо будет дозарядить до номинала. Но может быть и другая ситуация, когда плотность будет не ровной. В этом случае, необходимо будет совершить несколько циклов заряд – разряд, но разряжать уже не полностью, а до 10.5 вольт.
25 или 1.27 не так уж важно. Просто надо будет дозарядить до номинала. Но может быть и другая ситуация, когда плотность будет не ровной. В этом случае, необходимо будет совершить несколько циклов заряд – разряд, но разряжать уже не полностью, а до 10.5 вольт.
Все должно получиться, даже не смотря на сложность случая. Как ни странно, но рассмотренный нами вариант сложнее случая, с замерзанием аккумулятора.
Что такое электролит в батарее? (Принцип работы и типы аккумуляторов)
От высокотехнологичного электромобиля до дешевой игрушечной машинки с дистанционным управлением питание аккумуляторов стало неотъемлемой частью нашей повседневной жизни. На протяжении многих лет мир использовал дорогие источники энергии для выполнения повседневных задач.
Однако, после достаточного количества разработок, батареи оказались эффективным изобретением в качестве источника и хранения электроэнергии. Внутренний электролит в аккумуляторе является одним из основных компонентов, которые делают все волшебство.
В сегодняшнем посте мы обсудим, что такое электролит в аккумуляторе и как его сделать в домашних условиях.
Содержание
- Что такое электролит в батарее?
- Как электролиты работают в батарее?
- Из чего состоит электролит батареи?
- Общие типы батарей с их электролитами
- Как сделать раствор электролита для батареи?
- Резюме
Что такое электролит в батарее?
Электролит в батарее представляет собой вещество, которое дает ионы (электрически заряженные атомы, которые приобрели или потеряли электроны) при растворении в воде или жидкостях. Благодаря движению положительных и отрицательных ионов раствор проводит электрический ток, который течет между двумя электродами — анодом и катодом.
Электролит батареи может быть жидким или твердым, в зависимости от типа батареи. Однако потенциальными электролитами могут быть любые среды, содержащие ионы.
Электролиты можно разделить на сильные и слабые химические соединения. Сильные электролиты — это те, которые почти или полностью ионизируются в растворе, а слабые — частично.
Сильные электролиты — это те, которые почти или полностью ионизируются в растворе, а слабые — частично.
Как электролиты работают в батарее?
Чтобы понять, как работает электролит батареи, нам сначала нужно изучить основные компоненты батареи — анод, катод и электролит (который разделяет две клеммы). Поскольку мы уже обсуждали электролит выше, давайте рассмотрим анод и катод.
Анод – это отрицательная клемма или восстановительный электрод, который окисляет и высвобождает электроны во внешнюю цепь во время электрохимической реакции.
С другой стороны, катод – это положительный вывод или окислительный электрод. Он восстанавливается в ходе электрохимической реакции, приобретая электроны, выделяемые анодом во внешнюю цепь.
Электролит обеспечивает среду для перемещения электрического заряда в виде ионов между двумя клеммами. Катионы с положительным зарядом движутся к катоду, а анионы с отрицательным зарядом — к аноду. Кроме того, электролит приводит подходящее химическое вещество, необходимое для реакции, в контакт с клеммами, что преобразует накопленную энергию в пригодную для использования электрическую энергию.
Полезная электрическая энергия встречается с подключенным устройством, будь то лампочка или пылесос, и питает его.
Из чего состоит электролит батареи?
Электролит батареи состоит из растворимых солей, кислот или оснований. Однако точный характер электролита зависит от типа батареи и требуемой величины тока.
Например, в обычных щелочных бытовых батареях используется гидроксид калия, который является сильным электролитом и поэтому обладает высокой электропроводностью. С другой стороны, свинцово-кислотный аккумулятор в автомобилях использует серную кислоту в качестве электролита и вызывает требуемую реакцию.
Давайте рассмотрим некоторые типы аккумуляторов с подходящими для них электролитами.
Распространенные типы аккумуляторов с их электролитами
1. Свинцово-кислотные
Свинцово-кислотные аккумуляторы — это перезаряжаемые аккумуляторы, в которых для химических реакций используется кислый электролит (серная кислота) и металлический свинец (Pb). Серная кислота — очень коррозионное вещество, растворимое в воде. Он бесцветный, с легким желто-зеленым оттенком. Однако он обесцвечивается до коричневатого оттенка из-за ржавчины в результате анодной коррозии, возникающей при растворении анода в электролите.
Серная кислота — очень коррозионное вещество, растворимое в воде. Он бесцветный, с легким желто-зеленым оттенком. Однако он обесцвечивается до коричневатого оттенка из-за ржавчины в результате анодной коррозии, возникающей при растворении анода в электролите.
Для контролируемой химической реакции металлический свинец погружается в серную кислоту, в результате чего батарея вырабатывает электричество. Этот химический процесс извлечения тока из свинцово-кислотного аккумулятора известен как разрядка.
Кроме того, когда аккумулятору необходимо перезарядиться, реагенты (ранее использовавшиеся для выработки электроэнергии) можно регенерировать, пропуская ток через аккумулятор извне. Этот процесс известен как перезарядка.
Свинцово-кислотная батарея имеет большой вес, но вырабатывает высокое напряжение. Он оснащен ячейками 2 В, что означает, что он имеет четное количество вольт. Наиболее распространенные свинцово-кислотные батареи имеют напряжение 2 В, 6 В, 12 В и 24 В.
Поэтому он обычно используется в машинах, ИБП (источниках бесперебойного питания) и системах, которые требуют высокой мощности для работы и не имеют значения веса батареи.
2. Никель-кадмиевые (NiCd)
Электролит, используемый в никель-кадмиевых (NiCd) батареях, представляет собой тридцатипроцентный раствор гидроксида калия (КОН) в дистиллированной воде. При комнатной температуре его удельный вес остается между 1,240 и 1,300.
По сравнению со свинцово-кислотными батареями никель-кадмиевые батареи дороже, но имеют более высокую плотность энергии, что означает, что они могут хранить больше энергии на единицу веса. Он также служит дольше, чем свинцово-кислотные аккумуляторы, поскольку у него больше жизненных циклов, около 2000-2500.
3. Никель-металл-гидридный (NiMH)
Никель-металл-гидридный (NiMH) аккумулятор использует тот же электролит, что и NiCd, а именно гидроксид калия. Гидроксид калия, также известный как едкий калий, представляет собой неорганическое соединение и сильное основание, широко используемое в большинстве мягких и жидких мыл. Электролит бесцветен и имеет множество промышленных применений.
Электролит бесцветен и имеет множество промышленных применений.
Батарея содержит электроды, изготовленные из уникальных металлов, таких как никель, кобальт, марганец и алюминий, которые также присутствуют в литий-ионных батареях. Однако батарея NiMH более хрупкая, чем литий-ионная и никель-кадмиевая.
4. Литий-ионные (Li-ion)
В литий-ионных (Li-ion) батареях используются электролиты, состоящие из солей лития, таких как гексафторфосфат лития (LiPF6) в органическом растворителе. Литий-ионные аккумуляторы работают как с гелевым или сухим полимером, так и с жидким электролитом.
Элементы литий-ионных аккумуляторов легкие и обладают высокой плотностью энергии, что дает им преимущество перед любыми аккумуляторными элементами. Они способны генерировать мощность 3,6 В, что делает их полезными в широком диапазоне приложений, таких как транспортные средства, силовое оборудование и портативные устройства, такие как ноутбуки и сотовые телефоны.
Как сделать раствор электролита для батареи?
Когда в вашей жидкостной батарее заканчивается топливо (электролит), вы можете сделать его дома, а не покупать.
Хотя для приготовления раствора электролита требуются некоторые школьные знания химии, вы все равно можете сделать его, следуя этому руководству. Однако действовать нужно осторожно, так как процесс приготовления электролита опасен.
Прежде чем начать, решите, какой химический раствор вы хотите использовать для приготовления электролита. Обычно для аккумуляторов больше всего подходят сильные кислоты, растворенные в чистой смеси воды. Вода помогает стабилизировать активность ионов водорода. Вы можете использовать серную кислоту, если у вас есть свинцовые электроды, и азотную кислоту для никелевых электродов.
Примечание. Без состава чистой воды небольшой ток может взорвать аккумулятор.
Инструменты, которые вам понадобятся
Помимо вышеперечисленных химикатов, для эффективного выполнения процесса вам потребуется следующее оборудование.
- Не менее трех толстых изолирующих контейнеров
- Кислотостойкие перчатки
- Очки
- Захват
- Мультиметр
- Ареометр
- Чертежные трубы (желательно прозрачные)
- Аптечка с пищевой содой для лечения кислотных ожогов
Шаги
Все собралось? Если да, то следуйте следующим шагам!
- Возьмите изолированный контейнер и наполните его водой.
 Обязательно измерьте объем, прежде чем наливать его. Вы также можете оставить немного воды в другом контейнере, если вам нужно разбавить раствор. В любом случае используйте чистую воду, чтобы исключить риск загрязнения, которое может вызвать нежелательные химические реакции.
Обязательно измерьте объем, прежде чем наливать его. Вы также можете оставить немного воды в другом контейнере, если вам нужно разбавить раствор. В любом случае используйте чистую воду, чтобы исключить риск загрязнения, которое может вызвать нежелательные химические реакции. - Затем осторожно возьмите контейнер с кислотой с помощью захвата и вылейте его в воду. Если на поверхности появляются чрезмерные пузырьки, приостановите процесс на несколько секунд и дайте им рассеяться. Вы можете вылить остальную кислоту, как только исчезнут пузырьки.
- В этот момент раствор электролита должен иметь высокую температуру. Таким образом, вы можете накрыть его, чтобы позволить любым загрязнениям иметь место. Однако убедитесь, что горячий воздух выходит.
- Когда раствор в контейнере остынет, используйте ареометр, чтобы проверить его крепость и добавить жидкости по мере необходимости.
- Как только вы наберете необходимую силу, аккуратно залейте кислотный раствор в гнезда батареи.
 Для этого вы можете использовать волочильные трубы, один конец которых находится на дне контейнера, а другой — в батарейном отсеке.
Для этого вы можете использовать волочильные трубы, один конец которых находится на дне контейнера, а другой — в батарейном отсеке. - Надев кислотостойкие перчатки, наклоняйте контейнер под постепенно увеличивающимся углом, чтобы раствор кислоты попал в гнездо для батареи. Заполните каждый аккумуляторный отсек примерно на три четверти.
- Когда слоты заполнены, снимите трубу и закройте слоты. Вот и все! Ваша батарея готова генерировать энергию.
Наконец, используйте мультиметр, чтобы проверить, какое напряжение выдает ваша батарея на клеммах. Будем надеяться, что батарея в порядке!
Резюме
Электролит в батарее представляет собой раствор, который позволяет заряженным ионам и току проходить через катодные и анодные клеммы. Электролит имеет определенные химические характеристики, которые реагируют с электродами, и реакция преобразует накопленную энергию в пригодную для использования электрическую энергию.
Электролит имеет определенные химические характеристики, которые реагируют с электродами, и реакция преобразует накопленную энергию в пригодную для использования электрическую энергию.
Электролиты обычно состоят из растворов сильных кислот, таких как серная и азотная кислота, но обычно электролит может состоять из растворимых солей, кислот и оснований.
Мы надеемся, что этот пост был вам полезен. Если вы сегодня узнали что-то новое, не забудьте поделиться этим с друзьями!
Разработка улучшенных аккумуляторных электролитов | Аргоннская национальная лаборатория
Процесс проектирования батареи состоит из трех частей. Вам нужен положительный электрод, вам нужен отрицательный электрод и, что важно, вам нужен электролит, который работает с обоими электродами.
Электролит — это компонент батареи, который переносит ионы — частицы, несущие заряд, — туда и обратно между двумя электродами батареи, заставляя батарею заряжаться и разряжаться. Для современных литий-ионных аккумуляторов химический состав электролита относительно хорошо определен.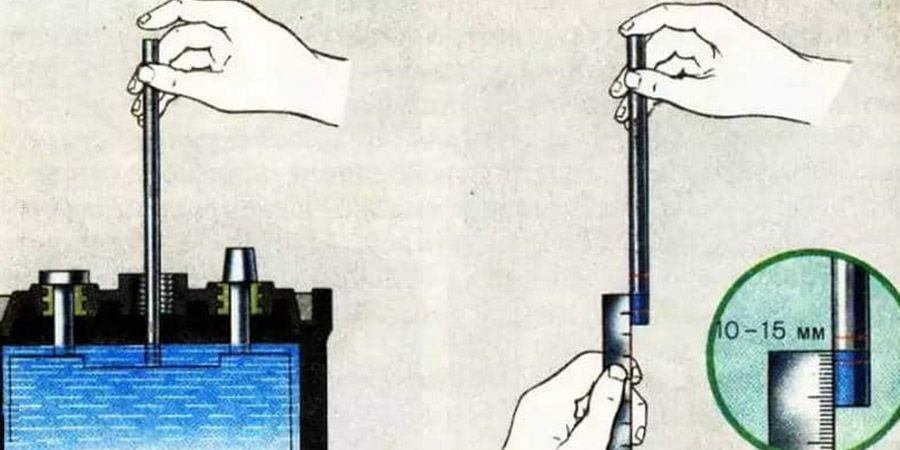
«Хотя мы привязаны к определенной концепции электролитов, которые будут работать с современными коммерческими батареями, для литий-ионных батарей решающее значение будет иметь дизайн и разработка различных электролитов», — сказала Ширли Менг, главный научный сотрудник Argonne Collaborative. Центр науки о хранении энергии (ACCESS) и профессор молекулярной инженерии в Притцкеровской школе молекулярной инженерии Чикагского университета. «Разработка электролитов является одним из ключей к прогрессу, которого мы добьемся, сделав эти более дешевые, долговечные и более мощные батареи реальностью, и сделав один важный шаг к продолжению обезуглероживания нашей экономики».
В новой статье, опубликованной в журнале Science, Мэн и его коллеги изложили свое видение конструкции электролита в батареях будущих поколений.
По словам Мэн, даже относительно небольшие отклонения от современных аккумуляторов потребуют переосмысления конструкции электролита. По ее словам, переход от никельсодержащего оксида к материалу на основе серы в качестве основного компонента положительного электрода литий-ионной батареи может дать значительные преимущества в производительности и снизить затраты, если ученые смогут понять, как изменить электролит.
Для других химических элементов, помимо литий-ионных аккумуляторов, таких как перезаряжаемые натрий-ионные или литий-кислородные, ученым также придется уделить значительное внимание вопросу электролита.
Одним из основных факторов, который учитывают ученые при разработке новых электролитов, является то, как они склонны образовывать промежуточный слой, называемый межфазным, который использует реактивность электродов. «Интерфазы имеют решающее значение для функционирования батареи, потому что они контролируют то, как селективные ионы поступают в электроды и выходят из них», — сказал Мэн.
Ближайшая цель, по словам команды, состоит в том, чтобы разработать электролиты с правильными химическими и электрохимическими свойствами, чтобы обеспечить оптимальное образование межфазных фаз как на положительном, так и на отрицательном электродах батареи. В конечном счете, однако, исследователи полагают, что они смогут разработать группу твердых электролитов, которые будут стабильны при экстремальных (как высоких, так и низких) температурах и позволят батареям с высокой энергией иметь гораздо более длительный срок службы.
«Твердотельный электролит для полностью твердотельной батареи изменит правила игры», — сказал Венкат Шринивасан, директор ACCESS, заместитель директора Объединенного центра исследований в области хранения энергии и соавтор статьи. «Ключом к твердотельной батарее является металлический анод, но его производительность в настоящее время ограничена образованием игольчатых структур, называемых дендритами, которые могут закорачивать батарею.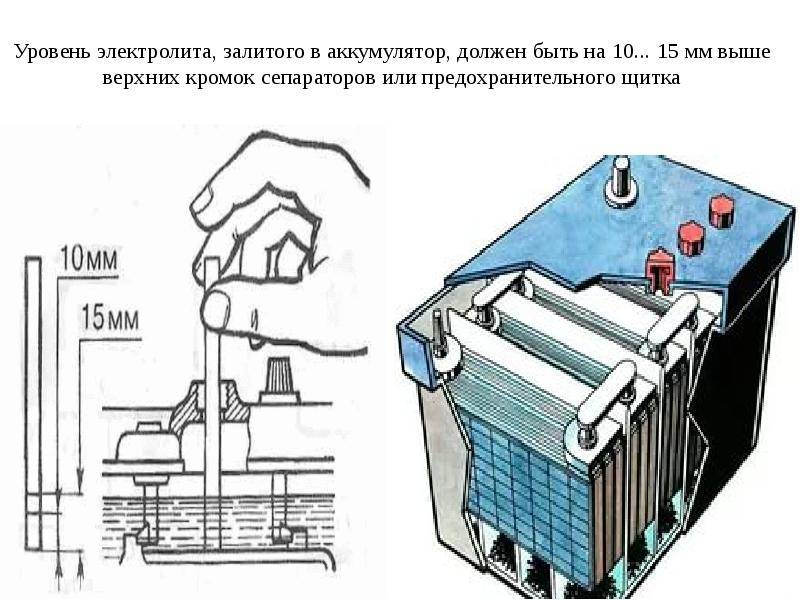 Найдя твердый электролит, который предотвращает или ингибирует образование дендритов, мы можем реализовать преимущества некоторых действительно захватывающих химических процессов в батареях».
Найдя твердый электролит, который предотвращает или ингибирует образование дендритов, мы можем реализовать преимущества некоторых действительно захватывающих химических процессов в батареях».
Чтобы ускорить охоту за прорывами в области электролитов, ученые обратились к возможностям расширенной характеристики и искусственного интеллекта (ИИ) для поиска в цифровом виде множества возможных кандидатов, ускорив медленный и кропотливый процесс лабораторного синтеза. «Высокопроизводительные вычисления и искусственный интеллект позволяют нам определять лучшие дескрипторы и характеристики, которые позволят разрабатывать различные электролиты для конкретных целей», — сказал Мэн. «Вместо того, чтобы рассматривать несколько десятков электролитов в год в лаборатории, мы рассматриваем многие тысячи с помощью вычислений».
«У электролитов есть миллиарды возможных комбинаций компонентов — солей, растворителей и добавок — с которыми мы можем играть», — сказал Шринивасан. «Чтобы превратить это число во что-то более управляемое, мы начинаем действительно использовать мощь ИИ, машинного обучения и автоматизированных лабораторий».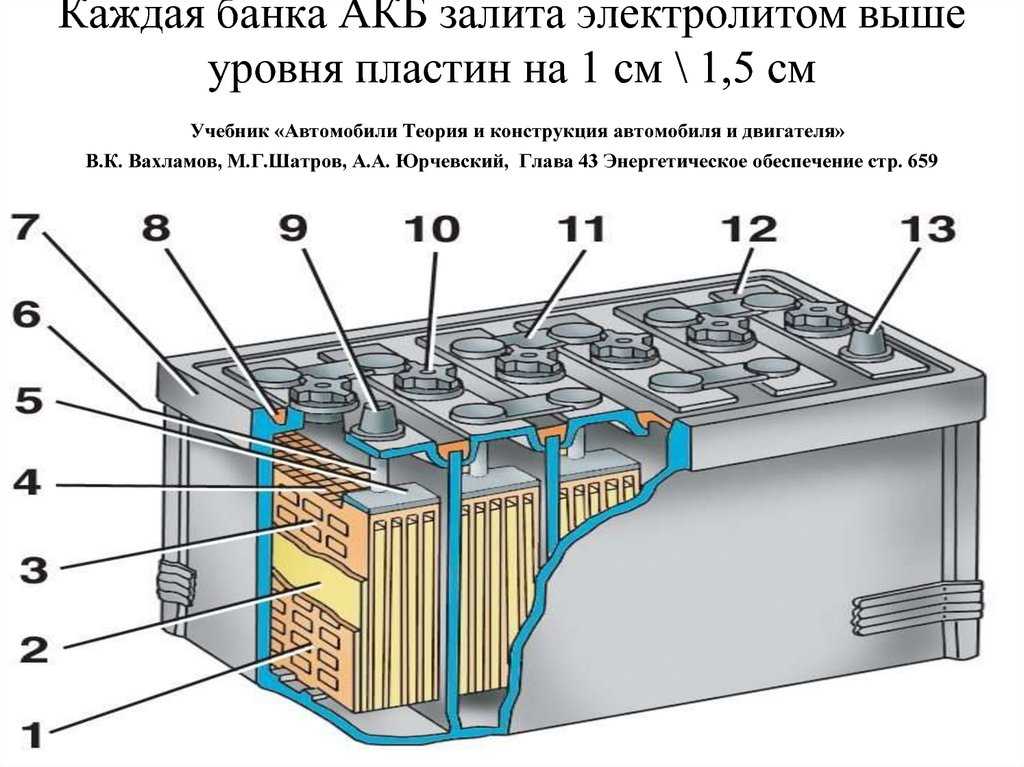
Автоматизированные лаборатории, о которых говорил Шринивасан, будут включать экспериментальный режим, управляемый роботами. Таким образом, машины могут проводить без посторонней помощи все более тщательно точные и калиброванные эксперименты, чтобы в конечном итоге определить, какая комбинация компонентов образует идеальный электролит. «Автоматизированное обнаружение может значительно повысить эффективность наших исследований, поскольку машины могут работать круглосуточно и снижать вероятность человеческой ошибки», — сказал он.
Мэн, Шринивасан и научный сотрудник армейской исследовательской лаборатории Кан Сюй обсуждают проблему электролитов в статье под названием «Разработка лучших электролитов», опубликованной в журнале Science 8 декабря.
Работа финансировалась Объединенным центром исследований в области хранения энергии. , Центр инноваций в области науки и энергетики Министерства энергетики, а также программа Управления науки Министерства энергетики по фундаментальным наукам об энергетике.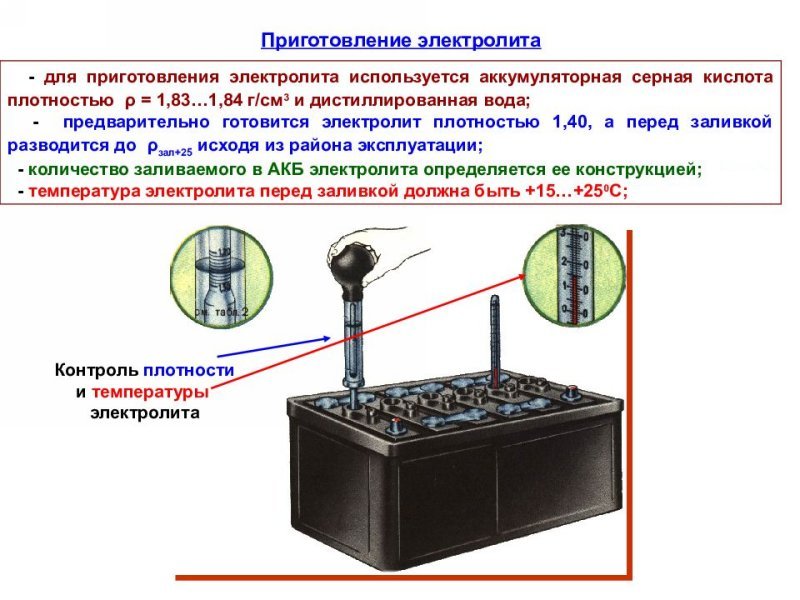
Объединенный центр исследований в области хранения энергии (JCESR) , Центр инноваций в области энергетики Министерства энергетики США, представляет собой крупное партнерство, объединяющее исследователей из многих дисциплин для преодоления критических научных и технических барьеров и создания новой революционной технологии хранения энергии. В число партнеров, возглавляемых Аргоннской национальной лабораторией Министерства энергетики США, входят национальные лидеры в области науки и техники из академических кругов, частного сектора и национальных лабораторий. Их совместный опыт охватывает весь спектр процессов разработки технологий, от фундаментальных исследований до разработки прототипов, разработки продукта и доставки его на рынок.
Аргоннская национальная лаборатория занимается поиском решений насущных национальных проблем в области науки и техники.

 Обязательно измерьте объем, прежде чем наливать его. Вы также можете оставить немного воды в другом контейнере, если вам нужно разбавить раствор. В любом случае используйте чистую воду, чтобы исключить риск загрязнения, которое может вызвать нежелательные химические реакции.
Обязательно измерьте объем, прежде чем наливать его. Вы также можете оставить немного воды в другом контейнере, если вам нужно разбавить раствор. В любом случае используйте чистую воду, чтобы исключить риск загрязнения, которое может вызвать нежелательные химические реакции. Для этого вы можете использовать волочильные трубы, один конец которых находится на дне контейнера, а другой — в батарейном отсеке.
Для этого вы можете использовать волочильные трубы, один конец которых находится на дне контейнера, а другой — в батарейном отсеке.