Как поднять плотность электролита в аккумуляторе самостоятельно, причины падения плотности электролита
Почему падает плотность электролита в АКБ
Автомобильный аккумулятор состоит из корпуса, помещенных в него емкостей с электродами, заполненных электролитом, датчика уровня плотности этой жидкости и клемм. Подключение простое – к выходам на электрическую цепь транспортного средства. При снижении заряда прибора автомобиль завести невозможно. При полной зарядке возникновение подобной проблемы свидетельствует о снижении плотности электролита и неспособности АКБ выдавать ток нужных параметров. Диагностировать это можно с помощью соответствующего щупа в обслуживаемых АКБ или специального индикатора, вмонтированного в одну из банок.
Почему плотность электролита падает
Нормальная работа батареи подразумевает постоянную подзарядку и высокотемпературный режим химических процессов на электродах и в электролите. Результатом становится постоянное снижение жидкости в банках АКБ, которая пополняется дистиллированной водой. Среди наиболее распространенных причин снижающих в аккумуляторе плотность раствора:
Среди наиболее распространенных причин снижающих в аккумуляторе плотность раствора:
- Не контролируется уровень концентрации раствора в емкостях с электродами после каждого пополнения дистиллятом. С каждым новым разбавлением концентрата снижается доля электролита за счет испарения воды и небольшого количества электролитической жидкости;
- Неоднократная зарядка аккумулятора приводит к закипанию раствора и его испарению, что снижает его количество и повышает концентрацию. В этом случае активных молекул для ионизации свинца и его солей становится меньше, соответственно снижается густота жидкости;
- Батарея разрядилась.
ВАЖНО: Длительная работа АКБ в режиме сниженной плотности электролита – это дорога к сульфатации пластин и выходе устройства из строя.
Для установления причины низкого заряда батареи производят замеры концентрации раствора в банках АКБ используя ареометр. Оптимальный температурный режим для этой процедуры – от 22 до 25 °С.
Подготовка перед поднятием плотности электролита
Для измерения концентрации электролита в аккумуляторной батарее необходимо, чтобы соблюдались условия:
- На АКБ отсутствуют сколы или трещины, корпус абсолютно целый и клеммы без повреждений;
- Нормальный уровень жидкости в каждой из банок;
- Температурный режим электролитического раствора в диапазоне от 20 до 25°С;
- Заряд батареи полный.
При наличии повреждений клемм или корпуса данные могут быть неточными, а причина отсутствия способности выдать нужный разряд для старта ТС совсем не в низкой плотности электролита.
ВАЖНО: Добавление серного концентрата для коррекции плотности электролита должно производиться очень аккуратно, поскольку более высокие показатели способствуют осыпанию пластин и порче АКБ.
Зарядка от генератора автомобиля аккумулятора выполняется не в полном объеме, а всего на 80-90%, что требует подзарядки прибора для измерения концентрации раствора.
В подготовительные работы по поднятию плотности электролита входит:
- Изъятие АКБ из ТС;
- Хранение в теплом помещении до приобретения АКБ температуры 20-25 °С;
- Проверка уровня насыщенности раствора;
- Зарядка и зачистка клемм по необходимости до пополнения жидкости в банках.

Для определения нормы существуют специальные таблицы, согласно которым эксплуатационный показатель для теплого периода должен быть не ниже 1,27 г/куб. см, а для зимнего – 1,3 г/куб. см.
Поднимаем плотность электролита в АКБ
Для повышения концентрации активного раствора в банках аккумулятора необходимо приготовить:
- Средства для личной защиты при работе с едкими веществами: старая одежда, защитные очки, респиратор или защитная маска, перчатки резиновые;
- Мерный стакан;
- Емкость, в которую будет сливаться старый раствор;
- Аэрометр с резиновой грушей для откачки имеющейся в банках жидкости;
- Дрель со сверлом диаметром 3-4 мм;
- Паяльная лампа или паяльник;
- Кислотная пластмасса.
Электролит содержит в составе серную кислоту, способную разъесть кожу или одежду, поэтому следует позаботиться о личной защите и постараться все манипуляции делать предельно аккуратно. Повышение плотности раствора достигается несколькими способами:
Повышение плотности раствора достигается несколькими способами:
- Полной заменой электролита в банках при концентрации ниже 1 г/куб. см;
- Добавлением аккумуляторной кислоты в раствор;
- Заливанием дистиллята и серной кислоты до нужного уровня и показателя плотности.
Полная замена электролита
Это является крайней радикальной мерой в случае полной выработки своего ресурса электролитом при снижении его плотности до 1 г/куб. см. Действия осуществляются в следующем порядке:
- Аккумуляторная батарея после подготовки подвергается полной откачке раствора из банок с помощью груши;
- Перевернув АКБ набок необходимо в дне каждой емкости с электродами просверлить дырки и слить остаток жидкости;
- В таком положении нужно продержать прибор и промыть внутренние полости дистиллятом;
- Очищенную батарею снова делают герметичной, запаивая кислотной пластмассой, сделанные ранее отверстия дрелью.
 Для этого пользуются паяльной лампой или паяльником;
Для этого пользуются паяльной лампой или паяльником; - В каждую банку заливается нужное количество дистиллята, которое рассчитывается в соотношении от общего объема банки и нужного количества аккумуляторной кислоты для раствора с концентрацией 1,25-1,27 г/куб. см;
- Банки хорошо закупориваются, слегка встряхивается батарея без сильного отклонения от вертикали.
ВАЖНО:
Добавление аккумуляторной кислоты
При показателе плотности раствора ниже 1,2 г/куб. см необходимо применять кардинальные меры для повышения значения электролита. Следует приобрести аккумуляторную кислоту, плотность которой составляет 1,84 г/куб. см, и залить тем же способом, что и обычный электролит.
Добавление дистиллята и серной кислоты
Необходимо сначала откачать имеющийся раствор из каждой банки АКБ. Затем залить новую жидкость плотностью 1,25-1,27 г/куб.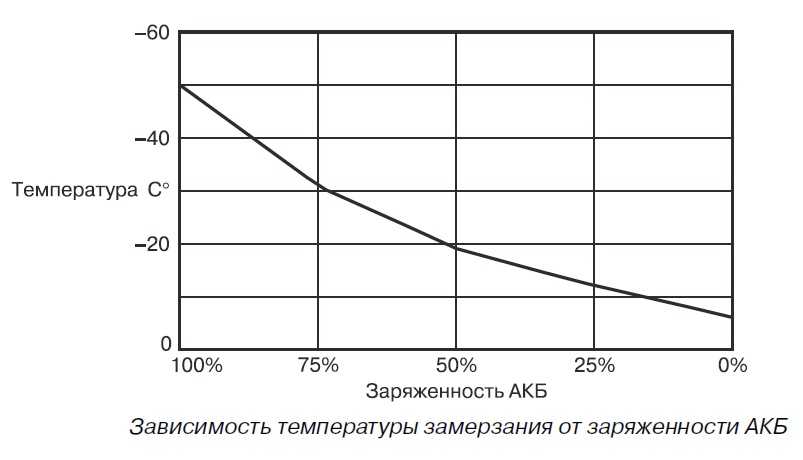 см. Заполнив банки до отметки «Норма», следует хорошо закрыть крышки и слегка встряхнуть батарею.
см. Заполнив банки до отметки «Норма», следует хорошо закрыть крышки и слегка встряхнуть батарею.
ВАЖНО: Запрещается переворачивать вверх дном АКБ. При такой манипуляции могут отколоться кусочки соли свинца с решетки и попасть на соседний электрод, замкнув таким образом банку. После этого поврежденная емкость станет непригодной для эксплуатации.
Замеры концентрации подскажут необходимость повторения процесса замены электролита. Если показатель ниже 1,25 г/куб. см, то следует повторять операцию до тех пор, пока не будет получен нужный результат.
Корректирующая подзарядка АКБ
После замены или манипуляций по повышению плотности электролита в банках батареи устанавливается раствор с отличным друг от друга показателем. Допускается разнос в диапазоне 0,01 г/куб. см. Чтобы выровнять это значение необходимо произвести корректирующую подзарядку. Суть метода заключается в подаче на протяжении 1-2 часов тока при зарядке в 2-3 раза ниже номинального значения.
При отсутствии положительного результата применяются более радикальные способы выравнивания. Применяется зарядка устройствами, оснащенными регуляторами, обеспечивающими стабильное напряжение на входе.
Инструкция восстановления плотности корректирующей подзарядкой:
- Заряжается батарея полностью;
- В момент достижения максимального заряда при наблюдении кипения электролита сила тока снижается до уровня 1-2 А;
- В процессе кипения происходит испарение дистиллята и повышается густота жидкости;
- Для каждого отдельного случая время выпаривания может быть разным и иногда достигать 1 сутки;
- При снижении плотности ниже 1,25 г/куб. см электролит доливается, концентрация замеряется при остывании прибора до 25 °С;
- Производится повторная операция при необходимости.
Единственный недостаток процедуры – большая длительность.
Корректирующий электролит
Под корректирующей смесью понимают электролит, плотность которого составляет 1,4 г/куб.
- Скорректировать уровень электролита при вытекании раствора;
- Поднять уровень плотности жидкости в банке при заливании большего количества, чем нужно, дистиллята.
Порядок использования корректирующего электролита:
- С помощью спринцовки или аэрометра откачать из полости банки жидкость;
- Заменить откачанный раствор аналогичным объемом корректирующего состава;
- Поставить заряжаться аккумулятор на срок от 30 минут до часа;
- По окончанию зарядки выдержать прибор в спокойном состоянии часа 2-3;
- Провести контрольный замер в каждой из банок;
- Повторить процедуру при необходимости.
ВАЖНО: Откачивая электролит необходимо оставлять поверхность пластин покрытыми жидкостью.
Заключение
В заключении хотим отметить, что работа с АКБ и электролитом не проста. Поэтому, если у вас мало опыта в сервисных работах по вашему авто, то лучше всего обратиться в сервис и доверить это дело профессионалам. В любом случае, следите за плотностью электролита для надежной работы АКБ хоть летом, хоть зимой.
Если материал был для вас интересен или полезен, опубликуйте его на своей странице в социальной сети:
Добавить комментарий
В начало страницы
В одной банке аккумулятора плотности нет
Прежде чем, заняться восстановлением, выясним как правильно поднять плотность аккумулятора и найти причины, которые привели к падению этого показателя. В любой автомобильной батарее, данная величина не статична.
Содержание
Принцип работы автомобильного аккумулятораОсновной функцией аккумулятора автомобиля, по сути, является накапливание и хранение электрической энергии, которая протекает с помощью химической реакции, путем взаимодействия электролита и свинцовых пластин. Именно благодаря этим процессам вы и получаете полноценный автономный источник питания. От состояния вашего АКБ зависит не только успешность запуска двигателя, но и работа других автономных систем автомобиля.
Именно благодаря этим процессам вы и получаете полноценный автономный источник питания. От состояния вашего АКБ зависит не только успешность запуска двигателя, но и работа других автономных систем автомобиля.
Каждая батарея имеет свой определенный ток для холодного пуска двигателя. Он бывает разным, поэтому аккумулятор подбирается для каждого двигателя индивидуально, например, для дизеля с объемом 2500 минимальный пусковой ток должен быть не меньше 600-650 ампер, но лучше все же использовать 750 А. А количество времени, на протяжении которого батарея под нагрузкой может крутить стартер – называется емкостью аккумулятора. Измеряется этот показатель в А/ч.
Но все же принцип работы и неисправности у всех батарей одинаковые. Принцип действия прост: в пластиковом корпусе запаяны свинцовые пластины, а пространство между ними заполнено раствором серной кислоты строго определенной плотности. Концентрация кислоты напрямую связана с плотностью, чем ее больше, тем плотность выше. Второй составной частью является дистиллированная вода (полностью очищенная от посторонних примесей).
Второй составной частью является дистиллированная вода (полностью очищенная от посторонних примесей).
Почему снижается плотность электролита
Прежде чем, заняться восстановлением, выясним как правильно поднять плотность аккумулятора и найти причины, которые привели к падению этого показателя. В любой автомобильной батарее, данная величина не статична. Она постоянно изменяется и это является нормальным. Когда АКБ разряжается, то, понижается и плотность электролита. Когда заряжен, то вверх идет и этот параметр. Если происходит быстрая разрядка, то это, свидетельствует о том, что концентрация упала до критичного уровня.
Можно перечислить несколько основных причин, из-за которых образуется низкая плотность электролита в аккумуляторе:
- длительное воздействие низких температур;
- выкипание электролита в следствии перезарядки батареи;
- постоянное доливание воды.
Что касается третьего пункта, то, очень часто, чтобы поддержать уровень жидкости, доливают дистиллированную воду аккумуляторную. Обязательным условием является регулярная проверка плотности. Одновременно с водой выкипает электролит, что, в итоге ведет уменьшению. Кроме подзарядного устройства, важно иметь еще и ареометр для проверки значения плотности.
Обязательным условием является регулярная проверка плотности. Одновременно с водой выкипает электролит, что, в итоге ведет уменьшению. Кроме подзарядного устройства, важно иметь еще и ареометр для проверки значения плотности.
В каких случаях процесс происходит в рамках нормы?
Чтобы разобраться, должен ли кипеть электролит в аккумуляторе, нужно ареометром измерить плотность этой жидкости. По полученным показаниям определяют уровень заряда. Кипение возникает тогда, когда плотность электролитной жидкости достигает максимума и батарея не может удерживать поступающий в нее зарядный ток.
Излишки энергии поддерживают проходящую в аккумуляторной жидкости электролитную реакцию. Если при достижении полного заряда аккумулятор закипает – это нормально.
Причины для беспокойства отсутствуют, если характерные признаки кипения появляются не раньше, чем через 5-7 часов от начала зарядки батареи. Точное время зависит от состояния аккумулятора и от того, как долго он находился в эксплуатации.
Итак, при появлении первых признаков неисправностей, первое, на что мы обращаем внимание – это плотность электролита. Рабочая плотность в стартерных батареях должна быть около 1,24-1,30 г/см³. Замерять ее нужно специальным прибором – ареометром. При разрядке аккумулятора плотность электролита снижается, а при зарядке – увеличивается, поэтому замерять плотность следует только на полностью заряженной батарее.
Помните, что при сильном повышении температуры плотность электролита может падать, поэтому замер лучше всего проводить после 10 часов стоянки.
Из-за разного рода неисправностей в автомобиле плотность аккумулятора может уменьшиться. Также причиной снижения плотности может быть глубокий разряд АКБ и его долгий срок хранения без подзарядки. Если не устранить неполадки электросистемы автомобиля и долгое время не заряжать аккумулятор, то постоянная нехватка заряда приведет к появлению такого процесса, который называют сульфатацией. Именно он и вызывает преждевременное старение батареи. Чтобы этого избежать следует придерживаться некоторых рекомендаций по эксплуатации АКБ, которые описаны ниже в нашей статье.
Именно он и вызывает преждевременное старение батареи. Чтобы этого избежать следует придерживаться некоторых рекомендаций по эксплуатации АКБ, которые описаны ниже в нашей статье.
Подготовка к восстановлению батареи
Перед тем, как поднять плотность в аккумуляторе, проведем ее измерение ареометром. Делать замеры следует отдельно для каждой из банок. Что касается нормального уровня, то здесь диапазон должен составлять от 1,25 до 1,29. Такой разброс объясняется тем, что в регионах, где холодные зимы, лучше держать норму электролита повышенной, а в регионах с умеренным климатом чуть ниже. Если показатель ниже значения 1,25, восстановить нормальный уровень можно с помощью долива.
Химические причины кипения электролита
Во время зарядки АКБ накапливает энергию, которая поступает в нее от зарядного устройства. Она идет на восстановление свинцового покрытия пластин. Одновременно образуется кислотный остаток. Он переходит в электролит, тем самым повышая плотность данной жидкости.
Когда свинцовые соли полностью восстанавливаются, начинается электролиз воды. Так называется процесс ее разложения на части при условии, что через воду проходит электрический ток. Во время электролиза высвобождается кислород и водород.
Разложение воды сопровождается выделением пузырьков газа. Его интенсивность увеличивается постепенно: вначале будет слышно незначительное шуршание, со временем появляется четко различимое бульканье.
Внешне это выглядит как простое кипение воды, хотя температура аккумулятора при этом может достичь только 50 °С.
Повышение плотности электролита
В АКБ есть несколько банок, электролитический раствор есть в каждой из них. Проверять и при необходимости повышать уровень плотности необходимо в каждой банке.
Нормальный уровень данного показателя зависит от нескольких факторов, в первую очередь – от температуры воздуха. Нормальным считается значение 1,25-1,29г/см3. Разница таких показателей между банками не должна превышать 0,1.
Если измерение этого показателя является ниже нормы, нужно повысить плотность электролита в аккумуляторе.
При помощи спринцовки из каждой банки выкачивается раствор. При этом набирать нужно как можно большее количество жидкости, измеряя ее объем, чтобы затем долить точно такое же количество свежего электролита.
Залив столько же свежего раствора, сколько было извлечено старого, АКБ хорошенько прокачивается с целью размешивания нового и старого электролита.
После этого снова проводиться измерение этого показателя: если он все еще находиться ниже нормы, все действия повторяются до достижения нужного значения плотности. По завершению при необходимости в банки автомобильной батареи добавляется дистиллированная вода.
Как поднять плотность в аккумуляторе зарядным устройством?Если нет дефектов пластин или при малом выпадении кристаллов свинца можно попробовать простой, но действенный метод, подняв плотность в аккумуляторе зарядным устройством. Для этого следует полностью зарядить батарею малым током. После этого оставить на 10-12 часов отстояться и снова зарядить до полной зарядки аккумулятора. При этом напряжение следует выбрать около 14,6-14,8 В, а ток не более 1-2 Ампер. Однако этот метод подходит только в том случае, если нет явных признаков неполадки аккумулятора.
Для этого следует полностью зарядить батарею малым током. После этого оставить на 10-12 часов отстояться и снова зарядить до полной зарядки аккумулятора. При этом напряжение следует выбрать около 14,6-14,8 В, а ток не более 1-2 Ампер. Однако этот метод подходит только в том случае, если нет явных признаков неполадки аккумулятора.
Еще одним важным условием является соблюдение определенного уровня жидкости. Дело в том, что в процессе эксплуатации в каждой секции АКБ должно быть определенное количество раствора. При повышенных температурах, которые возникают из-за нагрузок в процессе работы аккумулятора, вода может испаряться. Вследствие чего концентрация кислоты в электролите увеличивается. А это в свою очередь также ведет к сульфатации пластин, тем самым снижая емкость аккумулятора, сокращает его срок службы.
Постоянная нехватка нужного уровня электролита приводит к преждевременному старению и потере емкости аккумулятора, поэтому уровень жидкости нужно контролировать. Для глубокого смешивания раствора после доливки жидкости необходимо через некоторое время снова зарядить аккумулятор.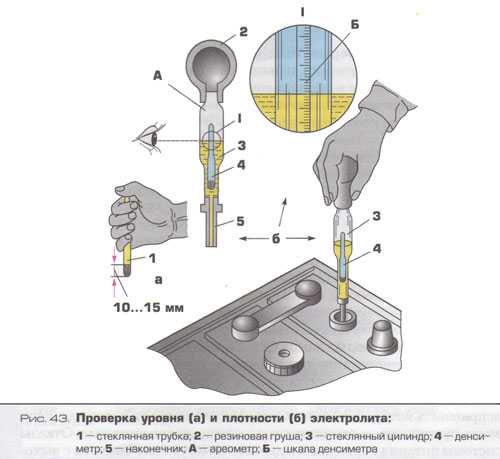
Для зарядки можно применять реле времени, которое автоматически отключает зарядное устройство через заданное время. Подключив реле, следует настроить его на автоматическое отключение через 15 минут. Вслед за тем делаем перерыв 15 минут и снова включаем зарядное устройство. И так до полного набора емкости АКБ.
Смотрим полезное видео, как восстановить свинцовый аккумулятор зарядным устройством:
Сейчас появились интеллектуальные зарядки, которые в зависимости от уровня разряда сами выбирают напряжение и ток. Такие зарядки способствуют реактивации и восстановлению аккумулятора.
Помните, что проверять плотность электролита следует только на полностью заряженной батарее. А долив дистиллированной воды следует производить лишь через некоторое время после поездки. Дело в том, что повышенная температура электролита может также влиять на объем жидкости в аккумуляторе. Такую реакцию еще называют температурным расширением. Что позволит вам не ошибиться с уровнем электролита.
Так как при переизбытке жидкости в батареи электролит может вытекать через отверстия в пробках, что приводит к повышенной утечке тока аккумулятора.
Повышение плотности электролита
Чтобы поднять плотность АКБ, следует начать со следующего:
- Следует убедиться, что аккумулятор заряжен. Если батарея разряжена, то, надо подзарядить и провести замер плотности. Нельзя приступать к работе, если АКБ имеет низкий заряд, так как, при заливе корректирующего раствора, в АКБ может резко подняться концентрация h3SO4. Как итог – полное разрушение в банках пластин, после чего, аккумуляторную батарею можно только утилизировать.
- Электролит в АКБ должен иметь температуру не менее 20, но не более 25 градусов цельсия.
- В каждой банке уровень должен быть в норме.
- Аккумулятор не должен иметь трещин и повреждений, особенно возле токовыводов. Часто возникает проблема снять клемму из-за того, что она прикипела или плотно закручена. Некоторые владельцы начинают расшатывать и стучать по токовыводу и клемме, что может целостность батареи.

При уровне не ниже 1,18, следует выполнять долив электролита с нормальной плотностью, чтобы увеличить, как минимум до 1,25. Долив выполняется для каждой банки отдельно. Через клизму-грушу берется забор старого, замеряется уровень и доливается свежий объемом не более половины от выкачанного. После этого, следует немного потрясти АКБ, чтобы дать жидкости возможность максимально перемешаться.
Как проверить плотность электролита в аккумуляторе
Измерения проводят при температуре 20–25 градусов, используя СИЗ (очки, перчатки, фартук или защитный костюм). Прибор для измерения плотности электролита называется денсиметром, его можно приобрести в любом автомагазине. По существу, это обычный ареометр, шкала которого откалибрована под измерение характеристик электролитической жидкости.
Алгоритм, как правильно измерить плотность электролита на предварительно заряженном АКБ, выглядит следующим образом:
- откручиваем пробки;
- последовательно погружаем денсиметр в банки;
- оцениваем показания прибора по рискам на шкале, следя за тем, чтобы прибор не касался стенок батареи;
- записываем показания для каждой банки.

Если в одной из секций значение не соответствует нормативным показателям, его корректируют.
Низкая плотность электролита в аккумуляторе после зарядки, что делать?Если при зарядке аккумулятора плотность электролита не поднимается до нормальных значений, то для того, чтобы восстановить прежнюю плотность батареи, придется добавить в нее свежий раствор электролита. Более концентрированный раствор поднимет плотность электролита, тем самым улучшив показатели в аккумуляторе. Ниже мы кратко опишем процесс увеличения низкой плотности электролита в аккумуляторе после зарядки.
В первую очередь измерьте показания плотности проблемных банок с помощью ареометра. Если после зарядки показания плотности равны или меньше 1,20, то это означает, что батарея нуждается в такой процедуре. В обслуживаемых аккумуляторах реализованы специальные отверстия, через которые можно долить электролит и тем самым поднять плотность раствора в аккумуляторе до нужного уровня, чаще всего это уровень равняется 1,28.
Все что от вас требуется, это откачать часть старого раствора с помощью клизмы-груши и добавить в него более концентрированный электролит, к примеру, плотностью 1,30. После этого нужно хорошенько перемешать раствор в аккумуляторе и снова измерить его плотность. В случае отклонений повторяем операцию до тех пор, пока плотность не поднимется до нужного уровня. Если же плотность поднялась слишком сильно, снова откачиваем часть электролита, но добавляем только воду.
Также из аккумулятора можно откачать сразу весь электролит, после чего залить заранее подготовленный раствор с нужной плотностью. Если вы решили заменить весь электролит, то для удобства, когда жидкость будет откачена, измерьте ее объем, чтобы залить в аккумулятор новый электролит в этом же количестве. Это можно провернуть с помощью мерного стаканчика или двух одинаковых емкостей. В заключение снова ставим аккумулятор на зарядку, после чего повторно замеряем плотность электролита, чтобы убедиться в работоспособности АКБ.
Как повысить при помощи зарядного устройства
Еще одним способом восстановления работоспособности АКБ, подзарядка ее на слабом токе. Этот способ требует много времени, но, довольно эффективен, если не поднимается плотность электролита до нормального уровня. Суть способа такова, что аккумуляторную батарею можно самостоятельно, через подзарядное устройство, зарядить до полного. Когда заряд будет максимальным, жидкость начнет кипеть. Признаком полной подзарядки будет появление мелких пузырьков (происходит испарение дистиллированной воды в батарее). Избыток воды испарится, а кислота останется. Одновременно понизится и общий уровень электролита. Теперь можно долить новый необходимой плотности. После этого, следует замерить показания ареометром и если они недостаточны, то повторить всю процедуру, пока не будет достигнута норма не ниже 1,25 г/см3.
Если станет вопрос о покупке нового или восстановления имеющегося аккумулятора, то конечно дешевле выбрать второе, тем более, что работа не является сложной и прочитав внимательно статью, даже человек, который плохо разбирается в технике, без труда сможет выполнить работу по повышению плотности электролита и восстановления работоспособности АКБ, как минимум на пару сезонов. Это серьезная экономия бюджета, тем более, что качественный аккумулятор стоит немалых средств.
Это серьезная экономия бюджета, тем более, что качественный аккумулятор стоит немалых средств.
Как мерить плотность аккумулятора
Измерение плотности электролита в сочетании с измерением напряжения под нагрузкой и без позволяет быстро установить причину неисправности в аккумуляторной батарее. При низкой плотности — это может быть дефект в какой-либо ячейке, глубокий разряд или обрыв цепи внутри АКБ. Плотность измеряется специальным прибором — ареометром (денсиметром).
В качестве электролита в аккумуляторных батареях применяют раствор серной кислоты, плотность которого измеряется в г/см3. В основном плотность зависит от концентрации раствора серной кислоты — чем больше концентрация раствора, тем больше плотность. Однако, она также зависит и от температуры раствора и от степени заряженности аккумулятора — при разрядке часть серной кислоты «уходит» в пластины, плотность снижается.
Поэтому измерение плотности принято проводить при 25 °С и полностью заряженном аккумуляторе. Плотность электролита в новой полностью заряженной батарее должна составлять 1.28±0.01 г/см3 для Средней полосы. Но может варьироваться в зависимости от климатической зоны.
Линейно снижаясь, по мере разряда АКБ, она составляет 1.20±0.01 г/см3 у батарей, степень заряженности которых снизилась до 50%. У полностью разряженной батареи плотность электролита составляет 1.10±0.01 г/см3.
Если значение плотности во всех банках аккумулятора одинаково (±0.01 г/см3), это говорит о степени заряженности батареи и отсутствии внутренних замыканий. При наличии внутреннего короткого замыкания плотность электролита в дефектной ячейке будет значительно ниже (на 0.10-0.15 г/см3), чем в остальных.
Низкая плотность в одной из ячеек указывает на наличие дефекта в ней (короткое замыкание между пластинами в блоке). Одинаково низкая плотность во всех ячейках связана с глубоким разрядом всей батареи, ее сульфатацией или устареванием.
Все заливаемые аккумуляторные батареи во время заряда и работы теряют часть воды. При этом снижается уровень жидкости над пластинами и увеличивается концентрация кислоты в электролите. Работа аккумулятора с низким уровнем электролита отрицательно влияет на ресурс батареи. Поэтому перед проверкой плотности электролита необходимо проверить его уровень в банках аккумулятора. Принято считать нормальным уровень электролита на 10-15 мм выше верхней кромки пластин (сепараторов).
Существует три основных вида аккумуляторных батарей:
Малосурьмянистые (Sb/Sb) — это обычная «классическая» свинцовая батарея с добавками в пластины сурьмы, они подвержены наибольшему саморазряду и выкипанию воды из раствора электролита, но не боятся глубоких разрядов, их легко зарядить даже при низкой плотности электролита.
Кальциевые (Ca/Ca) — пластины легированы кальцием, они практически не требуют слежения за уровнем и плотностью электролита, виброустойчивы, застрахованы от длительного перезаряда до 14. 8 В, терпят перепады напряжения в бортовой сети, обладают коррозионной стойкостью, имеют низкий саморазряд, больший срок службы. Однако, имеют один недостаток — они неустойчивы к глубоким разрядам. Дело в том, что при длительной глубокой разрядке их положительные пластины покрываются сульфатом кальция, блокирующим электрохимические реакции. Этот процесс, в отличие от образования сульфата свинца в малосурьмянистых батареях, необратим. Если разрядить кальциевую батарею ниже 11.5 В, то она уже не восстановит изначальную емкость, при разряде ниже 10.8 В потеряет до 50% своей емкости. Два-три таких разряда – и аккумулятор придется выбрасывать. Также, в связи с тем, что пластины в таких батареях упакованы в плотные пакеты, плотность электролита неравномерна — более тяжелая серная кислота скапливается внизу банок, а поверх пластин оказывается более «легкий» электролит. Из-за этого ареометр будет показывать неадекватно низкую плотность при нормальной заряженности.
8 В, терпят перепады напряжения в бортовой сети, обладают коррозионной стойкостью, имеют низкий саморазряд, больший срок службы. Однако, имеют один недостаток — они неустойчивы к глубоким разрядам. Дело в том, что при длительной глубокой разрядке их положительные пластины покрываются сульфатом кальция, блокирующим электрохимические реакции. Этот процесс, в отличие от образования сульфата свинца в малосурьмянистых батареях, необратим. Если разрядить кальциевую батарею ниже 11.5 В, то она уже не восстановит изначальную емкость, при разряде ниже 10.8 В потеряет до 50% своей емкости. Два-три таких разряда – и аккумулятор придется выбрасывать. Также, в связи с тем, что пластины в таких батареях упакованы в плотные пакеты, плотность электролита неравномерна — более тяжелая серная кислота скапливается внизу банок, а поверх пластин оказывается более «легкий» электролит. Из-за этого ареометр будет показывать неадекватно низкую плотность при нормальной заряженности.
Такие батареи хорошо подходят тем, кто ездит много на большие расстояния, кому нужны виброустойчивые аккумуляторы, хорошо переносящие постоянные перезаряды в пути.
Гибридные (Sb/Ca) — являются золотой серединой. Они довольно стойки к глубоким разрядам, при этом значительно меньше подвержены выкипанию и саморазряду по сравнению с малосурьмянистыми.
На примере кальциевой батареи емкостью 60 А·ч, попробуем выяснить плотность электролита и ее исправность. Для начала, проверим напряжение на клеммах аккумулятора мультиметром, чтобы выяснить степень ее заряженности. Такая проверка проводится через 6-8 часов после выключения двигателя или отключения зарядного устройства. В нашем случае машина простояла около 4-х дней под сигнализацией — напряжение составляет 12 В, что говорит нам о том, что батарея почти полностью разряжена.
Теперь проверим выборочно плотность электролита в двух банках — она составляет 1.23 г/см3 при температуре окружающего воздуха 0°С, поэтому внесем поправку в показания ареометра, приведя их к 25°С: 1.23-0.02=1.21 г/см3 — это также говорит нам о том, что аккумулятор требует срочной подзарядки.
Снимаем аккумулятор и переносим в теплое помещение для подзарядки.
Для кальциевых батарей губительны старые «дедовские» методы зарядки, используемые для малосурмянистых АКБ с контрольно-тренировочным циклом заряда/разряда и «кипячением», а также малоэффективны некоторые автоматические зарядные устройства.
В наши дни в большинстве таких устройств используется комбинированный метод зарядки, когда в процессе зарядки сила тока снижается со временем, а напряжение, наоборот, повышается. Это объясняется тем, что ЭДС аккумуляторной батареи направлена именно на напряжение, соответственно при его повышении нужно повышать и напряжение. А вот сила тока уменьшается из-за все увеличивающегося сопротивления батареи.
Для современных батарей рекомендуется установочный заряд током в 10% от номинальной ёмкости напряжением 14.4 В и продолжительность зарядки не менее суток. Однако, допустимо кратковременное повышение напряжения до 16.5 В в конце цикла зарядки.
Батарея считается полностью заряженной, когда ток и напряжение при заряде сохраняются без изменения в течение 1-2 часов. Ток должен упасть практически до нуля, а входящее напряжение может повысится до 16,5 В, в зависимости от устройства.
Ток должен упасть практически до нуля, а входящее напряжение может повысится до 16,5 В, в зависимости от устройства.
Если вы часто заводите двигатель, двигаетесь на небольшие расстояния, и автомобиль долго простаивает без движения, то для такой батареи необходима ежемесячная плановая зарядка аккумулятора специализированным зарядным устройством, подходящим именно для кальциевых батарей.
После того, как электролит прогрелся до 20-25°С еще раз замерим напряжение и плотность. Теперь мультиметр показывает напряжение 12.45 В, а плотность в банках от 1.22 до 1.24 г/см3, что все равно указывает на недозаряд батареи.
Анализ электролита из аккумулятора и замер его плотности помогает владельцу автомобиля судить о его химическом состоянии. Плотность кислотосодержащей жидкости внутри банок АКБ зависит от очень многих факторов, поэтому важно уметь правильно определять значение этого параметра в зависимости от условий эксплуатации автомобиля.
Что такое плотность электролита
Плотностью любого физического тела или жидкости считается, как отношение массы вещества к занимаемому объёму.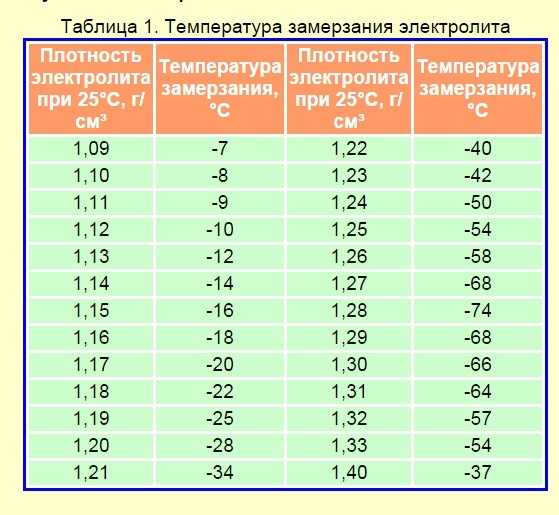 Этот параметр для жидкости, заливаемый в банки свинцового аккумулятора, выражается в граммах на кубический сантиметр.
Этот параметр для жидкости, заливаемый в банки свинцового аккумулятора, выражается в граммах на кубический сантиметр.
Определить плотность вещества визуально не представляется возможным поэтому для измерения этого параметра используют специальное устройство.
Чем можно померить плотность электролита
Замерить концентрацию электролита можно с помощью медицинского шприца объёмом 10 см3 и точных цифровых весов. Работа выполняется следующим образом:
- Пустой шприц без иглы кладётся на весы и показания измерительного прибора записываются в блокнот.
- На шприц одевается тонкая резиновая трубка, которая опускается в одну из банок аккумулятора.
- В шприц набирается ровно 10 мл кислотосодержащей жидкости.
- Шприц, без резиновой трубки, кладётся на весы и результат измерения снова записывается.
- Производятся несложные арифметические вычисления:
- Из массы шприца с электролитом вычитается масса пустого медицинского изделия.

- Получившееся значение делится на 10.
В результате получится точное значение плотности в одной банке. Таким образом нужно измерить этот показатель во всех банках.
Каждый раз осуществлять измерение таким образом невыгодно ни по затраченному времени, ни по удобству выполнения процедуры. Намного удобнее и проще произвести измерение плотности кислотосодержащей жидкости аккумулятора с помощью ареометра.
Он состоит из специальной колбы с находящимся внутри поплавком. Внутренняя деталь поплавка имеет свинцовую огрузку поэтому при закачивании в ёмкость жидкости, эта деталь устанавливается строго в вертикальном положении. На поверхности поплавка имеется градуированная шкала, по которой можно узнать точное значение плотности электролита аккумулятора.
Почему может повыситься или понизиться плотность электролита
Изменение концентрации электролита может произойти по следующим причинам:
- При изменении уровня заряженности батареи (прямая корреляция).

- При негерметичном корпусе аккумулятора. Если в нем есть трещины или пробки плохо прикручены, то будет уходить жидкость и при доливке дистиллированной воды плотность будет снижаться.
- Добавление электролита вместо дистиллированной воды, при испарении жидкости в летнее время (увеличение плотности).
- Неправильно приготовленный электролит. Наиболее часто такая ситуация может возникнуть при самостоятельном добавлении кислоты в воду.
- Интенсивное испарение воды из банок в летний период.
Как правило, установить причину изменения концентрации электролита в домашних условиях не составляет большого труда, но чтобы правильно определить величину такого отклонения, необходимо знать, какое значение является эталонным.
Какая плотность электролита в аккумуляторе должна быть
Технические требования по плотности электролита могут существенно отличаться для кислотных аккумуляторов, эксплуатируемых в различных климатических условиях.
Какая должна быть плотность электролита зимой
Необходимость в поддержании концентрации серной кислоты в электролите на более высоком уровне обусловлено опасностью замерзания жидкости при низких температурах воздуха. Полностью заряженный аккумулятор должен обладать плотностью смеси 1,27 – 1,28 г/см3. Тогда он легко переносит морозы до минус 70 градусов.
Полностью заряженный аккумулятор должен обладать плотностью смеси 1,27 – 1,28 г/см3. Тогда он легко переносит морозы до минус 70 градусов.
При падении плотности до 1,20 г/см3 жидкость гарантированно превратиться в лёд уже при температуре минус 30 градусов. В результате кристаллизации, жидкость значительно увеличивается в объёме, поэтому при эксплуатации машины в зимний период необходимо тщательно следить за тем, чтобы аккумулятор был полностью заряжен.
Невыполнение этого требования приведёт к разрушению внутренних пластин устройства, что станет причиной полной неработоспособности аккумуляторной батареи.
| Плотность электролита (г/см3) | Степень заряженности (%) | Замерзание электролита (С) |
|---|---|---|
| 1,27 | 100 | -60 |
| 1,26 | 94 | -55 |
| 1,25 | 87,5 | -50 |
| 1,24 | 81 | -46 |
| 1,23 | 75 | -42 |
| 1,22 | 69 | -37 |
| 1,21 | 62,5 | -32 |
| 1,2 | 56 | -27 |
| 1,19 | 50 | -24 |
| 1,18 | 44 | -18 |
| 1,17 | 37,5 | -16 |
| 1,16 | 31 | -14 |
| 1,15 | 25 | -13 |
| 1,14 | 19 | -11 |
| 1,13 | 12,56 | -9 |
| 1,12 | 6 | -8 |
| 1,11 | 0,0 | -7 |
Какая должна быть плотность электролита летом
Летом исключается вероятность образования льда внутри банок аккумулятора, но в обслуживаемых аккумуляторных батареях плотность может произвольно повышаться за счёт испарения воды.
Эксплуатация АКБ с повышенной концентрацией электролита приводит к существенному снижению эксплуатационного срока батареи, вследствие более агрессивного воздействия кислотосодержащей жидкости на сепараторы.
Чтобы избежать подобных негативных последствий, в обслуживаемых моделях, следует производить регулярный контроль уровня электролита в летний период и при необходимости разбавлять смесь дистиллированной водой.
Как проверить плотность аккумулятора
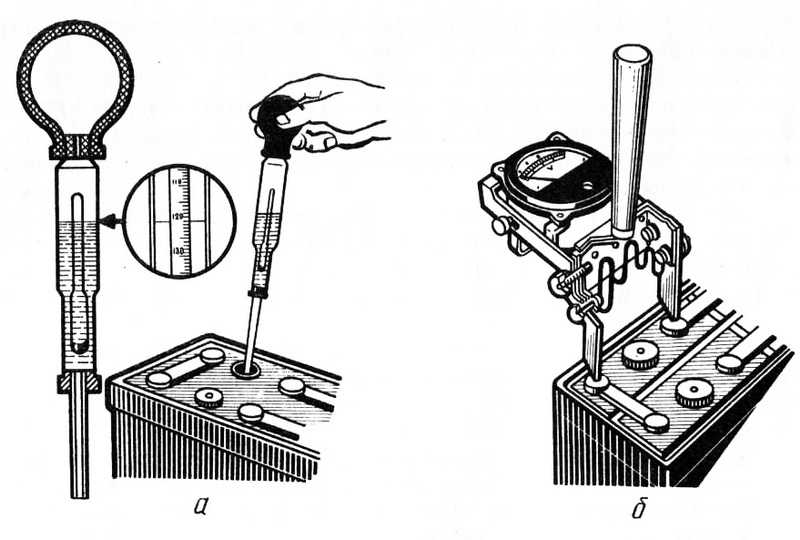
Если плотность электролита необходимо замерять регулярно, то без ареометра не обойтись. Осуществляется процедура замера следующим образом:
- Выкручиваются пробки аккумуляторной батареи.
- Узкая часть вводится в банку.
- Груша, находящаяся в верхней части прибора, сжимается. Затем необходимо отпустить резиновую верхнюю часть, чтобы образовавшееся отрицательное давление способствовало наполнению резервуара измерительного прибора кислотосодержащей жидкостью.
Определяется концентрация электролита по его уровню на градуированной шкале поплавка. Таким несложным методом производится измерение в каждой банке аккумуляторной батареи.
Таким несложным методом производится измерение в каждой банке аккумуляторной батареи.
Как измерить плотность в необслуживаемом аккумуляторе
Необслуживаемые аккумуляторы не имеют в своей конструкции закрываемых технологических отверстий. Это означает, что производителем не была предусмотрена возможность самостоятельного измерения плотности электролита в течение всего срока службы АКБ.
Для умельцев такая особенность конструкции необслуживаемого аккумулятора не является непреодолимой преградой на пути улучшения состояния устройства, в работе которого наблюдаются значительные отклонения от нормы.
Они превращают необслуживаемую модель аккумулятора в обслуживаемую при помощи дрели, которым в середине каждой банки делаются отверстия значительные отверстия.
В отверстиях метчиком нарезается резьба, а для изготовления пробки используется пластиковый прут подходящего диметра, на котором с помощью плашки делается определённого диаметра и шага резьба.
Получившуюся пластиковую шпильку разрезают на 6 отрезков длинной по 3 – 4 см. Самодельные пробки вкручиваются в сделанные ранее отверстия и далее батарея эксплуатируется как обслуживаемая.
Самодельные пробки вкручиваются в сделанные ранее отверстия и далее батарея эксплуатируется как обслуживаемая.
Есть другой популярные метод. С краю, в крышке просверливают 6 маленьких отверстий, через которые можно будет получить полноценный доступ к жидкости в каждой банке аккумулятора.
Замерив электролит таким образом, герметичность элемента питания можно восстановить при помощи силиконового герметика. Чтобы при проведении герметизации вещество не попало внутрь аккумулятора, рекомендуется с помощью самодельного проволочного крючка попытаться выпрямить часть пластмассы, которая была продавлена в процессе изготовления отверстия.
Внимание! При механическом повреждении корпуса аккумулятор слетает с гарантией, и в случае допущения ошибки она может выйти из строя. Мусор провалившийся в банки также может снизить продолжительность жизни батареи.
Как поднять плотность в аккумуляторе
Падает плотность электролита, обычно, при добавлении дистиллированной воды в аккумуляторную батарею, имеющую негерметичный корпус. В этом случае обычно наблюдается разная концентрация в банках.
В этом случае обычно наблюдается разная концентрация в банках.
Если плотность в аккумуляторе невозможно выровнять во всех банках до приемлемого значения зарядным устройством, то производят замещения части кислотосодержащей жидкости свежим заводским электролитом. Корректировка плотности электролита выполняется в такой последовательности:
- Из проблемной банки с помощью груши удаляется максимально возможное количество электролита.
- В банку заливается свежая кислотосодержащая смесь.
Если в результате подобных действий в банках не происходит достаточного увеличения плотности, то процедуру следует повторить.
Как понизить плотность АКБ
Работа аккумулятора с повышенной плотностью электролита может негативно отразиться на его работоспособности, поэтому при наличии в банке электролита, концентрация которого выше 1,28 проводят процедуру позволяющую снизить концентрацию серной кислоты.
Процесс понижения плотности производится таким же образом, как и при выполнении процедуры повышения концентрации раствора, но вместо электролита в аккумулятор добавляется дистиллированная вода. То есть, вначале из проблемной банки удаляется часть электролита, а затем объём восполняется химически чистой водой.
То есть, вначале из проблемной банки удаляется часть электролита, а затем объём восполняется химически чистой водой.
Остались вопросы по плотности электролита или есть что добавить? Тогда напишите нам об этом в комментариях, это позволит сделает материал более полезным, полным и точным.
Плотность электролита в аккумуляторе очень важный параметр у всех кислотных АКБ, и каждый автовладелец должен знать: какая плотность должна быть, как её проверить, а самое главное, как правильно поднять плотность аккумулятора (удельный вес кислоты) в каждой из банок со свинцовыми пластинами заполненных раствором h3SO4.
Проверка плотности – это один из пунктов процесса обслуживания аккумуляторной батареи, включающий так же проверку уровня электролита и замер напряжения АКБ. В свинцовых аккумуляторах плотность измеряется в г/см3. Она пропорциональна концентрации раствора, а обратно зависима, относительно температуры жидкости (чем выше температура, тем ниже плотность).
По плотности электролита можно определить состояние батареи. Так что если батарея не держит заряд, то следует проверить состояние её жидкости в каждой его банке.
Плотность электролита влияет на емкость аккумулятора, и срок его службы.
Проверяется денсиметром (ареометр) при температуре +25°С. В случае, если температура отличается от требуемой, в показания вносятся поправки, как показано в таблице.
Итак, немного разобрались, что это такое, и что нужно регулярно делать проверку. А на какие цифры ориентироваться, сколько хорошо, а сколько плохо, какой должна быть плотность электролита аккумулятора?
Какая плотность должна быть в аккумуляторе
Выдерживать оптимальный показатель плотности электролита очень важно для аккумулятора и стоит знать, что необходимые значения зависят от климатической зоны. Поэтому плотность аккумулятора должна быть установлена исходя из совокупности требований и условий эксплуатации. К примеру, при умеренном климате плотность электролита должна находиться на уровне 1,25-1,27 г/см3 ±0,01 г/см3. В холодной зоне, с зимами до -30 градусов на 0,01 г/см3 больше, а в жаркой субтропической — на 0,01 г/см3 меньше. В тех регионах, где зима особо сурова (до -50 °С), дабы аккумулятор не замерз, приходится повышать плотность от 1,27 до 1,29 г/см3.
К примеру, при умеренном климате плотность электролита должна находиться на уровне 1,25-1,27 г/см3 ±0,01 г/см3. В холодной зоне, с зимами до -30 градусов на 0,01 г/см3 больше, а в жаркой субтропической — на 0,01 г/см3 меньше. В тех регионах, где зима особо сурова (до -50 °С), дабы аккумулятор не замерз, приходится повышать плотность от 1,27 до 1,29 г/см3.
Много автовладельцев задаются вопросом: «Какой должна быть плотность электролита в аккумуляторе зимой, а какой летом, или же нет разницы, и круглый год показатели нужно держать на одном уровне?» Поэтому, разберемся с вопросом более подробно, а поможет это сделать, таблица плотности электролита в аккумуляторе с разделением на климатические зоны.
Также нужно помнить, что, как правило, аккумуляторная батарея, находясь на автомобиле, заряжена не более чем на 80-90 % её номинальной ёмкости, поэтому плотность электролита будет немного ниже, чем при полном заряде. Так что, требуемое значение, выбирается чуть-чуть повыше, от того, которое указано в таблице плотности, дабы при снижении температуры воздуха до максимального уровня, АКБ гарантированно оставался работоспособным и не замерз в зимний период. Но, касаясь летнего сезона, повышенная плотность может и грозить закипанием.
Так что, требуемое значение, выбирается чуть-чуть повыше, от того, которое указано в таблице плотности, дабы при снижении температуры воздуха до максимального уровня, АКБ гарантированно оставался работоспособным и не замерз в зимний период. Но, касаясь летнего сезона, повышенная плотность может и грозить закипанием.
Таблица плотности электролита в аккумуляторе
Таблица плотности составляется относительно среднемесячной температуры в январе-месяце, так что климатические зоны с холодным воздухом до -30 °C и умеренные с температурой не ниже -15 не требуют понижения или повышения концентрации кислоты. Круглый год (зимой и летом) плотность электролита в аккумуляторе не стоит изменять, а лишь проверять и следить, чтобы она не отклонялась от номинального значения, а вот в очень холодных зонах, где столбик термометра часто на отметке ниже -30 градусов (в плоть до -50), корректировка допускается.
Плотность электролита в аккумуляторе зимой
Плотность электролита в аккумуляторе зимой должна составлять 1,27 (для регионов с зимней температурой ниже -35 не менее 1. 28 г/см3). Если будет значение ниже, то это приводит к снижению электродвижущей силы и трудного запуска двигателя в морозы, вплоть до замерзания электролита.
28 г/см3). Если будет значение ниже, то это приводит к снижению электродвижущей силы и трудного запуска двигателя в морозы, вплоть до замерзания электролита.
Когда в зимнее время плотность в аккумуляторной батареи понижена, то не стоит сразу бежать за корректирующим раствором дабы её поднять, гораздо лучше позаботится о другом – качественном заряде АКБ при помощи зарядного устройства.
Получасовые поездки от дому к работе и обратно не позволяют электролиту прогрется, и, следовательно, хорошо зарядится, ведь аккумулятор принимает заряд лишь после прогрева. Так что разряженность изо дня в день увеличивается, и в результате падает и плотность.
Для новой и исправной АКБ нормальный интервал изменения плотности электролита (полный разряд – полный заряд) составляет 0,15-0,16 г/см3.
Помните, что эксплуатация разряженного аккумулятора при минусовой температуре приводит к замерзанию электролита и разрушению свинцовых пластин!
По таблице зависимости температуры замерзания электролита от его плотности, можно узнать минусовой порог столбика термометра, при котором образовывается лед в вашем аккумуляторе.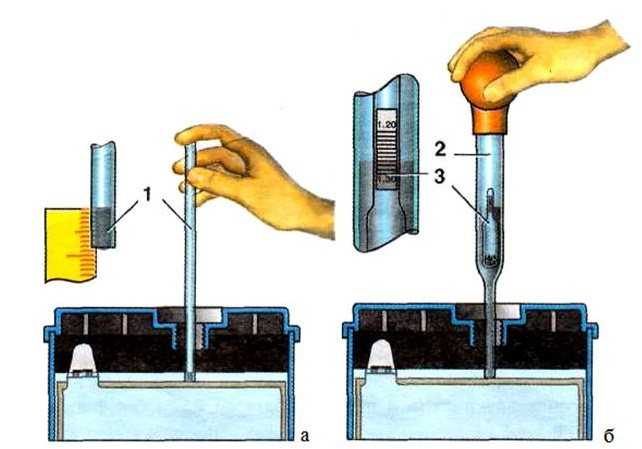
Как видите, при заряженности на 100% аккумуляторная батарея замерзнет при -70 °С. При 40% заряде замерзает уже при -25 °С. 10% не только не дадут возможности запустить двигатель в морозный день, но и напрочь замерзнет в 10 градусный мороз.
Когда плотность электролита не известна, то степень разряженности батареи проверяют нагрузочной вилкой. Разность напряжения в элементах одной батареи не должна превышать 0,2В.
Показания вольтметра нагрузочной вилки, B
Степень разряженности батареи, %
Если АКБ разрядилась более чем на 50% зимой и более чем на 25% летом, её необходимо подзарядить.
Плотность электролита в аккумуляторе летом
Летом аккумулятор страдает от обезвоживания, поэтому учитывая то, что повышенная плотность плохо влияет на свинцовые пластины, лучше если она будет на 0,02 г/см3 ниже требуемого значения (особенно касается южных регионов).
В летнее время температура под капотом, где зачастую находится аккумулятор, значительно повышена. Такие условия способствуют испарению воды из кислоты и активности протекания электрохимических процессов в АКБ, обеспечивая высокую токоотдачу даже при минимально допустимом значении плотности электролита (1,22 г/см3 для теплой влажной климатической зоны). Так что, когда уровень электролита постепенно падает, то повышается его плотность, что ускоряет процессы коррозионного разрушения электродов. Именно поэтому так важно контролировать уровень жидкости в аккумуляторной батарее и при его понижении добавить дистиллированной воды, а если этого не сделать, то грозит перезаряд и сульфация.
Такие условия способствуют испарению воды из кислоты и активности протекания электрохимических процессов в АКБ, обеспечивая высокую токоотдачу даже при минимально допустимом значении плотности электролита (1,22 г/см3 для теплой влажной климатической зоны). Так что, когда уровень электролита постепенно падает, то повышается его плотность, что ускоряет процессы коррозионного разрушения электродов. Именно поэтому так важно контролировать уровень жидкости в аккумуляторной батарее и при его понижении добавить дистиллированной воды, а если этого не сделать, то грозит перезаряд и сульфация.
Если аккумулятор разрядился по невнимательности водителя или другим причинам, следует попробовать вернуть ему его рабочее состояние при помощи зарядного устройства. Но перед тем как заряжать АКБ, смотрят на уровень и по надобности доливают дистиллированную воду, которая могла испариться в процессе работы.
Через некоторое время плотность электролита в аккумуляторе, из-за постоянного разбавления его дистиллятом, снижается, и опускается ниже требуемого значения. Тогда эксплуатация батареи становится невозможной, так что возникает необходимость повысить плотность электролита в аккумуляторе. Но для того, чтобы узнать насколько повышать, нужно знать как проверять эту самую плотность.
Тогда эксплуатация батареи становится невозможной, так что возникает необходимость повысить плотность электролита в аккумуляторе. Но для того, чтобы узнать насколько повышать, нужно знать как проверять эту самую плотность.
Как проверить плотность аккумулятора
Дабы обеспечить правильную работу аккумуляторной батареи, плотность электролита следует проверять каждые 15-20 тыс. км пробега. Измерение плотности в аккумуляторе осуществляется при помощи такого прибора как денсиметр. Устройство этого прибора состоит из стеклянной трубки, внутри которой ареометр, а на концах — резиновый наконечник с одной стороны и груша с другой. Чтобы произвести проверку, нужно будет: открыть пробку банки аккумулятора, погрузить его в раствор, и грушей втянуть небольшое количество электролита. Плавающий ареометр со шкалой покажет всю необходимую информацию. Более детально как правильно проверить плотность аккумулятора рассмотрим чуть ниже, поскольку есть еще такой вид АКБ, как необслуживаемые, и в них процедура несколько отличается — вам не понадобится абсолютно никаких приборов.
Индикатор плотности на необслуживаемой АКБ
Плотность необслуживаемого аккумулятора отображается цветовым индикатором в специальном окошке. Зеленый индикатор свидетельствует, что все в норме (степень заряженности в пределах 65 — 100%), если плотность упала и требуется подзарядка, то индикатор будет черный. Когда в окошке отображается белая или красная лампочка, то нужен срочный долив дистиллированной воды. Но, впрочем, точная информация о значении того или иного цвета в окошке, находится на наклейке аккумуляторной батареи.
Теперь продолжаем далее разбираться, как проверять плотность электролита обычного кислотного аккумулятора в домашних условия.
Проверка плотности электролита в аккумуляторе
Итак, чтобы можно было правильно проверить плотность электролита в аккумуляторной батарее, первым делом проверяем уровень и при необходимости его корректируем. Затем заряжаем аккум и только тогда приступаем к проверке, но не сразу, а после пары часов покоя, поскольку сразу после зарядки или долива воды будут недостоверные данные.
Следует помнить, что плотность напрямую зависит от температуры воздуха, поэтому сверяйтесь с таблицей поправок, рассматриваемой выше. Сделав забор жидкости из банки аккумулятора, держите прибор на уровне глаз – ареометр должен находиться в состоянии покоя, плавать в жидкости, не касаясь стенок. Замер производится в каждом отсеке, а все показатели записываются.
Таблица определения заряженности аккумулятора по плотности электролита.
Ионы в воде и электропроводность
Ионы в воде и электропроводность
До сих пор мы имели дело с законом Ома и электропроводностью в целом и надеемся, что вы поняли его концепцию. Вы можете, однако, задаться вопросом, какое это имеет отношение к измерению электропроводности воды — настоящий вопрос с самого начала. Итак, мы подошли к основной теме.
Под потоком заряда до сих пор подразумевался электрический ток. Металл, например электрический провод, содержит большое количество свободных электронов. Эти электроны передают электрический ток от одного к другому, как шеренга людей, образующих бригаду ведер. Такой металл называется проводником.
Такой металл называется проводником.
Во-вторых, введем ионный проводник, электрический ток которого переносится ионами, например, раствором электролита.
Сейчас мы обсудим некоторые новые термины, которые появились. Когда определенное вещество растворяется в жидкости — воде в случае Твин — и если полученная таким образом жидкость может проводить электричество, такая жидкость называется раствором электролита, а растворенное вещество называется электролитом. И каждая корпускула, несущая электричество, называется ионом (греческое слово, означающее странник).
Поваренная поваренная соль (NaCl) является электролитом, и когда она растворяется в воде с образованием соленой воды, она превращается в ионы натрия (Na + ) и ионы хлорида (Cl — ), каждый из которых представляет собой частицу который проводит электричество.
Вернемся к проводимости. Электропроводность — это показатель того, насколько легко протекает электричество. В воде именно ионы передают электричество от одного к другому. Это означает, что чем больше Na + и Cl — содержится в воде, тем больше электричества переносится и тем выше проводимость.
Это означает, что чем больше Na + и Cl — содержится в воде, тем больше электричества переносится и тем выше проводимость.
Подводя итог, если мы знаем электропроводность образца соленой воды, мы можем рассчитать, насколько соленая вода. (Это то, что происходит при преобразовании солености для получения значения, отображаемого кондуктометром Twin.)
Соленость (плотность соли в соленой воде) и электропроводность
Температура жидкости 25°C IEEE J.Ocean.Eng., ОЕ-5(1),3~8(1980).
| Плотность NaCl (В/об) % | Электропроводность (мСм/см) | Плотность NACL (вес / цепь) % | Проводящий. |
|---|---|---|---|
| 0.3 | 5.7 | 1.3 | 22.4 |
| 0.4 | 7.5 | 1.4 | 24.0 |
| 0.5 | 9.2 | 1.5 | 25. 6 6 |
| 0.6 | 10.9 | 1.6 | 27.1 |
| 0.7 | 12.6 | 1.7 | 28.6 |
| 0.8 | 14.3 | 1.8 | 30.1 |
| 0.9 | 16.0 | 1,9 | 31,6 |
| 1,0 | 17,6 | 2,0 | 33,0 |
Сильные электролиты, с помощью Слабых Электрит. Некоторые из вас могут задаться вопросом, можно ли также измерить сахарную воду. К сожалению, кондуктометр не может определить плотность сахара в воде. Хотя сахар растворим в воде, он не образует ионов, а значит, не является электролитом. Только когда в воде образуются ионы, можно рассчитать плотность растворенного вещества по проводимости, измеренной с помощью кондуктометра.
Как и человек, электролит обладает множеством свойств. Электролиты можно условно разделить на сильные электролиты и слабые электролиты. Давайте потратим немного времени на эту тему.
Сильные электролиты
Соль содержит NaCl и KCl, которые при растворении в воде образуют электролиты, большая часть которых становится ионами. Зависимость между плотностью и проводимостью почти линейна. Однако, как видно на диаграмме, в отличие от зоны низкой плотности, в зоне высокой плотности не наблюдается увеличения проводимости при дальнейшем увеличении плотности. Наступает точка насыщения, мало чем отличающаяся от дорожной пробки, когда ионы взаимодействуют друг с другом, и это затрудняет протекание электричества.
Слабые электролиты
В зоне очень низкой плотности проводимость имеет линейную зависимость от плотности, как это видно для органических кислот. Хорошим примером является раствор уксусной кислоты. Однако с увеличением плотности скорость ионизации уменьшается. В зоне высокой плотности ионизируется только часть электролита, и из-за переполненности большая часть потенциальных ионов остается растворенной в воде в виде молекул.
При ионизации CH 3 COOH становится CH 3 COO — и H + , но поскольку это слабый электролит, большая часть молекул остается CH 3 COOH. Другими словами, они хорошая пара. Когда ацетат натрия (CH 3 COONa) ионизируется, он превращается в ацетат ионов CH 3 COO — и ион натрия Na + , но, поскольку он является сильным электролитом, в отличие от ацетата, он проявляет разделение большинства его молекул. В отличие от ацетата, ацетат натрия похож на плохую пару.
Другими словами, они хорошая пара. Когда ацетат натрия (CH 3 COONa) ионизируется, он превращается в ацетат ионов CH 3 COO — и ион натрия Na + , но, поскольку он является сильным электролитом, в отличие от ацетата, он проявляет разделение большинства его молекул. В отличие от ацетата, ацетат натрия похож на плохую пару.
О моль/л (моль на литр): моль (обозначение единицы моль в системе СИ) — это одна из химических единиц, которую мы используем для выражения измеренного количества вещества. Число атомов или молекул в одном моле вещества равно константе Авогадро, которая имеет значение 6,022 х 10 23 . Поэтому единица плотности моль/л (моль на литр) показывает, какое количество вещества (в молях) растворено в 1 л раствора.
История электропроводности
Алессандро Вольта был физиком, родившимся в Италии в 1745 году. Он стал известен в 1800 году как изобретатель первой электрической батареи.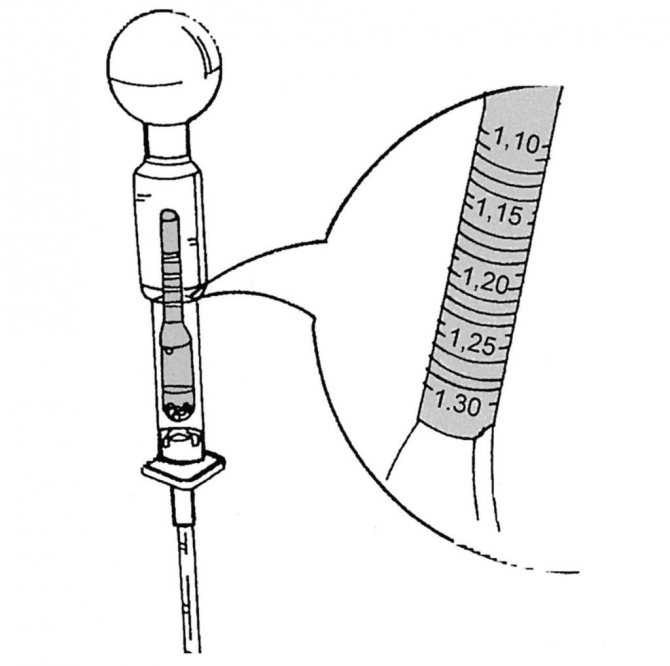 В отличие от фрикционных батарей, известных до того времени, батарея Вольта обеспечивала непрерывный электрический ток и была одним из величайших изобретений века. Это достижение Вольта проложило путь таким, как Георг Ом, немецкий физик, измеривший проводимость металлов и в 1827 году открывший знаменитый теперь закон Ома.
В отличие от фрикционных батарей, известных до того времени, батарея Вольта обеспечивала непрерывный электрический ток и была одним из величайших изобретений века. Это достижение Вольта проложило путь таким, как Георг Ом, немецкий физик, измеривший проводимость металлов и в 1827 году открывший знаменитый теперь закон Ома.
Майкл Фарадей родился в 179 г.1, сын английского кузнеца. В 13 лет он стал учеником переплетчика, что дало ему доступ ко многим книгам. В 1833 году он стал ассистентом профессора Дэвиса в Королевской исследовательской лаборатории. Он проделал выдающуюся работу в области химии и физики, а в 1833 году сформулировал закон электролиза и представил ион состоящим из корпускул, которые передают электричество в растворе.
Электропроводность электролитов была энергетически измерена Фридрихом Кольраушем из Германии в 1869 г.и 1880. Говорят, что он начал измерять проводимость как средство получения ионного продукта. Мост Кольрауша, изобретенный им в то время для измерения электропроводности, хорошо известен и сегодня.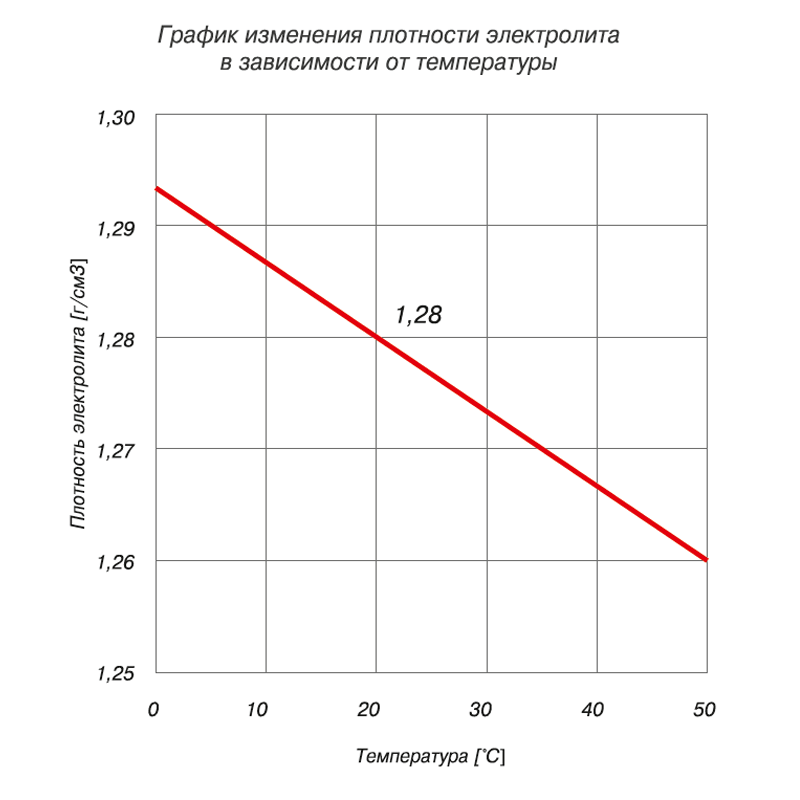
| A. Volta | (Italy) | 1745-1827 |
|---|---|---|
| G. Ohm | (Germany) | 1787-1854 |
| M. Faraday | (England) | 1791-1867 |
| F. Kohlrausch | (Германия) | 1840-1910 |
Следующая страница. Регулируемость. Рынок электроники в последние годы вызвал высокий спрос на более совершенные устройства хранения энергии с высокой удельной мощностью (Simon and Gogotsi, 2008; Etacheri et al., 2011). Электрохимические суперконденсаторы (ЭС) в значительной степени удовлетворяют этим требованиям, но относительно низкая плотность энергии ограничивает их применение в будущем (Simon and Gogotsi, 2008). Накопление энергии в суперконденсаторах включает обратимые реакции электростатической адсорбции/десорбции ионов электролита на поверхности заряженного электрода (т.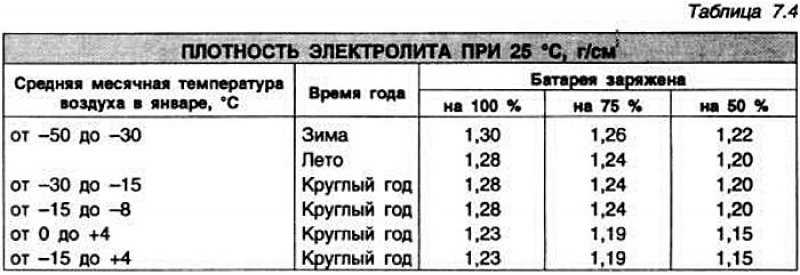 е. емкость двойного электрического слоя) (Simon and Gogotsi, 2008; Etacheri et al., 2011). Плотность энергии зависит от правильного выбора материалов электродов, а также от их совместимости с ионами электролита. Из-за чрезвычайно высокой удельной поверхности, широкой доступности и низкой стоимости активированные угли, полученные из биомассы, широко используются в качестве электродов в суперконденсаторах (Rufford et al., 2008; Bi et al., 2019).). Преимущества углей из биомассы перед другими заключаются в наличии разнообразных функциональных групп, способствующих накоплению дополнительного заряда в суперконденсаторах за счет их участия в псевдоемкостных окислительно-восстановительных реакциях (Bi et al., 2019). Недавно мы продемонстрировали, что коммерческие угли из кокосового ореха, обладающие большим количеством кислотных групп и узким распределением пор по размерам, демонстрируют превосходную устойчивость к циклированию в растворе щелочного электролита: разрядная емкость снижается всего на 2% после 37 000 циклов (Караманова и др.
е. емкость двойного электрического слоя) (Simon and Gogotsi, 2008; Etacheri et al., 2011). Плотность энергии зависит от правильного выбора материалов электродов, а также от их совместимости с ионами электролита. Из-за чрезвычайно высокой удельной поверхности, широкой доступности и низкой стоимости активированные угли, полученные из биомассы, широко используются в качестве электродов в суперконденсаторах (Rufford et al., 2008; Bi et al., 2019).). Преимущества углей из биомассы перед другими заключаются в наличии разнообразных функциональных групп, способствующих накоплению дополнительного заряда в суперконденсаторах за счет их участия в псевдоемкостных окислительно-восстановительных реакциях (Bi et al., 2019). Недавно мы продемонстрировали, что коммерческие угли из кокосового ореха, обладающие большим количеством кислотных групп и узким распределением пор по размерам, демонстрируют превосходную устойчивость к циклированию в растворе щелочного электролита: разрядная емкость снижается всего на 2% после 37 000 циклов (Караманова и др. ). ., 2019, 2020).
). ., 2019, 2020).
Используемый электролит является другим ключевым компонентом ЭС, обеспечивающим ионную проводимость и, таким образом, способствуя компенсации заряда на электродах в ячейке (Zhong et al., 2015). Желательными свойствами электролитов являются высокая ионная проводимость, широкий диапазон напряжений, высокая электрохимическая и термическая стабильность, низкая вязкость, низкая токсичность, низкая стоимость и т. д. (Wang et al., 2012). Оценка электролитов показывает, что водные электролиты обеспечивают более высокую плотность мощности, в то время как органические электролиты больше подходят для достижения более высокой плотности энергии (Calvo et al., 2014). Такой вывод является следствием того факта, что диапазон рабочих напряжений в органических электролитах шире (Phattharasupakun et al., 2017).
Различные характеристики углерода, полученного из биомассы, в водных и неводных электролитах обычно связаны с ионной проводимостью и размером ионов электролита, а также с взаимодействием между электролитом и материалами электродов (Chen et al. , 2019). В этом случае соответствие между размером иона электролита и размером пор углеродного электродного материала оказывает сильное влияние на достижимую удельную емкость (Янг и др., 2007; МакДоноу и др., 2012). Например, наличие очень маленьких пор в углеродном материале может увеличить удельную поверхность, но также может ограничить доступ ионов электролита. В частности, более крупные органические ионы не могут легко получить доступ через маленькие поры, что отрицательно влияет на удельную емкость (Chmiola et al., 2006).
, 2019). В этом случае соответствие между размером иона электролита и размером пор углеродного электродного материала оказывает сильное влияние на достижимую удельную емкость (Янг и др., 2007; МакДоноу и др., 2012). Например, наличие очень маленьких пор в углеродном материале может увеличить удельную поверхность, но также может ограничить доступ ионов электролита. В частности, более крупные органические ионы не могут легко получить доступ через маленькие поры, что отрицательно влияет на удельную емкость (Chmiola et al., 2006).
Совместимость электролита и активированного угля влияет на рабочее напряжение суперконденсаторов. Часто используемые органические электролиты (особенно для коммерческих ЭС) представляют собой раствор тетрафторбората тетраэтиламмония (TEABF 4 ) в растворителе ацетонитриле (ACN) или пропиленкарбонате (PC) (Rufford et al., 2008). Кроме того, аккумуляторные электролиты, такие как 1M LiPF 6 в этиленкарбонате (EC)/диметилкарбонате (DMC) или EC/этилметилкарбонате (EMC)/DMC, а также 1M NaPF 6 в EC-DMC-PC-EA, также используются (Qian et al. , 2014; Vali et al., 2014; Yue et al., 2020). Однако следует учитывать, что добавление ЭХ приводит к снижению электрохимической стабильности электролитов, особенно при более низких напряжениях (Yue et al., 2020). Из-за разного механизма хранения стабильность электролита в батареях и суперконденсаторах существенно различается независимо от их сходного состава: в то время как напряжение разложения LiPF 6 /(EC+EMC+DMC) в литий-ионных аккумуляторах выше 4 В; тот же электролит разлагается в ячейках суперконденсаторов выше 3,0 В (Pasquier et al., 2004; Hu et al., 2009). Все вышеперечисленные особенности свидетельствуют о том, что органические электролиты являются мощным средством повышения энергетической плотности ЭС. Несмотря на разнообразие экспериментальных данных, роль органического электролита в работе суперконденсатора все еще обсуждается.
, 2014; Vali et al., 2014; Yue et al., 2020). Однако следует учитывать, что добавление ЭХ приводит к снижению электрохимической стабильности электролитов, особенно при более низких напряжениях (Yue et al., 2020). Из-за разного механизма хранения стабильность электролита в батареях и суперконденсаторах существенно различается независимо от их сходного состава: в то время как напряжение разложения LiPF 6 /(EC+EMC+DMC) в литий-ионных аккумуляторах выше 4 В; тот же электролит разлагается в ячейках суперконденсаторов выше 3,0 В (Pasquier et al., 2004; Hu et al., 2009). Все вышеперечисленные особенности свидетельствуют о том, что органические электролиты являются мощным средством повышения энергетической плотности ЭС. Несмотря на разнообразие экспериментальных данных, роль органического электролита в работе суперконденсатора все еще обсуждается.
Здесь мы демонстрируем роль неводных электролитов лития и натрия для достижения высокой плотности энергии симметричных суперконденсаторов на основе коммерческого углерода, полученного из биомассы. В качестве электролитов использовали 1М LiBF 4 и 1M растворы LiPF 6 в этиленкарбонате/диметилкарбонате (EC/DMC = 1:1), а также 1M NaPF 6 в PC. Оба электролита LiPF -6- и NaPF -6- характеризуются высокой ионной проводимостью по сравнению с электролитом LiBF -4- (Ponrouch et al., 2015; Li et al., 2016). В качестве углерода, полученного из биомассы, используется коммерческий продукт YP-50F («Kuraray Europe» GmbH), полученный из кокосовых орехов. Эти продукты, обладающие большим количеством кислотных функциональных групп и узким распределением пор по размерам, являются предметом исследования, поскольку они демонстрируют великолепную циклическую стабильность в водных электролитах LiOH и NaOH (Караманова и др., 2020). Взаимодействие между углеродными электродами из биомассы и органическим электролитом исследовано на основе post mortem сканирующая электронная микроскопия (SEM)/энергодисперсионная рентгеновская спектроскопия (EDS) и рентгеновская фотоэлектронная спектроскопия (XPS) анализ электродов после циклирования клеток.
В качестве электролитов использовали 1М LiBF 4 и 1M растворы LiPF 6 в этиленкарбонате/диметилкарбонате (EC/DMC = 1:1), а также 1M NaPF 6 в PC. Оба электролита LiPF -6- и NaPF -6- характеризуются высокой ионной проводимостью по сравнению с электролитом LiBF -4- (Ponrouch et al., 2015; Li et al., 2016). В качестве углерода, полученного из биомассы, используется коммерческий продукт YP-50F («Kuraray Europe» GmbH), полученный из кокосовых орехов. Эти продукты, обладающие большим количеством кислотных функциональных групп и узким распределением пор по размерам, являются предметом исследования, поскольку они демонстрируют великолепную циклическую стабильность в водных электролитах LiOH и NaOH (Караманова и др., 2020). Взаимодействие между углеродными электродами из биомассы и органическим электролитом исследовано на основе post mortem сканирующая электронная микроскопия (SEM)/энергодисперсионная рентгеновская спектроскопия (EDS) и рентгеновская фотоэлектронная спектроскопия (XPS) анализ электродов после циклирования клеток.
Экспериментальная часть
Для изготовления электродов для элементов суперконденсаторов использовали коммерческий активированный уголь (YP-50F, «Kuraray Europe» GmbH). Электроды были составлены из смеси 80 мас. % YP-50F, 10 мас. % графита ABG 1005 EG-1 и 10 мас. % связующего из поливинилидендифторида (ПВДФ). Электроды сушили в вакууме при 80°С в течение 12 ч и прессовали под давлением 20 МПа. Полученные электроды устанавливали в электрохимическую ячейку с сепаратором Whatman и заливали электролитом в сухом боксе в атмосфере аргона. Электрод сравнения был Li/Li + или Na/Na + . Симметричная ячейка суперконденсатора была собрана из двух одинаковых электродов и трех типов органических электролитов: 1М LiBF -4- и 1М LiPF -6- в ЭХ/ДМК и 1М NaPF -6- в ПК. Все измерения проводились при комнатной температуре.
Измерения циклической вольтамперометрии (ЦВА) проводили в трехэлектродной ячейке, в окне напряжения до 3,6 В и скорости сканирования от 1 до 100 мВс –1 .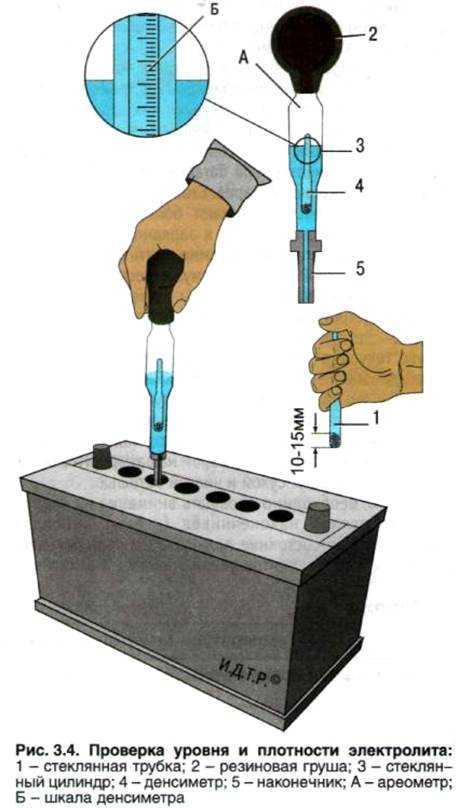 Эксперименты CV регистрировали на PAR Potentiostat/Galvanostat (США) и системе Multi PalmSens (модель 4, Нидерланды). Гальваностатические циклические испытания заряд-разряд проводили в двухэлектродной ячейке в режиме постоянного тока и токовой нагрузке от 60 до 600 мА·ч 9 .0015 –1 для 25 циклов на шаг. Все измерения выполнены на приборе Arbin Instrument System BT-2000 (США). Удельную емкость рассчитывали по циклическим вольтамперограммам и кривым заряда-разряда, как описано ранее (Караманова и др., 2019, 2020).
Эксперименты CV регистрировали на PAR Potentiostat/Galvanostat (США) и системе Multi PalmSens (модель 4, Нидерланды). Гальваностатические циклические испытания заряд-разряд проводили в двухэлектродной ячейке в режиме постоянного тока и токовой нагрузке от 60 до 600 мА·ч 9 .0015 –1 для 25 циклов на шаг. Все измерения выполнены на приборе Arbin Instrument System BT-2000 (США). Удельную емкость рассчитывали по циклическим вольтамперограммам и кривым заряда-разряда, как описано ранее (Караманова и др., 2019, 2020).
Изменения поверхности и морфологии углеродных электродов во время испытаний суперконденсаторов были проанализированы с помощью методов ex-situ SEM/EDS и XPS. РФЭС-спектры регистрировали с помощью электронного спектрометра AXIS Supra (Kratos Analytical Ltd., Великобритания) и ахроматического AlKα-излучения с энергией фотона 1486,6 эВ и системой нейтрализации заряда. Энергии связи (ЭС) определяли с точностью ± 0,1 эВ. Химический состав в глубине пленок определяли, контролируя площади и ОЭ фотоэлектронных пиков C1s, O1s и F1s. Используя коммерческое программное обеспечение для обработки данных Kratos Analytical Ltd., концентрации различных химических элементов (в атомных процентах) рассчитывали путем нормализации площадей пиков фотоэлектронов к их факторам относительной чувствительности.
Используя коммерческое программное обеспечение для обработки данных Kratos Analytical Ltd., концентрации различных химических элементов (в атомных процентах) рассчитывали путем нормализации площадей пиков фотоэлектронов к их факторам относительной чувствительности.
Краевой угол измеряется на приборе Force Tensiometer K100 фирмы KRÜSS K100 (Германия). Измерение заключается в капании 6,3 мкл электролита на электрод, а полученное значение угла смачивания усредняется из пяти измерений.
Результаты и обсуждение
На рис. 1 сравниваются ЦВА циклирования YP-50F в литиевом и натриевом электролитах. В целом все ВФХ типичны для симметричных суперконденсаторных систем. Однако необходимо обсудить некоторые дополнительные функции. Кривые CV в LiPF 9Электролит на основе 0174 6 демонстрирует резкий пик при низких скоростях сканирования при 0,50/0,15 В по сравнению с Li/Li + . Этот пик можно отнести к взаимодействию Li + с Al-собирателем (Hudak, Huber, 2011). Это специфическое свойство Al в электролите на основе LiPF 6 , которое не наблюдается в натриевых электролитах (рис. 1). В электролите LiBF 4 и ниже 0,5 В наблюдается сильное отклонение профилей ВФХ от прямоугольной формы, что свидетельствует о вкладе паразитного окислительно-восстановительного взаимодействия Li + с YP-50F и/или взаимодействие Li + с Al-собирателем. При высоких скоростях сканирования влияние окислительно-восстановительных пиков на профили CV-кривых незначительно, и все CV-кривые имеют черты емкостного поведения. Чтобы свести к минимуму влияние алюминиевого коллектора, на вставках того же рисунка показаны ВФХ, когда нижний предел напряжения превышает 1,0 В. В этом случае емкостное поведение лучше выражено в профилях ВФХ, которые выглядят похожими на прямоугольник. Сравнение профилей ВФХ YP-50F показывает, что оптимальные пределы напряжения зависят от состава электролита: для LiPF 9электролит на основе 0174 6 , диапазон 1,2–3,4 В по сравнению с Li/Li + ; 1,3–3,0 В по сравнению с Li/Li + для LiBF 4 ; и 1,0–3,6 В относительно Na/Na + в электролитах на основе NaPF 6 .
Это специфическое свойство Al в электролите на основе LiPF 6 , которое не наблюдается в натриевых электролитах (рис. 1). В электролите LiBF 4 и ниже 0,5 В наблюдается сильное отклонение профилей ВФХ от прямоугольной формы, что свидетельствует о вкладе паразитного окислительно-восстановительного взаимодействия Li + с YP-50F и/или взаимодействие Li + с Al-собирателем. При высоких скоростях сканирования влияние окислительно-восстановительных пиков на профили CV-кривых незначительно, и все CV-кривые имеют черты емкостного поведения. Чтобы свести к минимуму влияние алюминиевого коллектора, на вставках того же рисунка показаны ВФХ, когда нижний предел напряжения превышает 1,0 В. В этом случае емкостное поведение лучше выражено в профилях ВФХ, которые выглядят похожими на прямоугольник. Сравнение профилей ВФХ YP-50F показывает, что оптимальные пределы напряжения зависят от состава электролита: для LiPF 9электролит на основе 0174 6 , диапазон 1,2–3,4 В по сравнению с Li/Li + ; 1,3–3,0 В по сравнению с Li/Li + для LiBF 4 ; и 1,0–3,6 В относительно Na/Na + в электролитах на основе NaPF 6 .
Рис. 1. Кривые циклической вольтамперометрии симметричных ячеек суперконденсаторов в органических электролитах при различных скоростях развертки и пределах напряжения: (А) LiBF 4 (0,1–3,0 В), (Б) LiBF 4 ( 1,3–3,0 В), (C) LiPF 6 (0,1–3,0 В), (D) LiPF 6 (1,3–3,0 В), (E) NaPF 6 (0,1–3,0 В) и (F) NaPF 6 (1,0–3,6 В).
Из кривых CV удельная емкость (C sp, CV ) YP-50F рассчитывается по уравнению (1):
Csp,CV=Q△V⋅dvdt⋅m(1)
где Q — площадь под CV-кривой, d v /dt — частота сканирования, △ V — потенциальное окно, m — масса активного материала. Расчетные значения емкости в зависимости от скорости сканирования приведены на рис. 2.9.0005
Рис. 2. Удельная емкость (C sp , CV) в зависимости от скорости сканирования в различных органических электролитах и окнах потенциала при скоростях сканирования 1, 10, 25, 50 и 100 мВ·с – 1 .
YP-50F имеет более высокую емкость в электролите на основе LiBF 4 по сравнению с LiPF 6 . Емкость YP-50F в натриевом электролите приближается к емкости электролита на основе LiBF 4 . Стоит отметить, что в натриевом электролите диапазон напряжений шире, чем в литиевом электролите, что вносит свой вклад в плотность энергии суперконденсатора.
Гальваностатические испытания заряда-разряда проводятся для того, чтобы дополнительно дифференцировать характеристики YP-50F в литиевых и натриевых электролитах. Удельные емкости рассчитываются по следующему уравнению (Wang et al., 2017):
C=(IxΔt)/(mxΔV)(2)
, где I, Δt, m и ΔV обозначают ток разряда, время разряда, массу активного материала и напряжение окно.
Расчетная емкость YP-50F и ее зависимость от тока нагрузки показаны на рисунке 3. Здесь необходимо отметить несколько моментов. Во-первых, удельная емкость уменьшается с увеличением плотности тока, вероятно, из-за заметного усиления диффузионного ограничения внутри поровых каналов (Wang et al. , 2015). Зависимость скорости кажется одинаковой как для литиевых, так и для натриевых электролитов, когда используется широкий диапазон напряжений (между 0,1 и 3,0 В). В узком диапазоне напряжений (то есть между 0,6 и 2,4 В для литиевого электролита и между 0,1 и 2,6 В для натриевого электролита) скорость YP-50F значительно улучшается. Полученные значения емкости YP-50F в литий- и натрийорганических электролитах ниже, чем в водных электролитах (т.е. 6 М LiOH и 6 М NaOH) (Караманова и др., 2020): при токовой нагрузке 60 мА/г емкость около 80 Ф/г в LiBF 4 и NaPF 6 против 113 F/г и 108 F/г в LiOH и NaOH соответственно. Следует учитывать, что эти значения емкости достигаются в разном диапазоне напряжений: 1,8 В для LiPF 6 и LiBF 4 , 2,5 В для NaPF 6 и 1,2 В для водных электролитов. Это влияет на плотность энергии, которая обсуждается ниже:
, 2015). Зависимость скорости кажется одинаковой как для литиевых, так и для натриевых электролитов, когда используется широкий диапазон напряжений (между 0,1 и 3,0 В). В узком диапазоне напряжений (то есть между 0,6 и 2,4 В для литиевого электролита и между 0,1 и 2,6 В для натриевого электролита) скорость YP-50F значительно улучшается. Полученные значения емкости YP-50F в литий- и натрийорганических электролитах ниже, чем в водных электролитах (т.е. 6 М LiOH и 6 М NaOH) (Караманова и др., 2020): при токовой нагрузке 60 мА/г емкость около 80 Ф/г в LiBF 4 и NaPF 6 против 113 F/г и 108 F/г в LiOH и NaOH соответственно. Следует учитывать, что эти значения емкости достигаются в разном диапазоне напряжений: 1,8 В для LiPF 6 и LiBF 4 , 2,5 В для NaPF 6 и 1,2 В для водных электролитов. Это влияет на плотность энергии, которая обсуждается ниже:
Рис. 3. Разрядная емкость в зависимости от силы тока (A,C) и номера цикла (B,D) симметричных суперконденсаторов с YP-50F в разных электролитах.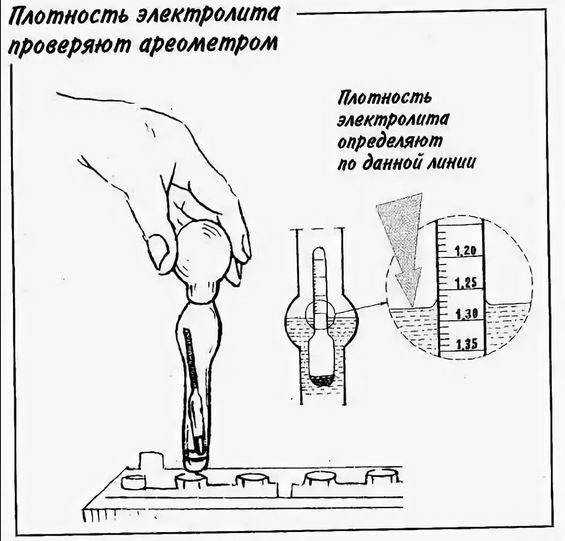
Среди органических электролитов при низкой плотности тока YP-50F, зацикленный в LiBF 4 , демонстрирует более высокую емкость, чем YP-50F в LiPF 6 . При высокой плотности тока эта тенденция меняется — емкости YP-50F в электролитах LiBF 4 и LiPF 6 практически одинаковы (рис. 3А). Замена лития натриевым электролитом не приводит к существенному изменению емкости YP-50F при слаботочной нагрузке. При увеличении токовой нагрузки емкость YP-50F в NaPF 6 убывает быстрее, чем YP-50F в литиевом электролите. Это означает, что в электролите NaPF 6 YP-50F показывает худшую скоростную способность. Наблюдаемый феномен может быть связан с различными размерами ионов Na + по сравнению с Li + и их совместимостью с размером пор YP-50F. На основе моделирования молекулярной динамики из первых принципов было рассчитано, что размеры первой сольватной оболочки ионов щелочных металлов в растворителе ЭК увеличиваются от Li + до Na + , т.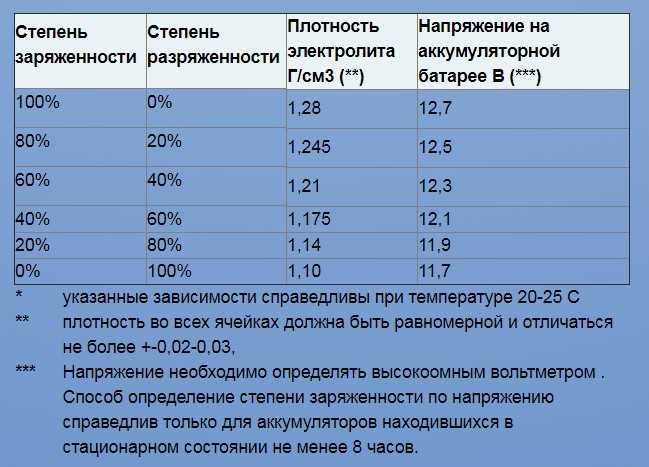 е. 1,95–2,34 Å (Cresce et al., 2017). Размеры пор YP-50F превышают 1 нм (Karamanova et al., 2019, 2020), а это означает, что они доступны для сольватированных ионов Li + и Na + . С другой стороны, больший размер сольватированных ионов Na + может быть связан с худшей скоростью реакции YP-50F в электролите NaPF 6 .
е. 1,95–2,34 Å (Cresce et al., 2017). Размеры пор YP-50F превышают 1 нм (Karamanova et al., 2019, 2020), а это означает, что они доступны для сольватированных ионов Li + и Na + . С другой стороны, больший размер сольватированных ионов Na + может быть связан с худшей скоростью реакции YP-50F в электролите NaPF 6 .
Стабильность при циклировании также различается при циклировании YP-50F в литиевом и натриевом электролитах (рис. 3). После 1000 циклов YP-50F характеризуется наивысшей циклической стабильностью, когда LiBF 9используется электролит 0174 4 (т.е. около 89%). Худшая устойчивость к циклированию наблюдается у YP-50F, циклированного в электролите на основе LiPF 6 (т.е. около 83%). В электролите NaPF 6 циклическая стабильность YP-50F колеблется в пределах 84%, что ниже, чем в электролите LiBF 4 . Примечательно, что и в водных электролитах устойчивость YP-50F к циклированию в натриевом электролите также хуже, чем в литиевом (т. е. 91–92 % в NaOH против 94% в LiOH) (Караманова и др., 2020). Кроме того, эффективность Колумба как в водных, так и в неводных электролитах составляет около 99–100%. Это означает, что ионная проводимость электролита и размеры ионов Li + и Na + не являются единственными факторами, влияющими на характеристики суперконденсатора.
е. 91–92 % в NaOH против 94% в LiOH) (Караманова и др., 2020). Кроме того, эффективность Колумба как в водных, так и в неводных электролитах составляет около 99–100%. Это означает, что ионная проводимость электролита и размеры ионов Li + и Na + не являются единственными факторами, влияющими на характеристики суперконденсатора.
Следующим фактором является смачиваемость электрода электролитом. Поэтому смачиваемость YP-50F органическими и водными электролитами (определяемая по краевому углу) указана в табл. 1. В целом органические электролиты лучше смачивают YP-50F по сравнению с водными электролитами. Будь то водный или органический электролит, смачиваемость YP-50F лучше в литиевом электролите, особенно в LiBF 9.0174 4 . Это может быть связано с улучшенными характеристиками YP-50F в электролите LiBF 4 .
Таблица 1. Контактные углы угольных электродов в водных и неводных литиевых и натриевых электролитах.
Чтобы получить представление о влиянии электролита на характеристики суперконденсатора, были проведены измерения ex-situ SEM и XPS.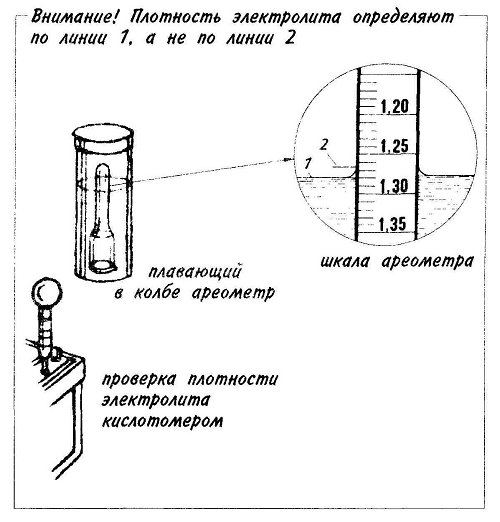 Для целей данного исследования электроды анализируются после измерения CV.
Для целей данного исследования электроды анализируются после измерения CV.
СЭМ-изображения исходного и циклированного электродов сравниваются на рис. 4. Сравнение показывает, что исходная морфология электрода, состоящая из относительно однородных и плотных связанных частиц, сохраняется в высокой степени при циклировании YP-50F в LiBF . 4 электролит. В электролите LiPF 6 морфология электрода претерпевает существенное изменение: появляются микротрещины, шероховатость электрода, по-видимому, увеличилась после циклирования ячейки. Это указывает на то, что LiPF 9Соль 0174 6 более агрессивна по отношению к YP-50F, чем LiBF 4 . В электролите NaPF 6 изменения морфологии являются промежуточными между таковыми для электролитов LiBF 4 и LiPF 6 : появляются трещины, но они менее выражены по сравнению с LiPF 6 . Это является экспериментальным свидетельством более низкой химической активности электролита NaPF 6 по отношению к YP-50F в симметричных суперконденсаторах, чем у электролита LiPF 6 .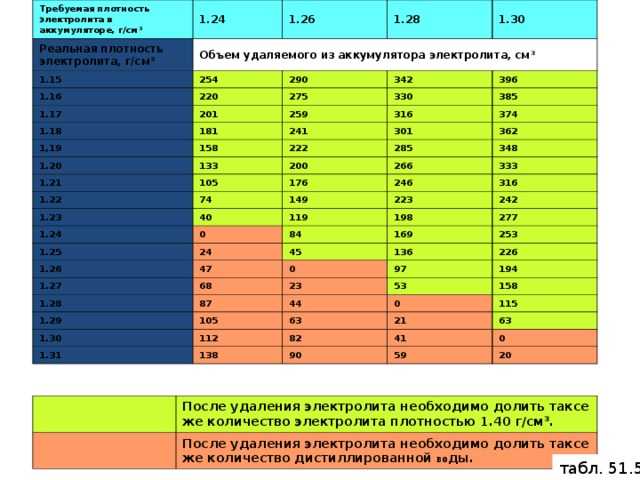 Химическая инертность LiBF 4 по отношению к YP-50F, а также превосходная смачиваемость YP-50F оказывает большое влияние на улучшенные характеристики суперконденсатора. Лучшая совместимость LiBF 4 с активированным углем можно сравнить с недавними выводами Metzger et al. (2020) о высоковольтной стабильности проводящего углерода с различными солями лития (Metzger et al., 2020). С помощью электрохимической масс-спектрометрии в режиме on-line показано, что соль LiBF 4 обладает большей стабильностью по отношению к проводящему углероду (даже при 50°C), чем соль LiPF 9.соль 0174 6 (Metzger et al., 2020). Это открытие относительно проводящего угля согласуется с нашим наблюдением относительно активированного угля.
Химическая инертность LiBF 4 по отношению к YP-50F, а также превосходная смачиваемость YP-50F оказывает большое влияние на улучшенные характеристики суперконденсатора. Лучшая совместимость LiBF 4 с активированным углем можно сравнить с недавними выводами Metzger et al. (2020) о высоковольтной стабильности проводящего углерода с различными солями лития (Metzger et al., 2020). С помощью электрохимической масс-спектрометрии в режиме on-line показано, что соль LiBF 4 обладает большей стабильностью по отношению к проводящему углероду (даже при 50°C), чем соль LiPF 9.соль 0174 6 (Metzger et al., 2020). Это открытие относительно проводящего угля согласуется с нашим наблюдением относительно активированного угля.
Рис. 4. Сканирующая электронная микроскопия исходного электрода переменного тока (A) , Электрод переменного тока после CV-теста в электролите LiBF 4 (B) , LiPF 6 электролит (45 , 9033) и электролит NaPF 6 (D) .
Другими параметрами, которые могут влиять на емкость YP-50F, являются функциональные группы. Недавно было продемонстрировано, что YP-50F имеет преимущественно основные функциональные группы (Karamanova et al., 2019)., 2020). Кроме того, кислотные группы, такие как фенольные, карбоксильные и лактонные группы, встречаются в небольших количествах (Караманова и др., 2019). При циклировании в щелочном электролите поверхность YP-50F обогащается карбоксильными группами (Караманова и др., 2019, 2020). Как правило, карбоксильные и гидроксильные группы депротонируются в щелочной среде, в то время как карбонильные группы участвуют в окислительно-восстановительных реакциях и вызывают псевдоемкость углеродистых материалов (Fraccowiak and Beguin, 2001; Fang et al., 2012). Следует отметить, что работ по химической активности функциональных групп в водном электролите много, а в органических электролитах работ мало. В этом исследовании мы изучаем поведение функциональных групп YP-50F в органических литий-натриевых электролитах с помощью XPS-спектроскопии (рис.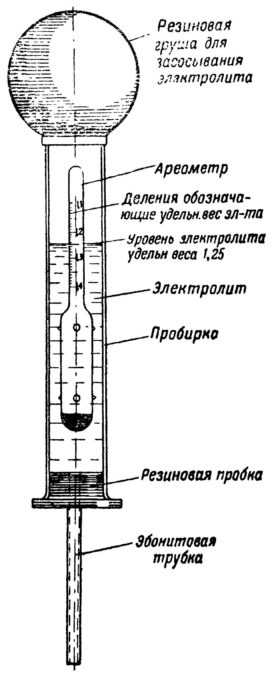 5). Спектр C1s исходного YP-50F состоит из интенсивного пика при 284,8 эВ, который исходит от sp 2 — углерод графитированный гибридный. Кроме того, низкоинтенсивные пики при 285,5, 287,0 и 288,8 эВ могут быть подвергнуты деконволюции. Эти пики связаны с атомами C, которые связаны с атомами кислорода в гидроксильных/эпоксидных группах (C-O), карбонильных группах (C=O) и карбоксильных группах (COOH). Эти назначения также поддерживаются спектром O1 оригинального YP-50F. Однако следует учитывать, что отнесение пиков O1s к соединениям O в литературе не является такой простой процедурой, как в случае спектров C 1 (Clark and Dilks, 19).79; Кунду и др., 2008). Независимо от этой неопределенности в спектре O1s наблюдаются два перекрывающихся пика при 531,5 и 533,0 эВ, которые могут быть отнесены к атомам кислорода с двойной связью в сложных эфирах, карбонатах и кислотах, а также к атомам кислорода с одинарной связью в кетонах, эфирах и спирты.
5). Спектр C1s исходного YP-50F состоит из интенсивного пика при 284,8 эВ, который исходит от sp 2 — углерод графитированный гибридный. Кроме того, низкоинтенсивные пики при 285,5, 287,0 и 288,8 эВ могут быть подвергнуты деконволюции. Эти пики связаны с атомами C, которые связаны с атомами кислорода в гидроксильных/эпоксидных группах (C-O), карбонильных группах (C=O) и карбоксильных группах (COOH). Эти назначения также поддерживаются спектром O1 оригинального YP-50F. Однако следует учитывать, что отнесение пиков O1s к соединениям O в литературе не является такой простой процедурой, как в случае спектров C 1 (Clark and Dilks, 19).79; Кунду и др., 2008). Независимо от этой неопределенности в спектре O1s наблюдаются два перекрывающихся пика при 531,5 и 533,0 эВ, которые могут быть отнесены к атомам кислорода с двойной связью в сложных эфирах, карбонатах и кислотах, а также к атомам кислорода с одинарной связью в кетонах, эфирах и спирты.
. ) и электролиты.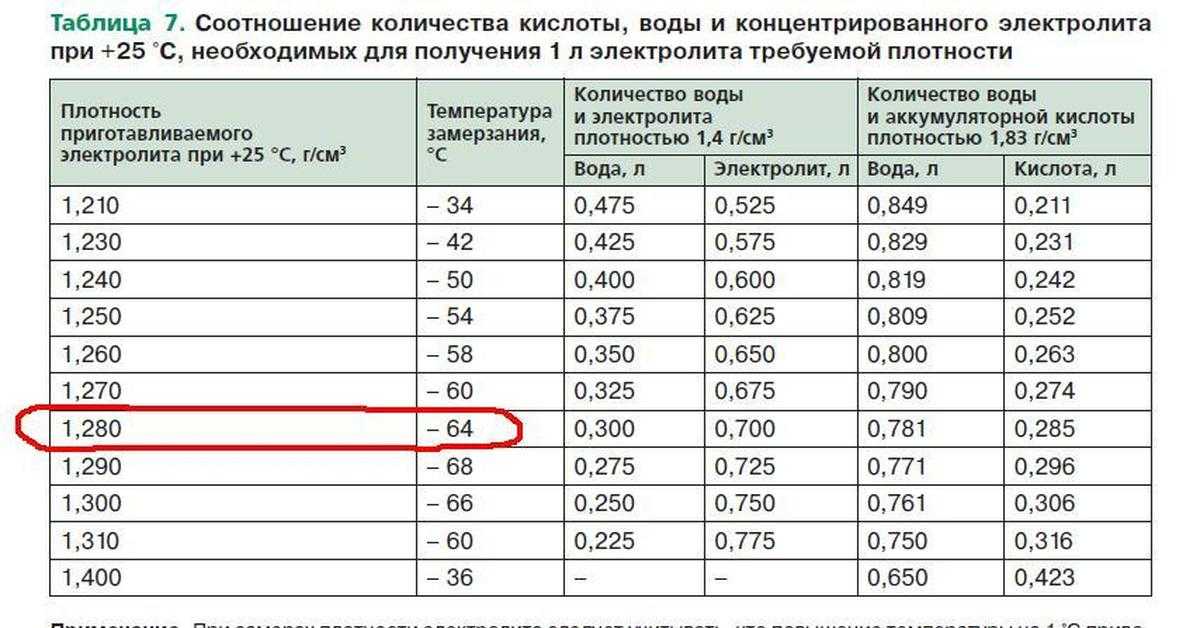
Цикл YP-50F в LiPF 6 и LiBF 4 приводит к обогащению поверхности электрода гидроксильными/эпоксидными группами (C-O) и карбонильными группами (C=O). Такое поведение функциональных групп противоположно наблюдаемому в водном литиевом электролите (т. е. 6M LiOH), где относительное количество карбоксильных групп значительно возрастает. По сравнению с литиевыми электролитами электролит NaPF -6- не вызывает каких-либо существенных взаимодействий с функциональными группами, что демонстрируют спектры C1s и O1s. Новую особенность здесь демонстрирует спектр F1s. Имеется пик при 683,6 эВ, обусловленный атомами F в NaF. Фториды также наблюдаются на поверхности YP-50F, подвергнутого циклированию в LiPF 9.0174 6 . Напротив, поверхность YP-50F свободна от фторидов в электролите LiBF 4 . Этот результат может быть связан с более высокой стабильностью LiBF 4 по сравнению с LiPF 6 и NaPF 6 .
Количество элементов в чистых и обработанных электродах определяется с помощью XPS и SEM/EDS. Совместное использование этих двух методов позволяет извлекать количественную информацию о химических элементах на разной глубине образцов: XPS дает химическую информацию только о нескольких верхних поверхностных слоях (т. более чем на 1000 глубже, чем XPS) (табл. 2).
Совместное использование этих двух методов позволяет извлекать количественную информацию о химических элементах на разной глубине образцов: XPS дает химическую информацию только о нескольких верхних поверхностных слоях (т. более чем на 1000 глубже, чем XPS) (табл. 2).
Таблица 2. Содержание элемента (ат. %) для YP-50F, определенное с помощью анализа РФЭС и СЭМ/ЭДС для чистых и обработанных электродов в различных электролитах после CV-испытаний.
Данные XPS и SEM-EDS показывают, что количество кислорода почти однородно распределено по глубине исходного YP-50F. После электрохимической реакции поверхность обогащается атомами кислорода и фтора. Важно, что поверхность электрода является самой бедной атомами O, F и Li при работе YP-50F в LiBF 9.0174 4 электролит. При этом электролите YP-50F обладает более высокими емкостными показателями.
Преимущество использования органических электролитов демонстрируется соотношением между плотностью энергии и удельной мощностью суперконденсаторов (СК) (графики Рагона, рис.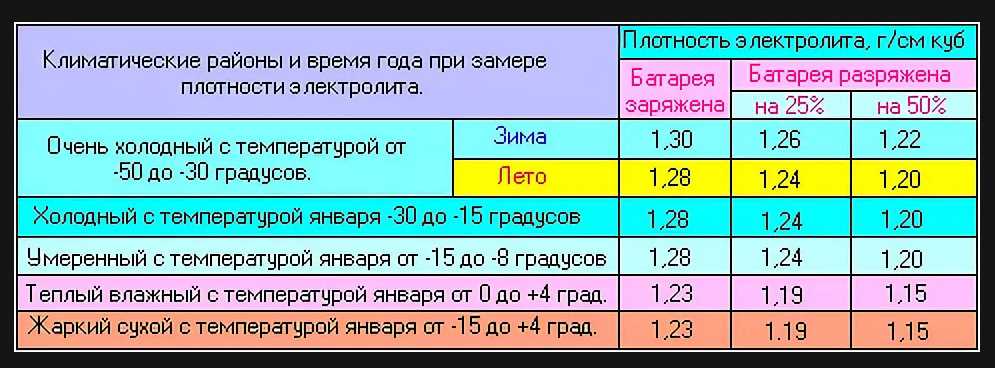 6). При удельной мощности 100 Вт·кг –1 СЭ, работающий в LiBF 4 , имеет удельную энергию 91,1 Вт⋅ч·кг –1 , что выше по сравнению с LiPF 6 и NaPF 6 9электролиты 0175. Важно, что плотность энергии суперконденсаторов с органическими электролитами сравнима, а в некоторых случаях и выше, чем ранее сообщалось (Mak et al., 2012; Zhong et al., 2015; Pazhamalai et al., 2019). Плотность энергии в органическом электролите в 3–4 раза выше, чем в электролитах LiOH и NaOH (т. е. при плотности мощности 100 Вт·кг·–1· его плотность энергии составляет около 21–22 Вт·кг·–1·). Из органических электролитов YP-50F работал в NaPF 9.Электролит 0174 6 показывает очень хорошее соотношение между энергией и плотностью мощности, что будет иметь значение для создания надежного суперконденсатора.
6). При удельной мощности 100 Вт·кг –1 СЭ, работающий в LiBF 4 , имеет удельную энергию 91,1 Вт⋅ч·кг –1 , что выше по сравнению с LiPF 6 и NaPF 6 9электролиты 0175. Важно, что плотность энергии суперконденсаторов с органическими электролитами сравнима, а в некоторых случаях и выше, чем ранее сообщалось (Mak et al., 2012; Zhong et al., 2015; Pazhamalai et al., 2019). Плотность энергии в органическом электролите в 3–4 раза выше, чем в электролитах LiOH и NaOH (т. е. при плотности мощности 100 Вт·кг·–1· его плотность энергии составляет около 21–22 Вт·кг·–1·). Из органических электролитов YP-50F работал в NaPF 9.Электролит 0174 6 показывает очень хорошее соотношение между энергией и плотностью мощности, что будет иметь значение для создания надежного суперконденсатора.
Рис. 6. График Рагона симметричных суперконденсаторов с YP-50F, работающих в органических и водных электролитах.
Заключение
Настоящее исследование показывает емкостные характеристики коммерческого углеродного продукта (YP-50F, «Kuraray Europe» GmbH), полученного из кокосовых орехов, в симметричных суперконденсаторах с использованием литиевых и натриевых органических электролитов. Обнаружено, что YP-50F обеспечивает более высокую плотность энергии, когда литиевый электролит, содержащий LiBF 4 используется соль. Этот электролит химически инертен по отношению к YP-50F. Наиболее агрессивным электролитом по отношению к YP-50F является электролит на основе LiPF 6 , что обуславливает более низкие плотности энергии и мощности. Взаимодействие электролитов на основе LiBF 4 — и LiPF 6 с функциональными группами приводит к обогащению поверхности электрода гидроксильными/эпоксидными и карбонильными группами. Для сравнения, в основном щелочном электролите на поверхности электрода преобладают карбоксильные группы (Караманова и др., 2019)., 2020). Натриевый электролит с солью NaPF 6 менее агрессивен по отношению к YP-50F, чем LiPF 6 , в результате чего в натриевом электролите наблюдаются хорошие емкостные характеристики. Полученные результаты являются хорошей предпосылкой для дальнейших исследований и более полного выяснения процессов, происходящих в различных органических электролитах.
Натриевый электролит с солью NaPF 6 менее агрессивен по отношению к YP-50F, чем LiPF 6 , в результате чего в натриевом электролите наблюдаются хорошие емкостные характеристики. Полученные результаты являются хорошей предпосылкой для дальнейших исследований и более полного выяснения процессов, происходящих в различных органических электролитах.
Заявление о доступности данных
Необработанные данные, подтверждающие выводы этой статьи, будут предоставлены авторами без неоправданных оговорок.
Вклад авторов
BK провел основной эксперимент и провел электрохимические испытания элементов суперконденсатора. MS, MG и TS участвовали в экспериментах, посвященных анализу ex-situ XPS и CV-характеристике YP-50F. А.С. и Р.С. участвовали в обсуждении экспериментальных результатов и пересмотре рукописи. Б.К., А.С. и Р.С. составили план исследования и написали рукопись. AS оказала финансовую поддержку. Все авторы внесли свой вклад в статью и одобрили представленную версию.
Финансирование
Работа выполнена при поддержке Болгарского национального научного фонда в рамках проекта DFNI κII-06-OIIP04/5 и частично Национальной дорожной карты для исследовательской инфраструктуры на 2017–2023 гг. «Хранение энергии и водородная энергетика (ESHER)», утвержденной ПКМ №354 от 29.08.2017.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы хотели бы поблагодарить профессора Олю Стойлову (Институт полимеров Болгарской академии наук) за измерение краевых углов YP-50F в органических и водных электролитах.
Ссылки
Bi, Z., Kong, Q., Cao, Y., Sun, G., Su, F., Wei, X., et al. (2019). Пористые углеродные материалы, полученные из биомассы, с различными размерами для электродов суперконденсаторов: обзор. Дж. Матер. хим. А 7, 16028–16045.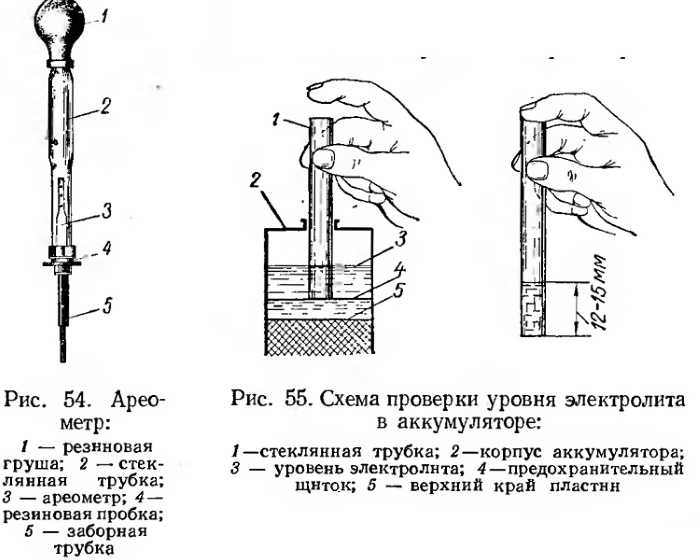 дои: 10.1039/C9TA04436A
дои: 10.1039/C9TA04436A
Полнотекстовая перекрестная ссылка | Google Scholar
Кальво, Э. Г., Рей-Раап, Н., Аренильяс, А., и Менендес, Дж. А. (2014). Влияние химии поверхности углерода и pH электролита на накопление энергии суперконденсаторами. RSC Adv. 4, 32398–32404. doi: 10.1039/C4RA04430D
Полный текст CrossRef | Google Scholar
Чен З., Ван Х., Дин З., Вэй К., Ван З., Ян Х. и др. (2019). Иерархический пористый углерод на основе биомассы для суперконденсаторов: влияние водных и органических электролитов на электрохимические характеристики. ChemSusChem 12, 5099–5110. doi: 10.1002/cssc.201
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Чмиола Дж., Юшин Г., Гогоци Ю., Портет К., Саймон П. и Таберна П. Л. (2006). Аномальное увеличение углеродной емкости при размерах пор менее 1 нанометра. Наука 313, 1760–1763. doi: 10.1126/science.1132195
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Кларк Д. Т. и Дилкс А. (1979). ESCA применяется к полимерам. 23. Модификация полимеров тлеющим разрядом ВЧ в смесях чистого кислорода и гелия с кислородом. Ж. Полим. науч. Полим. хим. 17, 957–976. doi: 10.1002/pol.1979.170170404
Т. и Дилкс А. (1979). ESCA применяется к полимерам. 23. Модификация полимеров тлеющим разрядом ВЧ в смесях чистого кислорода и гелия с кислородом. Ж. Полим. науч. Полим. хим. 17, 957–976. doi: 10.1002/pol.1979.170170404
CrossRef Full Text | Google Scholar
Кресе А.В.В., Рассел С., Бородин О.А., Аллен Дж.Л., Шредер М., Дай М. и др. (2017). Сольватационное поведение электролитов на основе карбонатов в натрий-ионных батареях. Физ. хим. хим. физ. 19, 574–586. doi: 10.1039/C6CP07215A
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Этачери В., Маром Р., Элазари Р., Салитра Г. и Аурбах Д. (2011). Проблемы разработки перспективных литий-ионных аккумуляторов: обзор. Энергетика Окружающая среда. науч. 4, 3243–3262. doi: 10.1039/C1EE01598B
CrossRef Полный текст | Google Scholar
Fang, Y., Luo, B., Jia, Y., Li, X., Wang, B., Song, Q., et al. (2012). Обновление функционализированного графена в качестве электродов для высокопроизводительных суперконденсаторов. Доп. Матер. 24, 6348–6355. doi: 10.1002/adma.201202774
Доп. Матер. 24, 6348–6355. doi: 10.1002/adma.201202774
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Фраковяк Э. и Бегин Ф. (2001). Углеродные материалы для электрохимического накопления энергии в конденсаторах. Углерод 39, 937–950. doi: 10.1016/S0008-6223(00)00183-4
CrossRef Full Text | Google Scholar
Hu, X., Deng, Z., Suo, J. и Pan, Z. (2009). Высокая скорость, большая емкость и долгий срок службы (LiMn 2 O 4 + AC)/Li 4 Ti 5 O 12 гибридная батарея-суперконденсатор. Дж. Источники питания 187, 635–639. doi: 10.1016/j.jpowsour.2008.11.033
CrossRef Полный текст | Google Scholar
Худак Н. и Хубер Д. (2011). Наноструктурированные электроды из литий-алюминиевого сплава для литий-ионных аккумуляторов. ЭКС Транс. 33, 1–13. doi: 10.1149/1.3557706
Полный текст CrossRef | Google Scholar
Караманова Б., Стоянова А. , Шипочка М., Гиргинов К. и Стоянова Р. (2019). О циклической стабильности углеродов, полученных из биомассы, в качестве электродов в суперконденсаторах. J. Alloys Compd. 803, 882–890. doi: 10.1016/j.jallcom.2019.06.334
, Шипочка М., Гиргинов К. и Стоянова Р. (2019). О циклической стабильности углеродов, полученных из биомассы, в качестве электродов в суперконденсаторах. J. Alloys Compd. 803, 882–890. doi: 10.1016/j.jallcom.2019.06.334
Полный текст CrossRef | Google Scholar
Караманова Б., Стоянова А., Шипочка М., Велева С. и Стоянова Р. (2020). Влияние щелочно-основных электролитов на емкостные характеристики углеродистых соединений, полученных из биомассы. Материалы 13, 2941–2952. doi: 10.3390/ma13132941
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Кунду С., Ван Ю. М., Ся В. и Мюлер М. (2008). Термическая стабильность и способность к восстановлению кислородсодержащих функциональных групп на поверхности многослойных углеродных нанотрубок: количественное исследование РФЭС с высоким разрешением и ТПД/ТПВ. J. Phys. хим. C 112, 16869–16878. doi: 10.1021/jp804413a
CrossRef Полный текст | Google Scholar
Li, Q.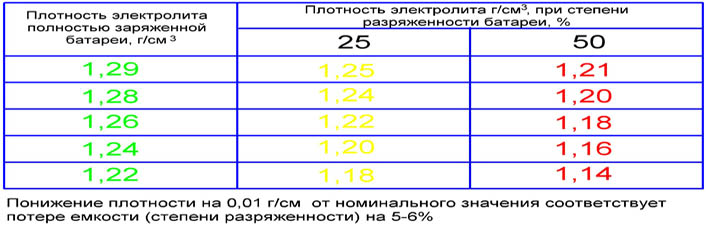 , Chen, J., Fan, L., Kong, X. и Lu, Y. (2016). Прогресс в области электролитов для аккумуляторных батарей на основе лития и не только. Зеленая энергия окружающей среды. 1, 18–42. doi: 10.1016/j.gee.2016.04.006
, Chen, J., Fan, L., Kong, X. и Lu, Y. (2016). Прогресс в области электролитов для аккумуляторных батарей на основе лития и не только. Зеленая энергия окружающей среды. 1, 18–42. doi: 10.1016/j.gee.2016.04.006
CrossRef Полный текст | Google Scholar
Мак В. Ф., Ви Г., Аравиндан В., Гупта Н., Мхайсалкар С. Г. и Мадхави С. (2012). Асимметричный суперконденсатор с высокой плотностью энергии на основе электроформованного пятиокиси ванадия и полианилиновых нановолокон в водном электролите. Дж. Электрохим. соц. 159, А1481–А1488.
Google Scholar
McDonough, J.K., Frolov, A.I., Presser, V., Niu, J., Miller, C.H., Ubieto, T., et al. (2012). Влияние структуры углеродных луковиц на их электрохимические характеристики в электродах суперконденсаторов. Углерод 50, 3298–3309. doi: 10.1016/j.carbon.2011.12.022
CrossRef Полный текст | Google Scholar
Мецгер М., Валке П., Зольхенбах С., Салитра Г., Аурбах Д. и Гастайгер Х. А. (2020).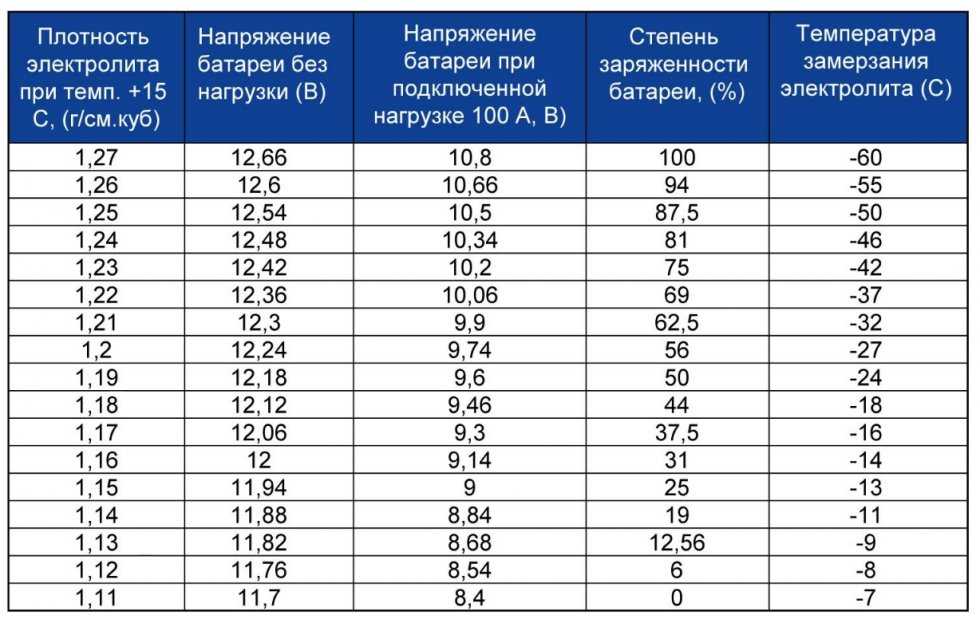 Оценка высоковольтной стабильности проводящего углерода и этиленкарбоната с различными солями лития. Дж. Электрохим. соц. 167:160522. doi: 10.1149/1945-7111/abcabd
Оценка высоковольтной стабильности проводящего углерода и этиленкарбоната с различными солями лития. Дж. Электрохим. соц. 167:160522. doi: 10.1149/1945-7111/abcabd
CrossRef Full Text | Google Scholar
Паскье А.Д., Плитц И., Гураль Дж., Бадуэй Ф. и Аматуччи Г.Г. (2004). Батарея Power-ion: преодоление разрыва между литий-ионной и суперконденсаторной химией. Дж. Источники питания 136, 160–170. doi: 10.1016/j.jpowsour.2004.05.023
CrossRef Полный текст | Google Scholar
Пажамалай П., Кришнамурти К., Манохаран С. и Ким С. Дж. (2019). Высокоэнергетический симметричный суперконденсатор на основе механически расслоенных малослойных листов MoS2 в органическом электролите. J. Alloys Compd. 771, 803–809. doi: 10.1016/j.jallcom.2018.08.203
CrossRef Полный текст | Google Scholar
Phattharasupakun, N., Wutthiprom, J., Suktha, P., Iamprasertkun, P., Chanlek, N., Shepherd, C., et al. (2017). Высокопроизводительные суперконденсаторы из модифицированных карбоксилатом полых углеродных наносфер, нанесенных на гибкую бумагу из углеродного волокна: влияние содержания кислородсодержащих групп, электролитов и рабочей температуры.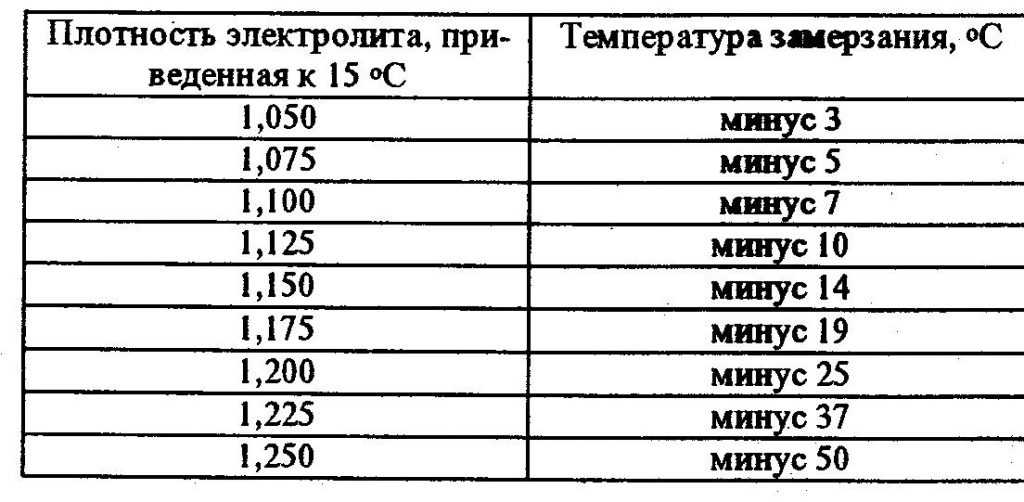 Электрохим. Acta 238, 64–73. doi: 10.1016/j.electacta.2017.03.208
Электрохим. Acta 238, 64–73. doi: 10.1016/j.electacta.2017.03.208
CrossRef Полный текст | Google Scholar
Понроуч А., Монти Д., Бощин А., Стин Б., Йоханссон П. и Паласин М. Р. (2015). Неводные электролиты для натрий-ионных аккумуляторов. Дж. Матер. хим. А 3, 22–42. doi: 10.1039/C4TA04428B
Полный текст CrossRef | Google Scholar
Qian, W.J., Sun, F.X., Xu, Y.H., Qiu, L.H., Liu, C.H., Wang, S.D., et al. (2014). Углеродные хлопья из человеческого волоса для электрохимических суперконденсаторов. Энергетика Окружающая среда. науч. 7, 379–386. doi: 10.1039/C3EE43111H
Полный текст CrossRef | Google Scholar
Раффорд Т. Е., Хуликова-Юрчакова Д., Чжу З. и Лу Г. К. (2008). Нанопористый углеродный электрод из отходов кофейных зерен для высокоэффективных суперконденсаторов. Электрохим. коммун. 10, 1594–1597. doi: 10.1016/j.elecom.2008.08.022
Полный текст CrossRef | Google Scholar
Саймон П. и Гогоци Ю.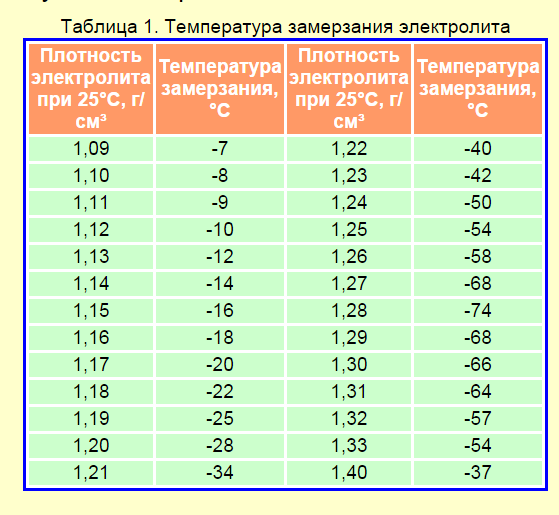 (2008). Материалы для электрохимических конденсаторов. Нац. Матер. 7, 845–854. doi: 10.1038/nmat2297
(2008). Материалы для электрохимических конденсаторов. Нац. Матер. 7, 845–854. doi: 10.1038/nmat2297
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Вали Р., Лахеар А., Джейнс А. и Ласт Э. (2014). Характеристики смеси неводных четвертичных растворителей и электролитов суперконденсаторов на основе солей натрия в широком диапазоне температур. Электрохим. Acta 121, 294–300. doi: 10.1016/j.electacta.2013.12.149
CrossRef Полный текст | Google Scholar
Ван, Г. П., Чжан, Л., и Чжан, Дж. Дж. (2012). Обзор электродных материалов для электрохимических суперконденсаторов. Хим. соц. Ред. 41, 797–828. doi: 10.1039/C1CS15060J
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Ван Х., Лю Дж., Чжан К., Пэн Х. и Ли Г. (2015). Мезо/микропористые азотсодержащие углеродные нановолокна с улучшенными характеристиками электрохимической емкости. Синтез. Встретились. 203, 149–155. doi: 10.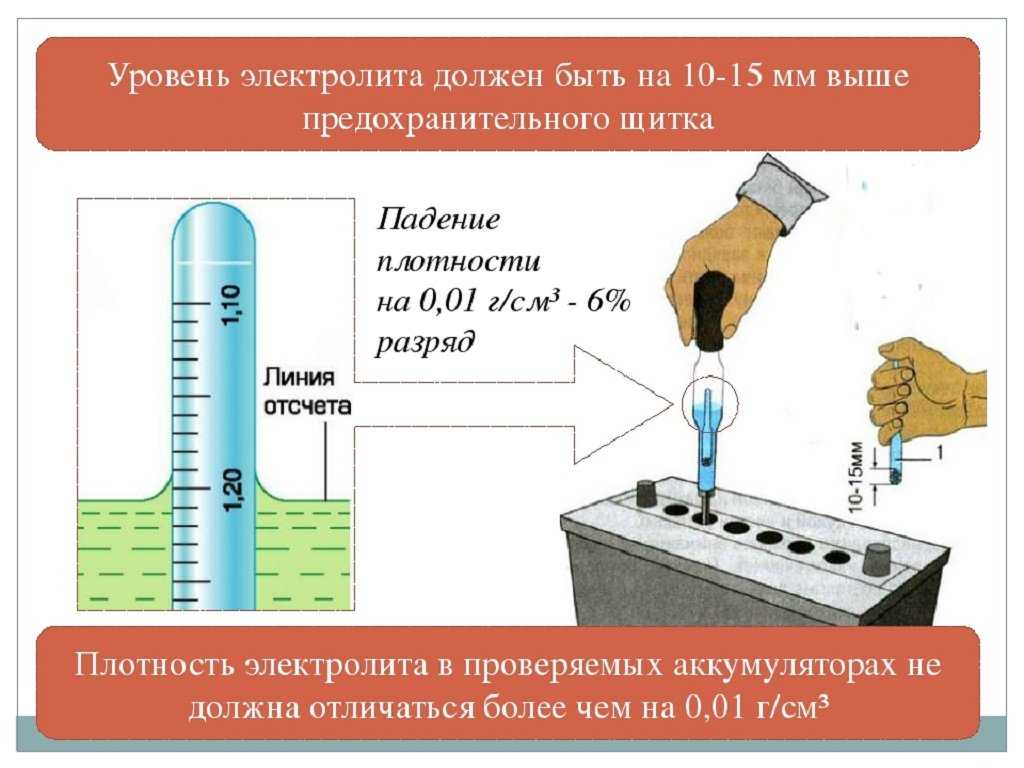 1016/j.synthmet.2015.02.013
1016/j.synthmet.2015.02.013
CrossRef Полный текст | Google Scholar
Ван, Т., Чжан, С., Ян, X., Лю, М., Ван, Белл, Дж., и др. (2017). Слоистые двойные гидроксидные нанолисты Ni-Co, полученные из 2-метилимидазола, в качестве материала для хранения высокой скорости и высокой плотности энергии в гибридных суперконденсаторах. Приложение ACS Матер. Интерфейсы 9, 15510–15524. doi: 10.1021/acsami.7b02987
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Ян К.М., Ким Ю.Дж., Эндо М., Канох Х., Юдасака М., Иидзима С. и др. (2007). Регулируемая наноокном удельная емкость электродов суперконденсаторов одностенных углеродных нанорогов. утра. хим. соц. 129, 20–21. doi: 10.1021/ja065501k
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Юэ З., Дуня Х., Ашури М., Кучук К., Арьял С., Антонов С. и др. (2020). Синтез активного угля с очень высокой удельной площадью поверхности и его электрических конденсаторных свойств с двойным слоем в органических электролитах. ХимИнжиниринг 4:43. doi: 10.3390/chemengineering4030043
ХимИнжиниринг 4:43. doi: 10.3390/chemengineering4030043
CrossRef Полный текст | Google Scholar
Чжун К., Дэн Г., Ху Х., Цяо Дж., Чжан Л. и Чжан Дж. (2015). Обзор электролитных материалов и композиций для электрохимических суперконденсаторов. Хим. соц. Ред. 44, 7484–7539. doi: 10.1039/C5CS00303B
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Новая конструкция аккумуляторной батареи с электролитом
Исследователи преодолевают трудности в разработке магниево-кальциевых батарей с помощью нового принципа конструкции.
ДЛЯ НЕМЕДЛЕННОГО ВЫПУСКА 8 октября 2021 г.
КОНТАКТЫ:
Кэти Холланд
301 405 0379
[email protected]
Аккумуляторные электролиты с использованием хелатообразователей на основе аминов, сольватирующих двухвалентные катионы, продемонстрировали стабильное и хорошо обратимое покрытие/удаление металлического Mg с изображениями сканирующей электронной микроскопии (СЭМ) зацикленного анода Mg, показанного слева, вместе с репрезентативной сольватной оболочкой катиона Mg2+ . Авторы и права: Нина Бородин, Сингюк Хоу, Сяо Цзи для UMD.
Авторы и права: Нина Бородин, Сингюк Хоу, Сяо Цзи для UMD.
Образ выпуска
Энергия, содержащаяся в литий-ионных батареях, может изменить технологию поля боя будущего, создавая во всем мире спрос на основные материалы для литий-ионных батарей, такие как литий, кобальт и никель, что создает проблемы с поставками для будущего производства.
Исследователи из Университета Мэриленда (UMD) и Командования по развитию боевых возможностей армии США, известного как DEVCOM, Армейская исследовательская лаборатория, разработали передовой аккумуляторный электролит, который может открыть новые возможности для многообещающих альтернатив, таких как перезаряжаемые магниево-металлические батареи. Подробное исследование этой новой аккумуляторной технологии было опубликовано в Science от 8 октября.
«Магния значительно больше, чем лития, что должно удовлетворить потребности постоянно растущего рынка аккумуляторов», — сказал Олег Бородин, армейский химик-вычислитель. «Низкий окислительно-восстановительный потенциал и большая емкость металлического магниевого анода также потенциально могут обеспечить плотность энергии, сравнимую или даже большую, чем у литий-ионных аккумуляторов в сочетании с высоковольтными оксидными катодами».
«Низкий окислительно-восстановительный потенциал и большая емкость металлического магниевого анода также потенциально могут обеспечить плотность энергии, сравнимую или даже большую, чем у литий-ионных аккумуляторов в сочетании с высоковольтными оксидными катодами».
Бородин также пояснил, что по сравнению с литием магний образует меньше дендритов, что эксперты называют основной причиной проблем с безопасностью литий-ионных аккумуляторов.
Несмотря на эти преимущества, батареи из магниевого металла по-прежнему сталкиваются со многими проблемами, которые мешают их развитию. Одна из основных проблем связана с сильной реакцией магния на обычные электролиты во время работы батареи — оба электрода должны быть совместимы с электролитом, чтобы батарея достигла достаточной плотности энергии.
В качестве материала анода магний имеет тенденцию вызывать коррозию электролита и создавать толстое покрытие вокруг анода.
В то время как аналогичные покрытия в литий-ионных батареях обеспечивают диффузию ионов лития и защищают электролит от дальнейшего разложения, это покрытие блокирует магниевое покрытие и предотвращает протекание необходимых электрохимических реакций.
Пытаясь решить эту проблему, исследовательская группа UMD под руководством Чуншэна Вана, профессора химического машиностроения и директора Центра исследований экстремальных аккумуляторов, разработала новую стратегию проектирования, включающую новый класс растворителей.
К их удивлению, конструкция электролита не только предотвратила процесс коррозии, но и значительно увеличила кинетику реакции как анода, так и катода, повысив общую производительность батареи.
«Предыдущие электролиты могли покрывать магний, но у них было много недостатков, — сказал Ван. «Это исследование решило эту проблему с помощью нового электролита, который позволил наносить покрытие из металлического магния, а также использовать катоды с более высоким напряжением. Это первый раз, когда магниевая батарея теоретически достигла такой же плотности энергии, как литий-ионная батарея».
Исследователи также обнаружили, что они могут применить тот же принцип проектирования к другим материалам, подпадающим под категорию двухвалентных металлов, а не только к магнию.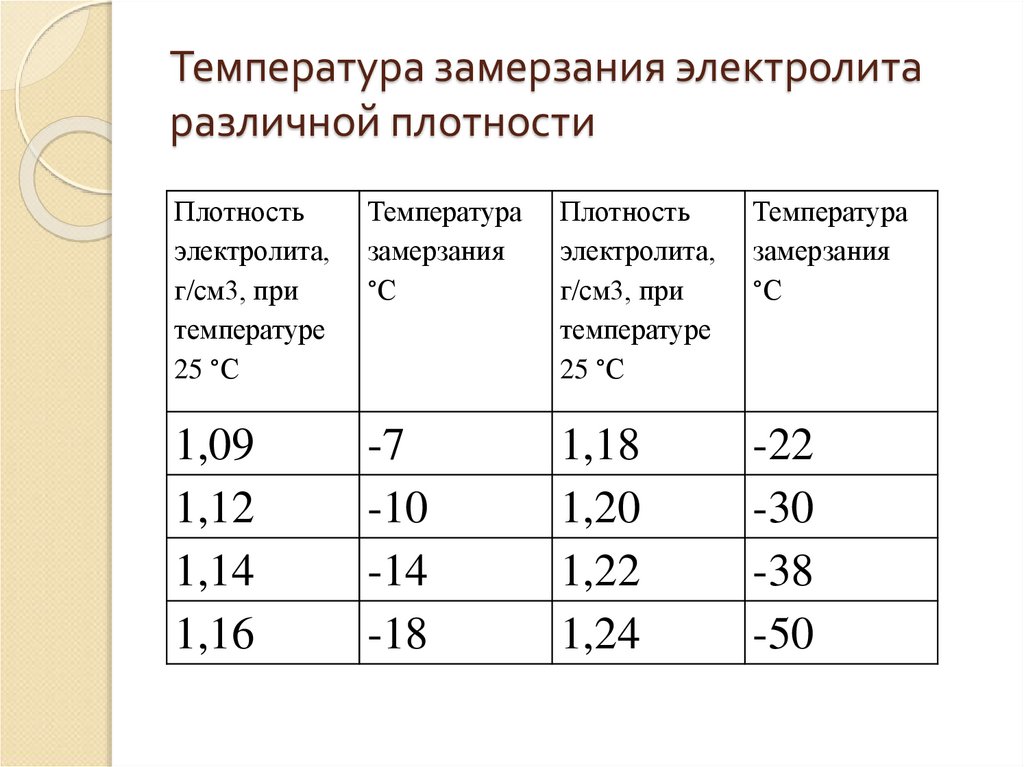
В своем эксперименте новая стратегия дизайна электролита позволила исследователям обойти часто встречающиеся проблемы как с перезаряжаемыми металлическими магниевыми, так и с кальциево-металлическими батареями.
«Испытание с кальцием показывает, что эта конструкция электролита может быть распространена на другие типы мультивалентных батарей с низким потенциалом и расширяет выбор электродных материалов в целом», — сказал Сингюк Хоу, аспирант UMD и соавтор исследования. . «Люди особенно интересуются кальцием, потому что потенциал кальциевого анода даже ниже, чем у магниевого, а кальция в земной коре очень много».
Армейские исследователи в основном поддержали исследование с помощью расчетов теории функционала плотности (DFT), которые помогли команде понять, почему новый электролит привел к этим улучшениям, и направить поиск новых электролитов.
«Армия помогла нам понять механизм того, что именно произошло», — сказал Ван. «У нас есть знания об этом явлении, но предоставленные ими расчеты сыграли важную роль в демонстрации этой технологии и того, что мы должны сделать дальше, чтобы улучшить ее».
По словам Вана, команда планирует оптимизировать электролит, а затем преобразовать концепцию в крупногабаритный силовой элемент.
Бородин объяснил, что эта новая стратегия проектирования может означать настоящий прорыв для двухвалентных металлических батарей после двух десятилетий исследований, сопряженных с проблемами, связанными с недостаточной плотностью энергии, вызванной несовместимостью электрод-электролит. Это продвижение может изменить то, как армия в будущем снабжает энергией солдат на поле боя.
Перейдите по этой ссылке, чтобы подготовить исследование по науке.
О Инженерной школе им. А. Джеймса Кларка
Инженерная школа им. А. Джеймса Кларка Университета Мэриленда — ведущая программа, входящая в число 20 лучших в мире. Школа Кларка, расположенная всего в нескольких милях от Вашингтона, округ Колумбия, находится в центре созвездия высокотехнологичных компаний и федеральных лабораторий, предлагая студентам и преподавателям доступ к уникальным профессиональным возможностям. Разное
Разное


 Для этого пользуются паяльной лампой или паяльником;
Для этого пользуются паяльной лампой или паяльником; Так как при переизбытке жидкости в батареи электролит может вытекать через отверстия в пробках, что приводит к повышенной утечке тока аккумулятора.
Так как при переизбытке жидкости в батареи электролит может вытекать через отверстия в пробках, что приводит к повышенной утечке тока аккумулятора.