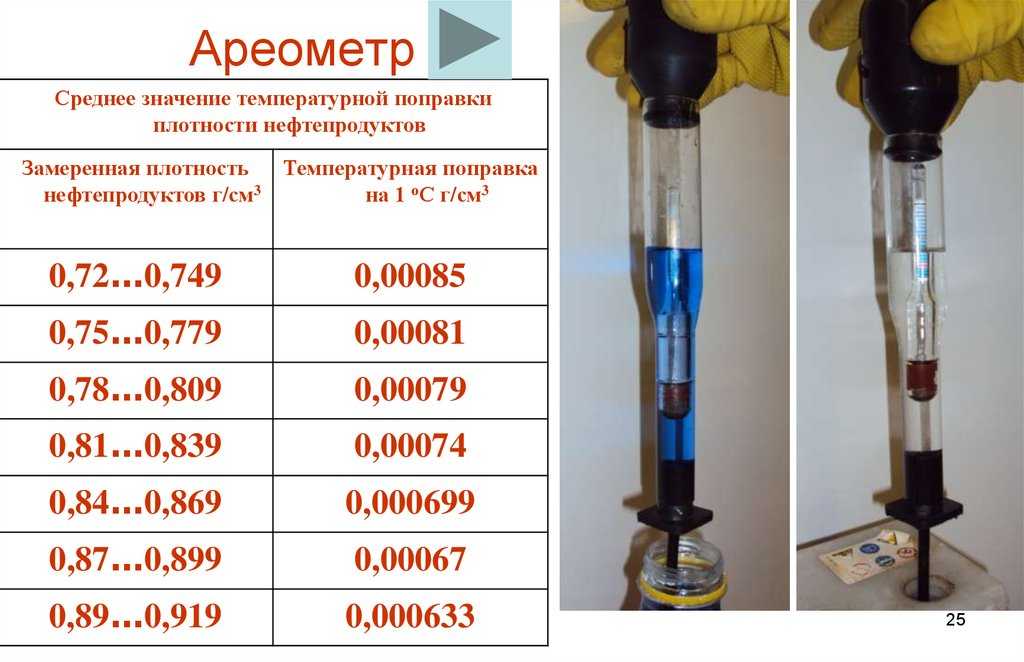
Температурные поправки к показаниям денсиметра для приведения плотности электролита к 25°с
Задание
1. Ознакомиться с правилами техника безопасности.
2. Изучить теоретические основы физико-химических процессов, происходящих а свинцово-кислотном аккумуляторе.
3. Изучить содержание операций технического обслуживания аккумуляторных
батарей
4. Проверить техническое состояние аккумуляторной батареи (АКБ).
5. Разработать технологическую карту (по заданию преподавателя).
6. Убрать рабочее место, составить отчет о проделанной работе и защитить работу.
Оборудование, приборы и инструмент
1. Аккумуляторные батареи (АКБ).
2. Выпрямитель переменного тока.
3. Комплект приспособлений и приборов для ТО АКБ.
4. Литература, плакаты.
Правила техники безопасности
В
процессе зарядки АК5 выделяется, водород,
который образует с кислородом воздуха
гремучий газ, легко взрывающийся при
наличии искры.
Малогабаритные аккумуляторные батареи можно переносить вручную, но при этом необходимо использовать захваты или носилки и соблюдать меры предосторожности во избежание обливания электролитом.
Приготовлять кислотный электролит нужно в специальных сосудах (керамических, пластмассовых). При этом необходимо сначала налить дистиллированную воду, а затем в нее влить кислоту. Переливать кислоту допускается только при помощи качалок, сифонов и других приспособлений. Перед заливкой, доливкой и приготовлением электролита аккумуляторщику следует надевать защитные очки и резиновые перчатки.
При
зарядке аккумуляторных батарей необходимо
выполнять следующие правила: соединять
аккумуляторные батареи между собой
плотно прилегающими (пружинными)
зажимами (для кислотных аккумуляторных
батарей), или плоскими наконечниками
(для щелочных АКБ), имеющими надежный
электрический контакт, исключающий
возможность искрения; контролировать
ход зарядки только при помощи термометра,
ареометра, нагрузочной вилки или других
специальных приборов; не наклоняться
близко к аккумуляторам во избежание
ожога брызгами кислоты, вылетающими из
отверстия аккумулятора.
Плавить свиней и заполнять им формы при отливке деталей аккумуляторов разрешается только в вытяжных шкафах. При плавке свинца в расплавленную массу нельзя класть пластины, использованные в аккумуляторах. Все работы по ремонту батарей, связанные с прикосновением со свинцом и его окислами, должны производиться только в резиновых перчатках.
В
аккумуляторном отделении должны иметься
умывальник, мыло, вата в упаковке,
полотенце и закрытые сосуды с 5- и 10%-ным
нейтрализующим раствором питьевой соды
(для кожи тела) и 2-3%-ным нейтрализующим
раствором питьевой соды (для глаз). При
эксплуатации щелочных аккумуляторов
f.
качестве
нейтрализующего раствора применяют
5-10%-ный раствор борной кислоты (для кожи
тела) и 2-3%-ный раствор той же кислоты
(для глаз). При попадании кислоты, щелочи
или электролита на открытые части тела
во избежание ожога необходимо немедленно
промыть этот участок тела сначала
нейтрализующим раствором, а затем водой
с мылом. Электролит, пролитый на стеллажи,
рекомендуется вытереть ветошью, смоченной
в 10%-г’см3 и дистиллированной золы. Однако
растворение концентрированной серной
кислоты а воде сопровождается выделением
большого количества тепла. По этой
причине для приготовления электролита
применяется посуда, стойкая не только
к действию серной кислоты, но и к высокой
температуре (керамическая, пластмассовая,
эбонитовая, свинцовая). В сосуд для
приготовления электролита сначала
заливается зола, а затем при непрерывном
помешивании серная кислота. Вливать
волу а концентрированную серную кислоту
запрещается, так как при вливании волы
в кислот)’ происходит быстрое разогревание
воды, она нагревается, вскипает и
разбрызгивается вместе с кислотой,
которая, попадая на кожу человека,
вызывает ожоги.
Однако
растворение концентрированной серной
кислоты а воде сопровождается выделением
большого количества тепла. По этой
причине для приготовления электролита
применяется посуда, стойкая не только
к действию серной кислоты, но и к высокой
температуре (керамическая, пластмассовая,
эбонитовая, свинцовая). В сосуд для
приготовления электролита сначала
заливается зола, а затем при непрерывном
помешивании серная кислота. Вливать
волу а концентрированную серную кислоту
запрещается, так как при вливании волы
в кислот)’ происходит быстрое разогревание
воды, она нагревается, вскипает и
разбрызгивается вместе с кислотой,
которая, попадая на кожу человека,
вызывает ожоги.
Плотность
электролита, применяемого для приготовления
в действие стартерных аккумуляторных
батарей, может быть от 1,20 до 1,28.
Используется так же раствор плотностью
1,40 г/см3,
который применяется как промежуточный
при приготовлении электролита необходимой
плотности и когда необходимо повысить
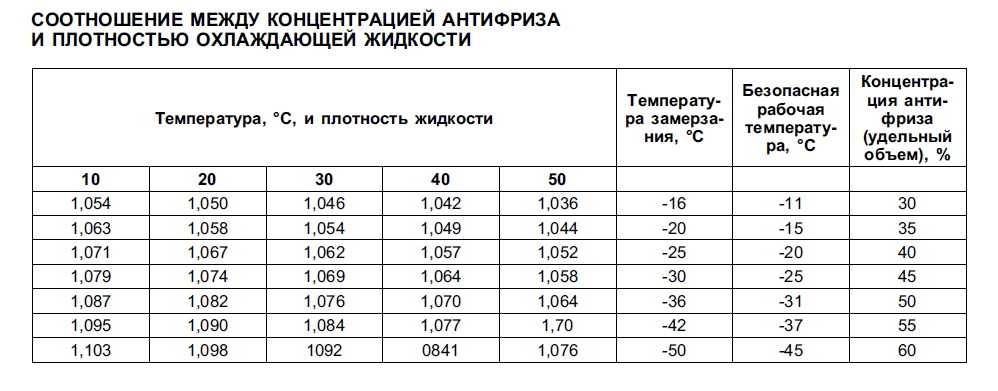
плотность электролита в аккумуляторе.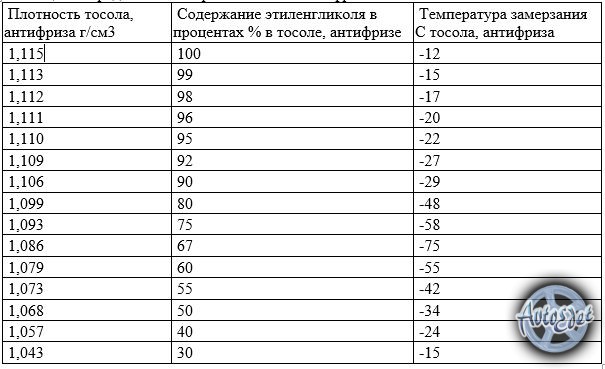
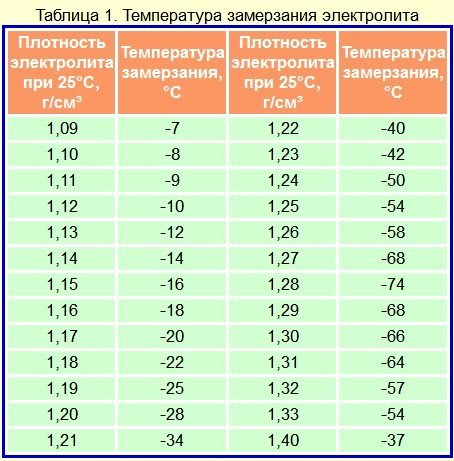
Из табл. 2 видно, что при использовании концентрированной серной кислоты объем раствора получается меньше суммы объемов компонентов. Это явление называется «усадкой» электролита, а проявляется сильнее с повышением плотности раствора. При применении для приготовления раствора электролита плотностью 1,40 г/см’ явление «усадки» сказывается незначительно и им можно пренебречь.
Плотность электролита определяется денсиметром с резиновой грушей. Одновременно с замером плотности замеряется температура электролита. Плотность электролита приводится к 25°С. В зависимости от температуры электролита показания денсиметра корректируются поправкой (табл.3).
Таблица 2
Соотношение
количества кислоты, воды и концентрированного
электролита при +250С
для получения 1 л электролита требуемой
плотности.
Требуемая плотность | Температура | Объем, л | Объем, л | ||
приготавливаемого электролита при +25°С, г/с | Замерзания, 0С | Воды | Электролита
плотностью
1,4
г/см | Воды | Электролита плотностью 1,4 г/см’ |
1,210 | -34 | 0,475 | 0,525 | 0,849 | 0,211 |
1,230 | -42 | 0,425 | 0,575 | 0,829 | 0,231 |
1,240 | -50 | 0,400 | 0,600 | 0,819 | 0,242 |
1,240 | -54 | 0,375 | 0,625 | 0,809 | 0,252 |
1,260 | -58 | 0,350 | 0,650 | 0,800 | 0,263 |
1,270 | -60 | 0,325 | 0,675 | 0,790 | 0,274 |
1,280 | -64 | 0,300 | 0,700 | 0,781 | 0,285 |
1,290 | -68 | 0,275 | 0,725 | 0,771 | 0,296 |
1,300 | -66 | 0,250 | 0,750 | 0,761 | 0,306 |
1,310 | -60 | 0,225 | 0,775 | 0,750 | 0,316 |
1,400 | -36 | — | 1,000 | 0,650 | 0,423 |
Примечание.
При замерах плотности электролита следует учитывать, что повышение температуры на 1°С приводит к снижению плотности электролита на 0,0007 г/см3, а понижение температуры электролита на 1°С, наоборот,- к увеличению плотности электролита на 0,0007 г/см3 (исходной считается температура +25°С).
Таблица 3
Температура электролита. 0С | Поправка, г/см |
-65…-50 | -0.06 |
-49…-35 | -0,05 |
-34…-20 | -0,04 |
-19. | -0.03 |
-4…+ 10 | -0,02 |
+ 11…+25 | -0,01 |
+26…+40 | +0,01 |
+0,02 |
Температура электролита, заливаемого р. АКБ, должна быть не выше 30 0С и не ниже 15°С. Плотность электролита, заливаемого в АКБ, зависит от климатического района, в котором эксплуатируется автомобиль.
Непосредственно
перед заливкой электролита вывертываются
вентиляционные пробки и удаляют
летали, герметизирующие вентиляционные
отверстия. Если в горловине под пробкой
имеется герметизирующий диск, его
необходимо удалить. Затем постепенно
небольшой струей заливаю! электролит,
до тех пор, пока поверхность электролита
не коснется нижнего торца тубуса
горловины крышки.
Затем постепенно
небольшой струей заливаю! электролит,
до тех пор, пока поверхность электролита
не коснется нижнего торца тубуса
горловины крышки.
■ Таблица 4
Климатические районы по Гост16350-80 (среднемесячная температура воздуха в январе) | Плотность электролита, приведенная к 25оС,г/см3 | |||
Врем года | Заливается при приведении батарей в действие | В плотностью заряженной батарей | ||
Очень холодный (-5О — ЗО°С) Холодный (-3O — I50С)’ Умеренный (-15. Жаркий сухой (+4.- 15°С) Теплый влажный (0 – 40С) | Зима лото Круглый год То же -«- -«- | 1,28 1,24 1,26 1,24 1,21 1,21 | 1,30 1,26 1,28 1,26 1,23 1,23 | |
Примечание:
Допускаются
отклонения плотности электролита от
значений, приведенных в таблице, на
±0,01 г/см3.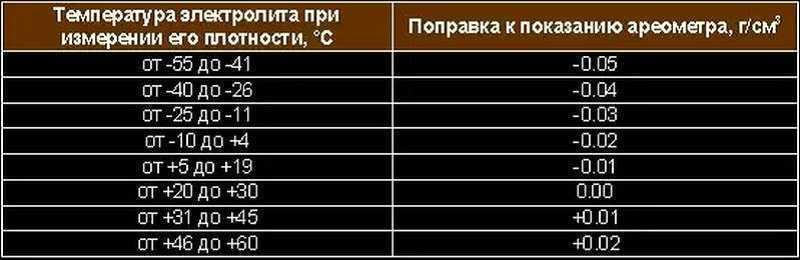
У сухозаряженных батарей сохранение сухозаряженности зависит от длительности и условий их хранения. Для определения потери сухозаряженностн после заливки электролита в промежутке времени от 20 мин до 2 ч производится контроль плотности электролита. Если снижение плотности заливаемого электролита не превышает 0,03 г/см3, батарея может быть сдана в эксплуатацию.
При снижении плотности электролита более 0,03 г/см3 батарею следует зарядить. Обязательному заряду подлежат так же несухозаряженные батареи.
При необходимости срочного ввода в эксплуатацию сухозаряженных батарей допускается установка их на автомобили без контроля плотности электролита. Такой способ возможен, если батареи хранились не более 1 года и температура электролита и батарей не ниже 15°С.
В
особых случаях батареи, хранящиеся при
отрицательных температурах до -30°.С,
допускается заливать электролитом
температурой 40°.С и плотностью 1,27
г/см3.
После 1 ч выдержки, если батарея хранилась
не более 1 года, дальнейшие операции
производятся как при обычном приведении
батареи в действие.
В случаях срочного ввода в эксплуатацию после возвращения автомобиля с линии батарею необходимо зарядить и довести плотность электролита до необходимой величины.
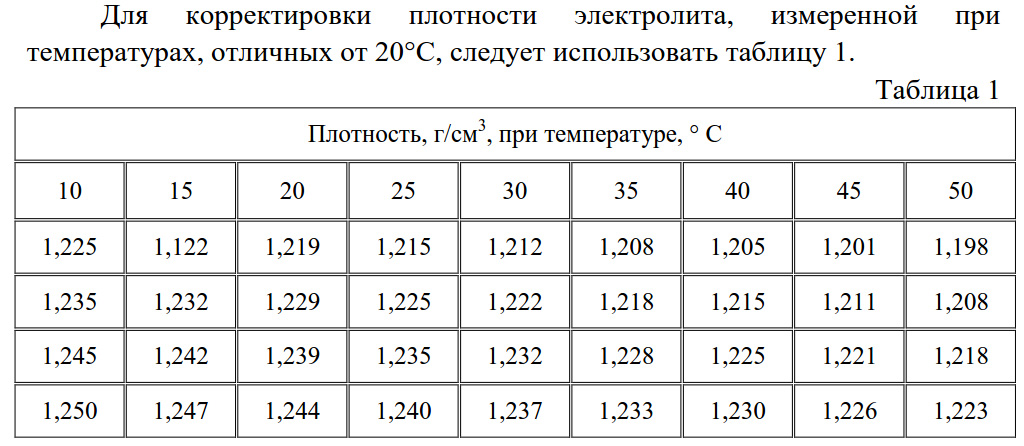
Температурная поправка к показаниям ареометра при измерении плотности электролита
Температура электролита,С | Поправка, г/см3 |
от –40 до –26 от –25 до –11 от –10 до +4 от +5 до +19 от +20 до +30 от +31 до +45 | –0,04 –0,03 –0,02 –0,01 0,00 +0,01 |
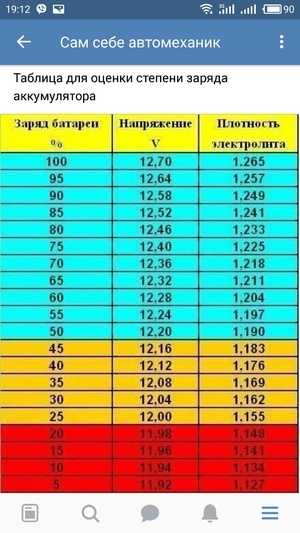
После
определения плотности электролита в
каждом элементе батареи, устанавливается
степень ее разряженности по таблице
7-4. Батарею, разряженную более, чем на
25% зимой и более, чем на 50% летом, снимите
с автомобиля и подзарядите.
Батарею, разряженную более, чем на
25% зимой и более, чем на 50% летом, снимите
с автомобиля и подзарядите.
Таблица 7-4
Плотность электролита при 25с, г/см3
Климатический район (средняя месячная температура воздуха в январе, С) | Время года | Полностью заряженная батарея | Батарея разряжена на 25% на 50% | |
Очень холодный (от –50 до –30) | Зима | 1,30 | 1,26 | 1,22 |
Лето | 1,28 | 1,24 | 1,20 | |
Холодный (от –30 до –15) | Круглый год | 1,28 | 1,24 | 1,20 |
Умеренный (от –15 до –8) | Круглый год | 1,28 | 1,24 | 1,20 |
Теплый влажный (от 0 до +4) | Круглый год | 1,23 | 1,19 | 1,15 |
Жаркий сухой (от –15 до +4) | Круглый год | 1,23 | 1,19 | 1,15 |
Во
время измерения плотности следите за
тем, чтобы на поверхность батареи, кузов
и другие детали с пипетки не падали
капли электролита, содержащие серную
кислоту, которая вызывает коррозию,
утечки тока и т. д.
д.
Чтобы не получить неправильных результатов, не замеряйте плотность электролита:
если его уровень не соответствует норме;
если электролит слишком горячий или холодный; оптимальная температура при измерении плотности 15–27С;
после доливки дистиллированной воды. Следует выждать, пока электролит перемешается; если батарея разряжена, то для этого может потребоваться даже несколько часов;
после нескольких включений стартера. Надо подождать, чтобы установилась равномерная плотность электролита в элементе батареи;
при «кипящем» электролите. Следует переждать, пока пузырьки в электролите, набранном в пипетку ареометра, поднимутся на поверхность.
Зарядка аккумуляторной батареи
Снятую с автомобиля батарею аккуратно очистите, особенно ее верхнюю часть, проверьте уровень электролита и при необходимости доведите его до нормы.
Батарея
заряжается силой тока 5,5 А при вывернутых
пробках.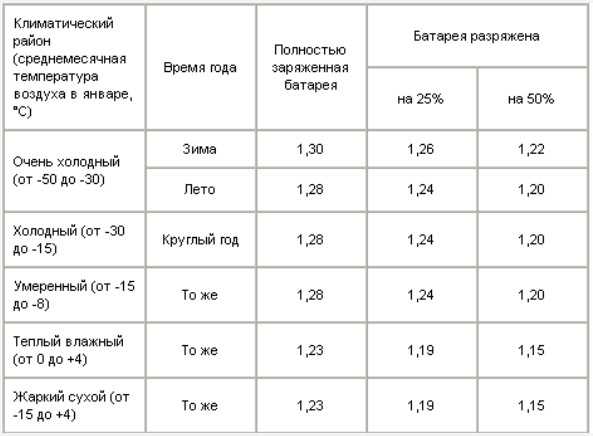 Зарядка проводится до начала
обильного газовыделения и достижения
постоянства напряжения и плотности
электролита в течение 3 часов. Плотность
электролита заряженной батареи при
25С
должна соответствовать данным таблицы
7-4 для каждого климатического района.
Зарядка проводится до начала
обильного газовыделения и достижения
постоянства напряжения и плотности
электролита в течение 3 часов. Плотность
электролита заряженной батареи при
25С
должна соответствовать данным таблицы
7-4 для каждого климатического района.
При зарядке батареи необходимо периодически проверять температуру электролита и не допускать ее повышения свыше 40С. Если температура достигнет 40С, то следует уменьшить наполовину зарядный ток или прервать зарядку и охладить батарею до 27С.
Зарядка прекращается, когда начнется обильное выделение газа во всех элементах батареи, а напряжение и плотность электролита в течение последних трех замеров (производимых через 1 ч) будут оставаться постоянными.
Если
в конце зарядки плотность электролита
(определенная с учетом температурной
поправки) отличается от указанной, то
откорректируйте ее. При повышенной
плотности отберите часть электролита
и долейте дистиллированной воды. Если
плотность электролита ниже нормы, то
отобрав его из элемента, долейте
электролит повышенной плотности (1,4
г/см3).
После корректировки плотности электролита продолжите зарядку батареи еще в течение 30 мин для перемешивания электролита. Затем отключите батарею и через 30 мин замерьте его уровень во всех элементах. Если уровень электролита окажется ниже нормы, то долейте электролит с плотностью, соответствующей данному климатическому району (см. табл. 7-4). Если уровень электролита выше нормы – отберите его избыток резиновой грушей.
Генератор
Плотности и кажущиеся молярные объемы атмосферно важных растворов электролитов. 1. Растворенные вещества h3SO4, HNO3, HCl, Na2SO4, NaNO3, NaCl, (Nh5)2SO4, Nh5NO3 и Nh5Cl от 0 до 50 °С, включая экстраполяции до очень низких температур и до чистого жидкого состояния, и NaHSO4, NaOH, и Nh4 при 25 °C
. 2011 21 апреля; 115 (15): 3393-460.
дои: 10.1021/jp108992a.
Epub 2011 25 марта.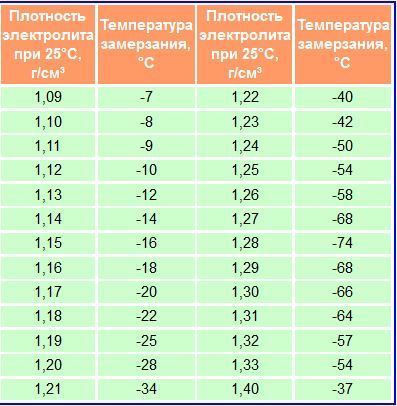
С Л Клегг 1 , A S Wexler
принадлежность
- 1 Школа наук об окружающей среде, Университет Восточной Англии, Норидж, Великобритания.
- PMID: 21438504
- DOI: 10.1021/jp108992а
S L Clegg et al. J Phys Chem А. .
. 2011 21 апреля; 115 (15): 3393-460.
дои: 10.1021/jp108992a.
Epub 2011 25 марта.
Авторы
С Л Клегг 1 , А. С. Векслер,
принадлежность
- 1 Школа наук об окружающей среде, Университет Восточной Англии, Норидж, Великобритания.
- PMID: 21438504
- DOI: 10.1021/jp108992a
Абстрактный
Расчеты размеров и плотности атмосферных аэрозолей осложняются тем, что они могут существовать в концентрациях, сильно пересыщенных по растворенным солям и переохлажденных по отношению ко льду. Плотности и кажущиеся молярные объемы растворенных веществ в водных растворах, содержащих растворенные вещества H(2)SO(4), HNO(3), HCl, Na(2)SO(4), NaNO(3), NaCl, (NH(4) )(2)SO(4), NH(4)NO(3) и NH(4)Cl были критически оценены и представлены с использованием подгоночных уравнений от 0 до 50 °C или выше и от бесконечного разбавления до насыщенных или перенасыщенных концентраций. по отношению к растворенным солям. Используя экстраполированные плотности высокотемпературных растворов и расплавов, связь между плотностью и концентрацией распространяется на гипотетические чистые жидкие растворенные вещества. Наблюдается, что выше заданной эталонной концентрации в несколько моль кг (-1) плотность увеличивается почти линейно с понижением температуры, а сравнение с доступными данными при температуре ниже 0 ° C позволяет предположить, что подобранные уравнения для плотности могут быть экстраполированы на очень низкие температуры. . Когда концентрация снижается ниже эталонной концентрации, изменение плотности с температурой имеет тенденцию к изменению плотности воды (которое уменьшается при снижении температуры ниже 3,9).8°С). В этой области ниже эталонной концентрации и ниже 0 °C плотности рассчитываются с использованием экстраполированных кажущихся молярных объемов, которые должны согласовываться при эталонных концентрациях с уравнением для непосредственно подобранной плотности.
по отношению к растворенным солям. Используя экстраполированные плотности высокотемпературных растворов и расплавов, связь между плотностью и концентрацией распространяется на гипотетические чистые жидкие растворенные вещества. Наблюдается, что выше заданной эталонной концентрации в несколько моль кг (-1) плотность увеличивается почти линейно с понижением температуры, а сравнение с доступными данными при температуре ниже 0 ° C позволяет предположить, что подобранные уравнения для плотности могут быть экстраполированы на очень низкие температуры. . Когда концентрация снижается ниже эталонной концентрации, изменение плотности с температурой имеет тенденцию к изменению плотности воды (которое уменьшается при снижении температуры ниже 3,9).8°С). В этой области ниже эталонной концентрации и ниже 0 °C плотности рассчитываются с использованием экстраполированных кажущихся молярных объемов, которые должны согласовываться при эталонных концентрациях с уравнением для непосредственно подобранной плотности. Рассчитанные объемные свойства хорошо согласуются с имеющимися данными при низких температурах как для концентрированных, так и для разбавленных растворов. Сравнения сделаны с литературными данными для температур максимальной плотности. Кажущиеся молярные объемы при бесконечном разбавлении согласуются, в расчете на один ион, лучше, чем ±0,1 см(3) моль(-1) от 0 до 50 °C. Объемные свойства водных растворов NaHSO(4), NaOH и NH(3) также были оценены только при 25 °C. В части 2 этой работы (ссылка 1) модель ионного взаимодействия (Питцера) использовалась для расчета кажущихся молярных объемов H(2)SO(4) в 0-3 моль кг(-1) водных растворах чистой кислоты. и представить непосредственно влияние реакции HSO(4)(-) ↔ H(+) + SO(4)(2-). Результаты включены в описанную здесь обработку плотности водного раствора H(2)SO(4). Плотности и кажущиеся молярные объемы от -20 до 50 °C и от 0 до 100 мас. % растворенного вещества приведены в таблице для электролитов, перечисленных в заголовке, и также включены в расширенную модель неорганических аэрозолей (E-AIM, http: //www.
Рассчитанные объемные свойства хорошо согласуются с имеющимися данными при низких температурах как для концентрированных, так и для разбавленных растворов. Сравнения сделаны с литературными данными для температур максимальной плотности. Кажущиеся молярные объемы при бесконечном разбавлении согласуются, в расчете на один ион, лучше, чем ±0,1 см(3) моль(-1) от 0 до 50 °C. Объемные свойства водных растворов NaHSO(4), NaOH и NH(3) также были оценены только при 25 °C. В части 2 этой работы (ссылка 1) модель ионного взаимодействия (Питцера) использовалась для расчета кажущихся молярных объемов H(2)SO(4) в 0-3 моль кг(-1) водных растворах чистой кислоты. и представить непосредственно влияние реакции HSO(4)(-) ↔ H(+) + SO(4)(2-). Результаты включены в описанную здесь обработку плотности водного раствора H(2)SO(4). Плотности и кажущиеся молярные объемы от -20 до 50 °C и от 0 до 100 мас. % растворенного вещества приведены в таблице для электролитов, перечисленных в заголовке, и также включены в расширенную модель неорганических аэрозолей (E-AIM, http: //www. aim.env.uea.ac.uk/aim/aim.php) вместе с плотностью твердых солей и гидратов.
aim.env.uea.ac.uk/aim/aim.php) вместе с плотностью твердых солей и гидратов.
Похожие статьи
Плотности и кажущиеся молярные объемы атмосферно важных растворов электролитов. 2. Системы H(+)-HSO4(-)-SO4(2-)-h3O от 0 до 3 моль кг(-1) в зависимости от температуры и H(+)-Nh5(+)-HSO4(- )-SO4)2-)-h3O от 0 до 6 моль кг(-1) при 25 °C с использованием модели взаимодействия ионов Питцера, а также Nh5HSO4-h3O и (Nh5)3H(SO4)2-h3O во всем диапазоне концентраций .
Клегг С.Л., Векслер А.С. Клегг С.Л. и соавт. J Phys Chem A. 21 апреля 2011 г.; 115 (15): 3461-74. дои: 10.1021/jp1089933. Epub 2011 25 марта. J Phys Chem A. 2011. PMID: 21438500
Поверхностное натяжение неорганических многокомпонентных водных растворов и расплавов электролитов.

Датчер К.С., Векслер К.С., Клегг С.Л. Датчер С.С. и соавт. J Phys Chem A. 25 ноября 2010 г.; 114 (46): 12216-30. дои: 10.1021/jp105191з. Epub 2010 2 ноября. J Phys Chem A. 2010. PMID: 21043484
Зависимая от температуры термодинамическая модель системы H(+)-NH₄(+)-Na(+)-SO₄²⁻-NO₃⁻-Cl⁻-H₂O.
Фризе Э., Эбель А. Фризе Э. и др. J Phys Chem A. 4 ноября 2010 г .; 114 (43): 11595-631. дои: 10.1021/jp101041j. J Phys Chem A. 2010. PMID: 21504090
Раскрытие основы неидеального поведения биологических молекул.
Рёсген Дж., Петтит Б.М., Болен Д.В. Рёсген Дж. и соавт. Биохимия. 2004 16 ноября; 43 (45): 14472-84. doi: 10.1021/bi048681o. Биохимия. 2004. PMID: 15533052 Обзор.

Растворимость в водных растворах нитратов, которые, по-видимому, меняют закон действующих масс.
Рейнольдс Дж.Г. Рейнольдс Дж.Г. Phys Chem Chem Phys. 2021 6 октября; 23 (38): 21407-21418. дои: 10.1039/d1cp03124d. Phys Chem Chem Phys. 2021. PMID: 34553199 Обзор.
Посмотреть все похожие статьи
Цитируется
Динамика ионного спаривания в разбавленных водных растворах HCl по спектроскопическим измерениям превращения гидроксильных радикалов в дихлоридные анион-радикалы.
Казмерчак Л., Яник И., Вольщак М., Святла-Войцик Д. Казмерчак Л. и соавт. J Phys Chem B. 2021 26 августа; 125 (33): 9564-9571. doi: 10.1021/acs.jpcb.1c05642. Epub 2021 12 августа.
 J Phys Chem B. 2021.
PMID: 34383496
Бесплатная статья ЧВК.
J Phys Chem B. 2021.
PMID: 34383496
Бесплатная статья ЧВК.Быстрое окисление диоксида серы пероксидом водорода в растворенных аэрозольных частицах.
Лю Т., Клегг С.Л., Abbatt JPD. Лю Т. и др. Proc Natl Acad Sci U S A. 2020 21 января; 117 (3): 1354-1359. doi: 10.1073/pnas.1916401117. Epub 2020 3 января. Proc Natl Acad Sci U S A. 2020. PMID: 31
1 Бесплатная статья ЧВК.
Диффузия и реактивность в сверхвязком аэрозоле и корреляция с вязкостью частиц.
Маршалл Ф.Х., Майлз Р.Х., Песня Ю.К., Ом П.Б., Пауэр РМ, Рейд Д.П., Датчер КС. Маршалл Ф.Х. и соавт. хим. наук. 2016 1 февраля; 7 (2): 1298-1308. дои: 10.1039/c5sc03223g. Epub 2015 10 ноября. хим. наук. 2016. PMID: 29910887 Бесплатная статья ЧВК.

Полевые измерения предполагают механизм лазерной конденсации воды.
Энен С., Пети Ю., Роветтер П., Стельмашчик К., Хао З.К., Накаэма В.М., Фогель А., Поль Т., Шнайдер Ф., Каспарян Дж., Вебер К., Весте Л., Вольф Дж.П. Энен С. и соавт. Нац коммун. 2011 30 августа; 2:456. дои: 10.1038/ncomms1462. Нац коммун. 2011. PMID: 21878910 Бесплатная статья ЧВК.
Типы публикаций
термины MeSH
вещества
Структура модулирующего электролита для сверхнизкотемпературных водных цинковых батарей
1. Armand M, Tarascon JM. Создание лучших аккумуляторов. Природа. 2008; 451: 652–657. [PubMed] [Академия Google]
Armand M, Tarascon JM. Создание лучших аккумуляторов. Природа. 2008; 451: 652–657. [PubMed] [Академия Google]
2. Yamada Y, Wang JH, Ko S, Watanabe E, Yamada A. Достижения и проблемы в разработке аккумуляторных электролитов на основе солей. Нац. Энергия. 2019; 4: 269–280. [Google Scholar]
3. Lu Y, Li L, Zhang Q, Niu ZQ, Chen J. Электролит и разработка интерфейса для твердотельных натриевых батарей. Джоуль. 2018;2:1747–1770. [Google Scholar]
4. Lu Y, Zhang Q, Li L, Niu ZQ, Chen J. Стратегии разработки, направленные на повышение производительности органических электродных материалов в металл-ионных батареях. хим. 2018;4:2786–2813. [Академия Google]
5. Kim H, et al. Водные перезаряжаемые ионно-литиевые и натриевые батареи. хим. 2014; 114:11788–11827. [PubMed] [Google Scholar]
6. Jiang LW, et al. Создание водных K-ионных батарей для хранения энергии. Нац. Энергия. 2019; 4: 495–503. [Google Scholar]
7. Zhao Q, et al. Твердоэлектролитные межфазные переходы для высокоэнергетических водных алюминиевых электрохимических элементов. науч. Доп. 2018;4:eaau8131. [Бесплатная статья PMC] [PubMed] [Google Scholar]
науч. Доп. 2018;4:eaau8131. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Zheng JX, et al. Обратимое эпитаксиальное электроосаждение металлов на анодах аккумуляторов. Наука. 2019;366:645–648. [PubMed] [Google Scholar]
9. Li HF, et al. Усовершенствованные перезаряжаемые батареи на основе цинка: недавний прогресс и перспективы на будущее. Нано Энергия. 2019;62:550–587. [Google Scholar]
10. Zhao Q, et al. Водно-цинковые батареи большой емкости с использованием устойчивых хиноновых электродов. науч. Доп. 2018;4:eaao1761. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Zhang N, et al. Перезаряжаемые водные батареи на основе диоксида цинка и марганца с высокой плотностью энергии и мощности. Нац. коммун. 2017;8:405. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Ван Ф. и др. Водные перезаряжаемые цинково-ванадатные батареи с повышенной производительностью за счет одновременной установки двух носителей. Нац. коммун. 2018;9:1656. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Guo Z, et al. Лед как твердый электролит для проведения различных видов ионов. Ангью. хим. Междунар. Эд. 2019;58:12569–12573. [PubMed] [Google Scholar]
Guo Z, et al. Лед как твердый электролит для проведения различных видов ионов. Ангью. хим. Междунар. Эд. 2019;58:12569–12573. [PubMed] [Google Scholar]
14. Liu, Z. Global Energy Interconnection (Academic Press, New York, 2016).
15. Ma T, et al. Симметричные окислительно-восстановительные батареи на основе порфирина для хранения энергии в холодном климате. Ангью. хим. Междунар. Эд. 2018;57:3158–3162. [PubMed] [Академия Google]
16. Марешаль, Ю. Водородная связь и молекула воды: физика и химия воды, водных и биосред (Elsevier Science, Амстердам, 2006).
17. Мацумото М., Сайто С., Омине И. Молекулярно-динамическое моделирование процесса зарождения и роста льда, приводящего к замерзанию воды. Природа. 2002; 416:409–413. [PubMed] [Google Scholar]
18. Мур Э.Б., Молинеро В. Структурные превращения в переохлажденной воде определяют скорость кристаллизации льда. Природа. 2011;479: 506–508. [PubMed] [Google Scholar]
19. Sosso GC, et al.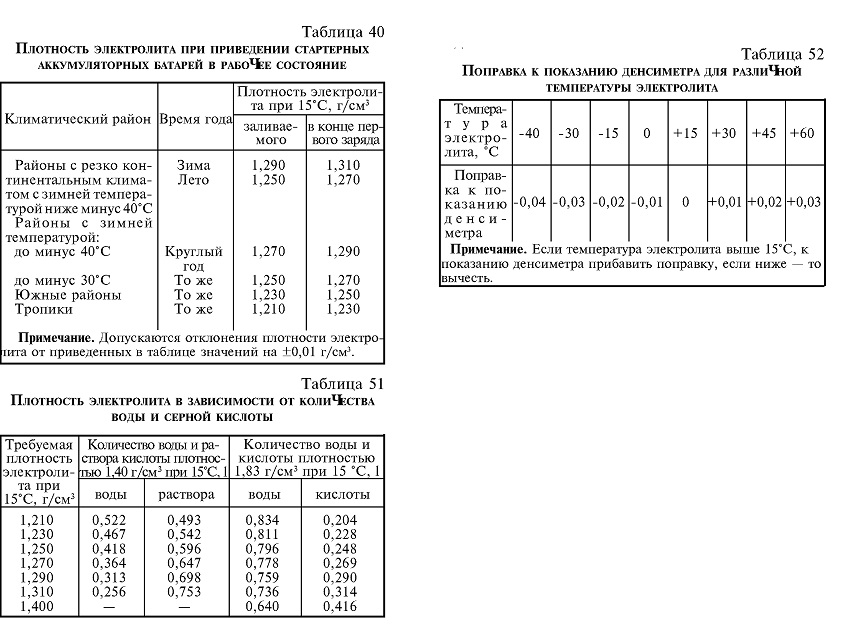 Зарождение кристаллов в жидкостях: открытые вопросы и будущие проблемы в моделировании молекулярной динамики. хим. 2016; 116:7078–7116. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Зарождение кристаллов в жидкостях: открытые вопросы и будущие проблемы в моделировании молекулярной динамики. хим. 2016; 116:7078–7116. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Чаплин, М. Ф. Прочность водородных связей воды. Препринт на https://arxiv.org/abs/0706.1355 (2007 г.).
21. Nian Q, et al. Водные аккумуляторы работали при температуре −50 °C. Ангью. хим. Междунар. Эд. 2019;58:16994–16999. [PubMed] [Академия Google]
22. Робертс А.Дж., Де Нэмор АФД, Слэйд Р.С. Низкотемпературные электролиты на водной основе для суперконденсаторов MnO 2 /углерод. физ. хим. хим. физ. 2013;15:3518–3526. [PubMed] [Google Scholar]
23. Mo F, et al. Гибкая перезаряжаемая водная цинк-диоксид-марганцевая батарея, работающая при температуре −20 °C. Энергетическая среда. науч. 2019;12:706–715. [Google Scholar]
24. Zhu M, et al. Незамерзающий гидрогель с высокой обратимостью цинка для гибких и долговечных аккумуляторов на водной основе за счет совместных гидратированных катионов. Доп. Функц. Матер. 2020;30:1907218. [Google Scholar]
Доп. Функц. Матер. 2020;30:1907218. [Google Scholar]
25. Rustomji CS, et al. Сжиженные газовые электролиты для электрохимических накопителей энергии. Наука. 2017;356:eaal4263. [PubMed] [Google Scholar]
26. Dong X, Guo Z, Guo Z, Wang Y, Xia Y. Органические батареи работали при температуре −70 °C. Джоуль. 2018;2:902–913. [Google Scholar]
27. Fan X, et al. Всетемпературные аккумуляторы на фторированных электролитах с неполярными растворителями. Нац. Энергия. 2019; 4: 882–890. [Google Scholar]
28. Reaser PB, Burch GE. Определение оксида дейтерия в воде измерением температуры замерзания. Наука. 1958;128:415–416. [PubMed] [Google Scholar]
29. Маркус Ю. Влияние ионов на структуру воды: создание и разрушение структуры. хим. 2009; 109:1346–1370. [PubMed] [Google Scholar]
30. Suo L, et al. Электролит «вода-в-соли» позволяет проводить высоковольтные водные литий-ионные химические процессы. Наука. 2015; 350:938–943. [PubMed] [Google Scholar]
31. Yang C, et al. Водный литий-ионный аккумулятор, созданный за счет химии превращения галогенов и интеркаляции в графит. Природа. 2019;569: 245–250. [PubMed] [Google Scholar]
Yang C, et al. Водный литий-ионный аккумулятор, созданный за счет химии превращения галогенов и интеркаляции в графит. Природа. 2019;569: 245–250. [PubMed] [Google Scholar]
32. Wang F, et al. Металлический цинковый анод с высокой степенью обратимости для аккумуляторов на водной основе. Нац. Матер. 2018;17:543–549. [PubMed] [Google Scholar]
33. Suo L, et al. Усовершенствованный высоковольтный литий-ионный аккумулятор на водной основе с электролитом «вода-в-бисоле». Ангью. хим. Междунар. Эд. 2016;55:7136–7141. [PubMed] [Google Scholar]
34. Wu X, et al. Реверсивная двухионная батарея через водно-солевой электролит ZnCl 2 . Варенье. хим. соц. 2019;141:6338–6344. [PubMed] [Google Scholar]
35. Zhang C, et al. Водно-солевой электролит ZnCl 2 для обратимого металлического цинкового анода. хим. коммун. 2018;54:14097–14099. [PubMed] [Google Scholar]
36. Chen CY, Matsumoto K, Kubota K, Hagiwara R, Xu Q. Расплавленный гидратный электролит комнатной температуры для перезаряжаемых цинково-воздушных батарей. Доп. Энергия Матер. 2019;9:16. [Google Scholar]
Доп. Энергия Матер. 2019;9:16. [Google Scholar]
37. Эмамиан С., Лу Т., Круз Х., Эмамиан Х. Изучение природы и предсказание прочности водородных связей: корреляционный анализ между дескрипторами атомов в молекулах, энергиями связи и энергетическими компонентами адаптированных к симметрии теория возмущений. Дж. Вычисл. хим. 2019;40:2868–2881. [PubMed] [Google Scholar]
38. Jiang L, et al. Высоковольтная водная натрий-ионная батарея с водно-солевым электролитом с инертным катионом. Доп. Матер. 2020;32:1904427. [PubMed] [Google Scholar]
39. Peng H, Nguyen AV. Связь между вязкостью и контактными парами катион-анион: исследование концепции создания/разрушения структуры концентрированных растворов солей. Дж. Мол. жидкость 2018; 263:109–117. [Google Scholar]
40. Okazaki Y, Taniuchi T, Mogami G, Matubayasi N, Suzuki M. Сравнительное исследование свойств гидратной воды ионов Na- и K-галогенидов с помощью рамановской спектроскопии OH/OD-растяжения и диэлектрической релаксации.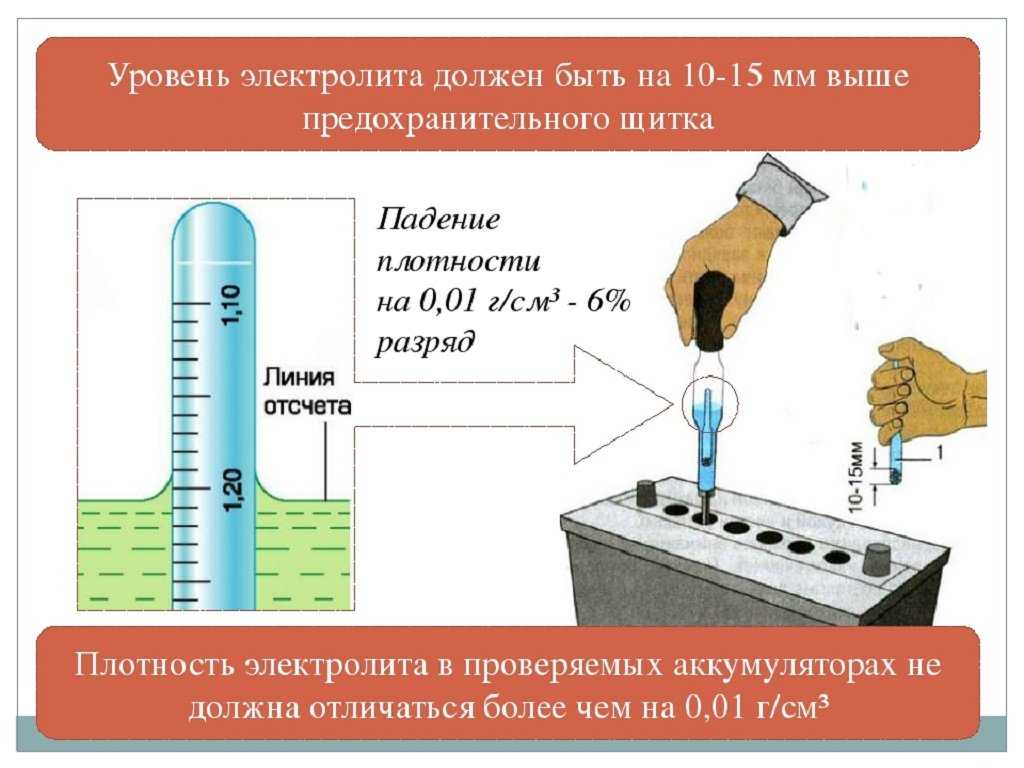 данные. Дж. Физ. хим. А. 2014; 118:2922–2930. [PubMed] [Google Scholar]
данные. Дж. Физ. хим. А. 2014; 118:2922–2930. [PubMed] [Google Scholar]
41. Bhattacharya TS, et al. Исследование происхождения генерации напряжения в потенцированном гомеопатическом лекарстве с помощью рамановской спектроскопии. Гомеопатия. 2019;108:121–127. [PubMed] [Google Scholar]
42. Zheng J, et al. Понимание термодинамического и кинетического вклада в расширение окна стабильности водных электролитов. хим. 2018;4:2872–2882. [Google Scholar]
43. Эблингер Ф., Шнайдер Х.Дж. Самоассоциацию воды и водно-растворенных ассоциаций в хлороформе изучали методом сдвигового титрования ЯМР. Дж. Физ. хим. 1996;100:5533–5537. [Google Scholar]
44. Mizuno K, Oda K, Maeda S, Shindo Y, Okumura A. 1 H-ЯМР исследование структуры воды в смесях галогеноспирт-вода. Дж. Физ. хим. 1995; 99: 3056–3059. [Google Scholar]
45. Irish DE, McCarroll B, Young TF. Раман-исследование растворов хлорида цинка. Дж. Хим. физ. 1963; 39: 3436–3444. [Google Scholar]
46. Verdonck E, Schaap K, Thomas LC. Обсуждение принципов и приложений DSC с модулированной температурой (MTDSC) Int. Дж. Фарм. 1999;192:3–20. [PubMed] [Google Scholar]
Verdonck E, Schaap K, Thomas LC. Обсуждение принципов и приложений DSC с модулированной температурой (MTDSC) Int. Дж. Фарм. 1999;192:3–20. [PubMed] [Google Scholar]
47. Саймон С.Л. Дифференциальная сканирующая калориметрия с температурной модуляцией: теория и применение. Термохим. Акта. 2001; 374: 55–71. [Google Scholar]
48. Роял С.П., Уильямс С.Р., Оцука Т., Танака Х. Прямое наблюдение локального структурного механизма динамической остановки. Нац. Матер. 2008; 7: 556–561. [PubMed] [Google Scholar]
49. Royall CP, Williams SR. Роль локальной структуры в динамической остановке. физ. Отчет 2015; 560: 1–75. [Академия Google]
50. Stoiber, R.E. & Morse, S.A. Идентификация кристаллов с помощью поляризационного микроскопа (Springer, Boston, 1994).
51. Димитров В.И. Переход жидкость—стекло — фазовый переход четвертого рода? J. Некристалл. Твердые вещества. 2005; 351: 2394–2402. [Google Scholar]
52. Шортино Ф., Тарталья П. Стекловидные коллоидные системы.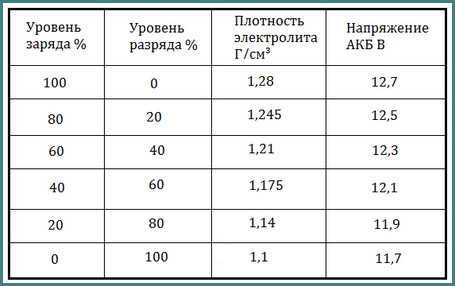 Доп. физ. 2005; 54: 471–524. [Google Scholar]
Доп. физ. 2005; 54: 471–524. [Google Scholar]
53. Adams BD, Zheng J, Ren X, Xu W, Zhang JG. Точное определение кулоновской эффективности для литий-металлических анодов и литий-металлических батарей. Доп. Энергия Матер. 2018;8:1702097. [Google Scholar]
54. Ma, L. et al. Критические факторы, определяющие обратимость металлического цинкового анода. Энергетика Окружающая среда. Мать . 10.1002/eem2.12077 (2020).
55. Sun W, et al. Zn/MnO 2 Химия аккумуляторов С добавлением H + и Zn 2+ . Варенье. хим. соц. 2017;139:9775–9778. [PubMed] [Google Scholar]
56. Сонг М., Тан Х., Чао Д.Л., Фань Х.Дж. Последние достижения в области Zn-ионных аккумуляторов. Доп. Функц. Матер. 2018;28:1802564. [Академия Google]
57. Dong X, et al. Высокоэнергетическая перезаряжаемая металлическая литиевая батарея при температуре −70 °C с сорастворяющим электролитом. Ангью. хим. Междунар. Эд. 2019;58:5623–5627. [PubMed] [Google Scholar]
58. Liang Y, et al. Универсальные хиноновые электроды для аккумуляторов на водной основе с длительным сроком службы. Нац. Матер. 2017; 16: 841–848. [PubMed] [Google Scholar]
Liang Y, et al. Универсальные хиноновые электроды для аккумуляторов на водной основе с длительным сроком службы. Нац. Матер. 2017; 16: 841–848. [PubMed] [Google Scholar]
59. Wan F, et al. Водная перезаряжаемая цинко-органическая батарея с гибридным механизмом. Доп. Функц. Матер. 2018;28:1804975. [Академия Google]
60. Линдфорс Т., Кварнстрем С., Иваска А. Исследование спектроскопии комбинационного рассеяния света и УФ-видимой области полианилиновых мембран, содержащих объемистую катионную добавку. J. Electroanalytical Chem. 2002; 518: 131–138. [Google Scholar]
61. Huang S, et al. Интегрированная ионно-цинковая батарея с самовосстановлением. Ангью. хим. Междунар. Эд. 2019;58:4313–4317. [PubMed] [Google Scholar]
62. Berendsen HJ, van der Spoel D, van Drunen R. GROMACS: реализация параллельной молекулярной динамики с передачей сообщений. Комп. физ. Комм. 1995;91:43–56. [Google Scholar]
63. Duan Y, et al. Силовое поле точечного заряда для молекулярно-механического моделирования белков на основе квантово-механических расчетов в конденсированной фазе.

 ..-5
..-5 -.8°С)
-.8°С)

 J Phys Chem B. 2021.
PMID: 34383496
Бесплатная статья ЧВК.
J Phys Chem B. 2021.
PMID: 34383496
Бесплатная статья ЧВК.