Каталитические нейтрализаторы — Что такое Каталитические нейтрализаторы?
36850
Каталитический нейтрализатор (обиходное название – катализатор) предназначен для снижения токсичности отработавших газов
Нейтрализатор — устройство в выхлопной системе, предназначенное для снижения токсичности отработавших газов посредством восстановления оксидов азота и использования полученного кислорода для дожига угарного газа и недогоревших углеводородов.
Основным требованием к успешной работе катализатора является стехиометрическое соотношение топлива и кислорода.
Задачей автомобильного каталитического нейтрализатора является снижение количества вредных веществ в выхлопных газах.
Среди них:
-
окись углерода (СО) — ядовитый газ без цвета и запаха;
-
углеводороды (CH), также известные как летучие органические соединения — один из главных компонентов смога, образуется за счет неполного сгорания топлива;
-
оксиды азота (NO и NO2, которые часто объединяют под обозначением NOx) - также являются компонентом смога, а также кислотных дождей, оказывают влияние на слизистую человека.

Принцип работы
Каталитический нейтрализатор расположен либо на приемной трубе, либо сразу после нее.
Внутри корпуса каталитического нейтрализатора находится керамическая сотовая конструкция.
Соты нужны, чтобы увеличить площадь контакта выхлопных газов с поверхностью, на которую нанесен тонкий слой платиноиридиевого сплава.
Недогоревшие остатки (CO, CH, NO) касаясь поверхности каталитического слоя, окисляются до конца кислородом, присутствующим также в выхлопных газах.
В результате реакции выделяется тепло, разогревающее катализатор и, тем самым, активизируется реакция окисления.
В конечном итоге на выходе из катализатора (исправного) выхлопные газы содержат в основном N2 и СО2.
Катализаторы в дизельных двигателях
Каталитические преобразователи дизельных двигателей плохо справляются с сокращением выбросов NOx.
Одна из причин в том, что дизельные двигатели сами по себе функционируют в более низком температурном режиме, чем бензиновые, а преобразователи работают лучше при нагреве.
Некоторые ведущие эксперты в области «зеленого» автомобилестроения придумали новую выхлопную систему, которая помогает исправить этот недостаток.
Они впрыскивают водный раствор мочевины в выхлопную трубу до того, как газы достигнут преобразователя.
При этом возникает химическая реакция, которая уменьшает количество NOx.
Карбамид, также известный как мочевина — органическое соединение углерода, азота, кислорода и водорода.
Его можно обнаружить в моче млекопитающих и земноводных, что и объясняет такое название.
Мочевина реагирует с NOx с получением азота и водяного пара, снижая количество оксидов азота в выхлопных газах более чем на 90%.
Последние новости
Катализаторы — Что такое Катализаторы?
Примерно 90% объема современного химического производства основано на каталитических процессах.
См. Спецпроект Neftegaz.RU «Национальный продукт: Отечественные катализаторы».
Катализаторы обеспечивают энергетически менее затрудненные пути реакции, что позволяет эффективно использовать сырье.
Катализ — это ускорение химических реакций под действием малых количеств веществ (катализаторов), которые сами в ходе реакции не изменяются.
Они широко используются при переработке нефти, получении различных продуктов, создании новых материалов (например, пластмасс).
Примерно 90% объема современного химического производства основано на каталитических процессах.
Катализаторы позволяют превратить низкосортное сырье в высокоценные продукты.
Без катализаторов невозможно обеспечить производство моторных топлив для двигателей экологического стандарта «Евро-5» и выше.
Например, в каталитическом крекинге — одном из ключевых процессов, обеспечивающих увеличение выхода светлых нефтепродуктов (особенно бензина), самое главное действие катализатора — расщепление больших углеводородных молекул на более мелкие с высоким октановым числом.
Гидрокрекинг в свою очередь — процесс получения высококачественных керосиновых и дизельных дистиллятов из тяжелого газойля вакуумной перегонки и вторичных процессов.
Он также позволяет получить высококачественную основу базовых масел, близкую по эксплуатационным характеристикам к синтетическим.
Иначе говоря, это каталитический крекинг в присутствии водорода — где сочетание водорода, катализатора и соответствующего режима процесса позволяют провести крекинг низкокачественного легкого газойля и добиться получения высококачественных основ для широкого ассортимента товарных смазочных масел.
Катализаторы здесь играют важную роль: они активно взаимодействуют с водородом, благодаря им идет сам крекинг и происходит образование изопарафинов.
В процессе гидроочистки понижается содержание серы в топливе.
Эффективность гидроочистки зависит от активности катализаторов, температурного режима и качества сырья.

И повышение эффективности процесса требует использования новых типов катализаторов.
- постоянная высокая каталитическая активность,
- селективность,
- механическая прочность,
- термостойкость,
- устойчивостью к действию каталитических ядов,
- большая длительность работы,
- легкая регенерируемость,
- необходимые гидродинамические характеристики,
- невысокая стоимость.
Формирование свойств катализатора происходит во время его приготовления и во время эксплуатации, поэтому метод приготовления катализатора должен учитывать возможность образования активных центров в условиях катализа. Во многих случаях активность промышленных катализаторов увеличивают добавлением промоторов (сокатализаторов).
Селективность изменяется из-за изменения электронных свойств и окружения активных центров катализатора (эффект лиганда).
В реакциях сложных органических молекул большое значение имеет преимущественное образование продукта, близкого по своей форме и размерам к размерам микропор катализатора.
В сложных многостадийных реакциях применяют многофазные многокомпонентные катализаторы, селективность которых выше благодаря тому, что каждая стадия сложной реакции ускоряется своим компонентом катализатора. Селективность катализатора зависит также от его пористости, размера зерен и характера их укладки.
Термостойкость катализаторов важна для первых по ходу реагента слоев катализаторов в экзотермических реакциях, когда выделение тепла может вызвать рекристаллизацию и дезактивацию катализаторов.
Для предотвращения рекристаллизации катализаторы наносят на термостойкие носители.
Устойчивость катализатора к действию ядов каталитических определяется спецификой их взаимодействия с катализатором.
Металлические катализаторы отравляются соединениями кислорода (Н2О, СО), серы (H2S, CS2 и др. ), N, Р, As и другими веществами, образующими более прочную химическую связь с катализатором, чем реагирующие вещества.
), N, Р, As и другими веществами, образующими более прочную химическую связь с катализатором, чем реагирующие вещества.
На оксидные катализаторы действуют те же яды, однако оксиды более устойчивы к отравлению.
Кроме того, катализаторы могут дезактивироваться из-за механического покрытия поверхности пылью, которая вносится извне или образуется при катализе.
Приготовление катализаторов
Катализаторы с развитой удельной поверхностью распространение получил метод осаждения из водных растворов солей с последующим прокаливанием образующихся соединений.
Так получают многие оксиды металлов. При этом лучше использовать водный раствор NH3, потому что отпадает необходимость отмывки осадка от щелочных металлов.
Охлажденный катализатор дробят, просеивают и восстанавливают азотно-водородной смесью в колонне синтеза.
Для получения правильной геометрической формы зерен катализатора используют специальные формовочные машины.
закатываются в сферические гранулы в специальных грануляторах.
Плоские цилиндрические таблетки получают прессованием сухого порошка на таблеточных машинах
Что такое катализ?
Катализ – это процесс модификации химической реакции с использованием катализатора. Этот процесс работает только с химическими веществами, у которых уже есть реакция, и используется для ускорения реакции в коммерческих целях. Катализ происходит быстрее, чем стандартная химическая реакция, потому что катализаторы требуют меньше энергии активации, которая представляет собой минимальный уровень энергии, необходимый для инициирования химической реакции.
В этом сообщении в блоге будут изложены принципы катализа и его различные типы.
Принцип работы катализатора
Когда химическое вещество помещается с совместимым катализатором, уменьшается свободная энергия, необходимая химическому веществу для достижения переходного состояния для данной конкретной реакции. Катализаторы могут влиять на реакционную среду в зависимости от конкретных требований реакции.
Например, катализаторы могут выделять больше тепла, образовывать специфические промежуточные соединения, которые не образуются естественным путем, связывать реагенты для поляризации связей или вызывать диссоциацию реакций обратно в их реактивные формы.
Типы катализаторов
Существует два основных типа катализаторов, используемых для катализа; гетерогенный или гомогенный. Гетерогенный катализатор имеет молекулы, которые не находятся в той же фазе, что и реагенты, тогда как молекулы гомогенного катализатора находятся в той же фазе, что и реагенты.
Если вы хотите узнать больше о процессах, связанных с исследованиями катализа, прочитайте нашу статью: Что такое TPR?
Обычно гетерогенный катализатор является твердым, тогда как реагенты являются газообразными или жидкими. Реагенты адсорбируются на активных центрах поверхности гетерогенного катализатора, и происходит взаимодействие. Это взаимодействие заставляет молекулы становиться более реактивными.
Электрокатализатор представляет собой гетерогенный катализатор, который используется специально в разработке топливных элементов для улучшения свойств и работы топливных элементов.
Гомогенные катализаторы находятся в той же фазе, что и реагент, обычно газ или жидкость. К этому типу катализаторов обычно применяются принципы гетерогенного катализатора.
Органокатализ — это форма катализа, которая может осуществляться с использованием гомогенного катализатора. Органокатализ — это изучение органических катализаторов, представляющих собой небольшие органические молекулы.
Подробнее: Инструменты для исследования катализа
Катализ в Hiden Analytical
Компания Hiden Analytical имеет более чем 30-летний опыт проектирования, разработки и производства масс-спектрометров для специализированного мониторинга технологических процессов и передовых исследовательских приложений.
У нас есть ряд продуктов, подходящих для анализа катализа, в том числе наш CATLAB-PCS, который обеспечивает полностью автоматизированные и точные исследования химии активной поверхности, возможность оптимизировать каталитическую активность и быстрый динамический скрининг.
Метод дифференциальной электрохимической масс-спектрометрии DEMS идеально подходит для анализа активности электрокатализаторов. Система Hiden HPR-40 DEMS предназначена для дифференциальной электрохимической масс-спектрометрии. Система включает ячейки DEMS, разработанные в сотрудничестве с Национальной лабораторией Лоуренса в Беркли, Калифорния, США.
Если вам нужна дополнительная информация о продуктах Hiden Analytical для исследования и анализа катализа, отправьте нам сообщение.
3.1: Общие принципы катализа
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 20281
Как видно из уравнения Аррениуса, величина энергии активации \(E_a\) определяет значение константы скорости \(k\) при данной температуре и, таким образом, общую скорость реакции. Катализаторы позволяют снизить \(E_a\) и увеличить скорость реакции. Катализаторы определяются как вещества, которые участвуют в химической реакции, но не изменяются и не расходуются. Вместо этого они обеспечивают новый механизм протекания реакции, который имеет более низкую энергию активации, чем реакция без катализатора.
Рассмотрим некатализируемую элементарную реакцию
\[\text{A} \overset{k}{\longrightarrow} \text{P}\]
, которая протекает со скоростью \(k\) при определенной температуре. Скорость реакции может быть выражена как
\[\dfrac{d \left[ \text{A} \right]}{dt} = -k \left[ \text{A} \right] \label{Eq1}\ ]
В присутствии катализатора \(\text{C}\) мы можем записать реакцию как
\[\text{A} + \text{C} \overset{k_\text{cat}} {\longrightarrow} \text{P} + \text{C}\]
и скорость реакции как
\[\dfrac{d \left[ \text{A} \right]}{dt} = -k \left[ \text{A} \right] — k_\text{cat } \left[ \text{A} \right] \left[ \text{C} \right] \label{Eq2}\]
где первый член представляет собой некатализируемую реакцию, а второй член представляет собой каталитическую реакцию.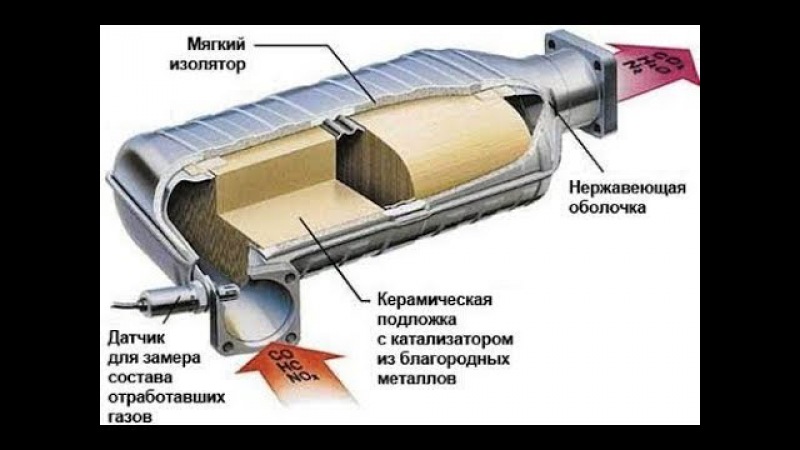 — &\overset{k_3}{\underset{k_{-3}}{\rightleftharpoons}} \text{A}H + H_2 O \end{align}\ ] 9+ \right]}{\left[ \text{A} H \right]} \label{Eq9}\]
— &\overset{k_3}{\underset{k_{-3}}{\rightleftharpoons}} \text{A}H + H_2 O \end{align}\ ] 9+ \right]}{\left[ \text{A} H \right]} \label{Eq9}\]
В этом случае реакция катализируется ионами водорода.
Ферментный катализ
Чтобы жить, расти и размножаться, микроорганизмы претерпевают ряд химических изменений. Они изменяют питательные вещества, чтобы они могли попасть в клетку, и они меняют их, как только они входят, чтобы синтезировать части клетки и получать энергию.
Метаболизм относится ко всем организованным химическим реакциям в клетке. Реакции, в которых происходит расщепление химических соединений, называются 9.0009 катаболические реакции , тогда как реакции, в которых синтезируются химические соединения, называются анаболическими реакциями . Все эти реакции находятся под контролем ферментов.
Ферменты представляют собой вещества, присутствующие в клетке в небольших количествах и функционирующие для ускорения или катализа химических реакций . На поверхности фермента обычно имеется небольшая щель, которая функционирует как активный центр или каталитический центр, с которым могут связываться один или два специфических субстрата. (Все, с чем обычно соединяется фермент, называется субстрат .) Связывание субстрата с ферментом приводит к тому, что гибкий фермент слегка меняет свою форму в результате процесса, называемого индуцированной подгонкой , с образованием временного промежуточного продукта, называемого фермент-субстратным комплексом (рис. 1).
На поверхности фермента обычно имеется небольшая щель, которая функционирует как активный центр или каталитический центр, с которым могут связываться один или два специфических субстрата. (Все, с чем обычно соединяется фермент, называется субстрат .) Связывание субстрата с ферментом приводит к тому, что гибкий фермент слегка меняет свою форму в результате процесса, называемого индуцированной подгонкой , с образованием временного промежуточного продукта, называемого фермент-субстратным комплексом (рис. 1).

Ферменты ускоряют скорость химических реакций, потому что они снижают энергию активации, энергию, которая должна быть предоставлена для того, чтобы молекулы реагировали друг с другом (Рисунок \(\PageIndex{3}\)). Подобно рассмотренным выше гомогенным катализаторам, ферменты снижают энергию активации, образуя комплекс фермент-субстрат, что позволяет образовываться и высвобождаться продуктам ферментативной реакции (рис. \(\PageIndex{2}\)).
Рисунок \(\PageIndex{3}\) : Фермент ускоряет химическую реакцию, снижая свою энергию активации, энергию, которая должна быть предоставлена для того, чтобы молекулы реагировали друг с другом.Реакции фермент-субстрат
Ферменты – это вещества, присутствующие в клетке в небольших количествах, которые ускоряют или катализируют химические реакции. Ферменты ускоряют скорость химических реакций, потому что они снижают энергию активации, энергию, которая должна быть предоставлена для того, чтобы молекулы реагировали друг с другом. Ферменты снижают энергию активации, образуя фермент-субстратный комплекс.
Многим ферментам требуется небелковый кофактор , чтобы помочь им в их реакции. В этом случае белковая часть фермента, называемая апофермент в сочетании с кофактором образует целый фермент или галофермент (рис. \(\PageIndex{4}\)). Некоторые кофакторы представляют собой ионы, такие как Ca ++, Mg ++ и K+; другие кофакторы представляют собой органические молекулы, называемые коферментами , которые служат переносчиками химических групп или электронов. НАД + , НАДФ + , ФАД и кофермент А (КоА) являются примерами коферментов.
Рисунок \(\PageIndex{4}\) : Апофермент и кофактор объединяются, образуя галофермент. Если кофактор представляет собой органическую молекулу, он называется коферментом. Ферменты обычно представляют собой глобулярные белки. (Некоторые молекулы РНК, называемые рибозимами, также могут быть ферментами. Обычно они находятся в ядерной области клеток и катализируют расщепление молекул РНК). Ферменты — это катализаторы, которые расщепляют или синтезируют более сложные химические соединения. Они позволяют химическим реакциям происходить достаточно быстро, чтобы поддерживать жизнь. Ферменты ускоряют скорость химических реакций, потому что они снижают энергию активации, энергию, которая должна быть предоставлена для того, чтобы молекулы реагировали друг с другом. Все, с чем обычно связывается фермент, называется субстратом. Ферменты очень эффективны: обычно ферменты способны катализировать от 1 до 10 000 молекул субстрата в секунду. Это означает, что ферменты должны присутствовать в клетке только в небольших количествах. Они не изменяются во время своей реакции и очень специфичны для своего субстрата, причем обычно для каждой конкретной химической реакции предназначен один конкретный фермент.
Ферменты — это катализаторы, которые расщепляют или синтезируют более сложные химические соединения. Они позволяют химическим реакциям происходить достаточно быстро, чтобы поддерживать жизнь. Ферменты ускоряют скорость химических реакций, потому что они снижают энергию активации, энергию, которая должна быть предоставлена для того, чтобы молекулы реагировали друг с другом. Все, с чем обычно связывается фермент, называется субстратом. Ферменты очень эффективны: обычно ферменты способны катализировать от 1 до 10 000 молекул субстрата в секунду. Это означает, что ферменты должны присутствовать в клетке только в небольших количествах. Они не изменяются во время своей реакции и очень специфичны для своего субстрата, причем обычно для каждой конкретной химической реакции предназначен один конкретный фермент.
Факторы, влияющие на скорость ферментативных реакций
На активность фермента влияет ряд факторов, включая:
- Концентрация фермента скорость реакции.

- Концентрация субстрата : При постоянной концентрации фермента и более низких концентрациях субстрата концентрация субстрата является ограничивающим фактором. С увеличением концентрации субстрата скорость ферментативной реакции увеличивается. Однако при очень высоких концентрациях субстрата ферменты насыщаются субстратом, и более высокая концентрация субстрата не увеличивает скорость реакции.
- Ингибиторы: Ингибиторы ингибируют активность фермента и снижают скорость реакции. Ингибиторы ферментов будут связываться с активными центрами ферментов и могут изменять химический состав активного центра, что может препятствовать проникновению субстрата.
- Температура : Каждый фермент имеет оптимальную температуру, при которой он работает лучше всего. Более высокая температура обычно приводит к увеличению активности фермента (кинетика Аррениуса). По мере повышения температуры молекулярное движение увеличивается, что приводит к большему количеству молекулярных столкновений.
 Однако, если температура поднимается выше определенной точки, тепло денатурирует фермент, заставляя его терять свою трехмерную функциональную форму из-за денатурации его водородных связей. Холодная температура, с другой стороны, замедляет активность ферментов за счет уменьшения молекулярного движения.
Однако, если температура поднимается выше определенной точки, тепло денатурирует фермент, заставляя его терять свою трехмерную функциональную форму из-за денатурации его водородных связей. Холодная температура, с другой стороны, замедляет активность ферментов за счет уменьшения молекулярного движения. - pH : Каждый фермент имеет оптимальный pH, который помогает поддерживать его трехмерную форму. Изменения pH могут денатурировать ферменты, изменяя заряд фермента. Это изменяет ионные связи фермента, которые способствуют его функциональной форме.
- Концентрация соли : Каждый фермент имеет оптимальную концентрацию соли. Изменения концентрации соли также могут денатурировать ферменты.
Применение ферментов
Ферменты необходимы для поддержания гомеостаза, поскольку любой сбой фермента может привести к заболеванию. Поэтому фармацевтические компании изучают ферменты для управления и синтеза новых лекарств.



 Однако, если температура поднимается выше определенной точки, тепло денатурирует фермент, заставляя его терять свою трехмерную функциональную форму из-за денатурации его водородных связей. Холодная температура, с другой стороны, замедляет активность ферментов за счет уменьшения молекулярного движения.
Однако, если температура поднимается выше определенной точки, тепло денатурирует фермент, заставляя его терять свою трехмерную функциональную форму из-за денатурации его водородных связей. Холодная температура, с другой стороны, замедляет активность ферментов за счет уменьшения молекулярного движения.