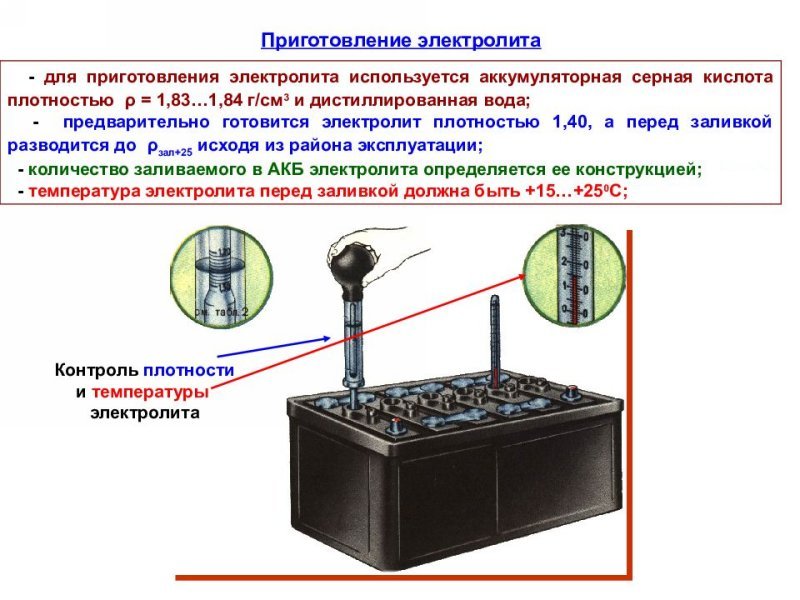
Что такое электролит в батарее? (Принцип работы и типы аккумуляторов)
От высокотехнологичного электромобиля до дешевой игрушечной машинки с дистанционным управлением питание аккумуляторов стало неотъемлемой частью нашей повседневной жизни. На протяжении многих лет мир использовал дорогие источники энергии для выполнения повседневных задач.
Однако, после достаточного количества разработок, батареи оказались эффективным изобретением в качестве источника и хранения электроэнергии. Внутренний электролит в аккумуляторе является одним из основных компонентов, которые делают все волшебство.
В сегодняшнем посте мы обсудим, что такое электролит в аккумуляторе и как его сделать в домашних условиях.
Содержание
- Что такое электролит в батарее?
- Как электролиты работают в батарее?
- Из чего состоит электролит батареи?
- Общие типы батарей с их электролитами
- Как сделать раствор электролита для батареи?
- Резюме
Что такое электролит в батарее?
Электролит в батарее представляет собой вещество, которое дает ионы (электрически заряженные атомы, которые приобрели или потеряли электроны) при растворении в воде или жидкостях. Благодаря движению положительных и отрицательных ионов раствор проводит электрический ток, который течет между двумя электродами — анодом и катодом.
Благодаря движению положительных и отрицательных ионов раствор проводит электрический ток, который течет между двумя электродами — анодом и катодом.
Электролит батареи может быть жидким или твердым, в зависимости от типа батареи. Однако потенциальными электролитами могут быть любые среды, содержащие ионы.
Электролиты можно разделить на сильные и слабые химические соединения. Сильные электролиты — это те, которые почти или полностью ионизируются в растворе, а слабые — частично.
Как электролиты работают в батарее?
Чтобы понять, как работает электролит батареи, нам сначала нужно изучить основные компоненты батареи — анод, катод и электролит (который разделяет две клеммы). Поскольку мы уже обсуждали электролит выше, давайте рассмотрим анод и катод.
Анод – это отрицательная клемма или восстановительный электрод, который окисляет и высвобождает электроны во внешнюю цепь во время электрохимической реакции.
С другой стороны, катод – это положительный вывод или окислительный электрод. Он восстанавливается в ходе электрохимической реакции, приобретая электроны, выделяемые анодом во внешнюю цепь.
Он восстанавливается в ходе электрохимической реакции, приобретая электроны, выделяемые анодом во внешнюю цепь.
Электролит обеспечивает среду для перемещения электрического заряда в виде ионов между двумя клеммами. Катионы с положительным зарядом движутся к катоду, а анионы с отрицательным зарядом — к аноду. Кроме того, электролит приводит подходящее химическое вещество, необходимое для реакции, в контакт с клеммами, что преобразует накопленную энергию в пригодную для использования электрическую энергию.
Полезная электрическая энергия встречается с подключенным устройством, будь то лампочка или пылесос, и питает его.
Из чего состоит электролит батареи?
Электролит батареи состоит из растворимых солей, кислот или оснований. Однако точный характер электролита зависит от типа батареи и требуемой величины тока.
Например, в обычных щелочных бытовых батареях используется гидроксид калия, который является сильным электролитом и поэтому обладает высокой электропроводностью.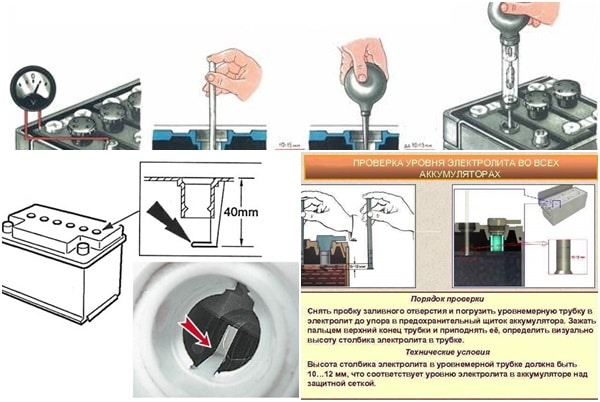 С другой стороны, свинцово-кислотный аккумулятор в автомобилях использует серную кислоту в качестве электролита и вызывает требуемую реакцию.
С другой стороны, свинцово-кислотный аккумулятор в автомобилях использует серную кислоту в качестве электролита и вызывает требуемую реакцию.
Давайте рассмотрим некоторые типы аккумуляторов с подходящими для них электролитами.
Распространенные типы батарей с их электролитами
1. Свинцово-кислотные
Свинцово-кислотные аккумуляторы — это аккумуляторы, в которых для химических реакций используется кислый электролит (серная кислота) и металлический свинец (Pb). Серная кислота — очень коррозионное вещество, растворимое в воде. Он бесцветный, с легким желто-зеленым оттенком. Однако он обесцвечивается до коричневатого оттенка из-за ржавчины в результате анодной коррозии, возникающей при растворении анода в электролите.
Для контролируемой химической реакции металлический свинец погружается в серную кислоту, в результате чего батарея вырабатывает электричество. Этот химический процесс извлечения тока из свинцово-кислотного аккумулятора известен как разрядка.
Кроме того, когда аккумулятору необходимо перезарядиться, реагенты (ранее использовавшиеся для выработки электроэнергии) можно регенерировать, пропуская ток через аккумулятор извне. Этот процесс известен как перезарядка.
Свинцово-кислотная батарея имеет большой вес, но вырабатывает высокое напряжение. Он оснащен ячейками 2 В, что означает, что он имеет четное количество вольт. Наиболее распространенные свинцово-кислотные батареи имеют напряжение 2 В, 6 В, 12 В и 24 В.
Поэтому он обычно используется в машинах, ИБП (источниках бесперебойного питания) и системах, которые требуют высокой мощности для работы и не имеют значения веса батареи.
2. Никель-кадмиевые (NiCd)
Электролит, используемый в никель-кадмиевых (NiCd) батареях, представляет собой тридцатипроцентный раствор гидроксида калия (КОН) в дистиллированной воде. При комнатной температуре его удельный вес остается между 1,240 и 1,300.
По сравнению со свинцово-кислотными батареями никель-кадмиевые батареи дороже, но имеют более высокую плотность энергии, что означает, что они могут хранить больше энергии на единицу веса. Он также служит дольше, чем свинцово-кислотные аккумуляторы, поскольку у него больше жизненных циклов, около 2000-2500.
Он также служит дольше, чем свинцово-кислотные аккумуляторы, поскольку у него больше жизненных циклов, около 2000-2500.
3. Никель-металл-гидридный (NiMH)
Никель-металл-гидридный (NiMH) аккумулятор использует тот же электролит, что и NiCd, а именно гидроксид калия. Гидроксид калия, также известный как едкий калий, представляет собой неорганическое соединение и сильное основание, широко используемое в большинстве мягких и жидких мыл. Электролит бесцветен и имеет множество промышленных применений.
Батарея содержит электроды, изготовленные из уникальных металлов, таких как никель, кобальт, марганец и алюминий, которые также присутствуют в литий-ионных батареях. Однако батарея NiMH более хрупкая, чем литий-ионная и никель-кадмиевая.
4. Литий-ионные (Li-ion)
В литий-ионных (Li-ion) батареях используются электролиты, состоящие из солей лития, таких как гексафторфосфат лития (LiPF6) в органическом растворителе. Литий-ионные аккумуляторы работают как с гелевым или сухим полимером, так и с жидким электролитом.
Элементы литий-ионных аккумуляторов легкие и обладают высокой плотностью энергии, что дает им преимущество перед любыми аккумуляторными элементами. Они способны генерировать мощность 3,6 В, что делает их полезными в широком диапазоне приложений, таких как транспортные средства, силовое оборудование и портативные устройства, такие как ноутбуки и сотовые телефоны.
Как сделать раствор электролита для аккумулятора?
Когда в вашей жидкостной батарее заканчивается топливо (электролит), вы можете сделать его дома, а не покупать.
Хотя для приготовления раствора электролита требуются некоторые школьные знания химии, вы все равно можете сделать его, следуя этому руководству. Однако действовать нужно осторожно, так как процесс приготовления электролита опасен.
Прежде чем начать, решите, какой химический раствор вы хотите использовать для приготовления электролита. Обычно для аккумуляторов больше всего подходят сильные кислоты, растворенные в чистой смеси воды.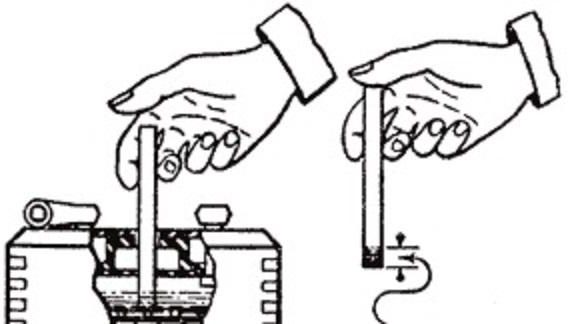 Вода помогает стабилизировать активность ионов водорода. Вы можете использовать серную кислоту, если у вас есть свинцовые электроды, и азотную кислоту для никелевых электродов.
Вода помогает стабилизировать активность ионов водорода. Вы можете использовать серную кислоту, если у вас есть свинцовые электроды, и азотную кислоту для никелевых электродов.
Примечание. Без состава чистой воды небольшой ток может взорвать аккумулятор.
Инструменты, которые вам понадобятся
Помимо вышеперечисленных химикатов, для эффективного выполнения процесса вам потребуется следующее оборудование.
- Не менее трех толстых изолирующих контейнеров
- Кислотостойкие перчатки
- Очки
- Захват
- Мультиметр
- Ареометр
- Чертежные трубы (желательно прозрачные)
- Аптечка с пищевой содой для лечения кислотных ожогов
Шаги
Все собралось? Если да, то следуйте следующим шагам!
- Возьмите изолированный контейнер и наполните его водой. Обязательно измерьте объем, прежде чем наливать его. Вы также можете оставить немного воды в другом контейнере, если вам нужно разбавить раствор.
 В любом случае используйте чистую воду, чтобы исключить риск загрязнения, которое может вызвать нежелательные химические реакции.
В любом случае используйте чистую воду, чтобы исключить риск загрязнения, которое может вызвать нежелательные химические реакции. - Затем осторожно возьмите контейнер с кислотой с помощью захвата и вылейте его в воду. Если на поверхности появляются чрезмерные пузырьки, приостановите процесс на несколько секунд и дайте им рассеяться. Вы можете вылить остальную кислоту, как только исчезнут пузырьки.
- В этот момент раствор электролита должен иметь высокую температуру. Таким образом, вы можете накрыть его, чтобы позволить любым загрязнениям иметь место. Однако убедитесь, что горячий воздух выходит.
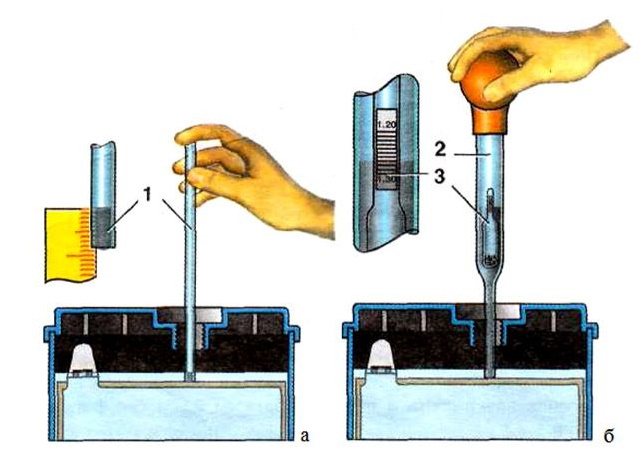
- Когда раствор в контейнере остынет, используйте ареометр, чтобы проверить его крепость и добавить жидкости по мере необходимости.
- Как только вы наберете необходимую силу, аккуратно залейте кислотный раствор в гнезда батареи. Для этого вы можете использовать волочильные трубы, один конец которых находится на дне контейнера, а другой — в батарейном отсеке.

- Надев кислотостойкие перчатки, наклоняйте контейнер под постепенно увеличивающимся углом, чтобы раствор кислоты попал в гнездо для батареи. Заполните каждый аккумуляторный отсек примерно на три четверти.
- Когда слоты заполнены, снимите трубу и закройте слоты. Вот и все! Ваша батарея готова генерировать энергию.
Наконец, используйте мультиметр, чтобы проверить, какое напряжение выдает ваша батарея на клеммах. Будем надеяться, что батарея в порядке!
Резюме
Электролит в батарее представляет собой раствор, который позволяет заряженным ионам и току проходить через катодные и анодные клеммы. Электролит имеет определенные химические характеристики, которые реагируют с электродами, и реакция преобразует накопленную энергию в пригодную для использования электрическую энергию.
Электролиты обычно состоят из растворов сильных кислот, таких как серная и азотная кислота, но обычно электролит может состоять из растворимых солей, кислот и оснований.
Мы надеемся, что этот пост был вам полезен. Если вы сегодня узнали что-то новое, не забудьте поделиться этим с друзьями!
Огнезащита литий-ионных аккумуляторов с помощью соли — ScienceDaily
Литий-ионные аккумуляторы питают телефоны, ноутбуки, другую персональную электронику и электромобили и даже используются для хранения энергии, вырабатываемой солнечными панелями. Но если температура этих батарей поднимется слишком высоко, они перестанут работать и могут загореться.
Отчасти это связано с тем, что электролит внутри них, который переносит ионы лития между двумя электродами при зарядке и разрядке батареи, легко воспламеняется.
«Одной из самых больших проблем в аккумуляторной промышленности является проблема безопасности, поэтому необходимо приложить много усилий, чтобы попытаться создать безопасный аккумуляторный электролит», — сказала Рэйчел З Хуанг, аспирант Стэнфордского университета и первый автор. доклада, опубликованного 30 ноября в Matter .
доклада, опубликованного 30 ноября в Matter .
Huang разработал негорючий электролит для литий-ионных аккумуляторов с 19другие исследователи из Национальной ускорительной лаборатории SLAC Министерства энергетики и Стэнфордского университета. Их работа показала, что батареи, содержащие этот электролит, продолжают функционировать при высоких температурах, не вызывая возгорания.
Их секрет? Больше соли.
Salty SAFEty
Электролиты обычных литий-ионных аккумуляторов изготавливаются из соли лития, растворенной в жидком органическом растворителе, таком как эфир или карбонат. Хотя этот растворитель улучшает характеристики батареи, помогая перемещать ионы лития, он также является потенциальным источником возгорания.
Батареи при работе выделяют тепло. А если в аккумуляторе есть проколы или дефекты, то он будет быстро нагреваться. При температуре выше 140 градусов по Фаренгейту маленькие молекулы растворителя в электролите начинают испаряться, превращаясь из жидкости в газ и раздувая батарею, как воздушный шар, пока газ не загорится, и все это не загорится.
За последние 30 лет исследователи разработали негорючие электролиты, такие как полимерные электролиты, в которых для перемещения ионов используется полимерная матрица вместо классического раствора соли-растворителя. Однако эти более безопасные альтернативы не так эффективно перемещают ионы, как жидкие растворители, поэтому их эффективность не соответствует характеристикам обычных электролитов.
Команда хотела создать электролит на полимерной основе, который мог бы обеспечить как безопасность, так и эффективность. И у Хуанга появилась идея.
Она решила добавить как можно больше литиевой соли под названием LiFSI в электролит на полимерной основе, разработанный и синтезированный Цзянь-Ченг Лаем, докторантом Стэнфордского университета и соавтором статьи.
«Я просто хотел посмотреть, сколько я могу добавить, и проверить предел», — сказал Хуанг. Обычно менее 50% массы электролита на основе полимера составляет соль. Хуан увеличил это число до 63%, создав один из самых соленых электролитов на основе полимеров.
БЕЗОПАСНОСТЬ работает, потому что растворители и соль работают вместе. Молекулы растворителя помогают проводить ионы, что приводит к производительности, сравнимой с производительностью батарей, содержащих обычные электролиты. Но вместо того, чтобы выходить из строя при высоких температурах, как большинство литий-ионных аккумуляторов, аккумуляторы, содержащие SAFE, продолжают работать при температурах от 77 до 212 градусов по Фаренгейту.
Между тем, большое количество добавленных солей действует как якорь для молекул растворителя, предотвращая их испарение и возгорание.
«Это новое открытие указывает на новый подход к проектированию электролитов на основе полимеров», — сказал Женан Бао, профессор Стэнфордского университета и исследователь Стэнфордского института материаловедения и энергетических наук (SIMES), консультирующий Хуана.
Сохранение вязкости
Электролиты на полимерной основе могут быть твердыми или жидкими. Важно отметить, что растворители и соль в SAFE пластифицируют его полимерную матрицу, превращая ее в липкую жидкость, как в обычных электролитах.
Одно преимущество: клейкий электролит может вписаться в существующие коммерчески доступные детали литий-ионных аккумуляторов, в отличие от других появившихся негорючих электролитов. Например, в твердотельных керамических электролитах должны использоваться специально разработанные электроды, что делает их производство дорогостоящим.
«С SAFE нет необходимости менять какие-либо производственные установки, — сказал Хуан. «Конечно, если он когда-либо будет использоваться для производства, электролиту потребуется оптимизация, чтобы вписаться в производственную линию, но работы намного меньше, чем в любой другой системе».
Йи Цуй, профессор SLAC и Стэнфорда и исследователь SIMES, который также консультирует Хуанга, сказал: «Этот очень интересный новый аккумуляторный электролит совместим с существующей технологией ионно-литиевых аккумуляторов и окажет большое влияние на бытовую электронику и электротехнику. транспорт.»
Одно приложение SAFE может быть в электромобилях.
Если несколько литий-ионных аккумуляторов в электромобиле расположены слишком близко друг к другу, они могут нагревать друг друга, что в конечном итоге может привести к перегреву и возгоранию. Но если в электромобиле есть батареи, заполненные таким электролитом, как SAFE, который стабилен при высоких температурах, его батареи можно упаковать близко друг к другу, не беспокоясь о перегреве.
Помимо снижения риска возгорания, это означает меньше места, занимаемого системами охлаждения, и больше места для батарей. Большее количество батарей увеличивает общую плотность энергии, а это означает, что автомобиль может дольше работать без подзарядки.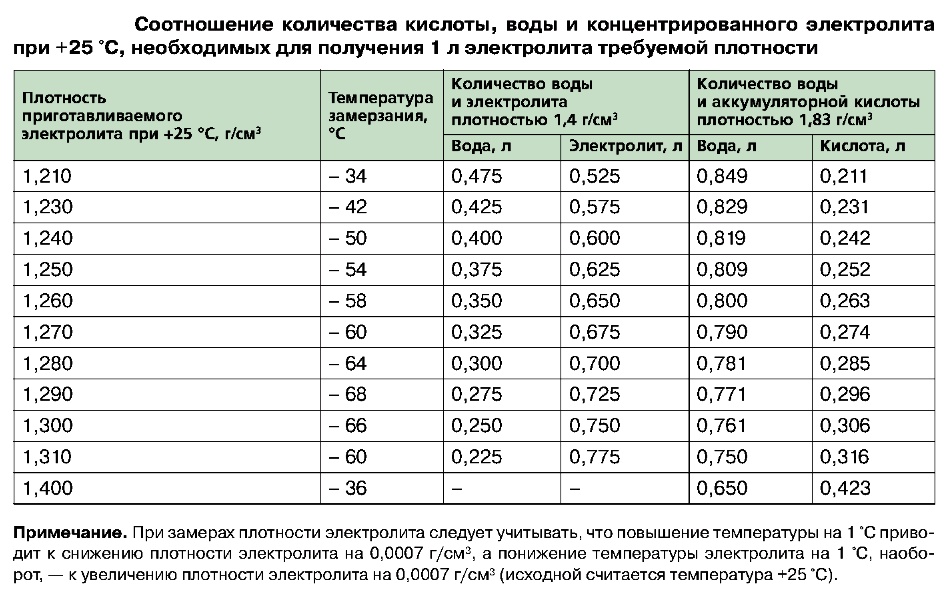

 В любом случае используйте чистую воду, чтобы исключить риск загрязнения, которое может вызвать нежелательные химические реакции.
В любом случае используйте чистую воду, чтобы исключить риск загрязнения, которое может вызвать нежелательные химические реакции.