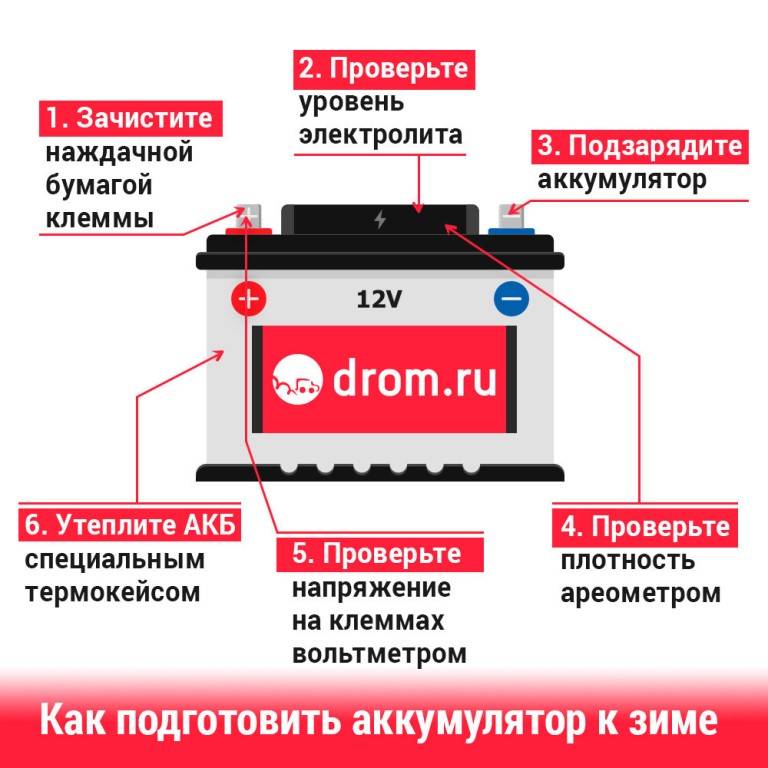
Сколько электролита в аккумуляторе на 60 Ампер, 55 Ампер, 190 Ампер
Аккумуляторные батареи
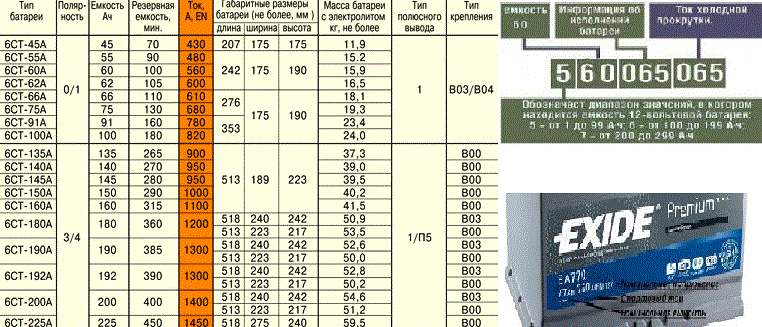
Аккумуляторные батареи отличаются емкостными характеристиками: 55ah, 60ah, 70ah, 44ah и технологией производства. Индикация ампер-часов (Ah) измеряет емкость аккумулятора – количество тока, которое принято при постоянной температуре 27° C в течение 20 часов до напряжения 1,75 вольт на ячейку батареи. Какие технологии используют в АКБ, содержимое батарей – об этом узнаете ниже.
Содержание статьи:
- 1 Характеристики аккумуляторной батареи зависят от материала пластины
- 1.1 Узнай время зарядки своего аккумулятора
- 2 Значение заряда АКБ и плотности электролита
- 3 О заправке АКБ электролитом
Характеристики аккумуляторной батареи зависят от материала пластины
Кальций (CA + / Ca-). Преимущества:
Диагностика АКБ
- низкое потребление воды,
- безопасность при авариях,
- низкий уровень саморазряда.

Кальциевые батареи рекомендуют, если батарея установлена в моторном отсеке и поэтому подвержена воздействию высоких температур или установлена в труднодоступном месте. В новых автомобилях производители теперь используют 90% этого типа батареи.
Гибрид (сурьма + / CA-). Высокое потребление воды по сравнению с чистыми батареями кальция. Время от времени дистиллированную воду пополняют. Таким образом, этот тип аккумулятора распознают по наличию пробки для долива воды. Для дорогих брендовых АКБ потребление воды практически сводится к 0.
Пластины сурьма (сурьма + / сурьма) Редко используется как стартерная батарея. Высокая прочность цикла, но ограниченный ток холодного пуска. Необходимо частое наполнение водой.
АКБ обслуживаемого типа
Из перечисленных выше, рассмотрим АКБ обслуживаемого типа – (сурьма + / Cа- ) и (сурьма + / сурьма – ) свинцово-кислотные батареи, где за счет химической реакции серной кислоты, воды, свинца на электродах батареи образуются электрические заряды.
Снижение уровня электролита в банках аккумулятора происходит за счет уменьшения объема воды. Концентрация серной кислоты при этом не снижается, а может увеличится. Вот почему при отсутствии утечек электролита в банки аккумулятора добавляют дистиллированную воду, чтобы закрыть верхний край пластин на 3-5 мм или до контрольной отметки.
Значение заряда АКБ и плотности электролита
Поскольку уровень заряда батареи будет зависеть от количественного состава химических элементов, участвующих в электролизе, логично предположить, что размеры пластин, вместимость банок – будут отличаться. Если сравнить 45Ah и 75Ah аккумуляторы, то геометрические размеры и вес последнего будут больше.
Свинцово-кислотные обслуживаемые батареи лучше хранятся в сухом виде, не заправленные электролитом. Так будет происходить окисление пластин, но это гораздо меньше, чем потеря массы пластин во время химической реакции. Электролит, если готовить самостоятельно, смешивают в рекомендованных пропорциях.
Электролит, если готовить самостоятельно, смешивают в рекомендованных пропорциях.
О заправке АКБ электролитом
Аккумуляторные заводы дают инструкцию по заправке АКБ. В автомагазинах продают уже готовые электролиты и дистиллированную воду. Воспользуйтесь таблицей для получения 1л электролита.
| Требуемая плотность электролита, г/см3 приведенная к температуре 25°С | Исходное количество воды, л | Требуемое количество кислоты в л плотностью 1,4г/см3 при температуре 25°С |
| 1,22 | 0,490 | 0,522 |
| 1,23 | 0,463 | 0,549 |
| 1,24 | 0,436 | 0,576 |
| 1,25 | 0,410 | 0,601 |
| 1,26 | 0,383 | 0,628 |
| 1,27 | 0,357 | 0,652 |
| !,28 | 0,330 | 0,680 |
| 1,29 | 0,302 | 0,705 |
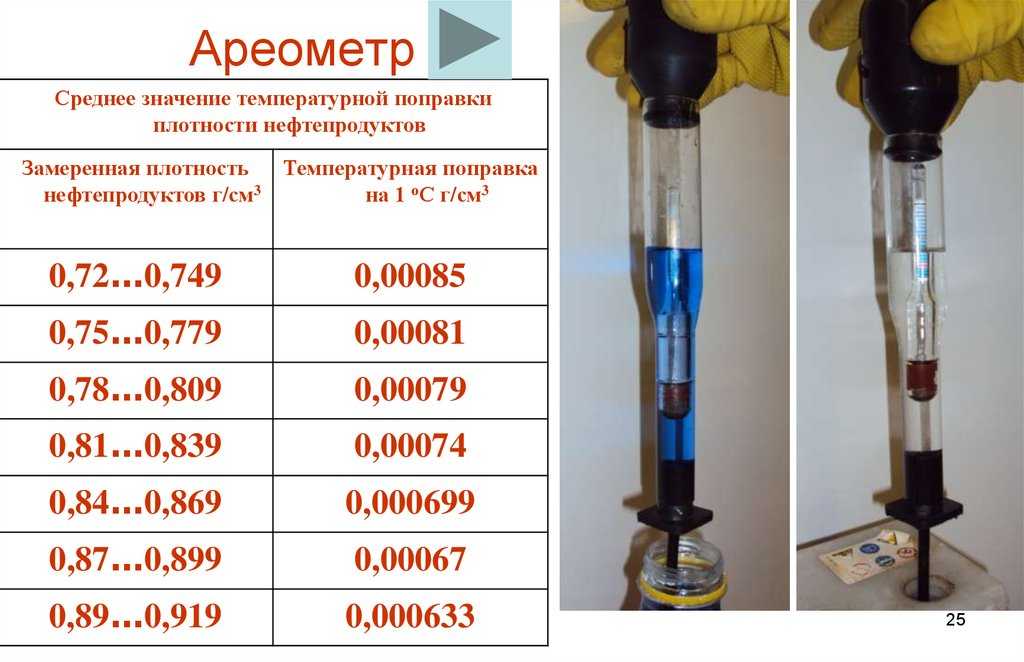
Ареометр
Узнать плотность электролита в АКБ можно ареометром. Как пользоваться указано в прилагаемой инструкции. В зависимости от температуры делается поправка. Если, например, +15°С, то поправка 0, затем на каждые 15 градусов вверх или вниз делается поправка на 0,01г/см3, например, при – 15°С поправку делают – 0,02г/см3.
Как пользоваться указано в прилагаемой инструкции. В зависимости от температуры делается поправка. Если, например, +15°С, то поправка 0, затем на каждые 15 градусов вверх или вниз делается поправка на 0,01г/см3, например, при – 15°С поправку делают – 0,02г/см3.
Раствор электролита готовят из расчета объема, указанного в паспорте. В АКБ 50Ah, 75Ah, 90Ah, 190Ah объем электролита примерно составит 2,5л, 4л, 5л, 10л. Зависит от производителя.
В действительности, уход за обслуживаемыми АКБ, заключается в проверке плотности электролита и заряженности батареи. Надо хотя бы раз в год, в особенности при подготовке к зиме, проверять уровень и плотность электролита, а если АКБ со стажем, то и чаще.
Внимание! Во время работы с электролитом соблюдайте меры предосторожности: работайте в очках и перчатках в проветриваемом помещении. Добавляйте кислоту в воду, а не наоборот. При попадании раствора на кожу, обильно промойте участок проточной водой с добавлением пищевой соды.
Используйте посуду стойкую к кислоте: стекло, керамика, эбонит, пластик.
Если обнаружили, что уровень электролита упал ниже контрольной отметки, проделайте следующее:
АКБ
- Снимите аккумулятор и занесите в теплое проветриваемое помещение.
- Добавьте дистиллированную воду до отметки уровня: на 3-5 мм сверху пластин.
- Зарядным устройством зарядите аккумулятор.
- Если после этого плотность ниже нормы, например, 1,19 – 1,21г/см3, то добавьте электролит, который продается уже в готовом виде плотностью 1,34 – 1,40г/см3. Для этого откачайте грушей электролит из банки и влейте туда свежий.
Внимание! Ни в коем случае не переворачивайте АКБ вверх дном, возможно замыкание пластин отслоившимися кусочками свинца со дна аккумуляторной банки. - Проделайте эту операцию с другими банками, доведя плотность до нормальной. Для умеренного климата 1,25 – 1,27г/см3. Для суровых условий плотность 1,29г/см3.
- Опять зарядите аккумулятор 10% — током Ah аккумулятора, например, если это 60Ah, то ток зарядки сделайте 6А.

Следите за зарядкой, не допускайте разрядов, поддерживайте уровень электролита в банках АКБ. Не допускайте саморазряда аккумулятора, который возможен при неисправностях электропроводки, не плотных контактах, утечках заряда по грязному корпусу аккумулятора. Продлите жизнь АКБ выше гарантийного срока.
Похожие статьи
8 лучших грузовых аккумуляторов на 190 и 200 ампер — Рейтинг 2022
Аккумуляторные батареи для грузовых машин отличаются от моделей АКБ легковых автомобилей большими размерами, повышенными техническими характеристиками. Они адаптированы к высоким нагрузкам, работе в различных регионах страны. Наш рейтинг лучших грузовых аккумуляторов на 190 и 200 ампер-час поможет выбрать нужную модель для водителя. В обзоре мы познакомимся с особенностью работы АКБ, их сильными сторонами и недостатками. Также поможем владельцам транспортных средств правильно выбрать автомобильный аккумулятор на 190 и 200 ампер, ответим на вопросы по эксплуатации.
Также поможем владельцам транспортных средств правильно выбрать автомобильный аккумулятор на 190 и 200 ампер, ответим на вопросы по эксплуатации.
Содержание:
- Лучшие аккумуляторы на 190 ампер-час
— VARTA Promotive Heavy Duty M10 (690 033 120)
— Bosch T3 056 (0 092 Т30 560)
— TYUMEN BATTERY Standard 6СТ-190
— АКОМ 6СТ-190
— Topla Energy Truck (159913/69032)
— Аком Bravo 190
— Mutlu SFB 2 (D5.190.125.A) - Лучший аккумулятор на 200 ампер-час
— VARTA Promotive Heavy Duty N2 (700 038 105) - На что обратить внимание при выборе аккумулятора на 190 и 200 ампер-час
- Часто задаваемые вопросы про грузовые аккумуляторы на 190 и 200 ампер
Лучшие аккумуляторы на 190 ампер-час
VARTA Promotive Heavy Duty M10 (690 033 120)
Описание. Аккумулятор грузовой немецкой компании Varta предназначен для эксплуатации в тяжёлых условиях. Конструкция модели оснащена решёткой PowerFrame, фирменной разработкой компании.
Подобное решение позволяет получить высокий стартовый ток, устойчивость к коррозионным образованиям, допускает выполнить быструю перезарядку АКБ.
Усиленное крепление элементов батареи даёт возможность выдерживать значительные силы вибрации, что важно в условиях применения источников питания в грузовом и сельскохозяйственном транспорте.
Модель нормально функционирует после многочисленных остановок, не боится потери заряда. Это – необслуживаемый аккумулятор прямой полярности. Наличие двух ручек сбоку ударопрочного корпуса облегчает переноску АКБ.
VARTA Promotive Heavy Duty M10 (690 033 120).
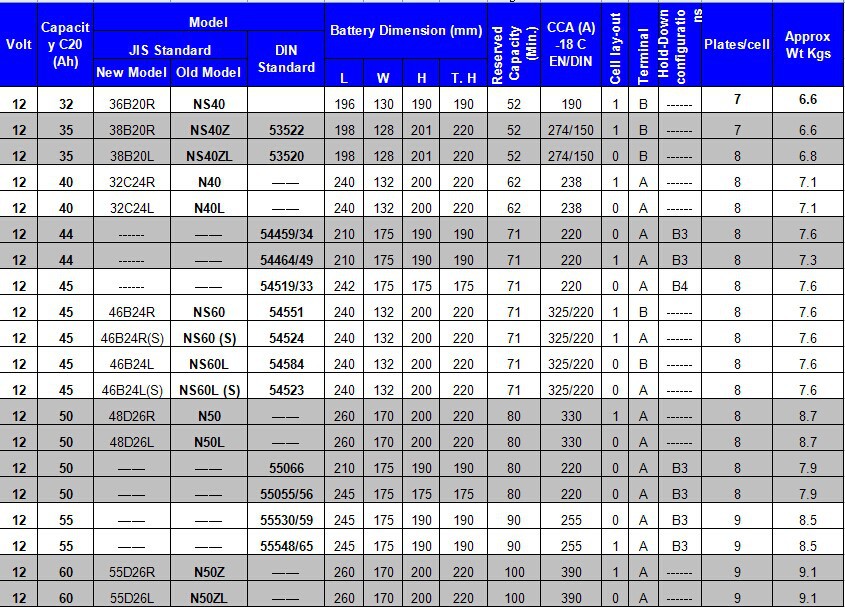
Характеристики. Габариты: 513х223х223 мм.
- Вес: 45 кг.
- Пусковой ток: 1200 А.
- Рабочее напряжение: 12 В.
Плюсы VARTA Promotive Heavy Duty M10 (690 033 120):
- Качество пластика.
- Удобный в работе.
- Уверенный запуск агрегата в морозы.
- Есть защита клеммам.

- Знаменитая фирма.
Минусы VARTA Promotive Heavy Duty M10 (690 033 120):
- Не обнаружено.
Очень хорошо пишут про данную модель АКБ в отзывах автовладельцы, замечаний по работе не имеется.
Bosch T3 056 (0 092 Т30 560)
Описание. Аккумулятор для грузовых автомобилей прямой полярности другого известного бренда из Германии Bosch произведён по гибридной технологии.
Положительный электрод батареи выполнен из сплава свинца и сурьмы, отрицательный – свинца и кальция.
Подобная комбинация материалов обеспечивает стойкость батареи к глубоким разрядам, нивелирует саморазряд, минимизирует испарение воды.
Катод произведён при низких температурах, что увеличивает эксплуатационные параметры источника питания. Батарея необслуживаемая, однако возможен долив воды через пробки в крышке.
В полимерном материале корпуса присутствуют добавки, позволяющие эксплуатацию АКБ при низких минусовых температурах.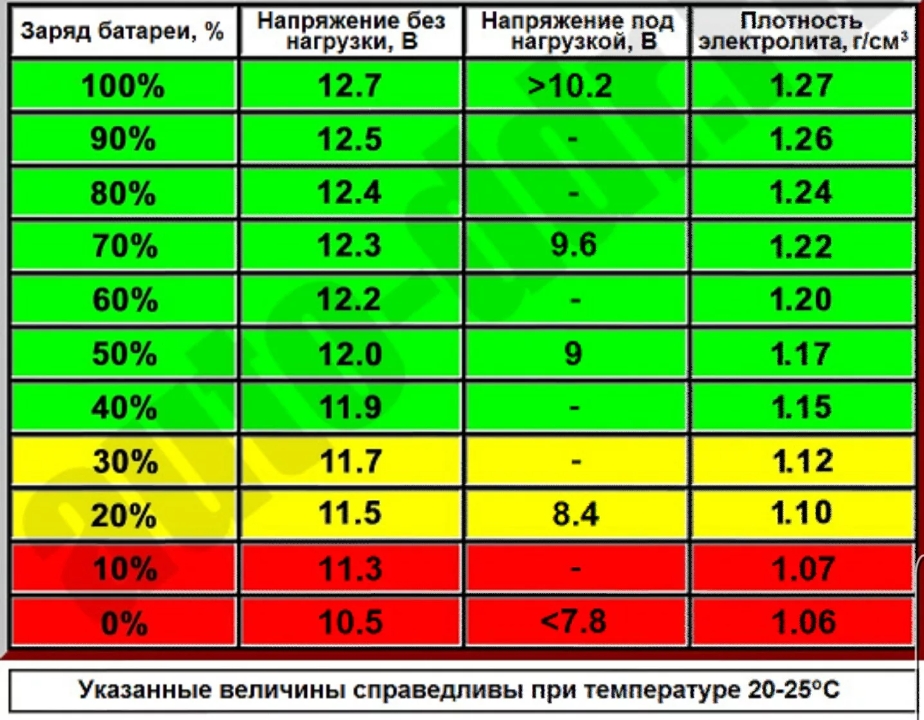
Наличие выступа в нижней части корпуса даёт возможность прочно закрепить батарею на площадке.
Bosch T3 056 (0 092 Т30 560).
Характеристики. Размеры: 513x223x223 мм.
- Масса: 51 кг.
- Пусковой ток: 1200 А.
- Напряжение для работы: 12 В.
Плюсы Bosch T3 056 (0 092 Т30 560):
- Новая АКБ – полностью заряженная.
- В наличие пластиковые колпачки, защищающие клеммы о воды и грязи.
- Есть наклейки на корпусе по эксплуатации.
- Отличные рабочие показатели.
- Не подводит в морозы с запуском.
Минусы Bosch T3 056 (0 092 Т30 560):
- Неудобные ручки для транспортировки.
Пользователи рекомендуют модель к покупке, она их не подводит.
TYUMEN BATTERY Standard 6СТ-190
Описание. Характерной особенностью в работе аккумулятора 190 А-ч тюменского производителя является его адаптация к сложным климатическим условиям эксплуатации в северных регионах России.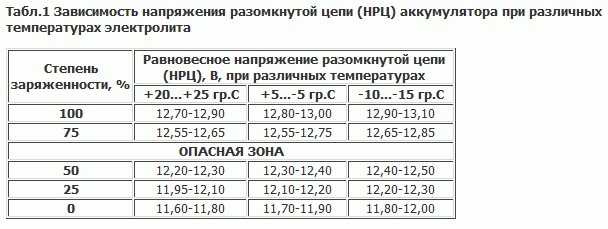
Повышенный пусковой ток позволяет забыть о проблемах с запуском силового агрегата при сильных морозах.
Пластиковый корпус с оригинальными добавками надёжно защищает начинку батареи от холода.
Батарея обладает прямой полярностью, плюс – слева, при просмотре от клемм. Клеммы источника питания – европейского типа, под конус.
Модель произведена по кальциевой технологии, что гарантирует пластинам АКБ устойчивость к коррозии, увеличивает эксплуатационный срок.
Надёжное крепление позволяет конструкции модели не бояться сил вибрации, механических контактов.
Тюмень 6СТ-190.
Характеристики. Габариты: 518х228х238 мм.
- Вес: 51 кг.
- Ток холодного запуска: 1320 А.
- Напряжение в сети автомобиля: 12 В.
Плюсы TYUMEN BATTERY Standard 6СТ-190:
- Мощный пусковой ток.
- Приятный фирменный дизайн.
- Адекватная цена.
- Не подводит в любое время года.

- Возможность долива воды.
Минусы TYUMEN BATTERY Standard 6СТ-190:
- Неважное качество пластика.
У этой модели грузовых аккумуляторов в основном положительные отзывы, автовладельцев устраивает её работа.
АКОМ 6СТ-190
Описание. Аккумулятор для грузовых автомобилей компании из России выпускается по технологии Punch.
Это говорит о том, что в свинцово-кальциевые сплавы, идущие на изготовление решётки, легируются серебром.
Подобная добавка укрепляет конструкцию, препятствует распространению коррозионных очагов. Драгоценный металл улучшает прочность модели, увеличивает её рабочий ресурс.
АКБ обратной полярности выполнена в морозостойком корпусе, не боящимся ударов. Наличие ручек с обеих сторон делает удобнее переноску батареи.
Элементы аккумулятора производятся по растяжной температуре при более низких температурах. Такой метод делает решётку прочнее, устойчивее к вибрационным силам.
АКОМ 6СТ 190.
Характеристики. Размеры: 513x223x215 мм.
- Вес: 50 кг.
- Ток запуска: 1200 А.
- Напряжение в автомобильной сети: 12 В.
Плюсы АКОМ 6СТ-190:
- Лаконичное рабочее оформление.
- Нормально переносит морозы.
- Добротная сборка.
- Новый приходит заряженным.
- Разумная стоимость.
Минусы АКОМ 6СТ-190:
- Неудобные ручки для тяжёлой АКБ.
Пользователи привыкли к постоянному присутствию в рейтингах лучших аккумуляторов 190 ампер-час наших моделей. Их привлекает в отечественных АКБ не только приемлемая цена, но и качество товара.
Topla Energy Truck (159913/69032)
Описание. Эта модель словенской компании отвечает всем требованиям, предъявляемым к грузовым аккумуляторам.
При производстве АКБ используется сурьмянисто-кальциевая технология или сокращённо Sb/Ca. Подобное легирование делает прочнее батарею, улучшает характеристики, в частности, стартовый ток.
Подобное легирование делает прочнее батарею, улучшает характеристики, в частности, стартовый ток.
Решётки АКБ изготовлены просечно-растяжным способом. Такой метод позволяет элементам конструкции успешно противостоять силам вибрации.
Надёжная защита от коррозии, короткого замыкания увеличивает эксплуатационный ресурс модели, позволяет использовать её в различных климатических условиях.
Батарея обратной полярности с электролитом в комплекте предназначена для установки на автомобилях со средним количеством локальных потребителей электроэнергии.
Topla Energy Truck 159913/69032.
Характеристики. Габариты: 513х223х223 мм.
- Масса: 45 кг.
- Ток холодного запуска: 1200 А.
- Рабочее напряжение; 12 В.
Плюсы Topla Energy Truck (159913/69032):
- Надёжный, предсказуемый аккумулятор.
- Европейская сборка.
- Качество материалов.
- Быстрый запуск двигателя в холод.

- Нормальная цена.
Минусы Topla Energy Truck (159913/69032):
- Смущает небольшая масса.
Аком Bravo 190
Описание. Фирменными фишками аккумуляторов 190 А-ч линейки Bravo являются:
- стабильная работа в течение долгого времени без изменений технических характеристик;
- сохранение объёма электролита на протяжении всего срока эксплуатации;
- улучшенные показатели.
Эта батарея произведена по современной кальциевой технологии, которую характеризует минимальный уровень саморазряда батареи, повышенный рабочий ресурс, минимальный электролиз.
Аком Bravo 190 способна демонстрировать свои заявленные производителем свойства как в обычных, так и в экстремальных условиях.
Прочный пластик корпуса предохраняет конструкцию от механических соприкосновений, стойко выдерживает низкие температуры.
Аком Bravo 190.
Характеристики. Размеры: 513x223x213 мм.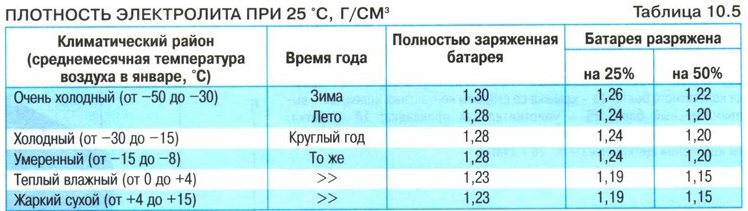
- Вес: 46 кг.
- Пусковой ток: 1100 А.
- Напряжение в автомобильной сети: 12 В.
Плюсы Аком Bravo 190:
- Качество производства.
- Удобен в переноске.
- Возможность добавки воды.
- Есть выступ для крепления.
- Пригоден для зимней эксплуатации.
Минусы Аком Bravo 190:
- Высокая для российской продукции цена.
Хорошая, рабочая модель без изъянов в работе, так охарактеризовали АКБ пользователи.
Mutlu SFB 2 (D5.190.125.A)
Описание. Необслуживаемый аккумулятор для грузовых автомобилей компании из Турции выполнен по технологии SFB второй серии.
В качестве рабочего тела в ней используется электролит нового поколения.
К числу характерных особенностей Superior Flooded Battery Technology можно отнести:
- повышенную прочность конструкции благодаря использования кальциевых сплавов с добавками серебра;
- улучшенную производительность по сравнению с аналоговой продукцией;
- стойкость к действию вибрационных сил.

Также модель Mutlu SFB 2 привлекает внимание покупателей фирменным оформлением и повышенным уровнем безопасности.
Герметичная крышка гарантирует отсутствие утечек. Пластиковые колпачки клемм защищают их от пыли и воды, а водителя от случайного касания.
Mutlu SFB 2 (D5.190.125.A).
Характеристики. Габариты: 513x223x223 мм.
- Масса: 47 кг.
- Ток холодной прокрутки: 1250 А.
- Напряжение в бортовой сети: 12 В.
Плюсы Mutlu SFB 2 (D5.190.125.A):
- Надёжная АКБ с долгим рабочим ресурсом.
- Эффектный дизайн.
- Прочный, стойкий к ударам пластик.
- Наличие буртика для фиксации.
- Именитая торговая марка.
Минусы Mutlu SFB 2 (D5.190.125.A):
- Неудобные ручки.
Эта модель – лучшая в своём сегменте, считают пользователи. Они рекомендуют приобрести этот аккумулятор на 190 ампер-час потенциальным покупателям.
Лучший аккумулятор на 200 ампер-час
VARTA Promotive Heavy Duty N2 (700 038 105)
Описание. Серия аккумуляторов для грузовых автомобилей Heavy Duty компании Варта предназначена для использования в сложных климатических условиях, в работе с экстремальными нагрузками.
Особенности конструкции PowerFrame позволяют батарее стойко переносить «рваный» ритм движения с частыми остановками, простоями.
Положительный электрод, на долю которого выпадает основная нагрузка при работе, обладает усиленной решёткой, что увеличивает его рабочий ресурс, улучшает производительность.
Сама конструкция решётки выполнена методом штамповки, обеспечивающим гибкость детали и улучшающим стойкость к вибрационным процессам.
Использование оригинальных пропорций составляющих сплавы позволяет увеличить стойкость к коррозии.
Корпус модели обратной полярности выполнен из морозоустойчивого полимерного материала, что даёт возможность использовать её в районах с низкими минусовыми температурами.
VARTA Promotive Heavy Duty N2 (700 038 105).
Характеристики. Размер: 518x276x242 мм.
- Вес: 53,6 кг.
- Ток запуска: 1050 А.
- Рабочее напряжение: 12 В.
Плюсы VARTA Promotive Heavy Duty N2 (700 038 105):
- Качество материала.
- Прочные ручки.
- В наличии колпачки защиты клемм.
- Уверенный запуск мотора.
- Именитый бренд.
Минусы VARTA Promotive Heavy Duty N2 (700 038 105):
- Высокая цена.
Батарея из серии: «поставил – забыл», такое мнение о модели у автовладельцев.
На что обратить внимание при выборе аккумулятора на 190 и 200 ампер-час
Владельцы грузовых машин должны подходить с большой ответственностью к выбору аккумуляторной батареи.
От её надёжности, способности завести двигатель в любую погоду, зависит доставка грузов, зарплата самого водителя.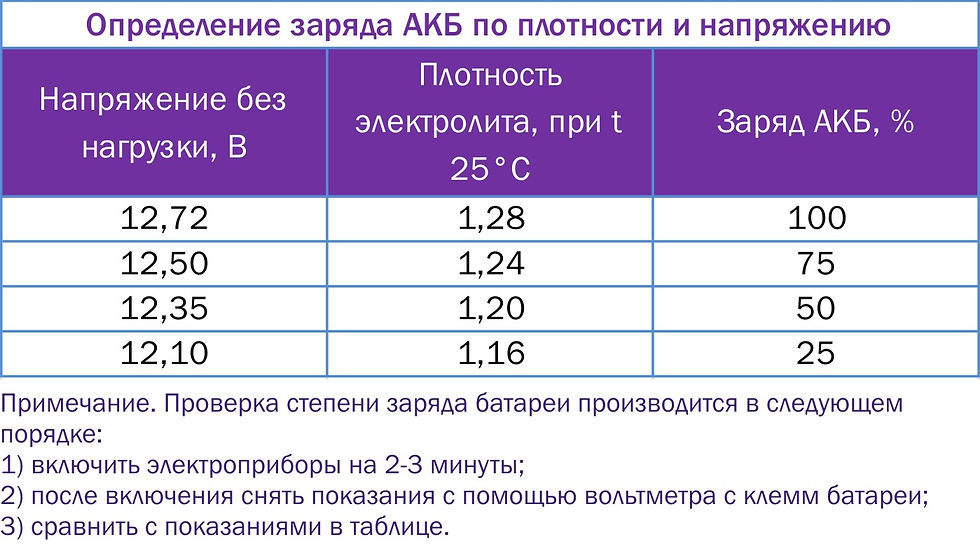
Поэтому прежде, чем купить аккумулятор на 190 ампер-час по цене, подходящей для финансового состояния автовладельца, он должен определиться со следующими критериями:
Величина стартового тока
Автовладелец, чья машина нередко бывает в поездках по северным районам страны, должен позаботиться об уверенном запуске двигателя при минусовой температуре.
Для этого следует приобретать аккумулятор с наибольшим стартовым током, но не превышающим максимально разрешенные характеристики автомобиля.
Размеры аккумуляторной батареи
Они могут быть разными, но критериями габаритов аккумулятора 190 А-ч должны стать размеры площадки в автомобиле, где будет стоять батарея.
Полярность
Также важный фактор при выборе. Соответствие по полярности с расположением высоковольтных проводов под капотом грузового автомобиля поможет комфортно подсоединить их.
В ином случае придётся натягивать провода, подвергать их риску обрыва.
Компания-изготовитель
Следует отдавать предпочтение компаниям, обладающим хорошей репутацией на рынке.
Информацию об этом можно получить на автомобильных форумах интернета. Нужно отметить такой нюанс – хороший аккумулятор 190 ампер-час не может стоить дёшево. За качество нужно платить.
Надеемся, что наш обзор поможет автовладельцам выбрать нужную для них модель грузового аккумулятора.
Ответы на часто задаваемые вопросы про грузовые аккумуляторы на 190 и 200 ампер
Как правильно заряжать грузовой аккумулятор на 190 и 200 ампер-час?
Зарядку аккумулятора 190-200 А-ч следует производить промышленным зарядником с соблюдением правил безопасности, описанных в инструкции.
Величина зарядного тока равна 10% от ёмкости АКБ, т.е. она должна быть равна 19 А.
Сколько должен весить грузовой аккумулятор на 190 и 200 ампер-час?
Вес аккумулятора подобной ёмкости в среднем равен 47-52 кг.
Сколько должно быть электролита в грузовом аккумуляторе на 190 и 200 ампер-час?
В грузовом аккумуляторе такой ёмкости находится 12-13 л электролита.
Сколько по времени заряжается грузовой аккумулятор на 190 и 200 А-ч зарядным устройством?
Аккумулятор автомобильный 190 и 200 ампер-час заряжается в среднем 10-12 часов.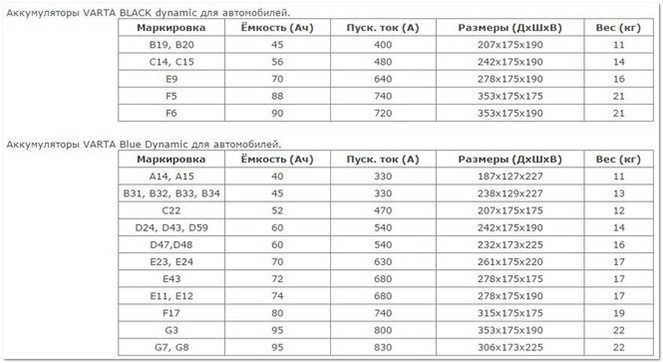
Можно ли ставить аккумулятор на 190 вместо 200 ампер-час?
Ставить аккумуляторную батарею большей ёмкости не запрещается, если подходят размеры АКБ под габариты установочной площадки.
Что значит 190 и 200 А-ч на аккумуляторе?
Показатель 190 и 200 А-ч означает ёмкость аккумулятора для грузовых автомобилей.
Патент США на вторичный аккумулятор Патент (Патент № 4,092,463, выдан 30 мая 1978 г.)
Большинство обычных вторичных аккумуляторов содержат электроды второго рода, в случае которых продукты разряда нерастворимы в электролите и остаются в пористой структуре электролита. материал электрода. Типичными примерами таких электродов являются Pb/PbSO4/H2SO4, Cd/Cd(OH)2/KOH и NiOOH/Ni(OH)2/KOH. , при котором продукты разряда, а именно сульфат свинца, гидроксид кадмия и никеля соответственно, нерастворимы в электролите. Преобладало мнение, что эффективные вторичные батареи не должны содержать никаких других типов электродов.
Однако уже было раскрыто использование электродов первого типа во вторичных батареях. В их случае продукт разряда растворяется и при зарядке транспортируется обратно из раствора на поверхность электрода и там осаждается. Таким образом, активные материалы формируются и растворяются в виде электродных слоев. Примерами таких электродов являются Zn/K 2 [Zn(OH) 4 ], MnO 2 /MnSO 4 и Pb или PbO 2 /Pb(BF 4 ). 4).под.2. Щелочной цинковый/цинкатный электрод на практике используется в батареях на основе цинка/оксида никеля, цинка/оксида серебра и цинк/воздух.
В их случае продукт разряда растворяется и при зарядке транспортируется обратно из раствора на поверхность электрода и там осаждается. Таким образом, активные материалы формируются и растворяются в виде электродных слоев. Примерами таких электродов являются Zn/K 2 [Zn(OH) 4 ], MnO 2 /MnSO 4 и Pb или PbO 2 /Pb(BF 4 ). 4).под.2. Щелочной цинковый/цинкатный электрод на практике используется в батареях на основе цинка/оксида никеля, цинка/оксида серебра и цинк/воздух.
Электроды в растворенном состоянии MnO 2 вместе с электродами в растворенном состоянии кислого цинка в кислых электролитах образуют элемент цинк/MnO 2 . Кислотный цинковый электрод в растворенном состоянии в кислых электролитах также используется в ячейке Zn/PbO 2 /H 2 SO 4 , которая известна уже много лет. Последние упомянутые электроды из свинца и диоксида свинца используются во вторичной батарее свинца в растворенном состоянии, в которой электролитом является, например, хлорная кислота, тетрафтороборная кислота, гексафторокремниевая кислота или амидосульфокислота.
Электроды первого типа имеют некоторые основные преимущества по сравнению с обычными электродами второго типа, а именно более высокую конверсию активного материала, более высокий КПД и улучшенные низкотемпературные характеристики. Таким образом, можно ожидать более высокой плотности энергии и выходной плотности в широком диапазоне температур. Однако, как правило, аккумуляторы в растворенном состоянии не могут эксплуатироваться без циркуляции электролита.
Известно, что в то время как свинцовый электрод в ячейке с растворенным свинцом ведет себя почти идеально, электрод из диоксида свинца проявляет необратимые явления, особенно во время разряда. Рассматриваемые явления представлены в недавней статье (Ber. Bunsenges. 79)., (1975), 133). Эта частичная необратимость электрода PbO 2 препятствует, прежде всего, частому циклированию свинцового элемента, т.е. в долговременном поведении клетки. В конце фазы разряда на опорной пластине положительного электрода остается остаточный оксид. Неполное восстановление слоя PbO 2 также вызывает отслаивание оксида в течение периода разряда. Оксидные частицы, скапливающиеся на дне ячейки, конечно, также не способны к дальнейшему циклированию. Кроме того, диоксид свинца подвергается все большей коррозии в кислоте под катодной нагрузкой. Все три эффекта вместе приводят к потере выхода по току, что проявляется в эквивалентном ему количестве остаточного свинца на пластине основания отрицательного электрода. В соответствии с этим механизмом определенная доля ионов свинца извлекается из системы в течение каждого цикла для формирования активного состава, так что количество достижимых циклов относительно невелико. Таким образом, вторичная батарея, основанная на этой системе, которая допускает большое количество циклов, достижима только в том случае, если окажется возможным существенно подавить эти необратимые явления, которые начинаются с диоксида свинца.
Неполное восстановление слоя PbO 2 также вызывает отслаивание оксида в течение периода разряда. Оксидные частицы, скапливающиеся на дне ячейки, конечно, также не способны к дальнейшему циклированию. Кроме того, диоксид свинца подвергается все большей коррозии в кислоте под катодной нагрузкой. Все три эффекта вместе приводят к потере выхода по току, что проявляется в эквивалентном ему количестве остаточного свинца на пластине основания отрицательного электрода. В соответствии с этим механизмом определенная доля ионов свинца извлекается из системы в течение каждого цикла для формирования активного состава, так что количество достижимых циклов относительно невелико. Таким образом, вторичная батарея, основанная на этой системе, которая допускает большое количество циклов, достижима только в том случае, если окажется возможным существенно подавить эти необратимые явления, которые начинаются с диоксида свинца.
Целью настоящего изобретения является создание аккумуляторной батареи, которая содержит водные растворы солей свинца в качестве электролита и которую можно часто задействовать без вышеуказанных недостатков.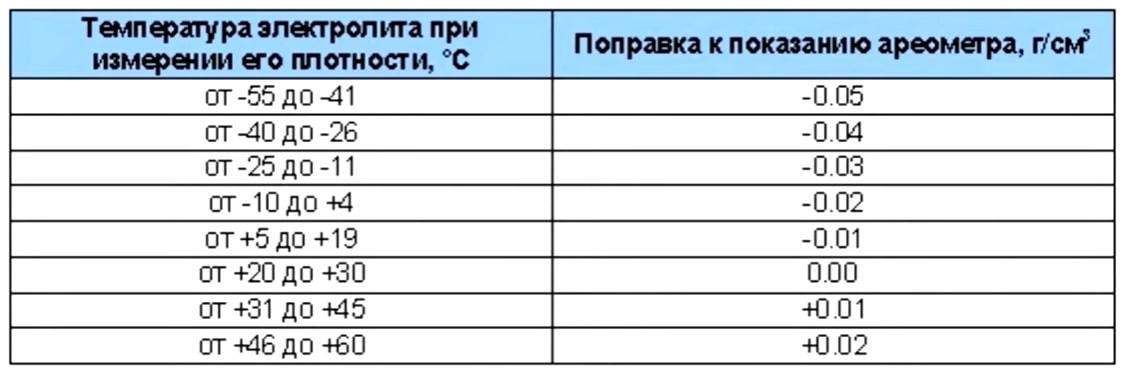
Мы обнаружили, что эта цель достигается, если окислительно-восстановительные системы, которые имеют стандартный потенциал от -0,1 до +1,4 В относительно стандартного водородного электрода сравнения, растворяются в электролите, при условии, что окислительно-восстановительные системы не образуют нерастворимых соединения с электролитом и не окисляются или необратимо восстанавливаются активным материалом в диапазоне их рабочих потенциалов.
Окислительно-восстановительные системы, присутствующие в электролите в соответствии с изобретением, имеют окислительно-восстановительный потенциал, который находится между стандартным потенциалом свинца — активного материала на отрицательной стороне, а именно o U H = 0,13 В, а стандартный потенциал двуокиси свинца — активного материала на положительной стороне — o U H = 1,46 В. Предпочтительно окислительно-восстановительные системы имеют стандартный потенциал от +0,1 до 1,1. V относительно стандартного водородного электрода сравнения. Важно, чтобы системы не образовывали нерастворимых соединений с растворенными солями свинца электролитов или с соответствующими кислотами и чтобы они не подвергались необратимому окислению или восстановлению активными веществами, нанесенными на опорные пластины электродов во время заряда, т. е. свинцом или двуокисью свинца при соответствующих потенциалах.
е. свинцом или двуокисью свинца при соответствующих потенциалах.
Особенно подходящие окислительно-восстановительные системы и их стандартные потенциалы перечислены ниже:
__________________________________________ V+++ /VO++++ (+0,36 В) Дурогидрохинон/дурохинон (+0,48 В) U.sup. +++ /UO 2 ++ (+0,62 В) Гидрохинон/хинон (+0,70 В) Fe++ /Fe+++ (+0,77 В) NO . 3 — /NO 2 — (+0,94 В) __________________________________________
Ванадий, уран и железо целесообразно добавлять в электролит в виде солей, анион которых соответствует аниону соли свинца содержится в электролите. Нитрат/нитрит целесообразно добавлять в электролит в виде нитрита натрия или HNO 3 . Особенно предпочтительна окислительно-восстановительная система Fe++/Fe+++.
Как правило, достаточно добавить в раствор один окислительно-восстановительный компонент, предпочтительно в восстановленной форме, поскольку во время работы батареи быстро устанавливается стационарное окислительно-восстановительное отношение.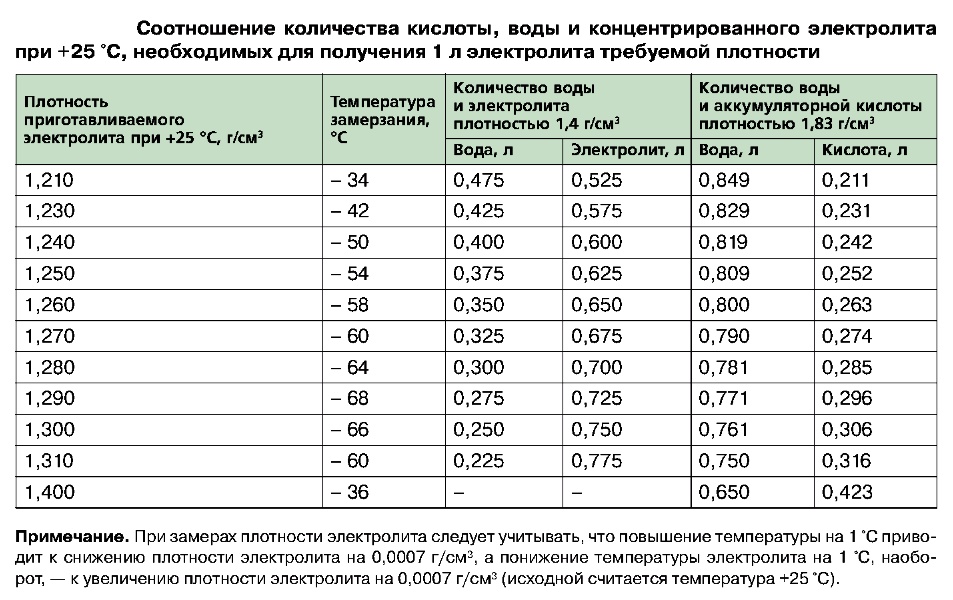
Концентрация окислительно-восстановительных компонентов, как правило, должна поддерживаться на низком уровне, чтобы уменьшить потери выхода по току, и составляет от 0,1 до 100 ммоль/л, предпочтительно от 1 до 30 ммоль/л.
Кроме того, оказалось выгодным добавлять окислительно-восстановительную систему не только в электролит, но также и в инертную опорную пластину электрода на положительной стороне, т.е. опорная пластина электрода, на которой во время зарядки осаждается диоксид свинца; эта последняя окислительно-восстановительная система должна быть нерастворима в электролите и также иметь потенциал от -0,1 до +1,4 В, предпочтительно от +0,1 до 1,1 В относительно стандартного водородного электрода. Подходящими материалами для этой опорной плиты электрода являются титан, а также, прежде всего, графит, электродный уголь и наполненные графитом пластмассы, т.е. частицы графита, встроенные в связующие вещества, устойчивые к электролиту. Примерами подходящих связующих являются полипропилен, полиэтилен и поливинилхлорид. Преимущественно связующее содержит от 50 до 80 мас.% графита. Согласно изобретению эти опорные пластины электродов могут содержать нерастворимые окислительно-восстановительные системы, которые могут быть введены в электрод в качестве наполнителя, но которые должны по крайней мере присутствовать на поверхности электрода. Подходящими нерастворимыми окислительно-восстановительными компонентами являются магнетит, оксид железа-(III), фталоцианин железа, оксид ванадия-(III), оксид урана-(IV) и полигидрохинон.
Преимущественно связующее содержит от 50 до 80 мас.% графита. Согласно изобретению эти опорные пластины электродов могут содержать нерастворимые окислительно-восстановительные системы, которые могут быть введены в электрод в качестве наполнителя, но которые должны по крайней мере присутствовать на поверхности электрода. Подходящими нерастворимыми окислительно-восстановительными компонентами являются магнетит, оксид железа-(III), фталоцианин железа, оксид ванадия-(III), оксид урана-(IV) и полигидрохинон.
Окислительно-восстановительные системы вводят в опорные пластины электродов в количестве от 0,01 до 20% по весу, предпочтительно от 0,1 до 3% по весу.
При использовании опорных пластин электродов, состоящих из пластмассы, наполненной графитом, возможно и выгодно использовать природный графит, напр. чешуйки природного графита с размером частиц от 0,1 до 0,2 мм, графит которых содержит около 1% по массе железа и одновременно служит окислительно-восстановительной системой.
Окислительно-восстановительные системы могут использоваться по отдельности или в комбинации; например, электролит может содержать смесь окислительно-восстановительных систем V+++/V4+ и хинон/гидрохинон.
Остальные параметры не отличаются от тех, которые обычно встречаются в свинцовых элементах в растворенном состоянии. Соответственно, предпочтительными растворами солей свинца являются водные растворы тетрафторбората свинца, гексафторсиликата свинца, перхлората свинца и амидосульфоната свинца, используемые по отдельности или в виде смесей. Как правило, свободная кислота присутствует в избытке до 100 мол.% (в разряженном состоянии). Концентрации солей составляют от не менее 20 мас.% до концентрации насыщения. В качестве опорных пластин отрицательного электрода также могут быть использованы вышеуказанные графитовые материалы и, кроме того, кислотостойкие металлы, например медь, монель-металл, сплавы никеля с молибденом, хромом, марганцем, медью, кремнием или железом в качестве компонентов сплава или кислотостойкие стали, содержащие хром, никель или молибден. В целом электроды имеют гладкую поверхность. Однако для лучшей адгезии активных материалов, в частности PbO 2 , целесообразно обеспечить структурированную поверхность, т.е. использовать пластины с фрезерованными канавками или пирамидами, просечно-вытяжные листы, сетки или пластины, подвергнутые пескоструйной обработке. Электропроводка электродов может быть монополярной или предпочтительно биполярной. Предпочтительно циркулировать электролит, т.е. перемешиванием или перекачиванием при загрузке и/или разгрузке.
В целом электроды имеют гладкую поверхность. Однако для лучшей адгезии активных материалов, в частности PbO 2 , целесообразно обеспечить структурированную поверхность, т.е. использовать пластины с фрезерованными канавками или пирамидами, просечно-вытяжные листы, сетки или пластины, подвергнутые пескоструйной обработке. Электропроводка электродов может быть монополярной или предпочтительно биполярной. Предпочтительно циркулировать электролит, т.е. перемешиванием или перекачиванием при загрузке и/или разгрузке.
При загрузке конверсия растворов солей свинца составляет от 10 до 90%, предпочтительно от 20 до 70%. Плотности тока при зарядке и разрядке составляют от 0,5 до 25 А/дм 2 , предпочтительно от 1 до 10 А/дм 2 . Предпочтительно уменьшать плотность зарядного тока ближе к концу заряда. Величина заряда на единицу площади составляет от 0,1 до 10 Ад/дм 2 , предпочтительно от 1 до 5 Ач/дм 2 .
Неожиданно окислительно-восстановительные добавки по изобретению вызывают однородное катодное растворение диоксида свинца в аккумуляторе. Необратимые явления, особенно к концу разряда, практически не возникают. На электроде остается лишь небольшое количество остаточного оксида, не склонного к накоплению. Точно так же сильно замедляется накопление свинца на противоэлектроде. Количество оксидного шлама также очень мало.
Необратимые явления, особенно к концу разряда, практически не возникают. На электроде остается лишь небольшое количество остаточного оксида, не склонного к накоплению. Точно так же сильно замедляется накопление свинца на противоэлектроде. Количество оксидного шлама также очень мало.
Вторичные батареи, которые содержат окислительно-восстановительные системы по изобретению, но которые после очень длительных циклов перестают использоваться из-за накопления необратимо отложившегося материала, могут быть просто и эффективно регенерированы в присутствии окислительно-восстановительных систем. Это достигается следующими мерами, которые применяются по отдельности или в комбинации:
a. Дальнейшая циркуляция электролита при закороченной батарее. б. То же, что и в (а), но дополнительно сопровождающееся пропусканием через аккумулятор медленного мелкодисперсного потока воздуха. в. Изменение полярности батареи (во время зарядки) при малых плотностях тока от 0,01 до 0,2 А/дм 2 при продолжении циркуляции электролита и, при необходимости, при пропускании воздуха через батарею.
Без окислительно-восстановительной системы процессы регенерации протекают слишком медленно или могут привести к разрушению батареи. Например, в способе (с) свинец может осаждаться на положительном электроде. С обычными батареями эти меры нельзя эффективно использовать, поскольку, например, активный материал, оторвавшийся от пластин, не может повторно раствориться. Соответственно, батарея по изобретению отличается не только длительным сроком службы, но также может быть легко регенерирована и, таким образом, имеет практически неограниченный срок службы.
РИС. 1 показан двухэлектродный элемент, используемый во вторичной батарее согласно первому примеру настоящего изобретения.
РИС. 1а показана в увеличенном масштабе структура электрода ячейки по фиг. 1.
РИС. 2 представляет собой график, показывающий изменение напряжения заряда и напряжения разряда для различных циклов.
РИС. 3 показан многоэлектродный элемент, используемый во вторичной батарее согласно второму примеру изобретения.
РИС. 4 представляет собой график, суммирующий кривые потенциал-время, полученные для различных электролитов в еще одном примере.
ПРИМЕР 1
A. Коробчатая ячейка 1, показанная на фиг. 1 состоит из полиметилметакрилата и закрывается крышкой 1а. Две прямоугольные опорные пластины электродов 2 и 3 из графитонаполненного пластика стоят в ячейке в направляющих пазах на расстоянии 25 мм друг от друга. Зазор от дна составляет около 10 мм для предотвращения короткого замыкания из-за упавшего на дно активного состава. Электроды состоят из внутреннего слоя 4 из шероховатой листовой латуни толщиной 1 мм (фиг. 1а), поверх которого со всех сторон в соответствующей форме в нагретом прессе при 190° С и 10 атмосфер. Этот наполненный пластик состоит из 20% по весу полипропилена и 80% по весу природного графита в виде чешуек, имеющих гранулометрический состав в соответствии с DIN 4188, с удержанием не менее 70% на сите 0,16 мм. Природный графит, в свою очередь, содержит от 93 до 95 мас.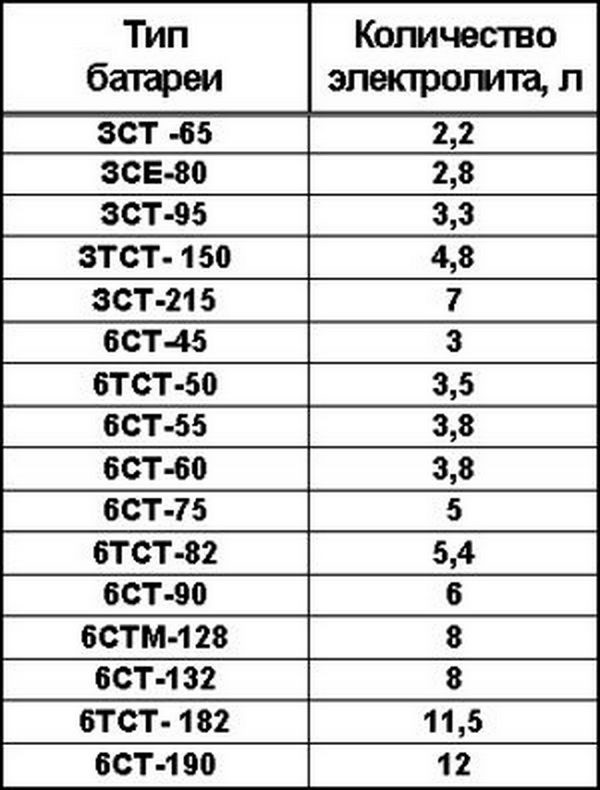 % (чистого) графита и от 5 до 7 мас.% золы. Зола в основном состоит из SiO 2 и Al 2 O 2 . 3, но также присутствует в общей сложности 1,12 вес.% железа в пересчете на природный графит, из которых 0,47 вес.% железа находится в нерастворимой форме. Поверхность электрода, обращенная к электролиту, равномерно шероховатая с помощью пескоструйной обработки. Ток подается через латунные соединения 6, защищенные кислотостойким реакционно-отверждаемым поверхностным покрытием и проходящие через крышку. Электролит перемешивают с помощью небольшой стержневой магнитной мешалки 7. Для большей эффективности к указанному магниту прикреплена полипропиленовая полоса 8 шириной 8 мм, другой конец которой снабжен подшипником в крышке. Во время езды на велосипеде это устройство вращается со скоростью около 100 об/мин.
% (чистого) графита и от 5 до 7 мас.% золы. Зола в основном состоит из SiO 2 и Al 2 O 2 . 3, но также присутствует в общей сложности 1,12 вес.% железа в пересчете на природный графит, из которых 0,47 вес.% железа находится в нерастворимой форме. Поверхность электрода, обращенная к электролиту, равномерно шероховатая с помощью пескоструйной обработки. Ток подается через латунные соединения 6, защищенные кислотостойким реакционно-отверждаемым поверхностным покрытием и проходящие через крышку. Электролит перемешивают с помощью небольшой стержневой магнитной мешалки 7. Для большей эффективности к указанному магниту прикреплена полипропиленовая полоса 8 шириной 8 мм, другой конец которой снабжен подшипником в крышке. Во время езды на велосипеде это устройство вращается со скоростью около 100 об/мин.
Ячейка заполнена 205 мл водного раствора, содержащего 1 моль/л Pb(BF4)2, 1 моль/л свободного HBF4 и 1,7 ммоль/л Fe(BF4)2. Площадь погружения опорной плиты электрода составляет 67 см 2 . Зарядка осуществляется при 2,67 А, что соответствует плотности тока 4 А/дм 2 .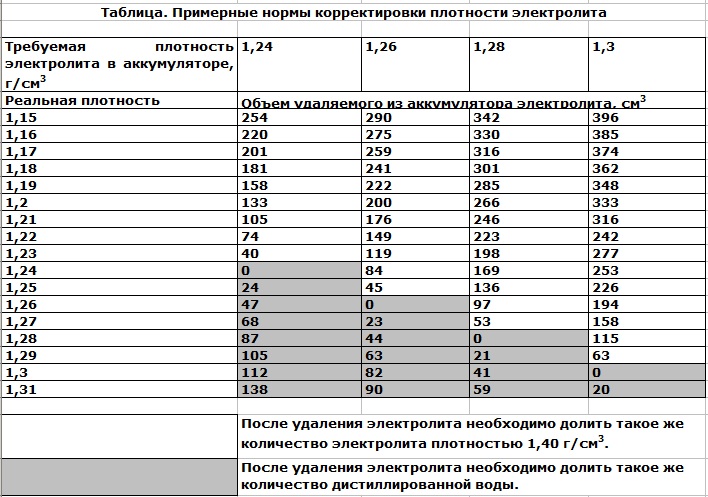 Время зарядки 15 минут. Теоретическая величина тока на единицу площади составляет 1,0 Ач/дм 2 . Теоретическая конверсия свинца в растворе составляет 12%. После зарядки выдерживают 5 минут, прежде чем аккумулятор разрядится при токе 0,67 А (после 150 циклов при токе 1,33 А), что соответствует плотности разрядного тока 1 и 2 А/дм 2 соответственно. После достижения конечного напряжения разряда 0,8 В система снова переключается на заряд. Электролит имеет температуру 20-25°С. C. Осажденные слои свинца гладкие, без дендритов и хорошо прилипают. Напряжение заряда изначально составляет 2,45 В, но падает до среднего значения 2,15 В уже через несколько циклов. ИНЖИР. 2 показано изменение напряжения заряда и разряда (а) в течение 1-го цикла (сплошная кривая), (б) в течение 10-го цикла (штриховая кривая), (в) в течение 100-го цикла (штрихпунктирная кривая), ( г) в течение 1000-го цикла (нижняя штриховая кривая) и (д) в течение 2000-го цикла (нижняя сплошная кривая). Интервалы, отмеченные в нижней части рисунка, обозначают: L = заряд, P = пауза и E = разряд.
Время зарядки 15 минут. Теоретическая величина тока на единицу площади составляет 1,0 Ач/дм 2 . Теоретическая конверсия свинца в растворе составляет 12%. После зарядки выдерживают 5 минут, прежде чем аккумулятор разрядится при токе 0,67 А (после 150 циклов при токе 1,33 А), что соответствует плотности разрядного тока 1 и 2 А/дм 2 соответственно. После достижения конечного напряжения разряда 0,8 В система снова переключается на заряд. Электролит имеет температуру 20-25°С. C. Осажденные слои свинца гладкие, без дендритов и хорошо прилипают. Напряжение заряда изначально составляет 2,45 В, но падает до среднего значения 2,15 В уже через несколько циклов. ИНЖИР. 2 показано изменение напряжения заряда и разряда (а) в течение 1-го цикла (сплошная кривая), (б) в течение 10-го цикла (штриховая кривая), (в) в течение 100-го цикла (штрихпунктирная кривая), ( г) в течение 1000-го цикла (нижняя штриховая кривая) и (д) в течение 2000-го цикла (нижняя сплошная кривая). Интервалы, отмеченные в нижней части рисунка, обозначают: L = заряд, P = пауза и E = разряд.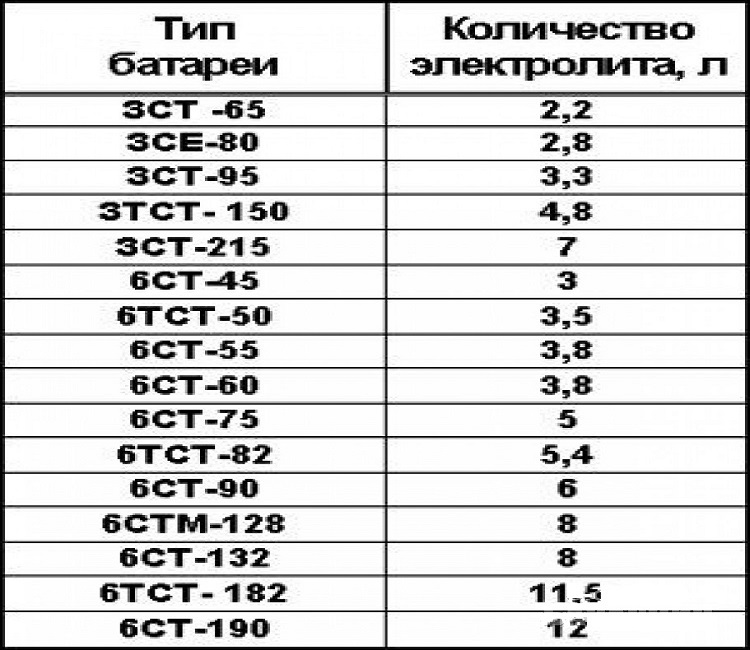 Напряжение без нагрузки составляет 1,85 В в каждом случае. Кривая расхода имеет идеальную горизонтальную форму; напряжение разряда составляет 1,6-1,65 вольт и практически не изменяется в процессе циклирования (фиг. 2). К концу второго-десятого периода разряда отмечается, что небольшое количество остаточного оксида отпадает от положительного электрода. Однако после десятого цикла общее количество больше не увеличивается. Наоборот, при дальнейшем циклировании количество осадка снова уменьшается, а примерно через 200 циклов осадок полностью исчезает. При этом раствор остается постоянно прозрачным и бесцветным. Исходя из времени разряда, эффективность Ач рассчитывается как 90-95% и не показывает тенденции к снижению во время циклирования (фиг. 2). Эффективность Втч имеет среднее значение 65-70%.
Напряжение без нагрузки составляет 1,85 В в каждом случае. Кривая расхода имеет идеальную горизонтальную форму; напряжение разряда составляет 1,6-1,65 вольт и практически не изменяется в процессе циклирования (фиг. 2). К концу второго-десятого периода разряда отмечается, что небольшое количество остаточного оксида отпадает от положительного электрода. Однако после десятого цикла общее количество больше не увеличивается. Наоборот, при дальнейшем циклировании количество осадка снова уменьшается, а примерно через 200 циклов осадок полностью исчезает. При этом раствор остается постоянно прозрачным и бесцветным. Исходя из времени разряда, эффективность Ач рассчитывается как 90-95% и не показывает тенденции к снижению во время циклирования (фиг. 2). Эффективность Втч имеет среднее значение 65-70%.
После продолжительности цикла более 2000 часов эксперимент прекращается после 2069 полных циклов. Основание отрицательного электрода покрыто ровным слоем 1,3 г остаточного свинца. Основание положительного электрода покрыто черно-коричневым слоем из 5,6 г остаточного оксида, который прочно прилипает.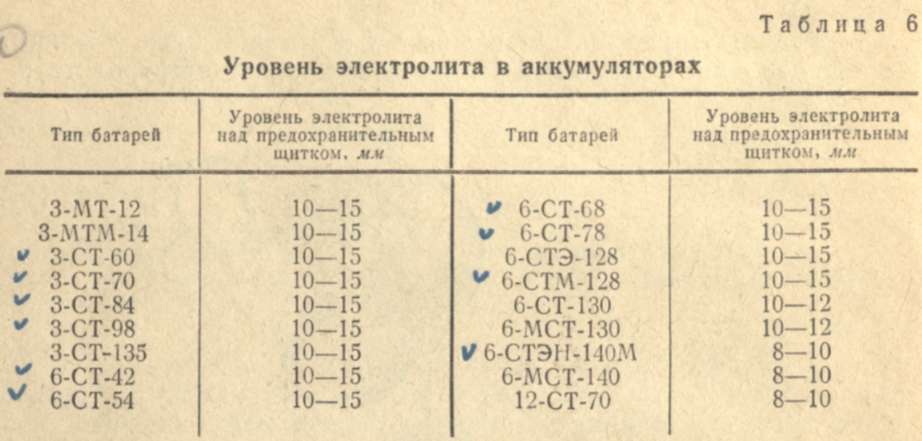 В электролите обнаружено 34,5 г свинца (с = 0,81 моль/л). Суммы свинцового баланса до 96%.
В электролите обнаружено 34,5 г свинца (с = 0,81 моль/л). Суммы свинцового баланса до 96%.
B. Сравнительный эксперимент проводят в тех же условиях, за исключением того, что опорные пластины электродов в этом случае состоят из не содержащего железа синтетического графита. Электролит также не содержит железа. Поверхность положительного электрода структурирована фрезерованием в виде пирамиды для улучшения адгезии оксида. Контакты выполнены через ввинчиваемые латунные выводы. При циклическом включении этой ячейки достигается примерно одинаковая эффективность Ач и Втч, но среднее напряжение заряда имеет тенденцию к увеличению. Однако после 87 циклов эксперимент пришлось прекратить. В этот момент концентрация ионов свинца упала примерно до 0,1 моль/л, так что при зарядке наблюдается избыточное образование губчатого свинца на отрицательном электроде и газов на обоих электродах, и в то же время емкость аккумулятора падает. стремительно. В конце этого эксперимента баланс свинца представляет собой следующую картину:
_____________________________________ Остаточный оксид, прилипший 4,7 г = 4,1 г Pb Остаточный оксид, отвалившийся 7,3 г = 6,3 г Pb Остаточный свинец на отрицательном электроде 23,8 г Ионы свинца в растворе 4,9 г (0,116 М) . SIGMA. Свинец 39,1 г 92,5% от теории ______________________________________
SIGMA. Свинец 39,1 г 92,5% от теории ______________________________________
Количество возможных циклов сильно зависит от степени превращения растворов солей свинца во время зарядки. В каждом случае, если используется опорная пластина электрода, состоящая из наполненного графитом полипропилена, содержащего железо, в присутствии 1,7 ммоль/л Fe ++ число достижимых циклов существенно больше, чем при использовании железа- свободная система с электродами из синтетического графита. При более низких конверсиях разница составляет около двух порядков. Результаты приведены в таблице 1.
ТАБЛИЦА 1 ______________________________________ Количество достигнутых циклов (%) электролита конверсии ##STR1## мин.время, заряд ApleExam- BpleExam- ______________________________________ 12 1,0 15 >2069+ 87 16 1,33 20 >1800+ — 20 1,67 25 >1237+ 30 30 2,5 37,5 46 12 50 4,2 62,5 25 6 ___________________________________________ 30 Эксперимент прекращен?
C. Чтобы исключить влияние структуры опорной пластины электрода, проводят сравнительный эксперимент с наполненным графитом полипропиленовым электродом того же состава, что и в примере А, но с использованием очищенного, не содержащего железа графита.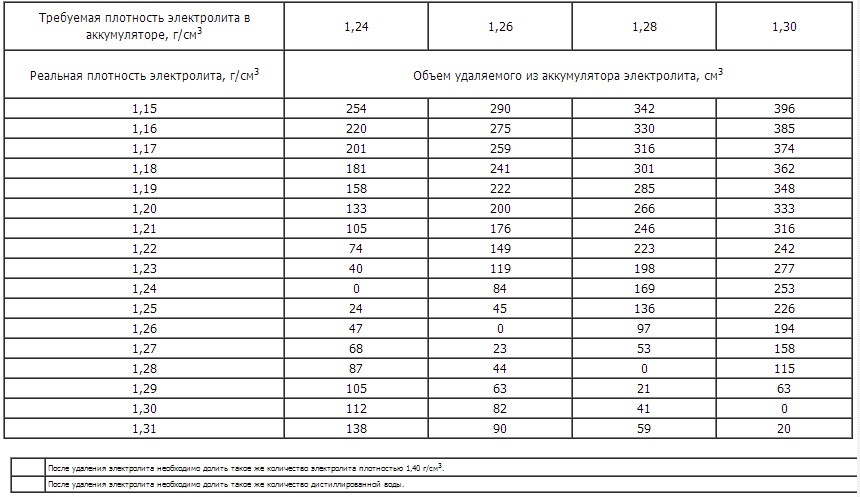 После пескоструйной обработки электрод дополнительно очищают, погружая его на трое суток в 18%-ную по массе водную соляную кислоту, которую дважды меняют. Текущая конверсия в циклическом эксперименте составляет 30%. Остальные параметры соответствуют параметрам примера А, за исключением того, что электролит не содержит ионов железа. В таблице 2 суммированы результаты вместе с результатами эксперимента с электродом, содержащим железо (пример А).
После пескоструйной обработки электрод дополнительно очищают, погружая его на трое суток в 18%-ную по массе водную соляную кислоту, которую дважды меняют. Текущая конверсия в циклическом эксперименте составляет 30%. Остальные параметры соответствуют параметрам примера А, за исключением того, что электролит не содержит ионов железа. В таблице 2 суммированы результаты вместе с результатами эксперимента с электродом, содержащим железо (пример А).
ТАБЛИЦА 2 ______________________________________ Графитонаполненный ПП-электрод ПП-электрод с железосодержащим графитом, не содержащим железа, с природным графитом Пример 1 C Пример 1 A ___________________________________________ Циклы, достигаемые при конверсии 30% 8 46 Баланс свинца: PbO.sub. 2 налипший (г) 10,5 0,85 PbO 2 отвалившийся (г) 16,6 7,4 Свинец налипший (г) 18,9 27,3 Свинец в растворе (г) 2,9 7,5 Общий свинец, % от теории 107% 99% __________________________________________
Несмотря на использование одной и той же структуры, в эксперименте с электродом, не содержащим железа, в отсутствие Fe++ достигается гораздо меньше циклов, чем в эксперименте с электродом, содержащим железо. Количество циклов, достигнутое с электродом, не содержащим железа, примерно соответствует количеству циклов, достигнутому с синтетическим графитом при конверсии 30%, сравните пример 1В.
Количество циклов, достигнутое с электродом, не содержащим железа, примерно соответствует количеству циклов, достигнутому с синтетическим графитом при конверсии 30%, сравните пример 1В.
ПРИМЕР 2
В этом эксперименте с использованием устройства, показанного на фиг. 3 используется коробчатая ячейка несколько большего размера, которая в дополнение к двум концевым электродам с латунными внутренними слоями 11, используемыми в примере 1, также содержит три биполярных электрода 12 из листов полипропилена толщиной 3 мм, заполненных природным графитом, которые прошли пескоструйную обработку с обеих сторон.
Эти биполярные электроды приклеиваются между концевыми электродами с интервалом 20 мм. Образуемые камеры должны быть герметичными, так как в противном случае становятся заметными потери из-за блуждающих токов. Электролит закачивается через отверстия 13 в днище электролизера, соединенные с коллектором 14, и возвращается по боковым каналам 15 и коллектору 16.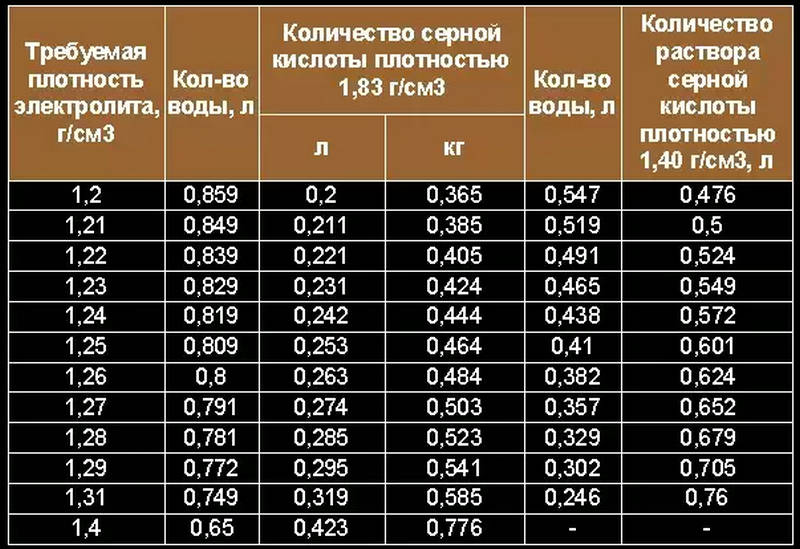 Длина и сечение подводящих 13 и отводящих 15 линий должны быть такими: что потери из-за блуждающих токов сведены к минимуму. Небольшой центробежный насос 17 медленно циркулирует электролит со скоростью 15 литров в час. В начале циклирования систему заполняют 820 мл раствора, содержащего 1 моль/л Pb(BF4), 1 моль/л HBF4 и 1,7 ммоль/л Fe(BF4). .4)2, и заряжается при 4 А/дм 2 в течение 25 минут, что соответствует конверсии 20% и плотности заряда 1,67 Ач/дм 2 . Остаточный осадок оксида, образовавшийся в ходе первых циклов, в дальнейшем полностью перерастворяется. На 85-м цикле плотность разрядного тока повышают до 2 А/дм 2 . Среднее напряжение заряда 8,5 вольт и среднее напряжение разряда 6,5 вольт удивительно постоянны и соответствуют значениям для моноэлемента в примере 1. Кривая разряда не показывает ступенек, и отдельные элементы демонстрируют практически идентичное поведение. КПД 84-86% Ач очень постоянен и дает КПД 64% Втч. После 609циклов КПД Ач снижается в течение нескольких циклов до низких значений, а при заряде наблюдается выделение газа.
Длина и сечение подводящих 13 и отводящих 15 линий должны быть такими: что потери из-за блуждающих токов сведены к минимуму. Небольшой центробежный насос 17 медленно циркулирует электролит со скоростью 15 литров в час. В начале циклирования систему заполняют 820 мл раствора, содержащего 1 моль/л Pb(BF4), 1 моль/л HBF4 и 1,7 ммоль/л Fe(BF4). .4)2, и заряжается при 4 А/дм 2 в течение 25 минут, что соответствует конверсии 20% и плотности заряда 1,67 Ач/дм 2 . Остаточный осадок оксида, образовавшийся в ходе первых циклов, в дальнейшем полностью перерастворяется. На 85-м цикле плотность разрядного тока повышают до 2 А/дм 2 . Среднее напряжение заряда 8,5 вольт и среднее напряжение разряда 6,5 вольт удивительно постоянны и соответствуют значениям для моноэлемента в примере 1. Кривая разряда не показывает ступенек, и отдельные элементы демонстрируют практически идентичное поведение. КПД 84-86% Ач очень постоянен и дает КПД 64% Втч. После 609циклов КПД Ач снижается в течение нескольких циклов до низких значений, а при заряде наблюдается выделение газа. К этому моменту концентрация ионов свинца упала примерно до 0,1 моль/л.
К этому моменту концентрация ионов свинца упала примерно до 0,1 моль/л.
После 103-й зарядки аккумулятор остается в заряженном состоянии. Езда на велосипеде возобновляется через 250 часов. 103-й разряд в этом случае дает КПД 68% Ач, т.е. 80% от нормальной емкости.
ПРИМЕР 3
Электролизер, описанный в примере 1А, подвергают циклированию в описанных там условиях, но при конверсии 30% (L QA = 2,5 А·ч/дм 2 ). Электролит содержит 5 ммоль/л Fe(BF 4 ) 2 . Достигнуто 157 циклов со средней эффективностью Ач 82%. Если ячейка подвергается циклированию в идентичных условиях, но с использованием не содержащего железа графитового электрода, как описано в примере 1C, достигается только 46 циклов, в то время как в системе, которая также подвергается циклированию в идентичных условиях, но с отсутствием железа в электролите, достигается только от 8 до 12 циклов при той же средней эффективности Ач. Если после этого электролит перемешивается еще в течение 40 часов с закороченными электродами и пропусканием щелевого потока воздуха через элемент, то достигается значительная регенерация элемента с полным растворением остаточного свинца и нормальная работа.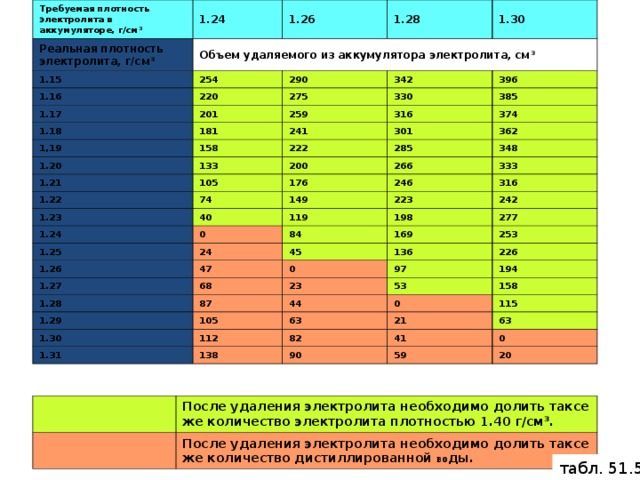 клетки можно продолжить.
клетки можно продолжить.
В таблице 3 ниже приведены результаты дальнейших экспериментов с различными конверсиями, концентрациями и окислительно-восстановительными системами.
ТАБЛИЦА 3 ______________________________________ Электролит Окислительно-восстановительный потенциал Число конвер-моль/состав циклов Ач-ион литр Достигнутая эффективность ______________________________________ 30% 5 ммоль/л Fe++ 157 82 30% 10 ммоль/л Fe++ 196 69 30% 25 ммоль/л Fe++ 400 64 30% 100 ммоль/л Fe++ 50 (не 47 продолжение) 50% 5 ммоль/л Fe++ 45 83 50% 25 ммоль/ л Fe.++ 112 62 30% 10 ммоль/л V+++ 167 81 30% 10 ммоль/л Гидро- 188 71-81 хинон ______________________________________
Как и ожидалось, эффективность Ач уменьшается с увеличением концентрации окислительно-восстановительной системы. В последнем эксперименте с добавлением гидрохинона в течение первых нескольких циклов устанавливается стационарная желтая окраска, обусловленная образованием хингидрона, но позднее окраска уменьшается.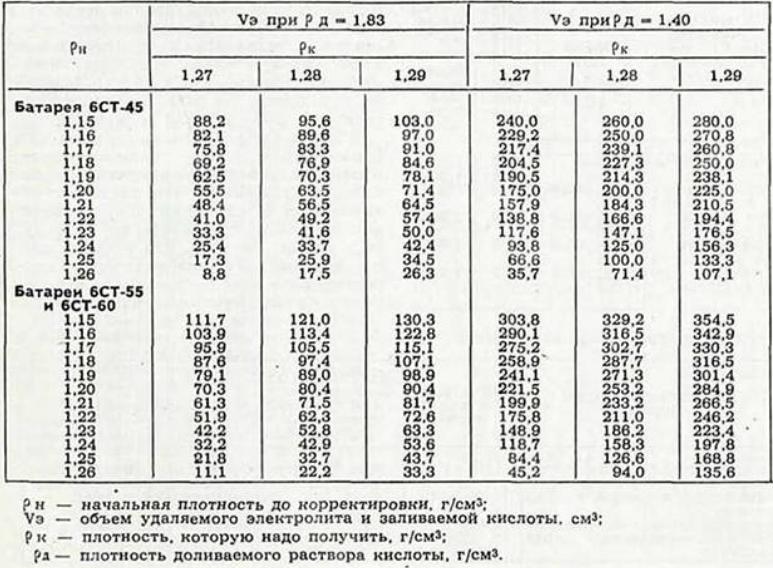 Эффективность Ah постепенно возрастает с 71 до 81%.
Эффективность Ah постепенно возрастает с 71 до 81%.
ПРИМЕР 4
Ячейка по примеру 1 содержит 205 мл раствора, содержащего 2 моль/л Pb(BF4)2, 1,7 ммоль/л Fe(BF4)2. .4)2 и 1 моль/л HBF4. Во время зарядки раствор подвергается конверсии 40%, что соответствует времени зарядки 1 час 39минут и высокой плотностью заряда 6,6 Ач/дм 2 . Плотность зарядного тока составляет 4 А/дм 2 , а плотность тока разряда — 1 А/дм 2 первоначально и после 7-го цикла — 2 А/дм 2 . Остальные условия такие же, как описано в примере 1А.
Слои, нанесенные во время циклирования, гладкие и прочно сцепляются. Эффективность Ач составляет 92-95%, а эффективность Втч около 68%. Достигнут 61 цикл. В конце этого периода 67 % свинца осаждается на отрицательном электроде, 10 % отпадает в виде шлама остаточного оксида, 5 % все еще присутствует в электролите, а оставшаяся часть присутствует в виде прочно прилипшего остаточного оксида на положительном электроде. электрод.
электрод.
Ячейку регенерируют следующим образом: меняют полярность ячейки, перемешивают электролит и подвергают ячейку воздействию 0,2 А/дм 2 в течение примерно 2 дней. По истечении этого времени остаточный свинец полностью растворился, а остаточные оксиды существенно растворились. Свинец не осаждается на положительном электроде.
ПРИМЕР 5
Относительно близкое расстояние между электродами 3,5 мм установлено в ячейке пластины и рамы. Таким образом, может быть достигнута относительно высокая конверсия 65% при относительно низкой плотности заряда 2 Ач/дм 2 . Электролит, содержащий 2 моля/литр Pb(BF4)2, 1 моль/литр HBF4 и 1,7 ммоль/литр Fe(BF4)2. , медленно циркулирует насосом. Электроды и плотность тока такие же, как описано в примере 1А. КПД средства Ah составляет 85%. достигается 275 циклов.
ПРИМЕР 6
Этот пример описывает простой метод измерения, с помощью которого можно проверить эффективность окислительно-восстановительных добавок при осаждении PbO 2 .
Платиновый цилиндр (А = 2 см 2 ), против которого нанесен электролит, состоящий из водного раствора, содержащего 1 моль/л Pb(BF 4 ) 2 и 1 моль/л литр HBF 4 , ударяется аксиально, анодно поляризован с плотностью тока 2 А/дм 2 . Через 30 минут ток меняют на противоположный и слой PbO 2 восстанавливают катодным способом. Записывают потенциал электрода относительно электрода из сульфата ртути (I) (потенциал U s ). После достижения потенциала U s = 0,6 В платиновый цилиндр снова анодно поляризуют и т. д. Конверсия электролита при этом составляет <1%.
РИС. 4 суммированы некоторые кривые потенциал-время, при этом сплошные кривые иллюстрируют результаты, полученные с электролитом, описанным выше, а пунктирные кривые представляют результаты, полученные с электролитом, содержащим Fe(BF 4 ) 2 , упомянутым ниже. В базовом электролите даже в конце первого разряда на электроде остается черно-коричневый остаточный оксид. Во время второй загрузки PbO 2 сначала осаждается на остаточном оксиде, в результате чего образуется впадина потенциала.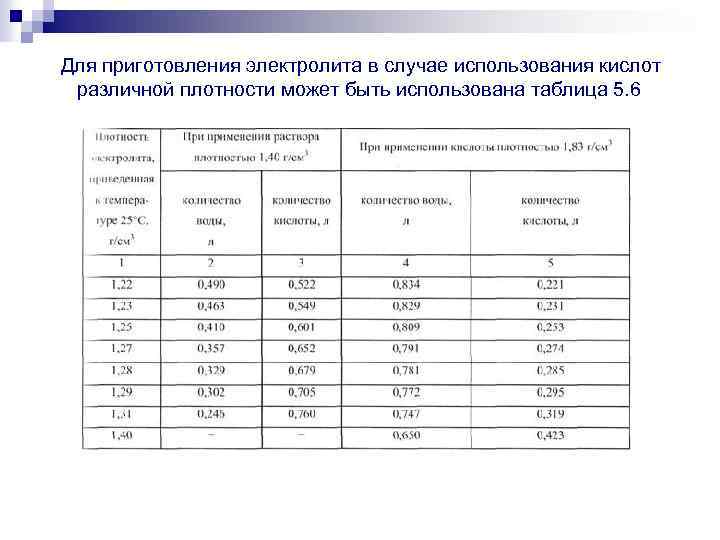 Воспроизводимость формы кривой плохая, так как часть остаточного оксида отслаивается.
Воспроизводимость формы кривой плохая, так как часть остаточного оксида отслаивается.
С другой стороны, в присутствии 25 ммоль/л Fe(BF 4 ) 2 диоксид свинца полностью растворялся к концу первого разряда. Практически не наблюдается провала потенциала во время следующей зарядки, и даже после длительного циклирования не обнаруживается отпадания остаточного оксида. Таблица 4 суммирует эти и другие результаты. .2 % __________________________________________ Нет 0,3 — 0,6 85 — 90 5 ммоль/л Fe++ 0,08 86 25 ммоль/л Fe++ 0,06 65 25 ммоль/л V+++ 0,05 74 25 ммоль/л U++++ 0,12 82 25 ммоль/л NO 2 — 0,04 86 5 ммоль/л Хингидрон 0,04 58 25 ммоль/л Гидрохинон 0,03 42 ___________________________________________
Выбросы токсичных фторидных газов при возгорании литий-ионных аккумуляторов
1. Samsung Note 7: Информация о пресс-конференции, Samsung US, Наше обещание безопасности, http://www.samsung.com/us/explore/committed-to-quality/?CID = van-brd-brd-0119-10000141, Дата доступа: 04.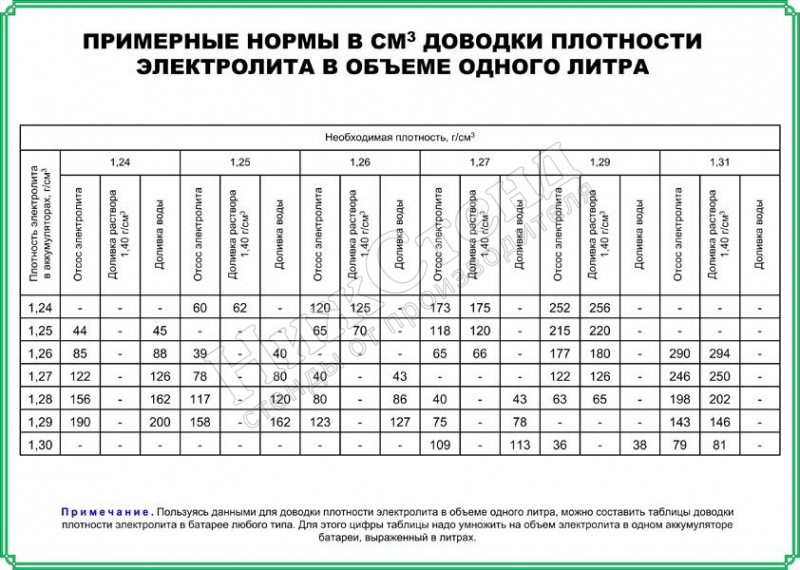 06.2017.
06.2017.
2. Пригг, М. НАСА показывает шокирующее видео секретного военного «РобоСимиана», ВЗРЫВАЮЩЕГОСЯ, когда его батареи загораются (2016 г.), http://www.dailymail.co.uk/sciencetech/article-3883158/Nasa-reveals- Shocking-video-secretive-military-RoboSimian-EXPLODING-batteries-catch-fire.html, Дата обращения: 04.06.2017.
3. Отчет о расследовании серьезного авиационного происшествия, JA804A. Японский совет по безопасности на транспорте (2014 г.), доступно в Интернете: http://www.mlit.go.jp/jtsb/eng-air_report/JA804A.pdf, дата обращения: 02.13.2017.
4. Пожар батареи вспомогательной силовой установки, Boeing 787–8 Japan Airlines, JA829J, Бостон, Массачусетс; НЦБ/АИР-14/01. Национальный совет по безопасности на транспорте (2014 г.), доступно в Интернете: http://www.ntsb.gov/investigations/AccidentReports/Reports/AIR1401.pdf, дата обращения: 02.13.2017.
5. Обзорный отчет об инциденте с батареей Chevrolet Volt, Национальное управление безопасности дорожного движения (NHTSA) , DOT HS 811 573 (2012).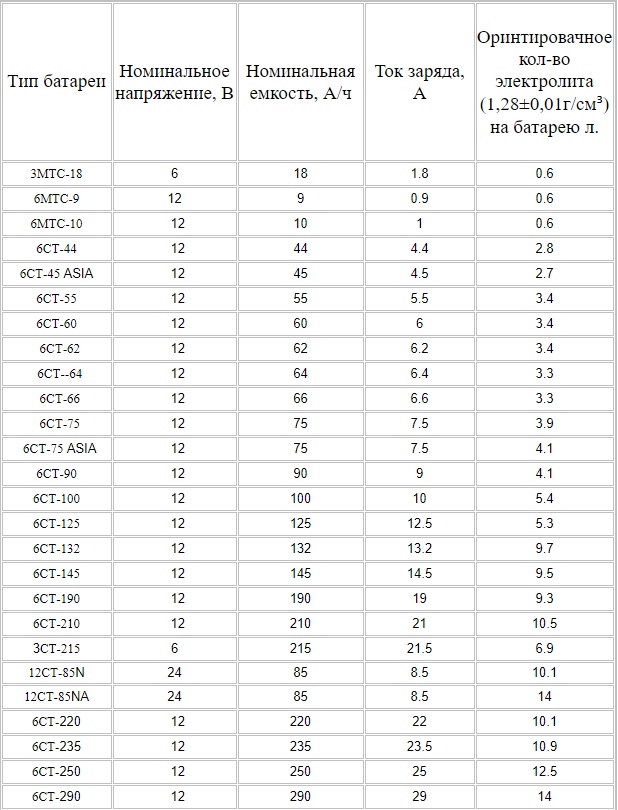
6. Даути, Д. и Рот, Е. П. Общее обсуждение безопасности литий-ионных аккумуляторов. Электрохим. соц. Интерфейс , лето 2012 , 37–44 (2012).
7. Ларссон Ф., Мелландер Б.-Э. Неправильное обращение с внешним нагревом, перезарядкой и коротким замыканием коммерческих литий-ионных аккумуляторов. Дж. Электрохим. соц. 2014;161(10):A1611–A1617. doi: 10.1149/2.0311410jes. [CrossRef] [Google Scholar]
8. Ларссон Ф., Андерссон П. и Мелландер Б.-Э. Являются ли электромобили более безопасными, чем автомобили с двигателем внутреннего сгорания? в Системные перспективы на Электромобильность (ред. Санден, Б. и Валлгрен, П.) 33–44 (Технологический университет Чалмерса, 2014 г.).
9. Finegan DP, et al. Эксплуатационная высокоскоростная томография литий-ионных аккумуляторов при тепловом разгоне. Нац. коммун. 2015;6:6924. doi: 10.1038/ncomms7924. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
10. Ларссон Ф., Андерссон П., Мелландер Б.-Э. Аспекты литий-ионных аккумуляторов при возгорании в электрифицированных транспортных средствах на основе экспериментальных испытаний на неправильное использование. Батареи. 2016;2:9. doi: 10.3390/batteries2020009. [CrossRef] [Google Scholar]
Ларссон Ф., Андерссон П., Мелландер Б.-Э. Аспекты литий-ионных аккумуляторов при возгорании в электрифицированных транспортных средствах на основе экспериментальных испытаний на неправильное использование. Батареи. 2016;2:9. doi: 10.3390/batteries2020009. [CrossRef] [Google Scholar]
11. Lopez FL, Jeevarajan JA, Mukherjee PP. Экспериментальный анализ теплового разгона и распространения в литий-ионных аккумуляторных модулях. Дж. Электрохим. соц. 2015;162(9):A1905–A1915. doi: 10.1149/2.0921509jes. [CrossRef] [Google Scholar]
12. Lamb J, Orendorff CJ, Steele LAM, Spangler SW. Распространение отказа в многоэлементных литий-ионных батареях. J. Источников энергии. 2015; 283:517–523. doi: 10.1016/j.jpowsour.2014.10.081. [Перекрестная ссылка] [Академия Google]
13. Ларссон Ф., Андерсон Дж., Андерссон П., Мелландер Б.-Э. Тепловое моделирование распространения пожара от ячейки к ячейке и каскадных эффектов теплового разгона для элементов и модулей литий-ионных батарей, использующих противопожарные экраны. Дж. Электрохим. соц. 2016;163(14):A2854–A2865. doi: 10.1149/2.0131614jes. [CrossRef] [Google Scholar]
Дж. Электрохим. соц. 2016;163(14):A2854–A2865. doi: 10.1149/2.0131614jes. [CrossRef] [Google Scholar]
14. Лебедева Н.П., Бун-Бретц Л. Соображения о химической токсичности электролитов современных литий-ионных аккумуляторов и их компонентов. Дж. Электрохим. соц. 2016; 163(6):A821–A830. дои: 10.1149/2.0171606jes. [CrossRef] [Google Scholar]
15. Sun J, et al. Токсичность, серьезная проблема теплового разгона коммерческих литий-ионных аккумуляторов. Нано Энергия. 2016;27:313–319. doi: 10.1016/j.nanoen.2016.06.031. [CrossRef] [Google Scholar]
16. Неджалков А. и др. Выбросы токсичных газов из поврежденных литий-ионных аккумуляторов – анализ и решение по повышению безопасности. Батареи. 2016;2:5. doi: 10.3390/batteries2010005. [CrossRef] [Google Scholar]
17. Liu K, et al. Электропрядный разделитель из микроволокна сердцевина-оболочка с термоактивируемыми огнезащитными свойствами для литий-ионных аккумуляторов. науч. Доп. 2017;3:e1601978. doi: 10.1126/sciadv. 1601978. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
1601978. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
18. Park Y-U, et al. Адаптация фторфосфата в качестве нового катода 4 В для литий-ионных аккумуляторов. Научные отчеты. 2012;2:704. doi: 10.1038/srep00704. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Ortiz GF, et al. Повышение плотности энергии более безопасных литий-ионных аккумуляторов за счет сочетания высоковольтных катодов из литий-кобальт-фторфосфата и наноструктурированных анодов из диоксида титана. Научные отчеты. 2016;6:20656. doi: 10.1038/srep20656. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
20. Yang H, Zhuang GV, Ross N. Термическая стабильность соли LiPF 6 и электролитов литий-ионных аккумуляторов, содержащих LiPF 6 . J. Источников энергии. 2006; 161: 573–579. doi: 10.1016/j.jpowsour.2006.03.058. [CrossRef] [Google Scholar]
21. Kawamura T, Okada S, Yamaki J-i. Реакция разложения электролитов на основе LiPF 6 для литий-ионных аккумуляторов.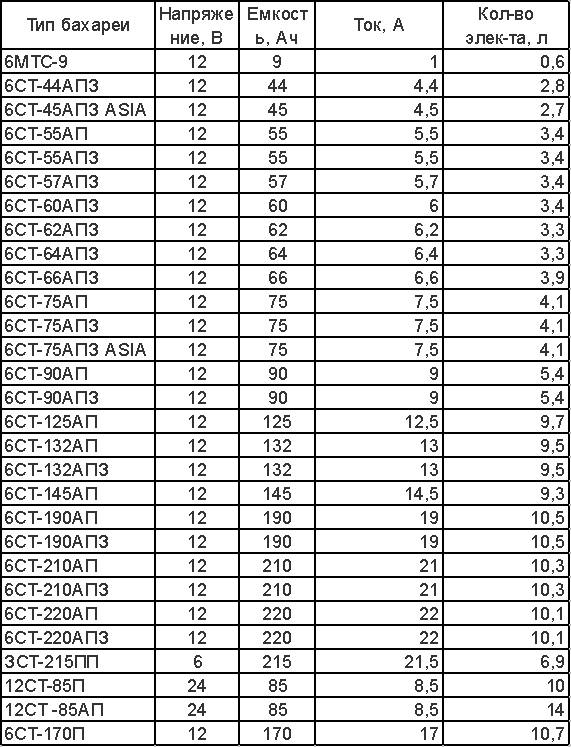 J. Источников энергии. 2006; 156: 547–554. doi: 10.1016/j.jpowsour.2005.05.084. [CrossRef] [Академия Google]
J. Источников энергии. 2006; 156: 547–554. doi: 10.1016/j.jpowsour.2005.05.084. [CrossRef] [Академия Google]
22. Документация по концентрациям, непосредственно опасным для жизни и здоровья (НПЖС) для фтористого водорода (как F). Национальный институт охраны труда и здоровья (NOISH) ( 1994).
23. Нормативные уровни острого воздействия для отдельных переносимых по воздуху химических веществ: том 4, подкомитет по нормативным уровням острого воздействия. ISBN: 0-309-53013-X. Комитет по токсикологии, Национальный исследовательский совет (2004).
24. Middelman, A. Hygiensiska gränsvärden AFS 2015:7, Hygieniska gränsvärden. Arbetsmiljöverkets föreskrifter om hygieniska gränsvärden och allmänna råd omtilämpningen av foreskrifterna. ISBN 978-91-7930-628-1. ISSN 1650-3163. Шведское управление по охране труда, (2015 г.).
25. Guéguen A, et al. Разложение LiPF 6 в литий-ионных батареях высокой энергии исследовано с помощью электрохимической масс-спектрометрии в режиме онлайн. Дж. Электрохим. соц. 2016;163(6):A1095–A1100. doi: 10.1149/2.0981606jes. [CrossRef] [Google Scholar]
Дж. Электрохим. соц. 2016;163(6):A1095–A1100. doi: 10.1149/2.0981606jes. [CrossRef] [Google Scholar]
26. Chatelain MD, Adams TE. Отбор проб ионно-литиевого газа из вентилируемых ячеек. Материалы конференции по источникам энергии. 2006; 42:87–89. [Google Scholar]
27. Блюм А. Ф. и Лонг-младший Р. Т. Оценка опасности систем накопления энергии с ионно-литиевыми батареями. Исследовательский фонд противопожарной защиты (2016).
28. Ларссон Ф., Андерссон П., Блумквист П., Лорен А., Мелландер Б.-Э. Характеристики литий-ионных аккумуляторов при огневых испытаниях. J. Источников энергии. 2014; 271:414–420. doi: 10.1016/j.jpowsour.2014.08.027. [CrossRef] [Google Scholar]
29. Ларссон Ф., Андерссон П., Блумквист П. и Мелландер Б.-Э. Выбросы газа из элементов литий-ионных аккумуляторов, подвергшихся повреждению из-за внешнего пожара в Материалы конференции Fires in Vehicles (FIVE) 2016 (ред. Андерссон, П. и Сандстром, Б.) 253–256 (Шведский институт технических исследований SP, 2016).
30. Ribière P, et al. Исследование пожарной опасности литий-ионных аккумуляторных элементов методом пожарной калориметрии. Энергетическая среда. науч. 2012;5:5271–5280. doi: 10.1039/C1EE02218K. [CrossRef] [Google Scholar]
31. Лекок А. Сценарное прогнозирование токсичности литий-ионных аккумуляторов при пожаре. J. Источников энергии. 2016;316:197–206. doi: 10.1016/j.jpowsour.2016.02.090. [CrossRef] [Google Scholar]
32. Лекок А., Бертана М., Трюшо Б. и Марлэр Г. Сравнение последствий пожара электромобиля и автомобиля с двигателем внутреннего сгорания в материалах конференции Пожары в транспортных средствах (ПЯТЬ) 2012 г. (ред. Андерссон, П. и Сандстрем, Б.) 183–193 (SP Институт технических исследований Швеции, 2012 г.).
33. Осаки Т. и соавт. Реакция перезарядки литий-ионных аккумуляторов. Дж. источника питания. 2005;146:97–100. doi: 10.1016/j.jpowsour.2005.03.105. [CrossRef] [Google Scholar]
34. Abraham DP, et al. Диагностическое исследование литий-ионных аккумуляторов большой мощности, подвергшихся термическому воздействию. J. Источников энергии. 2006; 161: 648–657. doi: 10.1016/j.jpowsour.2006.04.088. [CrossRef] [Google Scholar]
J. Источников энергии. 2006; 161: 648–657. doi: 10.1016/j.jpowsour.2006.04.088. [CrossRef] [Google Scholar]
35. Roth EP. Реакция литий-ионных элементов 18650 с различными катодами на злоупотребление с использованием электролитов EC:EMC/LiPF 6 и EC:PC:DMC/LiPF 6 . ЭКС-транзакции. 2008;11(19):19–41. дои: 10.1149/1.2897969. [CrossRef] [Google Scholar]
36. Голубков А.В. и соавт. Эксперименты по тепловому разгону потребительских литий-ионных аккумуляторов с катодами из оксида металла и оливина. RSC Adv. 2014;4:3633–3642. doi: 10.1039/C3RA45748F. [CrossRef] [Google Scholar]
37. Голубков А.В. и соавт. Тепловой разгон коммерческих литий-ионных аккумуляторов 18650 с катодами LFP и NCA — влияние уровня заряда и перезаряда. RSC Adv. 2015;5:57171–57186. doi: 10.1039/C5RA05897J. [CrossRef] [Академия Google]
38. Spinner NS, et al. Физический и химический анализ отказов между ячейками литий-ионных аккумуляторов внутри специальной топки. J. Источников энергии. 2015; 279:713–721. doi: 10.1016/j.jpowsour.2015.01.068. [CrossRef] [Google Scholar]
2015; 279:713–721. doi: 10.1016/j.jpowsour.2015.01.068. [CrossRef] [Google Scholar]
39. Fu Y, et al. Экспериментальное исследование характеристик горения литий-ионных аккумуляторов 18650 с использованием конусного калориметра. J. Источников энергии. 2015; 273:216–222. doi: 10.1016/j.jpowsour.2014.09.039. [CrossRef] [Google Scholar]
40. Huang P, Wang Q, Li K, Ping P, Sun J. Характер горения крупномасштабной батареи из титаната лития. Научные отчеты. 2015;5:7788. doi: 10.1038/srep07788. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
41. Ping P, et al. Изучение поведения высокоэнергетических литий-ионных аккумуляторов при возгорании при натурных испытаниях на горение. J. Источников энергии. 2015; 285:80–89. doi: 10.1016/j.jpowsour.2015.03.035. [CrossRef] [Google Scholar]
42. Roth EP, Orendorff CJ. Как электролиты влияют на безопасность батареи. Электрохим. соц. Интерфейс, лето. 2012; 2012: 45–49. doi: 10.1149/2.F04122if. [CrossRef] [Google Scholar]
43. Eshetu GG, et al. Углубленный анализ безопасности растворителей, используемых в электролитах для крупногабаритных литий-ионных аккумуляторов. физ. хим. хим. физ. 2013;15:9145–9155. doi: 10.1039/c3cp51315g. [PubMed] [CrossRef] [Google Scholar]
Eshetu GG, et al. Углубленный анализ безопасности растворителей, используемых в электролитах для крупногабаритных литий-ионных аккумуляторов. физ. хим. хим. физ. 2013;15:9145–9155. doi: 10.1039/c3cp51315g. [PubMed] [CrossRef] [Google Scholar]
44. Lamb J, Orendorff CJ, Roth EP, Langendorf J. Исследования термического разрушения обычных компонентов электролита литий-ионных аккумуляторов. Дж. Электрохим. соц. 2015;162(10):A2131–A2135. doi: 10.1149/2.0651510jes. [CrossRef] [Google Scholar]
45. Eshetu GG, et al. Огнестойкость электролитов на основе карбонатов, используемых в литий-ионных аккумуляторных батареях, с акцентом на роль солей LiPF 6 и LiFSI. J. Источников энергии. 2014;269: 804–811. doi: 10.1016/j.jpowsour.2014.07.065. [CrossRef] [Google Scholar]
46. Андерссон П., Блумквист П., Лорен А., Ларссон Ф. Использование инфракрасной спектроскопии с преобразованием Фурье для определения токсичных газов при пожарах с литий-ионными батареями. Огонь и материалы. 2016;40(8):999–1015. doi: 10.1002/fam.2359. [CrossRef] [Google Scholar]
2016;40(8):999–1015. doi: 10.1002/fam.2359. [CrossRef] [Google Scholar]
47. Lux SF. Механизм образования HF в карбонатно-органических электролитах на основе LiPF 6 . Электрохим. Комм. 2012; 14:47–50. doi: 10.1016/j.elecom.2011.10.026. [Перекрестная ссылка] [Академия Google]
48. Lux SF, Chevalier J, Lucas IT, Kostecki R. Образование HF в электролитах на основе органических карбонатов LiPF 6 . ЭКС Электрохим. лат. 2013;2(12):A121–A123. doi: 10.1149/2.005312eel. [CrossRef] [Google Scholar]
49. Wilken S, Treskow M, Scheers S, Johansson P, Jacobsson P. Начальные стадии термического разложения электролитов литий-ионных аккумуляторов на основе LiPF 6 с помощью подробной рамановской и ЯМР-спектроскопии. RSC Adv. 2013;3:16359–16364. doi: 10.1039/c3ra42611d. [Перекрестная ссылка] [Академия Google]
50. Хаммами А., Рэймонд Н., Арман М. Неуправляемый риск образования токсичных соединений. Нац. 2013; 424: 635–636. doi: 10.1038/424635b. [PubMed] [CrossRef] [Google Scholar]
[PubMed] [CrossRef] [Google Scholar]
51. Campion CL, et al. Подавление токсичных соединений, образующихся при разложении электролитов литий-ионных аккумуляторов. Электрохим. и твердотельный Lett. 2004;7(7):A194–A197. doi: 10.1149/1.1738551. [CrossRef] [Google Scholar]
52. Liu X, et al. Тепловыделение при термическом разрушении литий-ионного аккумулятора: влияние состава катода. Журнал пожарной безопасности. 2016;85:10–22. doi: 10.1016/j.firesaf.2016.08.001. [Перекрестная ссылка] [Академия Google]
53. Лион Р.Е., Уолтерс Р.Н. Энергетика отказа литий-ионного аккумулятора. J. опасных материалов. 2016; 318:164–172. doi: 10.1016/j.jhazmat.2016.06.047. [PubMed] [CrossRef] [Google Scholar]
54. EN 13823:2010. Реакция на огневые испытания строительных изделий – строительных изделий, за исключением полов, подвергающихся термическому воздействию одиночного горящего предмета. Европейский комитет по стандартизации (2010 г.).
55. EN 13501-1:2007 + A1:2009.

 Используйте посуду стойкую к кислоте: стекло, керамика, эбонит, пластик.
Используйте посуду стойкую к кислоте: стекло, керамика, эбонит, пластик.