Катализаторы — Что такое Катализаторы?
AИ-95
0
AИ-98
0
114142
Примерно 90% объема современного химического производства основано на каталитических процессах.
Катализаторы — вещества, изменяющие скорость химической реакции и не входящие в состав конечных продуктов.
См. Спецпроект Neftegaz.RU «Национальный продукт: Отечественные катализаторы».
Катализаторы обеспечивают энергетически менее затрудненные пути реакции, что позволяет эффективно использовать сырье.
Катализ — это ускорение химических реакций под действием малых количеств веществ (катализаторов), которые сами в ходе реакции не изменяются.
Примерно 90% объема современного химического производства основано на каталитических процессах.
Катализаторы позволяют превратить низкосортное сырье в высокоценные продукты.
Без катализаторов невозможно обеспечить производство моторных топлив для двигателей экологического стандарта «Евро-5» и выше.
Например, в каталитическом крекинге — одном из ключевых процессов, обеспечивающих увеличение выхода светлых нефтепродуктов (особенно бензина), самое главное действие катализатора — расщепление больших углеводородных молекул на более мелкие с высоким октановым числом.
Гидрокрекинг в свою очередь — процесс получения высококачественных керосиновых и дизельных дистиллятов из тяжелого газойля вакуумной перегонки и вторичных процессов.
Он также позволяет получить высококачественную основу базовых масел, близкую по эксплуатационным характеристикам к синтетическим.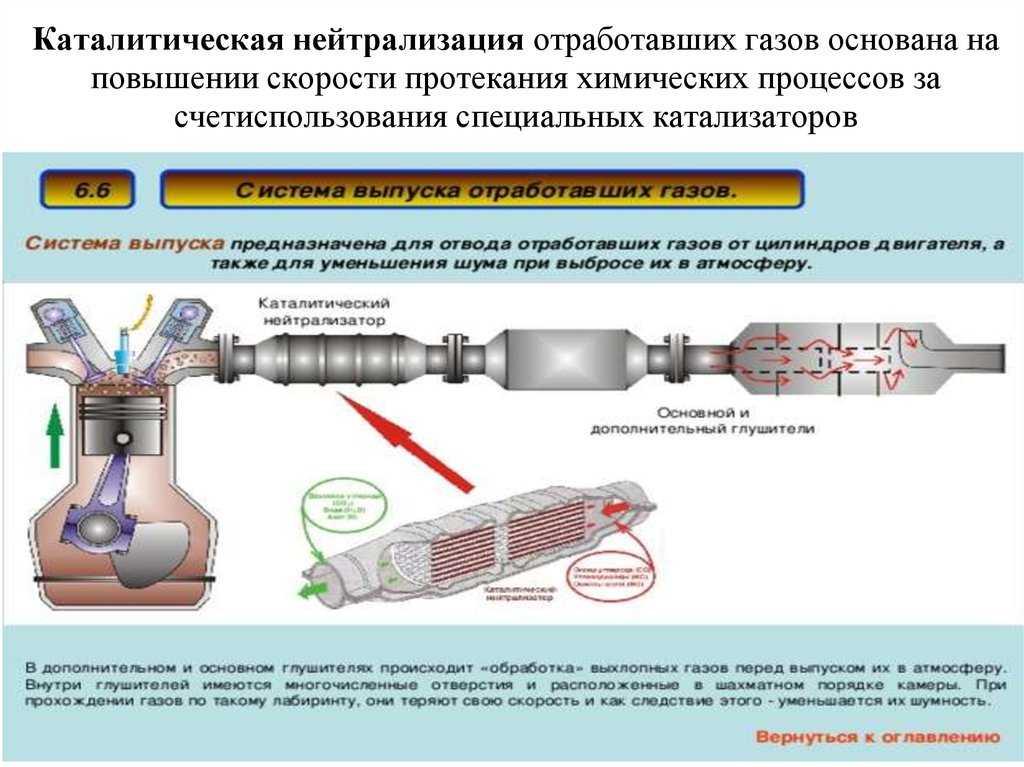
Иначе говоря, это каталитический крекинг в присутствии водорода — где сочетание водорода, катализатора и соответствующего режима процесса позволяют провести крекинг низкокачественного легкого газойля и добиться получения высококачественных основ для широкого ассортимента товарных смазочных масел.
Катализаторы здесь играют важную роль: они активно взаимодействуют с водородом, благодаря им идет сам крекинг и происходит образование изопарафинов.
Гидроочистка является наиболее крупнотоннажным каталитическим процессом в нефтепереработке.
В процессе гидроочистки понижается содержание серы в топливе.
Эффективность гидроочистки зависит от активности катализаторов, температурного режима и качества сырья.
- постоянная высокая каталитическая активность,
- селективность,
- механическая прочность,
- термостойкость,
- устойчивостью к действию каталитических ядов,
- большая длительность работы,
- легкая регенерируемость,
- необходимые гидродинамические характеристики,
- невысокая стоимость.

Активность определяется скоростью реакции, отнесенной к единице объема или массы катализатора и зависит от его хим. состава.
Формирование свойств катализатора происходит во время его приготовления и во время эксплуатации, поэтому метод приготовления катализатора должен учитывать возможность образования активных центров в условиях катализа. Во многих случаях активность промышленных катализаторов увеличивают добавлением промоторов (сокатализаторов).
Селективность изменяется из-за изменения электронных свойств и окружения активных центров катализатора (эффект лиганда).
В реакциях сложных органических молекул большое значение имеет преимущественное образование продукта, близкого по своей форме и размерам к размерам микропор катализатора.
В сложных многостадийных реакциях применяют многофазные многокомпонентные катализаторы, селективность которых выше благодаря тому, что каждая стадия сложной реакции ускоряется своим компонентом катализатора.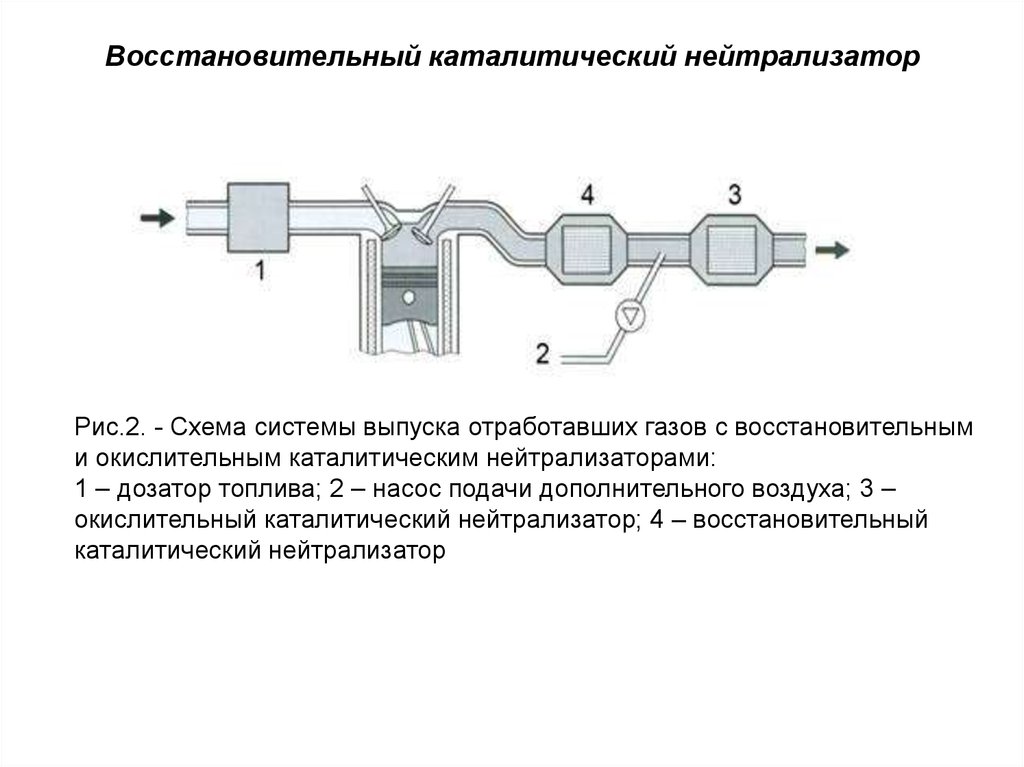 Селективность катализатора зависит также от его пористости, размера зерен и характера их укладки.
Селективность катализатора зависит также от его пористости, размера зерен и характера их укладки.
Термостойкость катализаторов важна для первых по ходу реагента слоев катализаторов в экзотермических реакциях, когда выделение тепла может вызвать рекристаллизацию и дезактивацию катализаторов.
Устойчивость катализатора к действию ядов каталитических определяется спецификой их взаимодействия с катализатором.
Металлические катализаторы отравляются соединениями кислорода (Н2О, СО), серы (H2S, CS2 и др.), N, Р, As и другими веществами, образующими более прочную химическую связь с катализатором, чем реагирующие вещества.
На оксидные катализаторы действуют те же яды, однако оксиды более устойчивы к отравлению.
В процессах крекинга, риформинга и других реакций углеводородов катализаторы отравляются в результате покрытия их слоем кокса.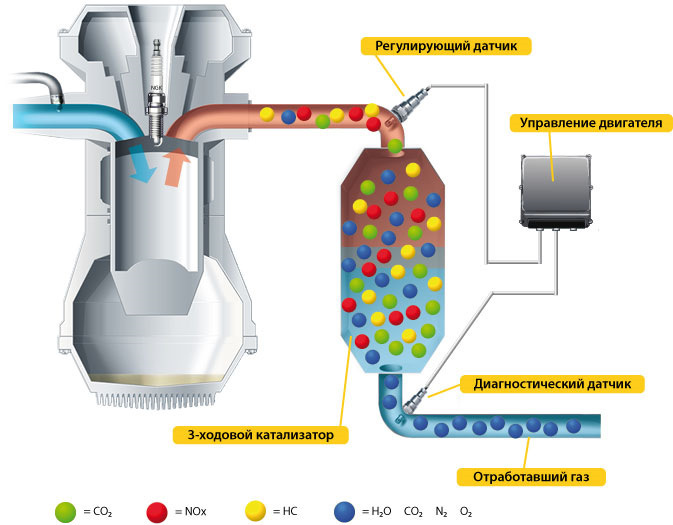
Кроме того, катализаторы могут дезактивироваться из-за механического покрытия поверхности пылью, которая вносится извне или образуется при катализе.
Приготовление катализаторов
Катализаторы с развитой удельной поверхностью распространение получил метод осаждения из водных растворов солей с последующим прокаливанием образующихся соединений.
Так получают многие оксиды металлов. При этом лучше использовать водный раствор NH3, потому что отпадает необходимость отмывки осадка от щелочных металлов.
Охлажденный катализатор дробят, просеивают и восстанавливают азотно-водородной смесью в колонне синтеза.
Для получения правильной геометрической формы зерен катализатора используют специальные формовочные машины.
Цилиндрические гранулы получают экструзией (выдавливанием) влажной массы с помощью массивного винта (шнека) через отверстия нужного диаметра, после чего разрезают полученный жгут на отдельные цилиндрики, которые
закатываются в сферические гранулы в специальных грануляторах.
Плоские цилиндрические таблетки получают прессованием сухого порошка на таблеточных машинах
Последние новости
Новости СМИ2
Произвольные записи из технической библиотеки
Используя данный сайт, вы даете согласие на использование файлов cookie, помогающих нам сделать его удобнее для вас. Подробнее.
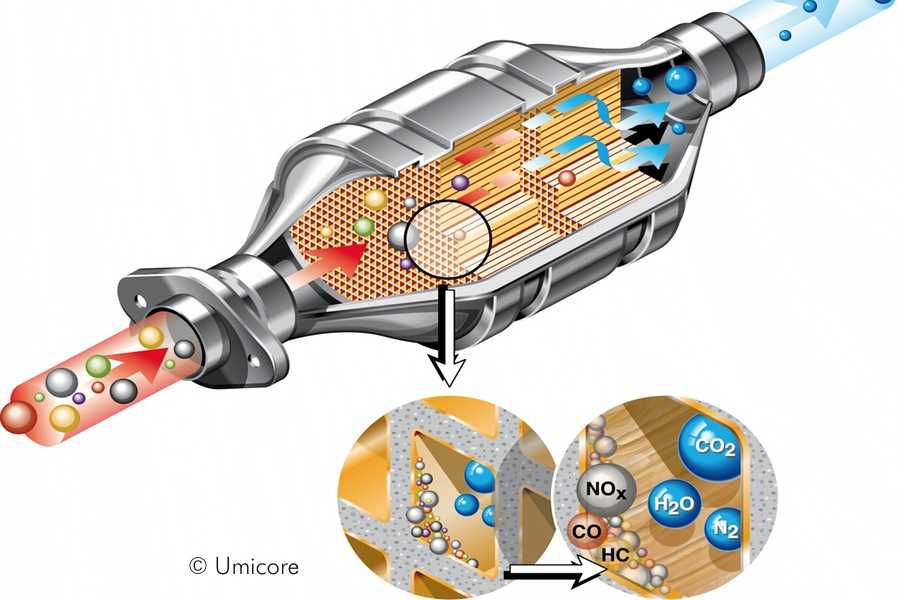
Принцип работы катализатора в автомобиле
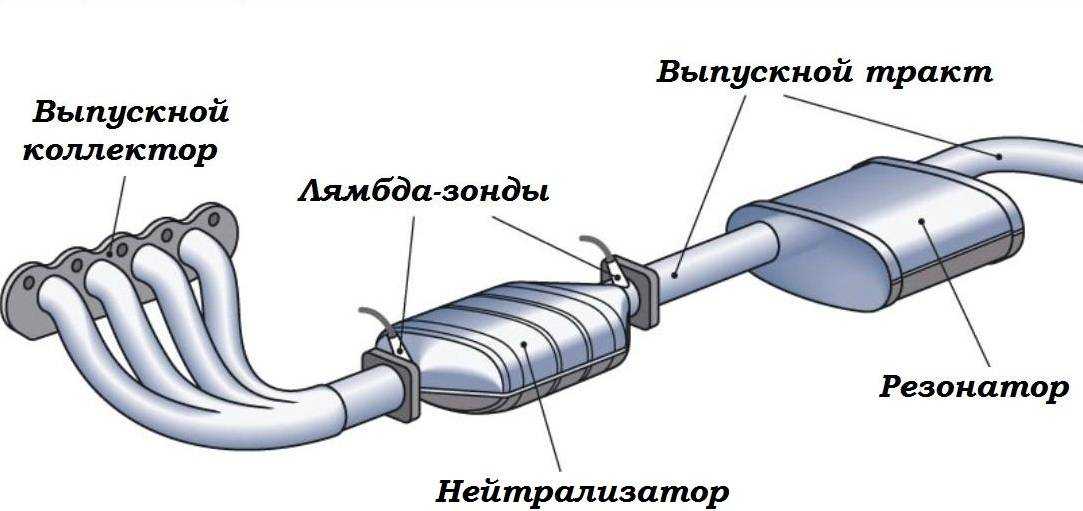
Выпускная система
На чтение 3 мин. Просмотров 1.4k.
Большинство автолюбителей даже не имеют представление о том, что такое автомобильный катализатор и в чем заключается принцип его работы. Именно поэтому сегодня мы попытаемся рассказать что это такое катализатор автомобильный.
Машины являются одним из самых крупных источников загрязнений атмосферы, так как они выбрасывают в атмосферу около 15 000 химических соединений, к которым относится газ и пыль. Компании по производству автомобилей постоянно стараются уменьшить количество вредных выбросов, именно это и привело к созданию автомобильного каталитического нейтрализатора системы выхлопа или как его еще называют катализатор.
Катализатор входит в состав выхлопной системы автомобиля и предназначается для понижения уровня выбросов вредоносных веществ вместе с продуктами горения.
Катализатор автомобильныйВ представленной статье мы более подробно поговорим о катализаторе, а именно обсудим такие вопросы:
- Что такое автомобильный катализатор?
- Конструкция автомобильного катализатора;
- В чем заключается принцип работы?
- Распространенные поломки каталитического нейтрализатора, при которых необходима его полная замена;
- Признаки неисправности, указывающие на то, что необходима замена;
- Как правильно проводится замена каталитического нейтрализатора выхлопной системы?
Большинство автолюбителей даже не имеют представления о том, что такое автомобильный катализатор и в чем заключается принцип его работы. Именно поэтому сегодня мы попытаемся рассказать основную информацию о каталитическом нейтрализаторе. Итак, автомобильный нейтрализатор это элемент выхлопной системы транспортного средства, снижающий температуру выхлопных газов, очищающий выхлопные газы и обеспечивающий догорание топливной смеси.
Схема катализатора автомобильногоКаталитический нейтрализатор используется на бензиновых и дизельных двигателях автомобиля. Представленное устройство чаще всего располагается за коллектором выпускной системы или же перед глушителями.
Основными элементами катализатора являются: теплоизоляция, корпус и блок-носитель. На сегодняшний момент существует несколько видов нейтрализаторов, которые соответствуют разному содержанию выхлопных газов в автомобильном двигателе.
К основным типам автомобильного катализатора выхлопной системы относятся: восстановительный, окислительный и окислительно-восстановительный.
Для правильной замены каталитического нейтрализатора должны соблюдаться некие условия, для соблюдения этих условий применяется лямбда-зонд. Благодаря данному устройству посылается обновленная информация и регулируется состав топливной смеси.
Признаки неисправности, указывающие на то, что необходима замена
При нормальном функционировании катализатор ломается только после полного сгорания каталитического слоя.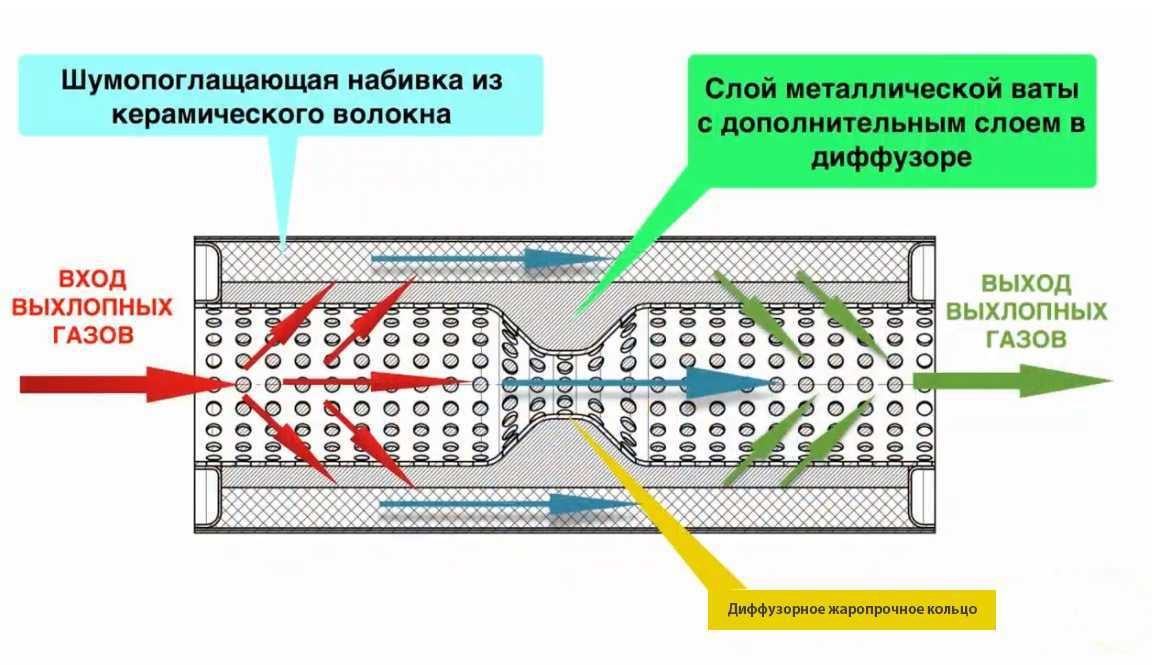 Такое формулирование даже не совсем правильно, так как он не ломается, а просто из-за уменьшения каталитического слоя он не может полностью сжигать выхлопные газы. То есть эффективность работы уменьшается, а токсичность продуктов горения повышается. Автомобильный катализатор достаточно редко выходит из строя, но все же каждый автолюбитель должен знать, как поступать в таком случае. Поэтому давайте рассмотрим, как проводится самостоятельная замена каталитического нейтрализатора.
Такое формулирование даже не совсем правильно, так как он не ломается, а просто из-за уменьшения каталитического слоя он не может полностью сжигать выхлопные газы. То есть эффективность работы уменьшается, а токсичность продуктов горения повышается. Автомобильный катализатор достаточно редко выходит из строя, но все же каждый автолюбитель должен знать, как поступать в таком случае. Поэтому давайте рассмотрим, как проводится самостоятельная замена каталитического нейтрализатора.
Для начала давайте рассмотрим основные признаки неисправности каталитического нейтрализатора выхлопной системы:
- Снизилась мощность автомобиля, это свидетельствует о том, что нейтрализатор забит.
- Во время передвижения транспортного средства на холостых оборотах двигателя заметно плаванье стрелочки тахометра.
- И выхлопной трубки чувствуется запах аммиака.
Итак, как же правильно проводится замена катализатора?
- Открутите болтики, закрепляющие устройство на дополнительном глушителе;
- Снимите болтики вместе с шайбой;
- Открутите болтики, которые закрепляют устройство на приемной трубке;
- Достаньте болтики вместе с пружинными шайбами;
- Достаньте устройство под днищем автомобиля;
- ПРоведите замену и соберите все в обратном порядке.

Как видите, замена катализатора системы выхлопа довольно проста и с ней сможет справиться даже не очень опытный автолюбитель. Обратите внимание на то, что в момент функционирования он может нагреваться до температуры около 600 градусов. Поэтому прежде чем перейти к замене катализатора дождитесь полного его охлаждения.
Что такое катализ?
от azoHAaccnt | 26 февраля 2018 г. | Блог
Катализ — это процесс модификации химической реакции с использованием катализатора. Этот процесс работает только с химическими веществами, у которых уже есть реакция, и используется для ускорения реакции в коммерческих целях. Катализ происходит быстрее, чем стандартная химическая реакция, потому что катализаторы требуют меньше энергии активации, которая представляет собой минимальный уровень энергии, необходимый для инициирования химической реакции.
В этом сообщении в блоге будут изложены принципы катализа и его различные типы.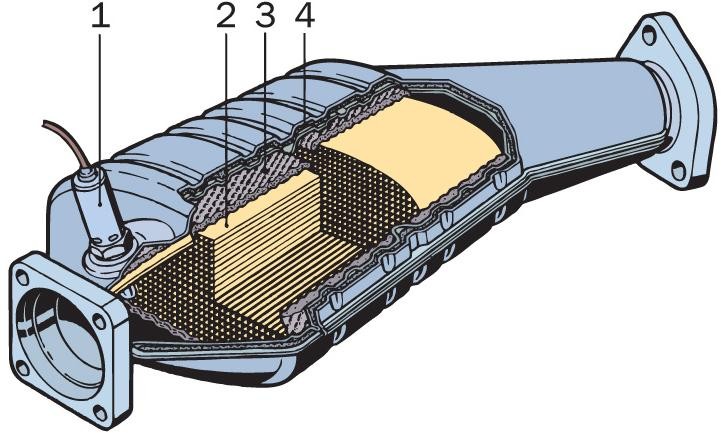
Принцип работы катализатора
Когда химическое вещество помещается с совместимым катализатором, уменьшается свободная энергия, необходимая химическому веществу для достижения переходного состояния для данной конкретной реакции. Катализаторы могут влиять на реакционную среду в зависимости от конкретных требований реакции.
Например, катализаторы могут выделять больше тепла, образовывать специфические промежуточные соединения, которые не образуются естественным путем, связывать реагенты для поляризации связей или вызывать диссоциацию реакций обратно в их реактивные формы.
Типы катализаторов
Существует два основных типа катализаторов, используемых для катализа; гетерогенный или гомогенный. Гетерогенный катализатор имеет молекулы, которые не находятся в той же фазе, что и реагенты, тогда как молекулы гомогенного катализатора находятся в той же фазе, что и реагенты.
Если вы хотите узнать больше о процессах, связанных с исследованиями катализа, прочитайте нашу статью: Что такое TPR?
Обычно гетерогенный катализатор является твердым, тогда как реагенты являются газообразными или жидкими. Реагенты адсорбируются на активных центрах поверхности гетерогенного катализатора, и происходит взаимодействие. Это взаимодействие заставляет молекулы становиться более реактивными.
Реагенты адсорбируются на активных центрах поверхности гетерогенного катализатора, и происходит взаимодействие. Это взаимодействие заставляет молекулы становиться более реактивными.
Электрокатализатор представляет собой гетерогенный катализатор, который используется специально в разработке топливных элементов для улучшения свойств и работы топливных элементов.
Гомогенные катализаторы находятся в той же фазе, что и реагент, обычно газ или жидкость. К этому типу катализаторов обычно применяются принципы гетерогенного катализатора.
Органокатализ — это форма катализа, которая может осуществляться с использованием гомогенного катализатора. Органокатализ — это изучение органических катализаторов, представляющих собой небольшие органические молекулы.
Подробнее: Инструменты для исследования катализа
Катализ в Hiden Analytical
Компания Hiden Analytical имеет более чем 30-летний опыт проектирования, разработки и производства масс-спектрометров для специализированного мониторинга технологических процессов и передовых исследовательских приложений.
У нас есть ряд продуктов, подходящих для анализа катализа, в том числе наш CATLAB-PCS, который обеспечивает полностью автоматизированные и точные исследования химии активной поверхности, возможность оптимизировать каталитическую активность и быстрый динамический скрининг.
Метод дифференциальной электрохимической масс-спектрометрии DEMS идеально подходит для анализа активности электрокатализаторов. Система Hiden HPR-40 DEMS предназначена для дифференциальной электрохимической масс-спектрометрии. Система включает ячейки DEMS, разработанные в сотрудничестве с Национальной лабораторией Лоуренса в Беркли, Калифорния, США.
Если вам нужна дополнительная информация о продуктах Hiden Analytical для исследования и анализа катализа, отправьте нам сообщение.
3.1: Общие принципы катализа
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 20281
Как видно из уравнения Аррениуса, величина энергии активации \(E_a\) определяет значение константы скорости \(k\) при данной температуре и, таким образом, общую скорость реакции.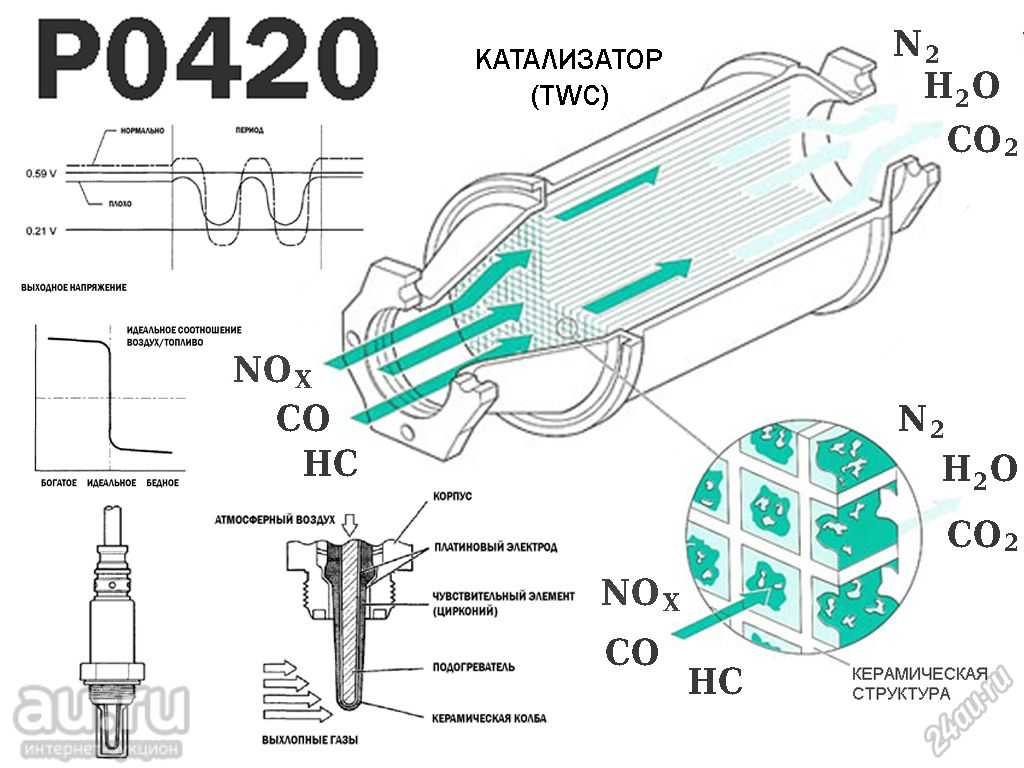
\[\text{A} \overset{k}{\longrightarrow} \text{P}\]
, которая протекает со скоростью \(k\) при определенной температуре.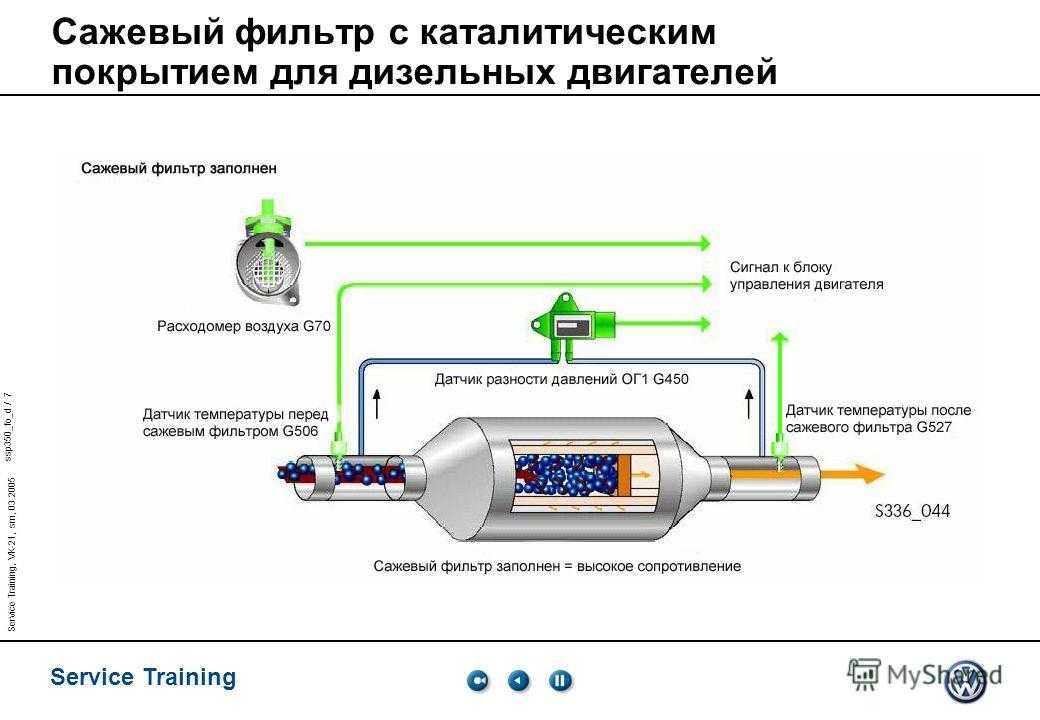 Скорость реакции может быть выражена как
Скорость реакции может быть выражена как
\[\dfrac{d \left[ \text{A} \right]}{dt} = -k \left[ \text{A} \right] \label{Eq1}\ ]
В присутствии катализатора \(\text{C}\) мы можем записать реакцию как
\[\text{A} + \text{C} \overset{k_\text{cat}} {\longrightarrow} \text{P} + \text{C}\]
и скорость реакции как
\[\dfrac{d \left[ \text{A} \right]}{dt} = -k \left[ \text{A} \right] — k_\text{cat } \left[ \text{A} \right] \left[ \text{C} \right] \label{Eq2}\]
где первый член представляет собой некатализируемую реакцию, а второй член представляет собой каталитическую реакцию. Поскольку скорость катализируемой реакции часто на порядок больше, чем скорость некаталитической реакции (т. е. \(k_\text{cat} \gg k\)), первым членом часто можно пренебречь.
Кислотный катализ
Типичным примером гомогенных катализаторов являются кислоты и основания. Например, общая реакция равна \(\text{S} \rightarrow \text{P}\). Если \(k\) скорость, то
\[\dfrac{d \left[ \text{P} \right]}{dt} = k \left[ \text{S} \right]\]
Целью фермента является увеличение скорости производства продукта \(\text{P}\). — &\overset{k_3}{\underset{k_{-3}}{\rightleftharpoons}} \text{A}H + H_2 O \end{align}\ ] 9+ \right]}{\left[ \text{A} H \right]} \label{Eq9}\]
— &\overset{k_3}{\underset{k_{-3}}{\rightleftharpoons}} \text{A}H + H_2 O \end{align}\ ] 9+ \right]}{\left[ \text{A} H \right]} \label{Eq9}\]
В этом случае реакция катализируется ионами водорода.
Ферментный катализ
Чтобы жить, расти и размножаться, микроорганизмы претерпевают ряд химических изменений. Они изменяют питательные вещества, чтобы они могли попасть в клетку, и они меняют их, как только они входят, чтобы синтезировать части клетки и получать энергию.
Метаболизм относится ко всем организованным химическим реакциям в клетке. Реакции, в которых происходит расщепление химических соединений, называются 9.0011 катаболические реакции , тогда как реакции, в которых синтезируются химические соединения, называются анаболическими реакциями . Все эти реакции находятся под контролем ферментов.
Ферменты представляют собой вещества, присутствующие в клетке в небольших количествах и функционирующие для ускорения или катализа химических реакций
 На поверхности фермента обычно имеется небольшая щель, которая функционирует как активный центр или каталитический центр, с которым могут связываться один или два специфических субстрата. (Все, с чем обычно соединяется фермент, называется субстрат .) Связывание субстрата с ферментом приводит к тому, что гибкий фермент слегка меняет свою форму в результате процесса, называемого индуцированной подгонкой , с образованием временного промежуточного продукта, называемого фермент-субстратный комплекс (рис. 1). Рисунок \(\PageIndex{2}\) : Ферменты представляют собой вещества, присутствующие в клетке в небольших количествах, которые ускоряют или катализируют химические реакции. Ферменты ускоряют скорость химических реакций, потому что они снижают энергию активации, энергию, которая должна быть выделена для того, чтобы молекулы реагировали друг с другом. Ферменты снижают энергию активации, образуя фермент-субстратный комплекс.
На поверхности фермента обычно имеется небольшая щель, которая функционирует как активный центр или каталитический центр, с которым могут связываться один или два специфических субстрата. (Все, с чем обычно соединяется фермент, называется субстрат .) Связывание субстрата с ферментом приводит к тому, что гибкий фермент слегка меняет свою форму в результате процесса, называемого индуцированной подгонкой , с образованием временного промежуточного продукта, называемого фермент-субстратный комплекс (рис. 1). Рисунок \(\PageIndex{2}\) : Ферменты представляют собой вещества, присутствующие в клетке в небольших количествах, которые ускоряют или катализируют химические реакции. Ферменты ускоряют скорость химических реакций, потому что они снижают энергию активации, энергию, которая должна быть выделена для того, чтобы молекулы реагировали друг с другом. Ферменты снижают энергию активации, образуя фермент-субстратный комплекс.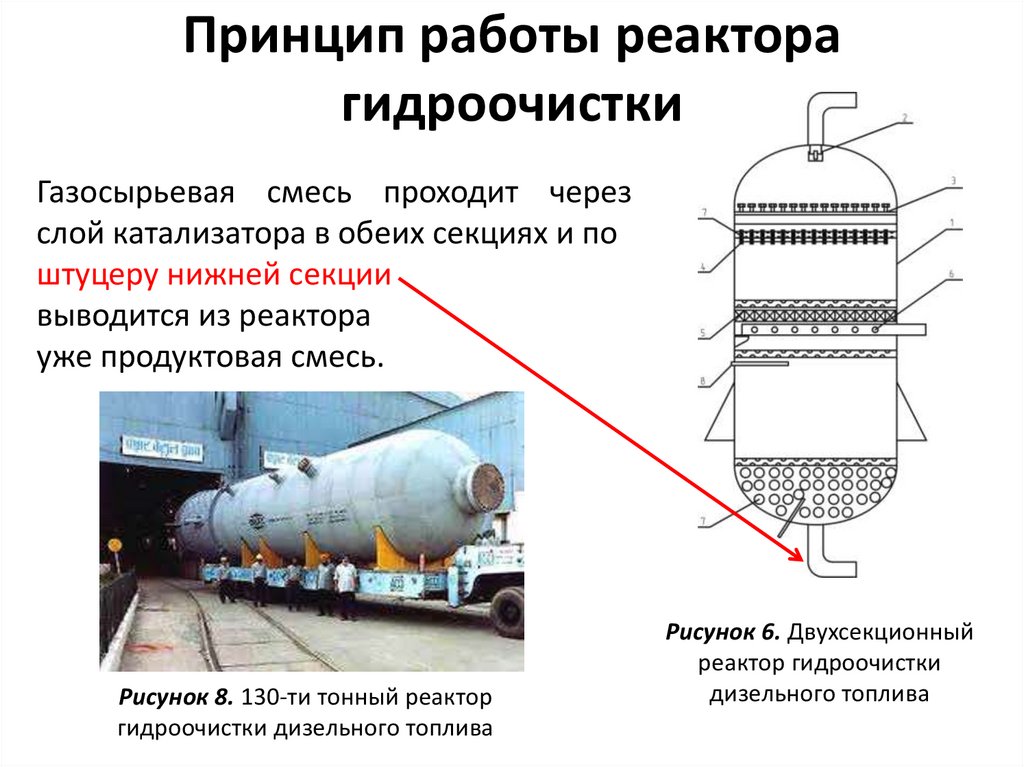
Ферменты ускоряют скорость химических реакций, потому что они снижают энергию активации, энергию, которая должна быть предоставлена для того, чтобы молекулы реагировали друг с другом (рис. \(\PageIndex{3}\)). Подобно рассмотренным выше гомогенным катализаторам, ферменты снижают энергию активации за счет образования комплекса фермент-субстрат, что позволяет образовываться и высвобождаться продуктам ферментативной реакции (рис. \(\PageIndex{2}\)).
Рисунок \(\PageIndex{3}\) : Фермент ускоряет химическую реакцию, снижая свою энергию активации, энергию, которая должна быть предоставлена для того, чтобы молекулы реагировали друг с другом.Ферментно-субстратные реакции
Ферменты – это вещества, присутствующие в клетке в небольших количествах, которые ускоряют или катализируют химические реакции. Ферменты ускоряют скорость химических реакций, потому что они снижают энергию активации, энергию, которая должна быть выделена для того, чтобы молекулы реагировали друг с другом. Ферменты снижают энергию активации, образуя фермент-субстратный комплекс.
Ферменты снижают энергию активации, образуя фермент-субстратный комплекс.
Многим ферментам требуется небелковый кофактор , чтобы помочь им в их реакции. В этом случае белковая часть фермента, называемая апофермент , соединяется с кофактором с образованием цельного фермента или галофермента (рис. \(\PageIndex{4}\)). Некоторые кофакторы представляют собой ионы, такие как Ca ++, Mg ++ и K+; другие кофакторы представляют собой органические молекулы, называемые коферментами , которые служат переносчиками химических групп или электронов. НАД + , НАДФ + , ФАД и кофермент А (КоА) являются примерами коферментов.
Рисунок \(\PageIndex{4}\) : Апофермент и кофактор объединяются, образуя галофермент. Если кофактор представляет собой органическую молекулу, он называется коферментом. Ферменты обычно представляют собой глобулярные белки. (Некоторые молекулы РНК, называемые рибозимами, также могут быть ферментами.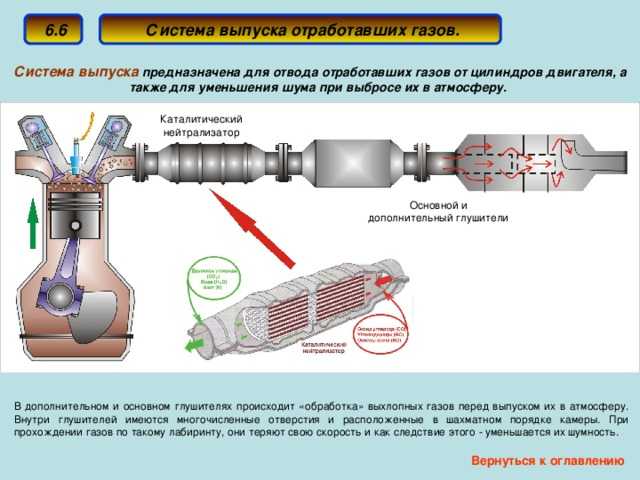 Обычно они находятся в ядерной области клеток и катализируют расщепление молекул РНК). Ферменты — это катализаторы, которые расщепляют или синтезируют более сложные химические соединения. Они позволяют химическим реакциям происходить достаточно быстро, чтобы поддерживать жизнь. Ферменты ускоряют скорость химических реакций, потому что они снижают энергию активации, энергию, которая должна быть выделена для того, чтобы молекулы реагировали друг с другом. Все, с чем обычно связывается фермент, называется субстратом. Ферменты очень эффективны: обычно ферменты способны катализировать от 1 до 10 000 молекул субстрата в секунду. Это означает, что ферменты должны присутствовать в клетке только в небольших количествах. Они не изменяются во время своей реакции и очень специфичны для своего субстрата, причем обычно для каждой конкретной химической реакции предназначен один конкретный фермент.
Обычно они находятся в ядерной области клеток и катализируют расщепление молекул РНК). Ферменты — это катализаторы, которые расщепляют или синтезируют более сложные химические соединения. Они позволяют химическим реакциям происходить достаточно быстро, чтобы поддерживать жизнь. Ферменты ускоряют скорость химических реакций, потому что они снижают энергию активации, энергию, которая должна быть выделена для того, чтобы молекулы реагировали друг с другом. Все, с чем обычно связывается фермент, называется субстратом. Ферменты очень эффективны: обычно ферменты способны катализировать от 1 до 10 000 молекул субстрата в секунду. Это означает, что ферменты должны присутствовать в клетке только в небольших количествах. Они не изменяются во время своей реакции и очень специфичны для своего субстрата, причем обычно для каждой конкретной химической реакции предназначен один конкретный фермент.
Факторы, влияющие на скорость ферментативных реакций
На активность фермента влияет ряд факторов, включая:
- Концентрация фермента скорость реакции.

- Концентрация субстрата : При постоянной концентрации фермента и более низких концентрациях субстрата концентрация субстрата является ограничивающим фактором. С увеличением концентрации субстрата скорость ферментативной реакции увеличивается. Однако при очень высоких концентрациях субстрата ферменты насыщаются субстратом, и более высокая концентрация субстрата не увеличивает скорость реакции.
- Ингибиторы : Ингибиторы подавляют активность фермента и снижают скорость реакции. Ингибиторы ферментов будут связываться с активными центрами ферментов и могут изменять химический состав активного центра, что может препятствовать проникновению субстрата.
- Температура : Каждый фермент имеет оптимальную температуру, при которой он работает лучше всего. Более высокая температура обычно приводит к увеличению активности фермента (кинетика Аррениуса). По мере повышения температуры молекулярное движение увеличивается, что приводит к большему количеству молекулярных столкновений.
 Однако, если температура поднимается выше определенной точки, тепло денатурирует фермент, заставляя его терять свою трехмерную функциональную форму из-за денатурации его водородных связей. Холодная температура, с другой стороны, замедляет активность ферментов за счет уменьшения молекулярного движения.
Однако, если температура поднимается выше определенной точки, тепло денатурирует фермент, заставляя его терять свою трехмерную функциональную форму из-за денатурации его водородных связей. Холодная температура, с другой стороны, замедляет активность ферментов за счет уменьшения молекулярного движения. - pH : Каждый фермент имеет оптимальный pH, который помогает поддерживать его трехмерную форму. Изменения pH могут денатурировать ферменты, изменяя заряд фермента. Это изменяет ионные связи фермента, которые способствуют его функциональной форме.
- Концентрация соли : Каждый фермент имеет оптимальную концентрацию соли. Изменения концентрации соли также могут денатурировать ферменты.
Применение ферментов
Ферменты необходимы для поддержания гомеостаза, поскольку любой сбой фермента может привести к заболеванию. Поэтому фармацевтические компании изучают ферменты для управления и синтеза новых лекарств.