Таблица зависимости плотности электролита от уровня заряда и температуры
Фильтр
по отрасли:
- Телекоммуникации
и связь - Энергетика
и промышленность - Торговые
предприятия - Строительные
компании
и объекты ЖКХ - Банки, финансовые
и гос. учереждения
Главная • Статьи • Таблица зависимости плотности электролита от уровня заряда и температуры
| Температура электролита | Wet Low Maintenance (Sb/Ca) or Wet Standard (Sb/Sb) батарея | Wet «Mainteneance Free» (Ca/Ca) или AGM/Gel Cell VRLA (Ca/Ca) батарея | ||||||||||||||
| Значение плотности электролита | Значение напряжения разомкнутой цепи | Значение напряжения разомкнутой цепи | ||||||||||||||
| °F | °С | 100% SoC | 75% SoC | 50% SoC | 25% SoC | 0% SoC | 100% SoC | 75% SoC | 50% SoC | 25% SoC | 0% SoC | 100% SoC | 75% SoC | 50% SoC | 25% SoC | 0% SoC |
| 120 | 48,9 | 1,249 | 1,209 | 1,174 | 1,139 | 1,104 | 12,663 | 12,463 | 12,253 | 12,073 | 11,903 | 12,813 | 12,613 | 12,413 | 12,013 | 11,813 |
| 110 | 43,3 | 1,253 | 1,213 | 1,178 | 1,143 | 1,108 | 12,661 | 12,461 | 12,251 | 12,071 | 11,901 | 12,811 | 12,611 | 12,411 | 12,011 | 11,811 |
| 100 | 37,8 | 1,257 | 1,217 | 1,182 | 1,147 | 1,112 | 12,658 | 12,458 | 12,248 | 12,068 | 11,898 | 12,808 | 12,608 | 12,408 | 12,008 | 11,808 |
| 90 | 32,2 | 1,261 | 1,221 | 1,186 | 1,151 | 1,116 | 12,655 | 12,455 | 12,245 | 12,065 | 11,895 | 12,805 | 12,605 | 12,405 | 12,005 | 11,805 |
| 80 | 26,7 | 1,265 | 1,225 | 1,190 | 1,155 | 1,120 | 12,650 | 12,450 | 12,240 | 12,060 | 11,890 | 12,800 | 12,600 | 12,400 | 12,000 | 11,800 |
| 70 | 21,1 | 1,269 | 1,229 | 1,194 | 1,159 | 1,124 | 12,643 | 12,443 | 12,233 | 12,053 | 11,883 | 12,793 | 12,593 | 12,393 | 11,993 | 11,793 |
| 60 | 15,6 | 1,273 | 1,233 | 1,198 | 1,163 | 1,128 | 12,634 | 12,434 | 12,224 | 12,044 | 11,874 | 12,784 | 12,584 | 12,384 | 11,984 | 11,784 |
| 50 | 10,0 | 1,277 | 1,237 | 1,202 | 1,167 | 1,132 | 12,622 | 12,422 | 12,212 | 12,032 | 11,862 | 12,772 | 12,572 | 12,372 | 11,972 | 11,772 |
| 40 | 4,4 | 1,281 | 1,241 | 1,206 | 1,171 | 1,136 | 12,606 | 12,406 | 12,196 | 12,016 | 11,846 | 12,756 | 12,556 | 12,356 | 11,956 | 11,756 |
| 30 | -1,1 | 1,285 | 1,245 | 1,210 | 1,175 | 1,140 | 12,588 | 12,388 | 12,178 | 11,998 | 11,828 | 12,738 | 12,538 | 12,338 | 11,938 | 11,738 |
| 20 | -6,7 | 1,289 | 1,249 | 1,214 | 1,179 | 1,144 | 12,566 | 12,366 | 12,156 | 11,976 | 11,806 | 12,716 | 12,516 | 12,316 | 11,916 | 11,716 |
| 10 | -12,2 | 1,253 | 1,218 | 1,183 | 1,148 | 12,542 | 12,342 | 12,132 | 11,952 | 11,782 | 12,692 | 12,492 | 12,292 | 11,892 | 11,692 | |
| 0 | -17,8 | 1,297 | 1,257 | 1,222 | 1,187 | 1,152 | 12,516 | 12,316 | 12,106 | 11,926 | 11,756 | 12,666 | 12,466 | 12,266 | 11,866 | 11,666 |
Зависимость плотности электролита от степени разряженности батареи
Таблица 2
Плотность электролита полностью заряженной батареи, г/см3 | Плотность электролита, г/см3,при степени разреженности батареи,% | плотность электролита полностью заряженной батареи,г/см 3 | Плотность электролита, г/см3,при степени разреженности батареи,% | ||
25 | 50 | 25 | 50 | ||
1,30 1,28 1,26 | 1,26 1,24 1,22 | 1,22 1,20 1,18 | 1,24 1,22 | 1,20 1,18 | 1,16 1,14 |
Аккумуляторные батареи, степень разреженности которых больше 50 % летом и 25 % зимой, необходимо снять с эксплуатации и зарядить в стационарных условия х
Проверка
технического состояния. Техническое
состояние аккумуляторных батарей
оценивают с помощью нагрузочной вилки
ЛЭ-2
или аккумуляторного пробника Э-107.
Нагрузочная вилка ЛЭ-2
(рис. 9 , а) позволяет
определять напряжение каждого аккумулятора
под нагрузкой. Нагрузочные резисторы
Техническое
состояние аккумуляторных батарей
оценивают с помощью нагрузочной вилки
ЛЭ-2
или аккумуляторного пробника Э-107.
Нагрузочная вилка ЛЭ-2
(рис. 9 , а) позволяет
определять напряжение каждого аккумулятора
под нагрузкой. Нагрузочные резисторы
21
При измерении
напряжения контактные ножки плотно
прижимают к выводам
аккумулятора, и через 5 с регистрируют
показания вольтметра.
Напряжение на выводах исправного
аккумулятора должно
быть в пределах 1,7—1,8 В. При снижении
напряжения до 1.4
— 1,7 В батарею
следует подзарядить. Если напряжение
хотя бы одного аккумулятора отличается
от напряжения других
аккумуляторов на 0,1
В или падает ниже 1,4
В, батарею требуется зарядить
в стационарных условиях или
отремонтировать.
Напряжение под нагрузкой у аккумуляторных
батарей с общей крышкой
емкостью до 190 А•ч
измеряют с помощью
пробника Э-107 (рис. 3 ,
б), у которого одна контактная ножка
заменена щупом 9. ЭДС
аккумуляторной батареи определяется
при отвернутых контактных гайках 3.
При снижении
напряжения до 1.4
— 1,7 В батарею
следует подзарядить. Если напряжение
хотя бы одного аккумулятора отличается
от напряжения других
аккумуляторов на 0,1
В или падает ниже 1,4
В, батарею требуется зарядить
в стационарных условиях или
отремонтировать.
Напряжение под нагрузкой у аккумуляторных
батарей с общей крышкой
емкостью до 190 А•ч
измеряют с помощью
пробника Э-107 (рис. 3 ,
б), у которого одна контактная ножка
заменена щупом 9. ЭДС
аккумуляторной батареи определяется
при отвернутых контактных гайках 3.
В
настоящее время вместо нагрузочной
вилки ЛЭ-2 используют
пробник Э-108, унифицированный с пробником
Э-107. Пробник
Э-108 в отличие от
Э-107 имеет
вольтметр с двусторонней шкалой (что
позволяет проводить измерения, не
соблюдая полярности), три нагрузочных
резистора и две контактные гайки.
Различное включение резисторов позволяет
проверять отдельные аккумуляторы
батарей емкостью 45—105, 105—150 и 150— 190
А•ч.
Прибор ЛЭ-ЗМ (рис. 9, в) используют как диагностический для определения напряжения аккумуляторов батареи при нагрузке, близкой к стартерной. Прибор позволяет, меняя положение переключателя 17 вольтметра, измерять напряжение на выводах трех аккумуляторов батареи.
Более точно техническое состояние аккумуляторной батареи определяют по фактической емкости 20-часового разряда и продолжительности стартерного разряда при температуре (25 ± 2) °С.
22
Неисправности аккумуляторных батарей.
Неисправности, причины их возникновения и способы устранения приведены ниже. К неисправностям аккумуляторных батарей, возникающим в эксплуатации, относятся окисление выводов и наконечников проводов, нарушение герметичности, ускоренный саморазряд, сульфитация, короткое замыкание и преждевременное разрушение электродов.
Сульфитация —
образование на поверхности электродов
крупных малорастворимых кристаллов
сернокислого свинца — происходит
при повышенной плотности электролита,
длительном хранении батарей без
подзаряда, систематическом недозаряде,
наличии контакта электродов с
воздухом вследствие пониженного уровня
электролита.
Изменение объема электродов при заряде и разряде приводит к отделению активной массы от решеток и оседанию ее на дне моноблока. Деформирование и разрушение электродов происходят интенсивнее при коротких замыканиях и длительных включениях стартера. Положительные электроды окисляются кислородом и быстро разрушаются при перезарядах батареи.
В связи с естественным износом электродов, коррозией решеток и выпадением активной массы положительных электродов, уплотнением активной массы отрицательных электродов происходит постепенное снижение емкости аккумуляторной батареи. Аккумуляторная батарея снимается с эксплуатации при снижении емкости до 40 % номинальной или уменьшении продолжительности стартерного разряда при температуре
(25 ± 2) °С до 1,5 мин.
Минимальный срок
службы батарей обычной конструкции и
с общей крышкой в эксплуатации должен
составлять 1 год при наработке
транспортного средства в пределах
этого срока не более 150 тыс. км пробега
или 2 года при наработке транспортного
средства в пределах этого срока не
более 90 тыс. км пробега.
км пробега
или 2 года при наработке транспортного
средства в пределах этого срока не
более 90 тыс. км пробега.
23
Причина неисправности | Способ устранения |
Аккумуляторная батарея не обеспечивает достаточной частоты вращения коленчатого электростартером вала | |
Повышенное падение напряжения в цепи питания стартера Разряд батареи ниже допустимого уровня Неисправность одного или нескольких аккумуляторов Ускоренный саморазряд батареи вследствие попадания электролита на поверхность батареи | Очистить выводы батареи и наконечники проводов, подтянуть креплениние наконечников проводов на выводах батареи и смазать их техническим вазелином Зарядить батарею,при необходимости проверить исправность генераторной установки Сдать батарею в ремонт Протереть
батарею сухой тряпкой, а затем тряпкой
смоченной 10%-ным раствором нашатырного
спирта или кальцинированной соды. Разрядить батарею током 10-часового режима до напряжения одного из аккумуляторов 1.1-1.2 В. Электролит вылить, батарею промыть, залить в неё свежий электролит и зарядить. |
Быстрое понижение уровня электролита | |
Повреждение моноблока батареи. Повышение зарядного напряжения | Сдать батарею в ремонт Проверить регулятор напряжении , при необходимости отрегулировать. |
Разряженная батарея плохо заряжается (быстро повышается напряжение и температура электролита, начинаеться обильное газовыделение) | |
Сульфатация электролита | Восстановить
батарею с сульфатированными электродами
зарядно-разрядным циклом при силе
тока менее 0.05С20 (А) в случае начальной
плотности 1. |
Выплескивание электролита из вентиляционных отверстий во время заряда | |
Повышение уровня электролита Повышение силы зарядного тока Короткое замыкание пластин в аккумуляторе | Удалить излишки электролита резиновой грушей Проверить регулятор напряжения, при необходимости отрегулировать Сдать батарею в ремонт |
Минимальный срок службы необслуживаемых батарей в эксплуатации должен быть равен 3 годам при наработке транспортного средства не более 100 тыс. км пробега.
Минимальный срок
сохраняемости не залитой электролитом
батареи должен составлять 3 года.
Сухозаряженность должна сохраняться
не менее 1 года. Для необслуживаемых
батарей, залитых электролитом,
устанавливается срок сохраняемости 2
года при условии промежуточного заряда
в пределах минимального срока службы.
ЗАРЯД БАТАРЕИ:
1. Присоедините положительный вывод батареи к положительному полюсу источника тока, а отрицательный — к отрицательному.
2. Включите батареи на заряд, если температура электролита в них не выше 30°С в холодной и умеренной зонах и не выше 35°С в жаркой и теплой влажной зонах.
3. Ток заряда должен соответствовать данным табл. 4.
4. Заряд батарей ведите до тех пор, пока не наступит обильное газовыделение во всех аккумуляторах батареи, а напряжение и плотность электролита останутся постоянными в течение 2 ч. Напряжение контролируйте вольтметром класса точности 1,0 со шкалой на ЗВ с ценой деления 0,02 В, для батареи со скрытыми перемычками — вольтметром со шкалой на 30 В с ценой деления 0,2 В.
5. Во время заряда
периодически проверяйте температуру
электролита и следите за тем, чтобы
она не поднималась выше 45.°С в
холодной и умеренной климатических
зонах и выше 50сС
в условиях жаркой и теплой влажной
зон, В случае, если температура окажется
выше упомянутых значений, следует
уменьшить зарядный ток наполовину или
прервать заряд на время, необходимое
для снижения температуры до 30—35°С.
6. В конце заряда, если плотность электролита, замеренная с учетом температурной поправки по табл.1, будет отличаться от нормы, указанной в табл. (графа 4), произведите корректировку плотности электролита доливкой дистиллированной воды в случаях, когда плотность выше нормы и доливкой раствора кислоты плотностью 1,400 г/см3, когда она ниже нормы.
После корректировки электролита водой или раствором кислоты продолжите заряд в течение 30 мин. для полного перемешивания электролита
По окончании корректировки плотности электролита батареи выключите с заряда, дайте постоять еще 30 мин. без тока.
Затем произведите
замер уровня электролита во всех
аккумуляторах батареи. Если уровень
электролита окажется, ни же нормы,
в аккумулятор
добавьте электролит такой же
плотности, какая указана в табл. t (графа 4), при уровне
электролита выше нормы отберите избыток
электролита резиновой грушей. После
заряда батареи сдаются в эксплуатацию.
После
заряда батареи сдаются в эксплуатацию.
что это такое и ее значения
Большинство автомобилей комплектуются свинцово-кислотными аккумуляторными батареями. Принцип действия свинцовых аккумуляторов заключается в обратимой химической реакции свинца и его окиси, расположенный в пластинах и раствора электролита. В качестве электролита используется водный раствор серной кислоты Плотность электролита показывает концентрацию (степень разбавленности) кислоты.
Содержание
- Что такое плотность электролита
- Какую плотность имеет электролит в аккумуляторах
- Зависимость плотности от степени заряженности
- Рекомендуемые значения плотности
- Коррекция плотности при смене сезона
- Выравнивание плотности
Что такое плотность электролита
Серная кислота и вода могут смешиваться в любых пропорциях. Понятие плотность электролита введено для того, чтобы показать, какое количество чистой кислоты содержится в единице объем электролита.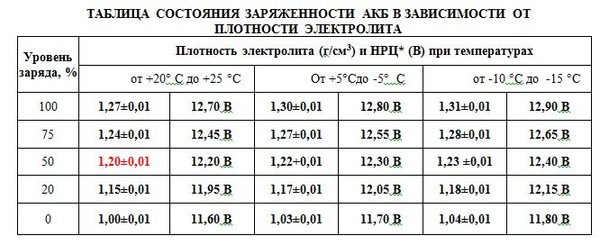
Смешивая кислоту с водой, получают промежуточные значения. Чем больше воды содержит раствор, тем меньшее значение плотности он имеет, поскольку концентрированная кислота гораздо тяжелее:
- дистиллированная вода – 1.00 г/см3;
- концентрированная серная кислота – 1.84 г/см3.
Какую плотность имеет электролит в аккумуляторах
Плотность электролита в аккумуляторе имеет определенные значения, которые существенны для нормального протекания химических реакций в процессе работы. В зимний период и летом концентрация кислоты должна иметь разные значения. Особенно это касается регионов с большими колебаниями температуры. Несоответствие плотности оптимальным значениям может привести к отрицательным последствиям:
- Низкая плотность:
- снижение КПД батареи из-за повышения внутреннего сопротивления;
- снижение емкости, так как свинец пластин не полностью вступает в реакцию из-за недостатка кислоты;
- вероятность замерзания при низких отрицательных температурах;
- Высокая плотность:
- Сульфатация пластин из-за образования крупных труднорастворимых кристаллов сульфида свинца;
- Осыпание пластин.

Важно! Плотность электролита в АКБ не является постоянной величиной. Это связано с тем, что во время разряда кислота из раствора реагирует с материалом пластин и ее концентрация падает. Во время зарядки происходит обратная реакция. Разность плотностей заряженного и разряженного аккумулятора составляет примерно 0.15 – 0.16 г/см3.
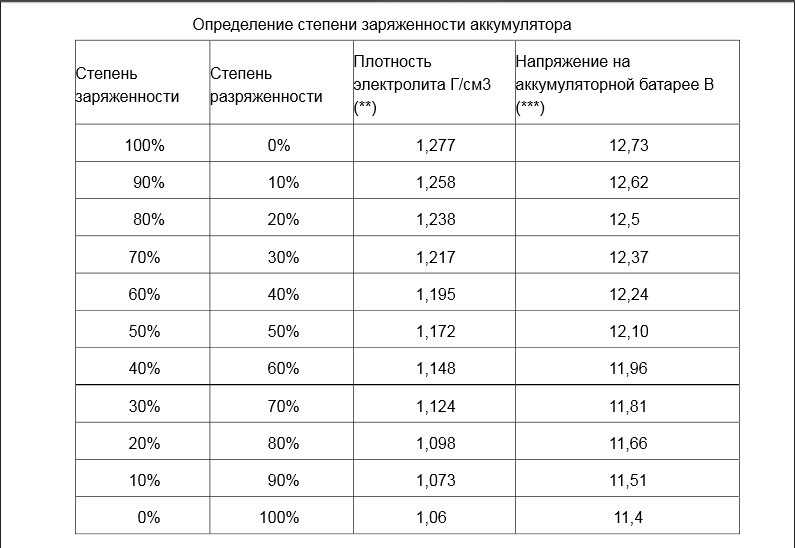
Таким образом, зная параметры электролита в полностью заряженном аккумуляторе, можно определить степень разрядки, не пользуясь измерительными приборами, а определив состояние электролита при помощи ареометра.
Измерения производят с учетом температуры, так как наблюдается сильная зависимость. Рекомендуемые значения относятся к измерениям при температуре от +20 до +30°С В других случаях поправки к измерениям должны иметь такие значения:
- от +31 до +45°С + 0.01 гр/см3;
- от +20 до +30°С + 0.00 гр/см3;
- от +5 до +19°С — 0.01 гр/см3;
- от +4 до -10°С — 0.02 гр/см3;
- от -11 до -25° -03 гр/см3;
- от -26 до -40° -04 гр/см3.

Зависимость плотности от степени заряженности
Для электролита автомобильного аккумулятора с нормальной плотностью 1.27 гр/см3 можно привести следующую зависимости от степени разряда батареи:
| Плотность гр/см3 | Уровень заряда | Температура замерзания |
| 1.27 | 100%, | – 60°С; |
| 1.26 | 95%, | – 55°С; |
| 1.25 | 87%, | – 50°С; |
| 1.24 | 80%, | – 46°С; |
| 1.23 | 75%, | – 42°С; |
| 1.22 | 70%, | – 37°С; |
| 1.21 | 63%, | – 32°С; |
| 1.20 | 56%, | – 27°С; |
| 1.19 | 50%, | – 24°С; |
| 1.18 | 44%, | – 18°С; |
| 1.17 | 37%, | – 16°С; |
| 1.16 | 31%, | – 14°С; |
| 1.15 | 25%, | – 13°С; |
| 1.14 | 19%, | – 11°С; |
1. 13 13 | 13%, | – 9°С; |
| 1.12 | 6%, | – 8°С; |
В таблице плотности электролита приведена зависимость плотности и температуры замерзания. Приведенные данные показывают, что глубокий разряд батареи чреват ее замерзанием уже при температуре 8 — 16°С
Рекомендуемые значения плотности
Часто задаваемый вопрос – какая должна быть плотность электролита для лета и для зимы? Большинство производителей аккумуляторов рекомендуют придерживаться следующих значений плотности, в зависимости от минимальной зимней температуры. Важность контроля плотности электролита зимой связана не только с недопущением перемерзания электролита, но и повышением КПД батареи для успешного запуска непрогретого двигателя:
- от +6 до +4° 22 гр/см3;
- от +4 до -15° 24 гр/см3;
- от -4 до -15° 26 гр/см3;
- от -15 до -30° 28 гр/см3;
- от -30 до -50° 29 гр/см3;
Перечисленные значения справедливы для полностью заряженных батарей. Заливка электролита в новую батарею производится раствором меньшей концентрации – на 0.02 гр/см3. В процессе зарядки значение поднимется до необходимой величины.
Заливка электролита в новую батарею производится раствором меньшей концентрации – на 0.02 гр/см3. В процессе зарядки значение поднимется до необходимой величины.
Нормой плотности электролита в средней полосе принято считать 1.26 – 1.27 гр/см3.
Коррекция плотности при смене сезона
При большой разнице среднесуточных температур в летний и зимний период рекомендуется корректировать значение плотности. Процесс не представляет сложности, но опасен из-за агрессивности электролита.
Если машина храниться в гараже и эксплуатируется регулярно, то необходимость в коррекции не возникает, поскольку в результате длительных поездок батарея успевает зарядиться до нормального состояния и содержание кислоты не палает до критических значений.
Кратковременные поездки не способствуют нормальному заряду. Старые аккумуляторы имеют повышенные значения саморазряда, поэтому после длительного простоя плотность может упасть до недопустимых значений.
Электролит корректируется на полностью заряженном аккумуляторе. Важно знать, что в большинстве автомобилей с правильно отрегулированной системой регулировки напряжения, уровень заряда аккумулятора не превышает 80 – 90%. В зимнее время при наличии большого числа мощных потребителей (вентилятор печки, обогрев стекол и сидений, свет фар), это значение еще меньше. Для правильной подготовки батареи к зимнему сезону необходима полная зарядка специализированным зарядным устройством.
Важно знать, что в большинстве автомобилей с правильно отрегулированной системой регулировки напряжения, уровень заряда аккумулятора не превышает 80 – 90%. В зимнее время при наличии большого числа мощных потребителей (вентилятор печки, обогрев стекол и сидений, свет фар), это значение еще меньше. Для правильной подготовки батареи к зимнему сезону необходима полная зарядка специализированным зарядным устройством.
Заряд производят при слабом кипении электролита до тех пор, пока в течении текущих двух часов плотность расти уже не будет. Рост плотности говорит о том, что заряд еще не окончен.
Плотность электролита в заряженном аккумуляторе измеряют через два часа после зарядки, чтобы пластины полностью освободились от пузырьков газа и снизилась температура. Не забывайте про учет температуры электролита!
Содержание кислоты повышают при помощи корректирующего электролита, который добавляют в банки взамен части основного электролита.
Важно! Отбор раствора из каждой банки батареи должен быть одинаковым! Количество добавляемого корректора также одинаково.
Сколько убрано жидкости, столько корректирующего раствора нужно добавлять
Плотность электролита в аккумуляторе и зимой и летом проверяется после получаса дополнительного заряда с последующей двухчасовой выдержкой. Это делается с целью равномерного перемешивания электролита. Обязателен учет температуры.
Переход на летнюю эксплуатацию делается аналогично, только вместо более крепкой кислоты добавляется дистиллированная вода. Дополнительный заряд должен продолжаться более длительное время, поскольку добавляемая вода из-за низкого удельного веса будет находится в верхнем слое.
Важно! Нельзя ускорять перемешивание покачиванием и переворачиванием батареи, поскольку осадок с дна емкости попадет между пластинами и батарея выйдет из строя.
Выравнивание плотности
В процессе эксплуатации аккумулятора можно увидеть, что разные банки имеют расхождения при измерении плотности. Если эта величина не превосходит 0.01 – 0. 02 гр/см3, то ничего страшного нет. Большая разница свидетельствует, что банка с меньшим значением начинает выходить из строя.
02 гр/см3, то ничего страшного нет. Большая разница свидетельствует, что банка с меньшим значением начинает выходить из строя.
Встречаются рекомендации исправлять состояние неисправной банки путем долива корректирующего раствора. Этого делать нельзя ни в коем случае. Простое увеличение концентрации кислоты даст только отрицательный эффект и ускорит выход банки из строя.
В данной ситуации необходимо произвести тренировочный цикл заряда. Полностью заряженный аккумулятор разряжают до 50% номинальной емкости, а затем заряжают малым током до полного заряда. Повторяя процесс несколько раз, можно полностью восстановить неисправные банки батареи.
Такие же требования предъявляются к выравниванию уровня электролита. В процессе зарядки током бортовой сети происходит частичное испарение воды из банок. Особенно активно этот процесс происходит летом. Кислота при этом не испаряется, вопреки некоторым источникам из интернета. Поэтому уровень электролита выравнивается исключительно дистиллированной водой.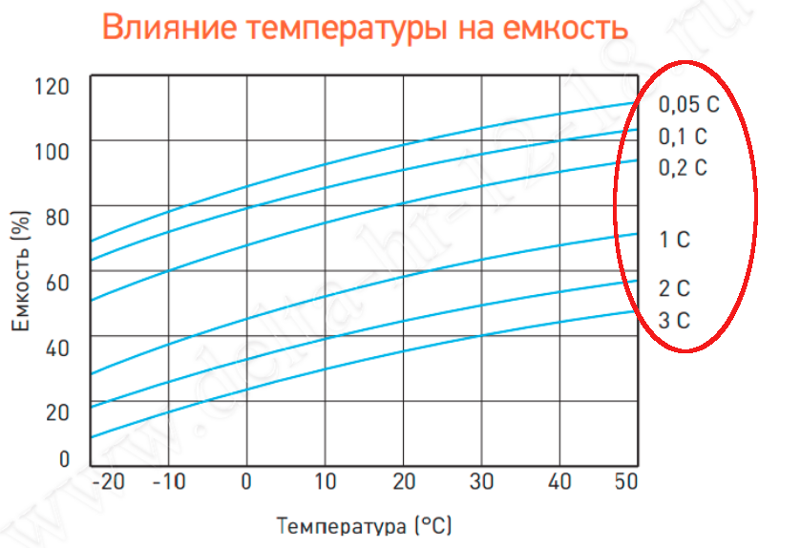
https://www.youtube.com/watch?v=dZDnSmBlPmwVideo can’t be loaded because JavaScript is disabled: Плотность электролита в аккумуляторе (https://www.youtube.com/watch?v=dZDnSmBlPmw)
Плотность электролита в аккумуляторе
Автомобильная батарея, известная как аккумулятор, отвечает за системы запуска, освещения и зажигания в машине. Как правило, автомобильные аккумуляторы являются свинцово-кислотными, состоят из гальванических элементов, обеспечивающих 12-вольтовую систему. Каждая из ячеек создает 2,1 В при полной зарядке. Плотность электролита – контролируемое свойство водно-кислотного раствора, обеспечивающее нормальную работу батарей.
Состав свинцово-кислотной батареи
Электролит свинцово-кислотной аккумуляторной батареи представляет собой раствор серной кислоты и дистиллированной воды. Удельный вес чистой серной кислоты составляет около 1,84 г/см3, и эту чистую кислоту разбавляют дистиллированной водой до тех пор, пока удельный вес раствора не станет равным 1,2-1,23 г/см3.
Хотя в некоторых случаях плотность электролита в аккумуляторе рекомендуется в зависимости от типа батареи, сезонного и климатического состояния. Удельный вес полностью заряженной батареи по промышленному стандарту в России — 1,25-1,27 г/см3 летом и для суровых зим- 1,27-1,29 г/см3.
Удельный вес электролита
Одним из основных параметров работы батареи является удельный вес электролита. Это отношение веса раствора (серной кислоты) к весу равного объема воды при определенной температуре. Обычно измеряется с помощью ареометра. Плотность электролита используется в качестве индикатора состояния заряда ячейки или батареи, однако не может характеризовать емкость аккумулятора. Во время разгрузки удельный вес уменьшается линейно.
Учитывая это, нужно уточнить размер допустимой плотности. Электролит в батарее не должен превышать 1,44 г/см3. Плотность может составлять от 1,07 до 1,3 г/см3. Температура смеси при этом будет составлять около +15 С.
Электролит повышенной плотности в чистом виде характеризуется довольно высокой величиной этого показателя. Его плотность составляет 1,6 г/см3.
Степень заряженности
При полностью заряженном стационарном режиме и при разряде измерение удельного веса электролита дает приблизительное указание на состояние заряда ячейки. Удельный вес = напряжение разомкнутой цепи — 0,845.
Пример: 2,13 В — 0,845 = 1,285 г/см3.
Удельный вес уменьшается при разрядке батареи до уровня, близкого к значению чистой воды, и увеличивается во время перезарядки. Аккумулятор считается полностью заряженным, когда плотность электролита в аккумуляторе достигает максимально возможного значения. Удельный вес зависит от температуры и количества электролита в ячейке. Когда электролит находится вблизи нижней отметки, удельный вес выше, чем номинальный, он падает, и воду добавляют в ячейку, чтобы довести электролит до требуемого уровня.
Объем электролита расширяется, когда температура поднимается, и сжимается с понижением температуры, что влияет на плотность или удельное значение силы тяжести. По мере расширения объема электролита показания снижаются и, наоборот, удельный вес увеличивается при более низких температурах.
По мере расширения объема электролита показания снижаются и, наоборот, удельный вес увеличивается при более низких температурах.
Перед тем как поднять плотность электролита в аккумуляторе, необходимо выполнить замеры и расчеты. Удельный вес для батареи определяется приложением, в котором он будет использоваться, с учетом рабочей температуры и срока службы батареи.
% Серная кислота | % Вода | Удельный вес (20 ° С) |
37,52 | 62,48 | 1,285 |
48 | 52 | 1,380 |
50 | 50 | 1,400 |
60 | 40 | +1,500 |
68,74 | 31,26 | 1,600 |
70 | 30 | 1,616 |
77,67 | 22,33 | 1,705 |
93 | 7 | 1,835 |
Химическая реакция в аккумуляторах
Как только нагрузка подключается через клеммы аккумулятора, разрядный ток начинает течь через нагрузку, и аккумулятор начинает разряжаться.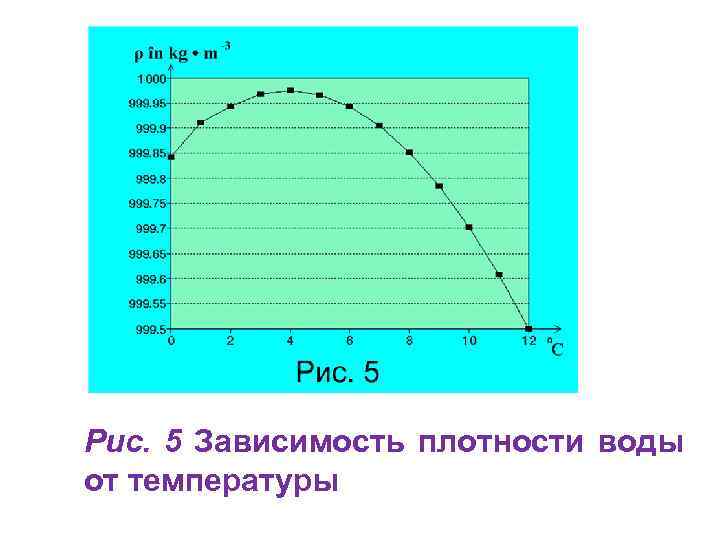 Во время процесса разрядки кислотность раствора электролита уменьшается и приводит к образованию сульфатных отложений как на положительных, так и на отрицательных пластинах. В этом процессе разряда количество воды в растворе электролита увеличивается, что уменьшает его удельный вес.
Во время процесса разрядки кислотность раствора электролита уменьшается и приводит к образованию сульфатных отложений как на положительных, так и на отрицательных пластинах. В этом процессе разряда количество воды в растворе электролита увеличивается, что уменьшает его удельный вес.
Ячейки аккумуляторной батареи могут быть разряжены до заданного минимального напряжения и удельного веса. Полностью заряженная свинцово-кислотная аккумуляторная батарея имеет напряжение и удельный вес, 2,2 В и 1,250 г/см3 соответственно, и эта ячейка обычно может разряжаться до тех пор, пока соответствующие значения не достигнут 1,8 В и 1,1 г/см3.
Состав электролита
Электролит содержит смесь серной кислоты и дистиллированной воды. Данные не будут точными при замерах, если водитель только что добавил воду. Нужно подождать некоторое время, чтобы свежая вода успела смешаться с существующим раствором. Перед тем как поднять плотность электролита, нужно помнить: чем больше концентрация серной кислоты, тем плотнее становится электролит. Чем выше плотность, тем выше уровень заряда.
Чем выше плотность, тем выше уровень заряда.
Для раствора электролита наилучшим выбором является дистиллированная вода. Это минимизирует возможные загрязнения в растворе. Некоторые загрязняющие вещества могут вызывать реакцию с ионами электролита. Например, если смешивать раствор с солями NaCl, получится осадок, что изменит качество раствора.
Влияние температуры на емкость
Какая плотность электролита — это будет зависеть от температуры внутри батарей. Руководство пользователя для конкретных батарей уточняет, какая коррекция должна применяться. Например, в руководстве Surrette/Rolls для температур в диапазоне от -17,8 до -54,4оC при температуре ниже 21оC, снимается 0,04 для каждых 6 градусов.
Многие инверторы или контроллеры заряда имеют датчик температуры батареи, который прикрепляется к аккумулятору. У них обычно есть ЖК-дисплей. Указание инфракрасного термометра также даст необходимую информацию.
Прибор для измерения плотности
Ареометр плотности электролита используется для измерения удельного веса раствора электролита в каждой ячейке. Кислотная аккумуляторная батарея полностью заряжена с удельным весом 1,255 г/см3 при 26оС. Удельный вес — это измерение жидкости, которая сравнивается с базовой. Это вода, которой присваивается базовое число 1.000 г/см3.
Кислотная аккумуляторная батарея полностью заряжена с удельным весом 1,255 г/см3 при 26оС. Удельный вес — это измерение жидкости, которая сравнивается с базовой. Это вода, которой присваивается базовое число 1.000 г/см3.
Концентрация серной кислоты в воде в новой аккумуляторной батарее составляет 1.280 г/см3, это означает, что электролит весит в 1.280 г/см3 раз больше веса того же объема воды. Полностью заряженная батарея будет тестироваться на уровне до 1.280 г/см3, в то время как разряженная будет учитываться в диапазоне от 1.100 г/см3.
Процедура проверки ареометром
Температура считывания ареометра должна быть скорректирована до температуры 27оC, особенно в отношении плотности электролита зимой. Высококачественные ареометры оснащены внутренним термометром, который будет измерять температуру электролита, и включают шкалу преобразования для коррекции показаний поплавка. Важно признать, что температура значительно отличается от показателей окружающей среды, если автомобиль эксплуатируется. Порядок измерения:
Порядок измерения:
- Несколько раз набрать резиновой грушей электролит в ареометр, чтобы термометр мог отрегулировать температуру электролита и замерить показания.
- Изучить цвет электролита. Коричневая или серая окраска указывает на проблему с батареей и является признаком того, что она приближается к концу своего срока службы.
- Набрать минимальное количество электролита в ареометр, чтобы поплавок свободно плавал без контакта с верхней или нижней частью измерительного цилиндра.
- Удерживать ареометр в вертикальном положении на уровне глаз и обратить внимание на показания, где электролит соответствует шкале на поплавке.
- Добавить или вычесть 0,004 доли единицы для показаний на каждые 6оC, при температуре электролита выше или ниже 27оC.
- Отрегулировать показания, например, если удельный вес 1.250 г/см3, а температура электролита составляет 32оC, значение 1.250 г/см3 дает скорректированное значение 1.
 254 г/см3. Аналогично, если температура составляла 21оC, вычесть значение 1.246 г/см3. Четыре балла (0.004) от 1.250 г/см3.
254 г/см3. Аналогично, если температура составляла 21оC, вычесть значение 1.246 г/см3. Четыре балла (0.004) от 1.250 г/см3. - Протестировать каждую ячейку и отметить показания, скорректированные до 27оC, перед тем как проверить плотность электролита.
Примеры измерения заряда
Пример 1:
- Показания ареометра — 1.333 г/см3.
- Температура 17 градусов, что на 10 градусов ниже рекомендуемого.
- Вычитаем 0,007 с 1,333 г/см3.
- Результат равен 1.263 г/см3, поэтому состояние заряда составляет около 100 процентов.
Пример 2:
- Данные плотности — 1,178 г/см3.
- Температура электролита — 43 градусов С, что на 16 градусов больше нормы.
- Добавляем 0,016 до 1,178 г/см3.
- Результат равен 1,194 г/см3, зарядка 50 процентов.
СОСТОЯНИЕ ЗАРЯДА | УДЕЛЬНЫЙ ВЕС г / см3 |
100% | 1,265 |
75% | 1,225 |
50% | 1,190 |
25% | 1,155 |
0% | 1,120 |
Таблица плотности электролита
Нижеследующая таблица температурной коррекции является одним из способов объяснить резкие изменения значений плотности электролита при различных температурах.
Чтобы использовать эту таблицу, нужно знать температуру электролита. Если измерение по каким-то причинам невозможно, то лучше использовать температуру окружающего воздуха.
Таблица плотности электролита приводится ниже. Это данные в зависимости от температуры:
| % | 100 | 75 | 50 | 25 | 0 |
| -18 | 1,297 | 1,257 | 1,222 | 1,187 | 1,152 |
| -12 | 1,293 | 1,253 | 1,218 | 1,183 | 1,148 |
| -6 | 1,289 | 1,249 | 1,214 | 1,179 | 1,144 |
| -1 | 1,285 | 1,245 | 1,21 | 1,175 | 1,14 |
| 4 | 1,281 | 1,241 | 1,206 | 1,171 | 1,136 |
| 10 | 1,277 | 1,237 | 1,202 | 1,167 | 1,132 |
| 16 | 1,273 | 1,233 | 1,198 | 1,163 | 1,128 |
| 22 | 1,269 | 1,229 | 1,194 | 1,159 | 1,124 |
| 27 | 1,265 | 1,225 | 1,19 | 1,155 | 1,12 |
| 32 | 1,261 | 1,221 | 1,186 | 1,151 | 1,116 |
| 38 | 1,257 | 1,217 | 1,182 | 1,147 | 1,112 |
| 43 | 1,253 | 1,213 | 1,178 | 1,143 | 1,108 |
| 49 | 1,249 | 1,209 | 1,174 | 1,139 | 1,104 |
| 54 | 1,245 | 1,205 | 1,17 | 1,135 | 1,1 |
Как видно из этой таблицы, плотность электролита в аккумуляторе зимой намного выше, чем в теплое время года.
Техническое обслуживание аккумуляторной батареи
Эти батареи содержат серную кислоту. При работе с ними всегда нужно использовать защитные очки и резиновые перчатки.
Если ячейки перегружены, физические свойства сульфата свинца постепенно изменяются, и они разрушаются, из-за чего нарушается процесс зарядки. Следовательно, плотность электролита уменьшается из-за низкой скорости химической реакции.
Качество серной кислоты должно быть высоким. В противном случае батарея может быстро стать неработоспособной. Низкий уровень электролита помогает высушить внутренние пластины устройства, после чего будет невозможно восстановить аккумулятор.
Сульфированные батареи можно легко распознать, просмотрев измененный цвет пластин. Цвет сульфатированной пластины становится светлее, а его поверхность становится желтой. Такие ячейки и демонстрируют снижение мощности. Если сульфирование происходит в течение длительного времени, наступают необратимые процессы.
Чтобы избежать этой ситуации, рекомендуется заряжать свинцово-кислотные аккумуляторные батареи в течение длительного времени при низкой скорости зарядного тока.
Всегда существует высокая вероятность повреждения клеммных колодок батарейных ячеек. Коррозия в основном поражает болтовые соединение между ячейками. Этого можно легко избежать, если обеспечить герметичность каждого болта с покрытием тонким слоем специальной смазки.
Во время зарядки аккумулятора существует высокая вероятность кислотного распыления и газов. Они могут загрязнять атмосферу вокруг батареи. Следовательно, около батарейного отсека нужна хорошая вентиляция.
Эти газы взрывоопасны, следовательно, открытое пламя не должно попадать внутрь пространства, где заряжаются свинцовые аккумуляторы.
Чтобы предотвратить взрыв батареи, который может привести к серьезным травмам или смерти, нельзя вставлять металлический термометр в аккумулятор. Нужно использовать ареометр со встроенным термометром, который предназначен для тестирования батарей.
Срок службы источника тока
Производительность батареи ухудшается с течением времени, независимо от того, используется она или нет, она также ухудшается при частых циклах заряда-разряда. Срок службы — это время, когда неактивная батарея может быть сохранена до того, как она станет непригодной для применения. Обычно считается, что это около 80% от ее первоначальной емкости.
Срок службы — это время, когда неактивная батарея может быть сохранена до того, как она станет непригодной для применения. Обычно считается, что это около 80% от ее первоначальной емкости.
Существует несколько факторов, которые существенно влияют на срок службы батареи:
- Циклическая жизнь. Время автономной работы определяется в основном циклами использования батареи. Обычно срок службы от 300 до 700 циклов при нормальном использовании.
- Эффект глубины разряда (DOD). Отказ от более высокой производительности приведет к сокращению жизненного цикла.
- Температурный эффект. Это является основным фактором производительности батареи, срока годности, зарядки и контроля напряжения. При более высоких температурах в батарее происходит большая химическая активность, чем при более низких температурах. Для большинства батарей рекомендуется использовать температурный диапазон -17 до 35оС.
- Напряжение и скорость перезарядки. Все свинцово-кислотные батареи выделяют водород из отрицательной пластины и кислород из положительной во время зарядки.
 Аккумулятор может хранить только определенное количество электроэнергии. Как правило, батарея заряжается на 90% за 60% времени. А 10% оставшегося объема батареи заряжается около 40% общего времени.
Аккумулятор может хранить только определенное количество электроэнергии. Как правило, батарея заряжается на 90% за 60% времени. А 10% оставшегося объема батареи заряжается около 40% общего времени.
Хорошее время жизни батарей — от 500 до 1200 циклов. Фактический процесс старения приводит к постепенному снижению емкости. Когда ячейка достигает определенного срока службы, она не перестает работать внезапно, этот процесс растянут во времени, за ним нужно следить, чтобы своевременно подготовиться к замене аккумулятора.
Справочные таблицы по автомобильным аккумуляторам, электролитам
Приведены полезные справочные таблицы по автомобильным аккумуляторам, электролитам, будут полезны для тех кто использует и обслуживает свинцовые аккумуляторные батареи.
Таблица 1. Удельное сопротивление электролита в зависимости от плотности и температуры.
| Температура, градусов С | Удельное сопротивление ом»см Минимальное удельное сопри плотности г/см3 противление, ом*см | ||||
| 1,105 | 1,184 | 1,265 | 1,353 | ||
| +30 | 1,596 | 1,180 | 1,140 | 1,312 | 1,129 (1,236) |
| +25 | 1,689 | 1,261 | 1,231 | 1,422 | 1,213 (1,233) |
| +20 | 1,800 | 1,357 | 1,334 | 1,549 | 1,310 (1,228) |
| +10 | 2,090 | 1,606 | 1,602 | 1,885 | 1,562 (1,222) |
| 0 | 2,510 | 1,961 | 1,998 | 2,371 | 1,928 (1,213) |
| -10 | — | 2,500 | 2,600 | 3,100 | 2,480 (1,206) |
| -20 | — | 3,350 | 3,570 | 4,310 | 3,340 (1,198) |
| -30 | — | — | 5,290 | 6,350 | — |
| -40 | — | — | 8,390 | 9,890 | — |
Примечание. В столбце Минимальное удельное сопротивление в скобках указана плотность электролита, имеющего минимальное сопротивление при данном значении температуры.
В столбце Минимальное удельное сопротивление в скобках указана плотность электролита, имеющего минимальное сопротивление при данном значении температуры.
Таблица 2. Температура замерзания электролита разной плотности.
| Плотность электролита, приведенная к температуру+15 аС, | Температура замерзания электролита, °С | Плотность электролита, приведенная к температуру +15 *С, | Температура замерзания электролита, °С |
| 1,050 | -3,0 | 1,250 | -50,0 |
| 1,075 | -5,0 | 1,260 | -54,0 |
| 1,100 | -7,0 | 1,270 | -58,0 |
| 1,125 | -10,0 | 1,275 | -59,0 |
| 1,150 | -14,0 | 1,280 | -68,0 |
| 1,175 | -19,0 | 1,300 | -68,0 |
| 1,200 | -25,0 | 1,310 | -66,0 |
| 1,225 | -37,0 | 1,400 | -49,0 |
| 1,230 | -39,0 | 1г550 | -38,0 |
| 1,240 | -45,0 | 1,800 | +6,0 |
Таблица 3. Приготовление электролита заданной плотности по объему и массе серной кислоты.
Приготовление электролита заданной плотности по объему и массе серной кислоты.
| Р, г/см3 | Количество серной кислоты | Р, г/см3 | Количество серной кислоты | ||
| мл | г | мл | г | ||
| 1,21 | 23,0 | 39,7 | 1,31 | 40,3 | 67,5 |
| 1,22 | 24,4 | 42,1 | 1,32 | 42,2 | 70,7 |
| 1,23 | 25,9 | 44,5 | 1,33 | 44,3 | 73,9 |
| 1,24 | 27,6 | 47,1 | 1,34 | 46,6 | 77,3 |
| 1,25 | 29,2 | 49,7 | 1,35 | 48,7 | 80,8 |
| 1,26 | 30,9 | 52,4 | 1,36 | 51,3 | 84,5 |
| 1,27 | 32,6 | 52,7 | 1,37 | 53,6 | 88,3 |
| 1,28 | 34,4 | 58,4 | 1,38 | 56,0 | 91,9 |
| 1,29 | 36,2 | 61,3 | 1,39 | 58,7 | 96,1 |
| 1,30 | 38,1 | 64,2 | 1,40 | 61,3 | 100. 0 0 |
Примечания. 1. Таблица составлена для плотности электролита, приведенной к температуре +15 °С. 2. Для получения электролита заданной плотности к исходному количеству 100 мл (при приготовлении электролита по объему) или 100 г (при приготовлении электролита по массе) дистилированной воды должно быть добавлено указанное в соответвующем столбце таблицы количество (в мл или в г) серной кислоты плотностью 1,840 г/см .
Таблица 4. Максимально допустимое содержание некоторых примесей.
| Вещество | Примеси | |||
| марганец, мышьяк | Железо | Хлористые соединения | Оксиды азота | |
| Серная кислота: марки А | 0,00005 | 0,005 | 0,0005 | 0,00005 |
| марки Б | 0,0001 | 0,012 | 0,0001 | |
| Дистиллированная вода | — | 0,5 | 5,5 | — |
| Электролит | 0,001 | 0,1 | 0,001 | — |
Примечания. 1. Содержание примесей указано для серной кислоты -в %, для дистиллированной воды и электролита — в мг/л. 2. Содержание меди в серной кислоте и дистиллированной воде не допускается. Допускается наличие меди в электролите в количестве не более 0,01 мг/л.
1. Содержание примесей указано для серной кислоты -в %, для дистиллированной воды и электролита — в мг/л. 2. Содержание меди в серной кислоте и дистиллированной воде не допускается. Допускается наличие меди в электролите в количестве не более 0,01 мг/л.
Таблица 5. Корректировка плотности электролита.
| Имеющаяся плотность электролита 1,25 Г/см3 | Требуемая плотность | |||||||||||
| 1,25 Г/см3 | 1,27 Г/см3 | 1,29 Г/смЗ | 1,31 Г/смЗ | |||||||||
| -Э | +КЭ | +В | -Э | +КЭ | +В | -Э | +КЭ | +В | -Э | +КЭ | +В | |
| 1.24 | 61 | 62 | — | 173 | 175 | — | 252 | 256 | — | — | — | — |
| 1,25 | — | — | — | 118 | 119 | — | 215 | 219 | — | — | — | — |
| 1,26 | 39 | — | 40 | 65 | 66 | — | 177 | 180 | — | 290 | 294 | — |
| 1,27 | 78 | — | 80 | — | — | — | 122 | 124 | — | 246 | 249 | — |
| 1,28 | 117 | — | 120 | 40 | — | 42 | 63 | 64 | — | 198 | 201 | — |
| 1,29 | 157 | — | 161 | 75 | — | 78 | — | — | — | 143 | 145 | — |
| 1,30 | — | — | — | 109 | — | 113 | 36 | — | 37 | 79 | 81 | — |
| 1,31 | — | — | — | 143 | — | 148 | 72 | — | 76 | — | — | — |
Примечание. Таблица составлена в расчете на 1 л электролита. В столбцах таблицы применены следующие обозначения: -Э — отобрать электролита; + КЭ — долить концентрированного электролита с плотностью 1,4 г/см3; +В — долить дистиллированной воды; Объемы даны в см3.
Таблица составлена в расчете на 1 л электролита. В столбцах таблицы применены следующие обозначения: -Э — отобрать электролита; + КЭ — долить концентрированного электролита с плотностью 1,4 г/см3; +В — долить дистиллированной воды; Объемы даны в см3.
Литература: В. Ю. Грачев — Как продлить срок службы аккумулятора.
Почему зимой АКБ работает хуже? Подготовка аккумулятора на зиму
Проблема подготовки аккумулятора на зиму знакома автомобилистам — зимой аккумулятор слабее и медленнее крутит стартер, быстро разряжается. Это связано с тем, что зимой нагрузка на аккумулятор возрастает, а характеристики аккумулятора резко ухудшаются в связи с понижением температуры эксплуатации.
Рассмотрим влияние холода на основные характеристики свинцовых аккумуляторов:
- внутреннее сопротивление
- напряжение
- емкость
- отдача
1.
 Внутреннее сопротивление аккумулятора
Внутреннее сопротивление аккумулятораВнутреннее сопротивление складывается из сопротивления материала пластин, активного поверхностного слоя пластин, сепараторов, и сопротивления электролита, которое сильно зависит от температуры, снижение подвижности ионов и увеличение вязкости электролита повышают внутреннее сопротивление.
При температуре от -30°C до -40°C снижается скорость диффузии ионов электролита, проводимость активного слоя падает в восемь раз, проводимость сепараторов в четыре раза.
Основными свойствами электролита являются плотность, температура замерзания, вязкость и удельное сопротивление.
Плотность электролита находится линейной зависимости от температуры в диапазоне от 20 С до – 30 С и может определяться по формуле 1.28 + (Т-20)Х0.007
В диапазоне от 0°C до -30°C при падении температуры на 1°C:
— вязкость увеличивается на 16%
— удельное сопротивление увеличивается на 15%
— емкость аккумулятора падает на 4%
Внутреннее сопротивление также увеличивается при разряде большими токами как результат уменьшения плотности электролита в порах активной массы и около электродов.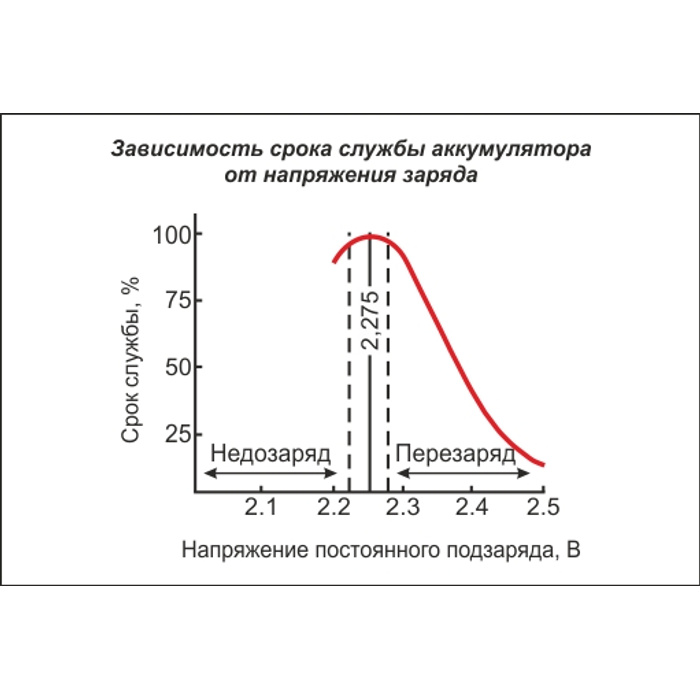
Зависимость удельного сопротивления электролита плотностью 1,30 г/см3 от температуры:
| Температура, °С | Удельное сопротивление электролита Ом·см |
| + 40 | 0,89 |
| + 25 | 1,28 |
| + 18 | 1,46 |
| 0 | 1,92 |
| – 18 | 2,39 |
Соответственно, с падением температуры аккумулятора снижается максимальный отдаваемый батареей ток.
Как видно из вышеприведенных данных, с понижением температуры электролита с +40°С до -18°С удельное сопротивление возрастает в 2,7 раза.
2. Напряжение на клеммах АКБ
Напряжение на клеммах аккумулятора является разницей значения электродвижущей силы (ЭДС) и падением напряжения на внутреннем сопротивлении аккумулятора, которое значительно зависит от температуры, плотности электролита и потребляемого тока.
Напряжение заряда при 20°С составляет 13,8 В, при снижении температуры должно увеличиваться на 0,003 В/град, что составляет при О°С дополнительно 0,6В (14,4В) и при -20°С дополнительно 1,2В (15В).
Зимой АКБ страдают от недозаряда, особенно при коротких поездках.
Напряжение на клеммах АКБ 12,72 В говорит о 100% заряде.
12,24 В — заряде 50%,
11,76 В соответствует полностью разряженному аккумулятору.
При частичном заряде падает плотность электролита и повышается вероятность его замерзания и разрушения батарей.
Электролит плотностью 1,28 замерзает при -65°C, плотностью 1.20 при -20°C, плотностью 1.10 при – 7 °C.
4. Емкость аккумулятора
Емкостью аккумулятора называется количество электричества, которое может отдать полностью заряженный аккумулятор при заданном режиме разряда, температуре и конечном напряжении. Емкость измеряют в ампер-часах и определяют по формуле C=Ip*tp, где С – емкость, а·ч;
Ip – сила разрядного тока, а;
tp – время разряда, ч.
Снижение емкости аккумулятора при понижении температуры вызвано повышением вязкости электролита и замедлением диффузии электролита в поры активной массы, внутренние слои которой не участвуют в реакции разряда.
5. Отдача по емкости
Отдача по емкости — отношение количества электричества, полученного от аккумулятора при разряде, к количеству электричества, необходимого для заряда аккумулятора до первоначального состояния при определенных условиях. Отдача по емкости зависит от полноты заряда, который падает с падением температуры электролита.
Выводы
Все вышесказанное объясняет значительное влияние холода на основные характеристики свинцовых аккумуляторов. В холодное время, разряженный после неудачного запуска двигателя и оставленный в машине почти новый аккумулятор, может быть испорчен в результате замерзания электролита.
Если рассматривать практический пример, то мы наблюдали падение емкости АКБ с 80 A/ч до 12 А/ч при температуре -18°C и токе разряда 240А.
Пути снижения влияния холода на характеристики АКБ:
1. Утепление подкапотного пространства
2. Если автомобиль хранится в гараже, то можно подсоединить к аккумулятору коннекторы постоянного подключения и соединять его с зарядным устройством Optimate или Battery Service — данные зарядные устройства имеют режим хранения и не требуют отключения от акб после окончания процесса зарядки акб.
Если автомобиль хранится в гараже, то можно подсоединить к аккумулятору коннекторы постоянного подключения и соединять его с зарядным устройством Optimate или Battery Service — данные зарядные устройства имеют режим хранения и не требуют отключения от акб после окончания процесса зарядки акб.
3. С периодичностью раз в неделю/месяц (в зависимости от состояния акб и температуры эксплуатации) подзаряжать аккумулятор зарядным устройством.
4. Обязательно менять масло в двигателе на зимнее — это позволит не только снизить нагрузку на акб в момент старта двигателя, но и значительно увеличит срок его службы.
источнтк:https://batteryservice.ru
Влияние температуры электролита и плотности тока на микротвердость слоя, создаваемого анодным окислением алюминия , и плотность тока на микротвердость по Виккерсу слоев оксида алюминия, в то же время. Слои формировались в электролитах с различной концентрацией серной и щавелевой кислот и плотностью поверхностного тока 1 А·дм
-2 , 3 А·дм -2 и 5 А·дм -2 . Температура электролита изменялась от -1,78°С до 45,78°С. Результаты показали, что при повышении температуры электролита при плотности тока 1 А·дм -2 увеличение значений микротвердости слоя составляет примерно 66 %. При одновременном увеличении молярной концентрации H 2 SO 4 в электролите скорость роста значения микротвердости снижается. При плотности тока 3 А·дм −2 , при повышении температуры электролита происходит снижение микротвердости формируемого слоя при времени анодного окисления менее 25 мин. Температура электролита не имеет существенного значения при изменении значений микротвердости слоя при напряжении менее 10,5 В.
Температура электролита изменялась от -1,78°С до 45,78°С. Результаты показали, что при повышении температуры электролита при плотности тока 1 А·дм -2 увеличение значений микротвердости слоя составляет примерно 66 %. При одновременном увеличении молярной концентрации H 2 SO 4 в электролите скорость роста значения микротвердости снижается. При плотности тока 3 А·дм −2 , при повышении температуры электролита происходит снижение микротвердости формируемого слоя при времени анодного окисления менее 25 мин. Температура электролита не имеет существенного значения при изменении значений микротвердости слоя при напряжении менее 10,5 В.1. Введение
слой, коррозионная стойкость [1, 2] и износостойкость предопределяют обработанные таким образом алюминиевые изделия для широкого применения не только в традиционных областях машиностроения, транспорта и строительства, но и для потенциального использования в носителях магнитной записи [3]. ], фотоэлектрические солнечные элементы [4], фильтры [5], химические сенсоры [6], фотоника [7] и металлические нанопроволоки [8, 9].].
], фотоэлектрические солнечные элементы [4], фильтры [5], химические сенсоры [6], фотоника [7] и металлические нанопроволоки [8, 9].].
Большинство экспериментальных операций в области (микро)твердости проводятся в «тяжелых» условиях анодирования. Сюда можно отнести низкие температуры электролита, а часто и особый химический состав электролитов. Их основной задачей является достижение высоких значений микротвердости слоев. По данным Скотта [10], который для анодного оксидирования в серной кислоте при постоянной плотности тока 4 А·дм -2 , изменяя температуру от -5°С до 15°С, микротвердость в этих условиях затрагивается в незначительной степени, что также связано с износостойкостью. Другое исследование, опубликованное Koizumi et al. В работе [11] рассмотрено анодное окисление алюминия в гальваностатическом режиме. Плотности тока от 1 до 8 А·дм -2 ; электролит состоял из серной кислоты и щавелевой кислоты. Температура электролита находилась в диапазоне от -5°С до 20°С. Коидзуми и др. В работе [11] утверждается, что микротвердость и износостойкость практически постоянны в интервале температур от -5°С до 5°С независимо от приложенной плотности тока. Кроме того, в этом исследовании утверждается, что повышение температуры электролита приводит к постепенному снижению значения микротвердости. Более значительное снижение микротвердости происходит при использовании более низких значений плотности тока. К этому утверждению, однако, следует отнестись с оговоркой, так как время анодного окисления в этом опыте всегда было постоянным, т. е. 45 минут, независимо от используемых плотностей тока. В результате были созданы и впоследствии оценены слои большей толщины. Толщина сформированного слоя напрямую влияет на результирующие значения микротвердости и износостойкости [12–14].
Коидзуми и др. В работе [11] утверждается, что микротвердость и износостойкость практически постоянны в интервале температур от -5°С до 5°С независимо от приложенной плотности тока. Кроме того, в этом исследовании утверждается, что повышение температуры электролита приводит к постепенному снижению значения микротвердости. Более значительное снижение микротвердости происходит при использовании более низких значений плотности тока. К этому утверждению, однако, следует отнестись с оговоркой, так как время анодного окисления в этом опыте всегда было постоянным, т. е. 45 минут, независимо от используемых плотностей тока. В результате были созданы и впоследствии оценены слои большей толщины. Толщина сформированного слоя напрямую влияет на результирующие значения микротвердости и износостойкости [12–14].
ААО-слои толщиной 25 мкм мкм и более, генерируемые в электролите, состоящем из серной кислоты, при температурах в интервале от 15°С до 30°С и при различных значениях прикладываемых плотностей тока (от 1 до 4 A·dm −2 ), по данным некоторых авторов [15], имеют более мягкий внешний слой, что снижает прозрачность слоя, а также его микротвердость и износостойкость.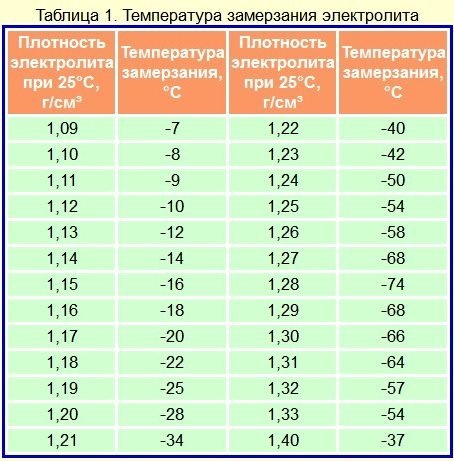 На основании публикации [16] было замечено, что на размер пор влияют напряжение, температура электролита и время анодного окисления. Вертикальный рост пор (10–250 нм·мин −1 ) экспоненциально зависит от напряжения и линейно зависит от изменения температуры электролита. С другой стороны, диаметр пор (50-130 нм) линейно изменяется вместе с приложенным напряжением. Размер и количество пор сильно влияют на микротвердость слоя. В работе [17], посвященной реанодированию, в попытке вывести кинетику экспериментально на основе расчетных зависимостей делается вывод, что имеющиеся значения констант, зависящих от напряженности электрического поля и температуры, неприменимы к анодному окисление при высоких плотностях тока. В качестве возможного объяснения дается повышение температуры внутри сгенерированного слоя.
На основании публикации [16] было замечено, что на размер пор влияют напряжение, температура электролита и время анодного окисления. Вертикальный рост пор (10–250 нм·мин −1 ) экспоненциально зависит от напряжения и линейно зависит от изменения температуры электролита. С другой стороны, диаметр пор (50-130 нм) линейно изменяется вместе с приложенным напряжением. Размер и количество пор сильно влияют на микротвердость слоя. В работе [17], посвященной реанодированию, в попытке вывести кинетику экспериментально на основе расчетных зависимостей делается вывод, что имеющиеся значения констант, зависящих от напряженности электрического поля и температуры, неприменимы к анодному окисление при высоких плотностях тока. В качестве возможного объяснения дается повышение температуры внутри сгенерированного слоя.
Целью авторов является экспериментальный анализ зависимости микротвердости слоя от изменения температуры электролита и плотности тока. Процессы обработки поверхности представляют собой сложные многофакторные системы со значительным эффектом взаимодействия. Эти взаимодействия обычно оказываются более значительными, чем влияние отдельных факторов. Поэтому микротвердость анализируют и с учетом влияния других эксплуатационных факторов. Таким образом, можно прийти к более точным выводам и рекомендациям.
Эти взаимодействия обычно оказываются более значительными, чем влияние отдельных факторов. Поэтому микротвердость анализируют и с учетом влияния других эксплуатационных факторов. Таким образом, можно прийти к более точным выводам и рекомендациям.
2. Экспериментальный
В качестве экспериментального анодного материала использовался алюминиевый лист EN AW-1050 A-h34 толщиной 0,5 мм. Химический состав экспериментального материала приведен в табл. 1.
Образцы размерами 100 × 70 × 0,5 мм химически обезжиривали в растворе, содержащем бикарбонат натрия < 20 %, пентагидрат метасиликата натрия < 5 %, фосфаты < 30 %, боратов < 40 % и поверхностно-активных веществ < 5 %, при температуре °С при общем времени воздействия 15 минут. Затем образцы тщательно промывали в деионизированной воде и погружали в 45% раствор гидроксида натрия при температуре °С на 1 мин. Анодирование было выполнено на основе методологии планирования экспериментов, соответствующей вращающейся центральной композитной конструкции с 44 тестовыми прогонами. Индивидуальные прогоны проводились по плану эксперимента как комбинация уровней факторов, соответствующих табл. 2.
Индивидуальные прогоны проводились по плану эксперимента как комбинация уровней факторов, соответствующих табл. 2.
После анодирования образцы сразу же промывали в охлажденной (приблизительно 10°C) деминерализованной воде в течение 1 минуты, после чего еще 2 минуты промывали в проточной водопроводной воде для вымывания электролита, попавшего в дефекты. После этого образцы сушили сжатым воздухом и в сушильном шкафу (при температуре 50°С, в течение 20 минут).
В области обработки поверхности ячейка Халла в основном используется для проверки функциональности электролита и химического состава электролита. Ячейка Халла в форме прямоугольной трапеции с размерами, соответствующими рисунку 1, использовалась для обоих проведенных экспериментов. На рис. 1 также показано подключение экспериментальной установки, включающей в себя регулируемый источник постоянного тока (непрерывное регулирование напряжения от 0 до 20 В), амперметр для контроля измерения постоянного тока, протекающего по электрической цепи (регулирование тока от 0 до 5 В). А), и вольтметр для измерения общего напряжения.
А), и вольтметр для измерения общего напряжения.
3. Результаты и обсуждение
Первоначальный эксперимент был проведен для определения основных физических эффектов, таких как напряжение, температура электролита и полный ток. Графическое представление временной зависимости представлено на рис. 2.
График (рис. 2(а)) показывает, что изменение общего тока во времени сильно зависит от температуры электролита. Кинетику роста анодного слоя можно увидеть на рис. 2(б), который представляет временную зависимость протекающего тока. Первые 30 секунд являются важным интервалом времени, когда формируется беспористый барьерный слой. Первая стадия характеризуется резким увеличением значения полного тока за очень короткое время и последующим его падением. Здесь происходит увеличение анодного потенциала. На этой стадии формируются зачатки оксидных клеток и поверхностный барьерный оксидный слой. Первые ячейки формируются в местах расположения узлов границ между кристаллами поверхности алюминия [18]. Вдоль этих границ образуются другие оксидные ячейки. Образование оксидных ячеек в этих местах обусловлено более высоким химическим потенциалом этих участков и высокой концентрацией кристаллографических дефектов. В конце этой стадии происходит повторный рост полного тока и уменьшение анодного потенциала. Количество оксидных клеток в этой фазе уменьшается. При этом происходит увеличение их размеров по механизму «конкуренции» (увеличение размеров клеток за счет других, неперспективных). В то же время происходит сгущение распределения клеток и тем самым уменьшение неклеточных участков барьерного оксидного слоя. На этой стадии уже не наблюдается резкого падения потенциала анода. Размеры оксидных ячеек увеличиваются, но скорость этого процесса существенно снижается. На третьей стадии, которая характеризуется установившимся значением тока, а также величиной анодного потенциала, анодно-окисленный слой увеличивается по толщине и имеет пористую структуру (рис. 3).
Вдоль этих границ образуются другие оксидные ячейки. Образование оксидных ячеек в этих местах обусловлено более высоким химическим потенциалом этих участков и высокой концентрацией кристаллографических дефектов. В конце этой стадии происходит повторный рост полного тока и уменьшение анодного потенциала. Количество оксидных клеток в этой фазе уменьшается. При этом происходит увеличение их размеров по механизму «конкуренции» (увеличение размеров клеток за счет других, неперспективных). В то же время происходит сгущение распределения клеток и тем самым уменьшение неклеточных участков барьерного оксидного слоя. На этой стадии уже не наблюдается резкого падения потенциала анода. Размеры оксидных ячеек увеличиваются, но скорость этого процесса существенно снижается. На третьей стадии, которая характеризуется установившимся значением тока, а также величиной анодного потенциала, анодно-окисленный слой увеличивается по толщине и имеет пористую структуру (рис. 3).
Анализ значений микротвердости слоев, образующихся при анодном оксидировании алюминия, в зависимости от температуры представлен на рис.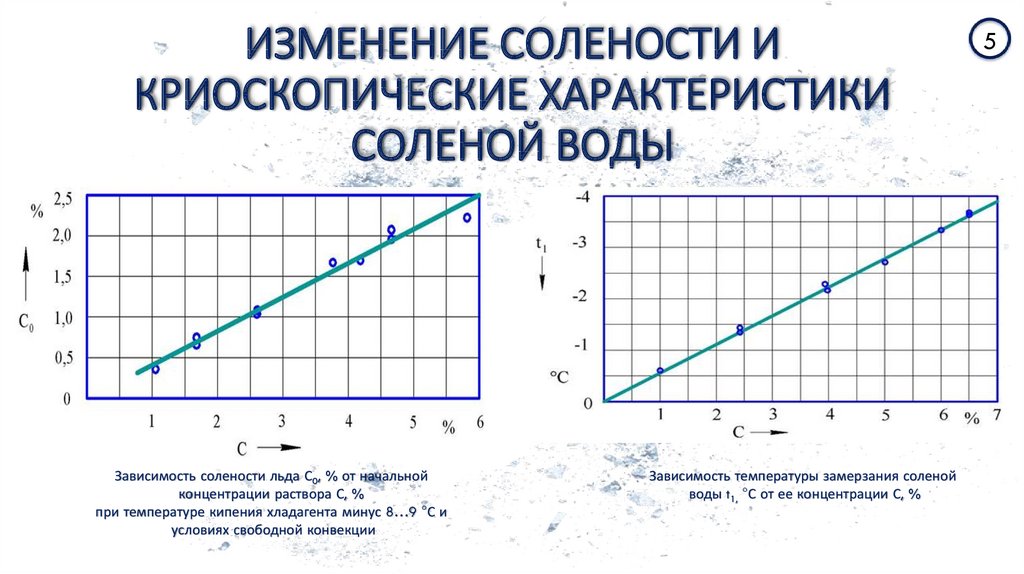 4–12. В рамках экспериментального анализа оценивается влияние других эксплуатационных факторов на изменение величины микротвердости. На рис. 4 при плотности тока 1 А·дм −2 наблюдается сильно нелинейная зависимость микротвердости слоя от температуры электролита.
4–12. В рамках экспериментального анализа оценивается влияние других эксплуатационных факторов на изменение величины микротвердости. На рис. 4 при плотности тока 1 А·дм −2 наблюдается сильно нелинейная зависимость микротвердости слоя от температуры электролита.
В интервале температуры электролита от -1,5 до 8,5°С происходит снижение микротвердости слоя. Это снижение можно объяснить низким напряжением, а также низким значением молярной концентрации H 2 СО 4 . Повышение температуры электролита более 8,5°С приводит к резкому увеличению значения микротвердости слоя. В интервале температуры электролита от 11,5°С до 45,5°С произойдет увеличение микротвердости слоя на 78%. При плотностях тока 3 А·дм –2 и 5 А·дм –2 температура электролита не оказывает существенного влияния на величину микротвердости слоя. При 3 А·дм -2 повышение температуры электролита вызывает даже снижение микротвердости слоя на 7 %. При плотности тока 5 А·дм −2 наблюдается незначительное увеличение микротвердости слоя около 4 %.
Зависимость микротвердости от температуры электролита при увеличении молярной концентрации серной кислоты до 1,43 моль·л −1 представлена на рис. 5. Здесь также можно наблюдать область минимальных значений микротвердости слоя при текущем плотность 1 А·дм −2 . Абсолютное значение микротвердости слоя в области минимума (от 1,5 до 8,5°С) составляет в среднем около 30 %. Возрастающая молярная концентрация H 2 SO 4 от 0,09 моль·л −1 до 1,43 моль·л −1 , в областях низких температур приводит к увеличению микротвердости слоя почти на 54 % при плотности тока 1 А · дм −2 . При плотности тока 3 А·дм -2 наблюдается снижение микротвердости слоя с повышением температуры электролита. Это снижение значения микротвердости составляет 23 %. Снижение микротвердости по сравнению с электролитом с с (H 2 SO 4 ) = 0,09 моль·л -1 составляет почти 16%. Развитие микротвердости слоя при плотности тока 5 А·дм -2 можно считать постоянным.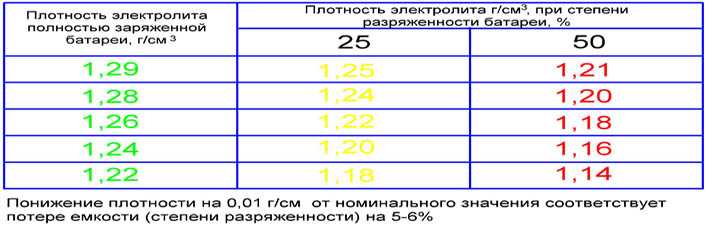 Температура электролита не оказывает существенного влияния на микротвердость слоя при плотности тока 5 А·дм -2 .
Температура электролита не оказывает существенного влияния на микротвердость слоя при плотности тока 5 А·дм -2 .
Дальнейшее увеличение молярной концентрации серной кислоты до 2,76 моль·л −1 (рис. 6) при плотности тока 1 А·дм −2 приводит к расширению областей минимальных значений и увеличению среднего значения микротвердости. Область минимума расширена от 1,5 до 11,5°С. Среднее значение микротвердости по сравнению с электролитом с c (H 2 SO 4 ) = 1,43 моль·л −1 увеличивается на 36 %. При плотности тока 3 А·дм –2 наблюдается значительное снижение микротвердости слоя в зависимости от температуры электролита. Это снижение составляет 35%. Увеличение абсолютного среднего значения микротвердости слоя по сравнению с электролитом с c (H 2 SO 4 ) = 1,43 моль·л −1 , при плотности тока 3 А·дм −2 , составляет в среднем 12 %. При температуре электролита -1,5°С разница значений микротвердости составляет 20%.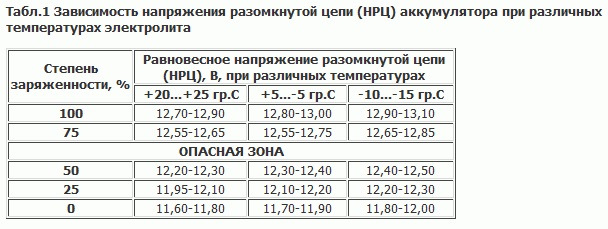 С повышением температуры электролита разница снижается до значения 12% при температуре 45,5°С. При плотности тока 5 А·дм -2 наблюдается лишь незначительное увеличение микротвердости слоя в зависимости от температуры электролита. Величина увеличения составляет 2,5%.
С повышением температуры электролита разница снижается до значения 12% при температуре 45,5°С. При плотности тока 5 А·дм -2 наблюдается лишь незначительное увеличение микротвердости слоя в зависимости от температуры электролита. Величина увеличения составляет 2,5%.
На основании анализа температура электролита является значимым фактором при плотности тока 1 А·дм −2 . Это также важнейший фактор, влияющий на микротвердость слоя. Доля температуры в общей изменчивости значений микротвердости составляет 14 %. Сильная зависимость микротвердости слоя от температуры электролита проявляется и во взаимодействии с молярной концентрацией серной кислоты в электролите. При одновременном повышении температуры электролита и молярной концентрации серной кислоты среднее значение микротвердости увеличивается. Это связано с характером анодного окисления. При разработке пористых оксидных слоев в одной и той же системе протекают две параллельные реакции: одна для электрохимического, анодного образования оксида металла (), а другая – для химического растворения того же оксида в том же электролите [19]. ]: Уравнение (1) представляет собой электрохимическую анодную реакцию. Изменение его свободной энергии подчиняется уравнению Нернста и является функцией электродного потенциала, определяющего способность металла переходить в электролите в ионную форму: где — число перенесенных электронов, — постоянная Фаррадея, и представляет собой электродный потенциал, на который влияет приложенное напряжение. Уравнение (2) выражает химическую реакцию с изменением свободной энергии на постоянную величину независимо от приложенного напряжения. Из-за повышения температуры электролита происходит преобладание химического растворения. Увеличение плотности тока, как правило, приводит к увеличению толщины слоя и, следовательно, к повышению температуры на границе оксид-электролит [14].
]: Уравнение (1) представляет собой электрохимическую анодную реакцию. Изменение его свободной энергии подчиняется уравнению Нернста и является функцией электродного потенциала, определяющего способность металла переходить в электролите в ионную форму: где — число перенесенных электронов, — постоянная Фаррадея, и представляет собой электродный потенциал, на который влияет приложенное напряжение. Уравнение (2) выражает химическую реакцию с изменением свободной энергии на постоянную величину независимо от приложенного напряжения. Из-за повышения температуры электролита происходит преобладание химического растворения. Увеличение плотности тока, как правило, приводит к увеличению толщины слоя и, следовательно, к повышению температуры на границе оксид-электролит [14].
Эти эффекты могут генерировать большие градиенты температуры и состава электролита вдоль более глубоких стенок пор с возможным благоприятным влиянием на растворение оксида и адсорбцию анионов сульфата на стенках пор [20].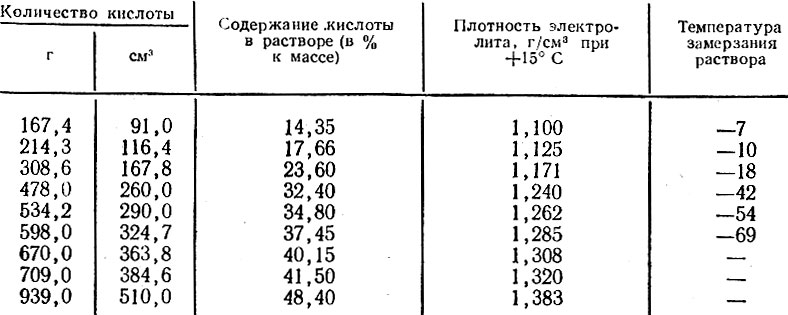 Кроме того, более высокая движущая сила ускоряет реакции на границе раздела подложка-оксид и, следовательно, появление дефектов. Ожидается, что эти локальные эффекты уменьшат микротвердость анодных оксидных слоев [14].
Кроме того, более высокая движущая сила ускоряет реакции на границе раздела подложка-оксид и, следовательно, появление дефектов. Ожидается, что эти локальные эффекты уменьшат микротвердость анодных оксидных слоев [14].
Для плотности тока 3 А·дм -2 и 5 А·дм -2 температура электролита имеет значение только во взаимодействии с молярной концентрацией серной кислоты, напряжением и временем анодирования. Можно предположить, что снижение микротвердости слоя обусловлено, помимо повышения температуры, еще и длительным периодом анодирования. При длительных периодах анодного окисления создаются условия для растворения образовавшегося слоя. Это растворение вытравливает слой и значительно ухудшает механические и эксплуатационные свойства сформированного слоя.
Зависимость микротвердости слоя от изменения температуры электролита при времени анодирования 1,22 мин представлена на рис. 7. При плотности тока 1 А·дм наблюдаются развития. В интервале от -1,5°С до 11,5°С происходит снижение микротвердости. Этот эффект можно объяснить сочетанием низкой температуры электролита, низкого напряжения и короткого времени анодирования. Из-за повышения температуры электролита выше 11,5°С происходит резкое увеличение микротвердости слоя. Повышение температуры на 1°С соответствует увеличению микротвердости на 2,2%. При плотности тока 3 А·дм −2 , можно наблюдать увеличение значений микротвердости слоя с ростом температуры электролита. Среднее увеличение значения микротвердости в диапазоне температур электролита от минус 1,5°С до 45,5°С составляет 62 %. Увеличение плотности тока до 5 А·дм -2 не оказывает существенного влияния на изменение величины микротвердости слоя в зависимости от температуры электролита.
Этот эффект можно объяснить сочетанием низкой температуры электролита, низкого напряжения и короткого времени анодирования. Из-за повышения температуры электролита выше 11,5°С происходит резкое увеличение микротвердости слоя. Повышение температуры на 1°С соответствует увеличению микротвердости на 2,2%. При плотности тока 3 А·дм −2 , можно наблюдать увеличение значений микротвердости слоя с ростом температуры электролита. Среднее увеличение значения микротвердости в диапазоне температур электролита от минус 1,5°С до 45,5°С составляет 62 %. Увеличение плотности тока до 5 А·дм -2 не оказывает существенного влияния на изменение величины микротвердости слоя в зависимости от температуры электролита.
Влияние температуры электролита на микротвердость слоя при времени анодирования 25 мин показано на рис. 8. При плотности тока 1 А·дм −2 , наблюдается увеличение значения микротвердости во всем диапазоне температур электролита. Изменение температуры от -1,5°С до 45,5°С приведет к увеличению микротвердости почти на 65%. При плотности тока 3 А·дм -2 наблюдается значительное снижение значения микротвердости при повышении температуры электролита. Можно предположить, что при увеличении времени анодирования до 25 мин за счет повышения температуры электролита создаются условия для растворения образовавшегося слоя. Снижение микротвердости слоя на 1,5 % по результатам эксперимента соответствует повышению температуры электролита на 1°С. Дальнейшее увеличение плотности тока до 5 А·дм -2 не приводит к изменению значения микротвердости слоя из-за изменения температуры электролита. Микротвердость во всем диапазоне температур электролита (от -1,5°С до 45,5°С) изменится лишь на 2,8%.
При плотности тока 3 А·дм -2 наблюдается значительное снижение значения микротвердости при повышении температуры электролита. Можно предположить, что при увеличении времени анодирования до 25 мин за счет повышения температуры электролита создаются условия для растворения образовавшегося слоя. Снижение микротвердости слоя на 1,5 % по результатам эксперимента соответствует повышению температуры электролита на 1°С. Дальнейшее увеличение плотности тока до 5 А·дм -2 не приводит к изменению значения микротвердости слоя из-за изменения температуры электролита. Микротвердость во всем диапазоне температур электролита (от -1,5°С до 45,5°С) изменится лишь на 2,8%.
При времени анодирования 48,78 мин зависимость микротвердости слоя от изменения температуры электролита представлена на рис. 9.
При плотности тока 1 А·дм −2 микротвердости слоя от температуры электролита можно разделить на две области: область увеличения микротвердости слоя и область уменьшения значения микротвердости. Эти области можно разделить по значению критической температуры. Экспериментально выявленная зависимость изменения микротвердости от температуры электролита при плотности тока 1 А·дм −2 , для конкретных условий анодного окисления ( c (H 2 SO 4 ) = 1,43 моль·л −1 , c (C 10 5 O 2 2 900 4 ) = 0,06 моль·л −1 , U = 10 В, t = 48,78 мин), можно выразить в виде: Локальные экстремумы функции вычисляются, если первая производная (4 ) равен нулю: Решая (5), получим стационарные точки, а именно, и . Поскольку диапазон температур (таблица 2) составляет от −1,78°C до 48,78°C, значение будет считаться допустимым решением. Подставляя значение из интервала в (5), первая производная больше нуля; т. е. функция (4) на отрезке возрастает. Подставляя значение из интервала в (5), первая производная меньше нуля; т. е. функция (4) на отрезке убывает. Таким образом, значение является локальным максимумом функции (4) и при этой температуре микротвердость слоя достигает максимального значения; то есть, .
Эти области можно разделить по значению критической температуры. Экспериментально выявленная зависимость изменения микротвердости от температуры электролита при плотности тока 1 А·дм −2 , для конкретных условий анодного окисления ( c (H 2 SO 4 ) = 1,43 моль·л −1 , c (C 10 5 O 2 2 900 4 ) = 0,06 моль·л −1 , U = 10 В, t = 48,78 мин), можно выразить в виде: Локальные экстремумы функции вычисляются, если первая производная (4 ) равен нулю: Решая (5), получим стационарные точки, а именно, и . Поскольку диапазон температур (таблица 2) составляет от −1,78°C до 48,78°C, значение будет считаться допустимым решением. Подставляя значение из интервала в (5), первая производная больше нуля; т. е. функция (4) на отрезке возрастает. Подставляя значение из интервала в (5), первая производная меньше нуля; т. е. функция (4) на отрезке убывает. Таким образом, значение является локальным максимумом функции (4) и при этой температуре микротвердость слоя достигает максимального значения; то есть, . В области ниже критической температуры скорость роста микротвердости слоя в зависимости от температуры составляет в среднем 55 %. В области выше критической температуры скорость снижения микротвердости слоя составляет 12,8 %. При плотности тока 3 А·дм −2 , за счет повышения температуры электролита происходит снижение микротвердости слоя. Средняя скорость снижения значения микротвердости слоя в диапазоне экспериментальных температур электролита составляет 691 %. При плотности тока 5 А·дм -2 наблюдается лишь минимальное влияние температуры электролита на величину микротвердости слоя. Скорость роста микротвердости слоя составляет 1,8 %.
В области ниже критической температуры скорость роста микротвердости слоя в зависимости от температуры составляет в среднем 55 %. В области выше критической температуры скорость снижения микротвердости слоя составляет 12,8 %. При плотности тока 3 А·дм −2 , за счет повышения температуры электролита происходит снижение микротвердости слоя. Средняя скорость снижения значения микротвердости слоя в диапазоне экспериментальных температур электролита составляет 691 %. При плотности тока 5 А·дм -2 наблюдается лишь минимальное влияние температуры электролита на величину микротвердости слоя. Скорость роста микротвердости слоя составляет 1,8 %.
Другим важным фактором, влияющим на формирование анодного слоя, является напряжение. Напряжение существенно влияет на механические свойства слоя, а также на его микротвердость. На рисунках 10–12 представлена зависимость микротвердости слоя от температуры электролита при изменении напряжения для плотностей тока 1 А·дм -2 , 3 А·дм -2 и 5 А·дм -2 . Зависимость микротвердости слоя от температуры электролита при напряжении 8,5 В представлена на рисунке 10. наблюдается от 1,78°С до 11,5°С. Это снижение микротвердости слоя составляет около 2,3 %. В этих условиях анодирования проводимость электролита слишком низкая. Приложенное напряжение относится к ситуации, когда оно всегда ниже . В этом случае оксид образуется по (1), но он нестабилен и сразу растворяется по реакции (2). Этот случай называется электрохимическим травлением. Повышение температуры электролита выше температуры 11,5°С приводит к увеличению значения микротвердости слоя. Этот рост составляет в среднем 42,8%. Повышение температуры электролита приводит к значительному изменению проводимости электролита, и даже при низком напряжении формируется устойчивый слой. При плотности тока 3 А·дм −2 , за счет повышения температуры электролита происходит снижение микротвердости слоя. Дальнейшее увеличение плотности тока до 5 А·дм -2 приводит к увеличению микротвердости слоя за счет повышения температуры.
Зависимость микротвердости слоя от температуры электролита при напряжении 8,5 В представлена на рисунке 10. наблюдается от 1,78°С до 11,5°С. Это снижение микротвердости слоя составляет около 2,3 %. В этих условиях анодирования проводимость электролита слишком низкая. Приложенное напряжение относится к ситуации, когда оно всегда ниже . В этом случае оксид образуется по (1), но он нестабилен и сразу растворяется по реакции (2). Этот случай называется электрохимическим травлением. Повышение температуры электролита выше температуры 11,5°С приводит к увеличению значения микротвердости слоя. Этот рост составляет в среднем 42,8%. Повышение температуры электролита приводит к значительному изменению проводимости электролита, и даже при низком напряжении формируется устойчивый слой. При плотности тока 3 А·дм −2 , за счет повышения температуры электролита происходит снижение микротвердости слоя. Дальнейшее увеличение плотности тока до 5 А·дм -2 приводит к увеличению микротвердости слоя за счет повышения температуры. Этот рост во всем интервале экспериментально применяемых температур составляет около 17 %. Напряжение 8,5 В в практических приложениях не используется. В работе он использовался только для сравнения возникающих изменений микротвердости слоев.
Этот рост во всем интервале экспериментально применяемых температур составляет около 17 %. Напряжение 8,5 В в практических приложениях не используется. В работе он использовался только для сравнения возникающих изменений микротвердости слоев.
Увеличение напряжения до 10,5 В при анализе изменения микротвердости слоя под влиянием температуры электролита представлено на рис. 11. При плотности тока 1 А·дм −2 приложенных температурах электролита происходит увеличение значения микротвердости. Этот рост составляет около 73%. По сравнению с ходом зависимости микротвердости слоя от влияния температуры электролита при напряжении 8,5 В и температуре -1,78°С снижение значения микротвердости составляет 35%. При повышении температуры электролита до 48,78°С при напряжении 10,5 В происходит увеличение значения микротвердости на 34% по сравнению с микротвердостью слоя при напряжении 8,5 В. При плотности тока 3 А ·дм −2 , наблюдается небольшое снижение значения микротвердости слоя за счет повышения температуры электролита на 8,4 %. За счет повышения напряжения на 2 В значение микротвердости слоя при температуре электролита -1,78°С увеличится на 10%, а при температуре электролита 48,78°С почти на 94%. Увеличение плотности тока до 5 А·дм -2 приводит к росту значения микротвердости слоя в зависимости от температуры примерно на 15 %.
За счет повышения напряжения на 2 В значение микротвердости слоя при температуре электролита -1,78°С увеличится на 10%, а при температуре электролита 48,78°С почти на 94%. Увеличение плотности тока до 5 А·дм -2 приводит к росту значения микротвердости слоя в зависимости от температуры примерно на 15 %.
Зависимость микротвердости слоя от температуры электролита при напряжении 13,5 В представлена на рис. 12. При всех плотностях тока наблюдается рост микротвердости слоя по мере увеличения температуры электролита. Таким образом, величина напряжения достаточна для образования стабильного оксида независимо от плотности тока. На основании (1) и (2) курсы и пересекаются в некоторой точке. При этом в зависимости от напряжения прогрессии и можно разделить на три области с двумя критическими значениями. — приложенное напряжение, когда и — напряжение, при котором . При выполнении условия при анодном окислении в электролите присутствует устойчивый оксидный слой, который анодным напряжением защищен от растворения по химической реакции (2). При плотности тока 1 А·дм −2 , скорость роста значения микротвердости слоя по изменению температуры электролита во всем интервале составляет в среднем 83 %. При увеличении плотности тока до 3 А·дм -2 скорость роста значения микротвердости слоя в зависимости от температуры падает примерно до 56 %. В интервале температур более 36°С значение микротвердости слоя выше при 1 А·дм –2 , чем при плотности тока 3 А·дм –2 на 8 %. При плотности тока 5 А·дм −2 микротвердость слоя достигает наибольших значений при повышении температуры электролита. Прирост значений микротвердости составляет 47 %. Мы видим, что температура электролита оказывает существенное влияние на значения микротвердости при напряжении до 13,5 В.
При плотности тока 1 А·дм −2 , скорость роста значения микротвердости слоя по изменению температуры электролита во всем интервале составляет в среднем 83 %. При увеличении плотности тока до 3 А·дм -2 скорость роста значения микротвердости слоя в зависимости от температуры падает примерно до 56 %. В интервале температур более 36°С значение микротвердости слоя выше при 1 А·дм –2 , чем при плотности тока 3 А·дм –2 на 8 %. При плотности тока 5 А·дм −2 микротвердость слоя достигает наибольших значений при повышении температуры электролита. Прирост значений микротвердости составляет 47 %. Мы видим, что температура электролита оказывает существенное влияние на значения микротвердости при напряжении до 13,5 В.
4. Выводы
проведена оценка анодного окисления алюминия. Электролит состоял из H 2 SO 4 и C 2 H 2 O 4 . Показано, что повышение температуры электролита приводит к росту значения микротвердости слоя при плотности тока 1 А·дм -2 .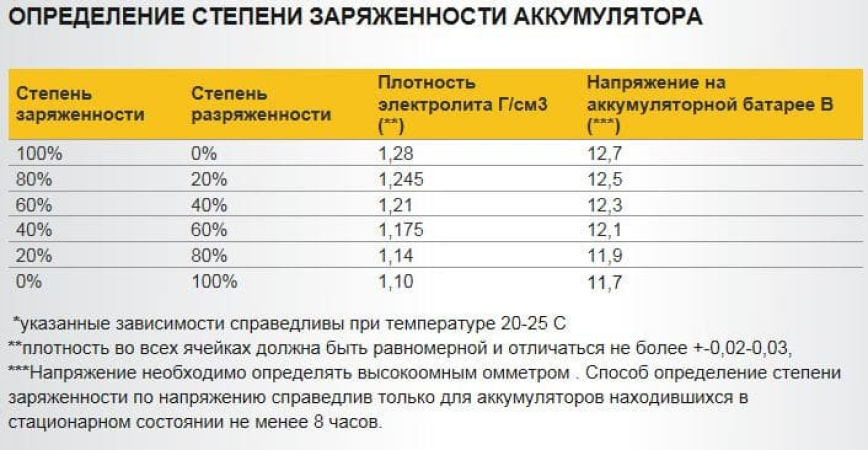 Однако при времени анодирования 48,78 мин можно определить критическую температуру, при которой происходит влияние изменения температуры электролита на значения микротвердости слоя. Средний рост значений микротвердости слоев в зависимости от температуры при плотности тока 1 А·дм −2 составляет 66%. Однако с увеличением количества серной кислоты в электролите рост микротвердости слоя снижается примерно на 24 %. Наряду с сопутствующим влиянием времени анодирования в интервале от 1,22 мин до 25 мин наблюдается рост значения микротвердости слоя в зависимости от температуры электролита на 5%. При увеличении времени анодного окисления более 25 минут происходит снижение значения микротвердости слоя примерно на 4 %. Повышение напряжения приводит к росту микротвердости слоя в зависимости от температуры электролита почти 39%. При плотности тока 3 А·дм -2 микротвердость слоя снижается из-за температуры с увеличением молярной концентрации серной кислоты. Рост значения микротвердости слоя наблюдался при времени анодирования 25 мин.
Однако при времени анодирования 48,78 мин можно определить критическую температуру, при которой происходит влияние изменения температуры электролита на значения микротвердости слоя. Средний рост значений микротвердости слоев в зависимости от температуры при плотности тока 1 А·дм −2 составляет 66%. Однако с увеличением количества серной кислоты в электролите рост микротвердости слоя снижается примерно на 24 %. Наряду с сопутствующим влиянием времени анодирования в интервале от 1,22 мин до 25 мин наблюдается рост значения микротвердости слоя в зависимости от температуры электролита на 5%. При увеличении времени анодного окисления более 25 минут происходит снижение значения микротвердости слоя примерно на 4 %. Повышение напряжения приводит к росту микротвердости слоя в зависимости от температуры электролита почти 39%. При плотности тока 3 А·дм -2 микротвердость слоя снижается из-за температуры с увеличением молярной концентрации серной кислоты. Рост значения микротвердости слоя наблюдался при времени анодирования 25 мин.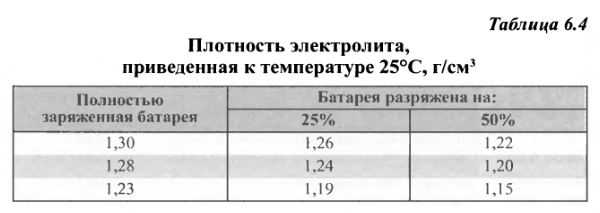 Выше и ниже этого времени происходит снижение значения микротвердости слоя за счет температуры электролита. При плотности тока 5 А·дм -2 влияние температуры электролита на изменение величины микротвердости слоя незначительно. Рост значения микротвердости слоя происходит только при напряжении выше 10,5 В.
Выше и ниже этого времени происходит снижение значения микротвердости слоя за счет температуры электролита. При плотности тока 5 А·дм -2 влияние температуры электролита на изменение величины микротвердости слоя незначительно. Рост значения микротвердости слоя происходит только при напряжении выше 10,5 В.
Процесс анодного оксидирования алюминия сложный процесс. Существует множество факторов, действующих одновременно на изменение величины микротвердости слоя. Поэтому необходимо учитывать влияние этих эксплуатационных факторов при изучении изменений параметров слоев. Как показано, при различных условиях анодирования микротвердость слоя в зависимости от температуры и плотности тока изменялась по-разному. Исследуя эти зависимости, можно генерировать слои с требуемыми параметрами качества.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
Благодарности
Работа выполнена при поддержке Проекта структурных фондов ЕС «Исследование и разработка интеллектуальных нетрадиционных приводов на основе искусственных мышц», код ITMS: 26220220103, а также поддерживается Грантом ВЕГА 1/0738/14 «Исследование коррозионной стойкости стальных листов с покрытием для использования в автомобильной промышленности» Агентства научных грантов Министерства образования Словацкой Республики и Словацкой академии наук.
Ссылки
Х. А. Гонсалес, Э. Эскудеро, В. Лопес, Х. Симанкас и М. Морсильо, «Долговечность голого и анодированного алюминия в атмосфере с очень разной коррозионной активностью. I. Чистый алюминий», Revista de Metalurgia (Мадрид) , том. 40, нет. 4, стр. 259–269, 2004 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
В. Лопес, Э. Эскудеро, Х. А. Гонсалес, Э. Отеро и М. Морсильо, «Долговечность чистого и анодированного алюминия в атмосфере самых разных агрессивных сред. II. Анодированный алюминий», Revista de Metalurgia , vol. 40, нет. 4, стр. 270–279, 2004.
Посмотреть по адресу:
Сайт издателя | Google Scholar
D. AlMawlawi, N. Coombs и M. Moskovits, «Магнитные свойства железа, осажденного в поры анодного оксида алюминия, в зависимости от размера частиц», Journal of Applied Physics , vol.
 70, нет. 8, стр. 4421–4425, 1991.
70, нет. 8, стр. 4421–4425, 1991.Посмотреть по адресу:
Сайт издателя | Google Scholar
Н. Хаберкорн, Дж. С. Гутманн и П. Теато, «Изготовление с помощью шаблона отдельно стоящих массивов наностержней из сшитого производного трифениламина с дырочной проводимостью: к упорядоченным солнечным элементам с объемным гетеропереходом», ACS Nano , об. 3, нет. 6, стр. 1415–1422, 2009.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Горох Г., Мозалев А., Соловей Д., Хатко В., Ллобет Э., Коррейг X. Анодное формирование пленок пористого оксида алюминия с низким соотношением сторон для применения в датчиках оксидов металлов, Electrochimica Acta , vol. 52, нет. 4, стр. 1771–1780, 2006.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Дж.
 Х. Хольц и С. А. Ашер, «Полимеризованные коллоидно-кристаллические гидрогелевые пленки как интеллектуальные химические сенсорные материалы», Природа , том. 389, нет. 6653, стр. 829–832, 1997.
Х. Хольц и С. А. Ашер, «Полимеризованные коллоидно-кристаллические гидрогелевые пленки как интеллектуальные химические сенсорные материалы», Природа , том. 389, нет. 6653, стр. 829–832, 1997.Посмотреть по адресу:
Сайт издателя | Google Scholar
М. Дойбель, Г. фон Фрейманн, М. Вегенер, С. Перейра, К. Буш и К. М. Сукулис, «Прямая лазерная запись трехмерных фотонно-кристаллических шаблонов для телекоммуникаций», Nature Materials , том. 3, нет. 7, стр. 444–447, 2004.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Г. Зауэр, Г. Брем, С. Шнайдер и др., «Высокоупорядоченные массивы монокристаллических серебряных нанопроволок», Журнал прикладной физики , том. 91, нет. 5, стр. 3243–3247, 2002.
Посмотреть по адресу:
Сайт издателя | Google Scholar
А.
 Сантос, Л. Войкувка, Дж. Палларес, Дж. Ферре-Борруль и Л. Ф. Марсал, «Наностолбы кобальта и никеля на алюминиевых подложках с помощью процесса электроосаждения на постоянном токе», Nanoscale Research Letters , vol. . 4, нет. 9, стр. 1021–1028, 2009.
Сантос, Л. Войкувка, Дж. Палларес, Дж. Ферре-Борруль и Л. Ф. Марсал, «Наностолбы кобальта и никеля на алюминиевых подложках с помощью процесса электроосаждения на постоянном токе», Nanoscale Research Letters , vol. . 4, нет. 9, стр. 1021–1028, 2009.Посмотреть по адресу:
Сайт издателя | Академия Google
Скотт Б.А. Декоративно-защитные покрытия, получаемые на алюминии методом твердого анодирования // Труды Института отделки металлов . Вып. 43, с. 1, 1965.
. Просмотр по адресу:
Google Scholar. Общество отделки металлов Японии , том. 19, нет. 12, стр. 504–510, 1968.
Посмотреть по адресу:
Сайт издателя | Google Scholar
К. Окубо, «Анодирование высокопрочных и легкообрабатываемых алюминиевых сплавов», Metal Finishing , vol.
 81, нет. 11, pp. 63–66, 1983.
81, нет. 11, pp. 63–66, 1983.Просмотр по адресу:
Google Scholar
Груаро А.П., Гейб Д.Р. Анодирование алюминия переменным током в модифицированной серной кислоте: влияние температуры. Труды института. Отделки металлов , вып. 63, с. 1, 1985.
View at:
Google Scholar
L. E. Fratila-Apachitei, J. Duszczyk, and L. Katgerman, «Микротвердость по Виккерсу анодных оксидных слоев AlSi(Cu), сформированных в H 2 SO 4 900 », Технология поверхностей и покрытий , vol. 165, нет. 3, стр. 309–315, 2003 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Р. В. Томас, «Измерение твердости, индекса износа и сопротивления истиранию анодного покрытия на алюминии», Труды института отделки металлов , вып.
 59, pp. 97–103, 1981.
59, pp. 97–103, 1981.Посмотреть по адресу:
Google Scholar
П. Чоудхури, К. Рагхуваран, М. Кришнан, Х. К. Баршилия и К. С. Раджам, «Влияние параметров процесса на скорость роста и диаметр шаблонов из нанопористого оксида алюминия», Bulletin of Materials Science , vol. 34, нет. 3, стр. 423–427, 2011.
Посмотреть по адресу:
Сайт издателя | Академия Google
Захариев А., Гиргинов А. Формирование сложных анодных пленок на пористых матрицах оксида алюминия // Бюллетень материаловедения . Вып. 26, нет. 3, стр. 349–353, 2003 г.
Посмотреть по адресу:
Сайт издателя | Академия Google
Ž. Холицка, М. Хованцова и М. Земанова, «Анодное окисление алюминия в кислых электролитах», Chemicke Listy , vol.
 94, нет. 12, стр. 1081–1086, 2000.
94, нет. 12, стр. 1081–1086, 2000.Посмотреть по адресу:
Google Scholar
М. Ван, Ю. Лю и Х. Ян, «Единая термодинамическая теория формирования структур анодированного оксида металла», Electrochimica Acta , vol. 62, стр. 424–432, 2012.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Дж. Расмуссен, «Новые взгляды на микротвердость анодированного алюминия», Metal Finishing , vol. 99, нет. 9, стр. 46–51, 2001.
Посмотреть по адресу:
Google Scholar
Copyright
Copyright © 2015 Emil Spišák et al. Это статья с открытым доступом, распространяемая в соответствии с лицензией Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии надлежащего цитирования оригинальной работы.
Влияние температуры и концентрации на транспорт электролита через пористые тонкопленочные композитные нанофильтрационные мембраны: механизмы транспорта в порах и энергетика проникновения
. 2006 1 июня; 298 (1): 327-40.
doi: 10.1016/j.jcis.2005.12.033. Epub 2006, 30 января.
Рамеш Р Шарма 1 , Шанкарараман Челлам
принадлежность
- 1 Факультет гражданского и экологического строительства, Университет Хьюстона, Хьюстон, Техас 77204, США.
- PMID: 16448663
- DOI:
10.
 1016/j.jcis.2005.12.033
1016/j.jcis.2005.12.033
Рамеш Р. Шарма и др. J Коллоидный интерфейс Sci. .
. 2006 1 июня; 298 (1): 327-40.
doi: 10.1016/j.jcis.2005.12.033. Epub 2006, 30 января.
Авторы
Рамеш Р Шарма 1 , Шанкарараман Челлам
принадлежность
- 1 Факультет гражданского и экологического строительства, Университет Хьюстона, Хьюстон, Техас 77204, США.
- PMID: 16448663
- DOI:
10.
 1016/j.jcis.2005.12.033
1016/j.jcis.2005.12.033
Абстрактный
Сообщается о влиянии температуры и концентрации на плотность заряда нанофильтра и механизмы транспорта электролита в порах. Были проведены эксперименты по фильтрации с поперечным потоком для измерения переноса нескольких электролитов (NaCl, NaNO3, NaClO4, CaCl2, MgCl2 и MgSO4) через две коммерчески доступные тонкопленочные композитные нанофильтрационные мембраны в диапазоне 5–41°C. Эксперименты также проводились с выбранными соли в диапазоне 1-50 мэкв/л для количественной оценки эффектов концентрации. Три разных подхода: необратимая термодинамика, расширенная формулировка Нернста-Планка и теория скоростей процессов использовались для интерпретации удерживания этих симметричных и асимметричных электролитов при различных температуре и концентрации. Повышение температуры питательной воды слегка увеличивает коэффициенты отражения электролита и лишь незначительно увеличивает проницаемость по сравнению с нейтральными растворенными веществами.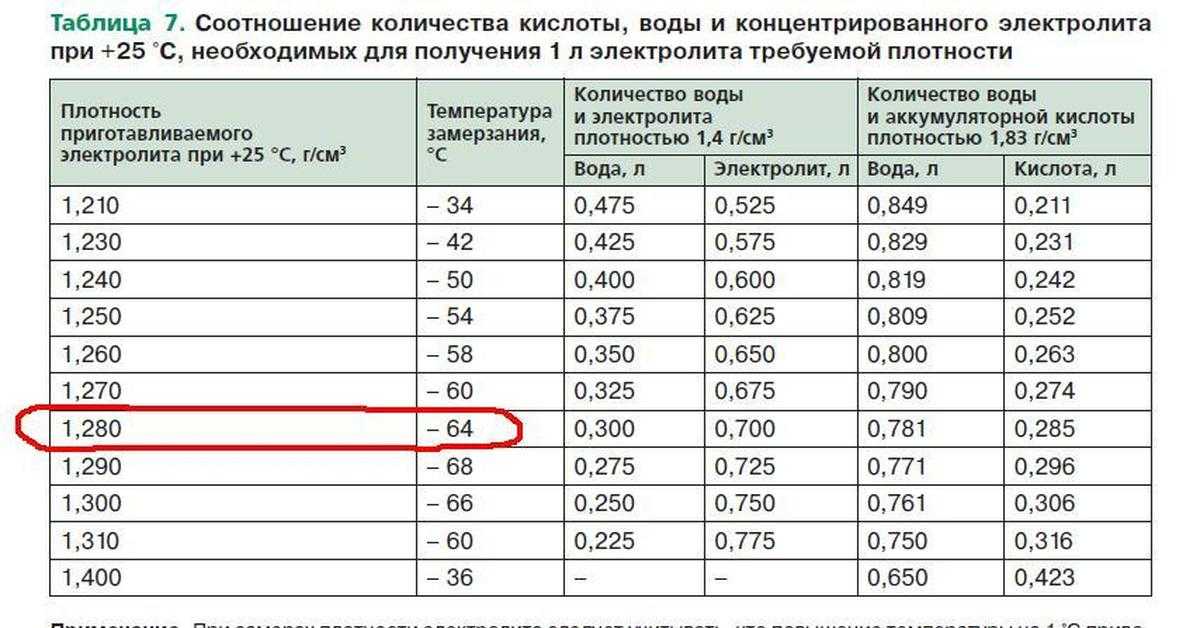 Электромиграция и конвекция имеют тенденцию противодействовать друг другу при больших потоках, что объясняет слабую температурную зависимость коэффициента отражения. Изменения плотности поверхностного заряда мембраны в зависимости от температуры связывают с повышенной адсорбцией электролитов на полимере, из которого состоит активный слой. Энергия активации проникновения заряженных растворенных веществ в первую очередь определялась потенциалом Доннана на границе мембрана-исходная вода. Было показано, что проникновение электролита представляет собой процесс, управляемый энтальпией, который приводит к небольшим изменениям энтропии. Увеличение сорбционной емкости с температурой и низкой энергией сорбции указывает на то, что сорбция коионов на полимерных мембранах является эндотермическим процессом физиосорбции, который, по-видимому, определяет температурную зависимость проникновения электролита при повышенных концентрациях сырья.
Электромиграция и конвекция имеют тенденцию противодействовать друг другу при больших потоках, что объясняет слабую температурную зависимость коэффициента отражения. Изменения плотности поверхностного заряда мембраны в зависимости от температуры связывают с повышенной адсорбцией электролитов на полимере, из которого состоит активный слой. Энергия активации проникновения заряженных растворенных веществ в первую очередь определялась потенциалом Доннана на границе мембрана-исходная вода. Было показано, что проникновение электролита представляет собой процесс, управляемый энтальпией, который приводит к небольшим изменениям энтропии. Увеличение сорбционной емкости с температурой и низкой энергией сорбции указывает на то, что сорбция коионов на полимерных мембранах является эндотермическим процессом физиосорбции, который, по-видимому, определяет температурную зависимость проникновения электролита при повышенных концентрациях сырья.
Похожие статьи
Вклад конвекции, диффузии и миграции в транспорт электролита через нанофильтрационные мембраны.

Шимчик А., Лаббез С., Фиве П., Видонн А., Фойсси А., Пэджетти Дж. Шимчик А. и соавт. Adv Коллоидный интерфейс Sci. 2003 19 марта; 103 (1): 77-94. doi: 10.1016/S0001-8686(02)00094-5. Adv Коллоидный интерфейс Sci. 2003. PMID: 12689761
Характеристики проникновения электролитов и нейтральных растворенных веществ через нанофильтрационные мембраны из диоксида титана при высоких температурах.
Цуру Т., Огава К., Канезаши М., Йошиока Т. Цуру Т. и др. Ленгмюр. 2010 6 июля; 26 (13): 10897-905. doi: 10.1021/la100791j. Ленгмюр. 2010. PMID: 20405860
Удаление растворенных веществ пористыми тонкопленочными композитными нанофильтрационными мембранами при высоком извлечении питательной воды.
Шарма Р.
 Р., Челлам С.
Шарма Р.Р. и соавт.
J Коллоидный интерфейс Sci. 2008 г., 15 декабря; 328(2):353-66. doi: 10.1016/j.jcis.2008.09.036. Epub 2008, 19 сентября.
J Коллоидный интерфейс Sci. 2008.
PMID: 18930248
Р., Челлам С.
Шарма Р.Р. и соавт.
J Коллоидный интерфейс Sci. 2008 г., 15 декабря; 328(2):353-66. doi: 10.1016/j.jcis.2008.09.036. Epub 2008, 19 сентября.
J Коллоидный интерфейс Sci. 2008.
PMID: 18930248Моделирование нанофильтрации растворов электролитов.
Ярощук А., Брюнинг М.Л., Жолковский Е. Ярощук А и др. Adv Коллоидный интерфейс Sci. 2019 июнь; 268:39-63. doi: 10.1016/j.cis.2019.03.004. Epub 2019 13 марта. Adv Коллоидный интерфейс Sci. 2019. PMID: 30951927 Обзор.
Заряженные полимерные мембраны для экологических и энергетических приложений.
Камцев Ю., Фриман Б.Д. Камцев Дж. и соавт. Annu Rev Chem Biomol Eng. 2016 7 июня; 7: 111-33. doi: 10.1146/annurev-chembioeng-080615-033533.
 Epub 2016 14 марта.
Annu Rev Chem Biomol Eng. 2016.
PMID: 26979410
Обзор.
Epub 2016 14 марта.
Annu Rev Chem Biomol Eng. 2016.
PMID: 26979410
Обзор.
Посмотреть все похожие статьи
Цитируется
Фракционирование раствора галактоолигосахаридов при низкой и высокой температуре с использованием нанофильтрации.
Пруксари С., Нгуен Т.Х., Халтрич Д., Новалин С. Пруксари С. и соавт. Сентябрь Purif Technol. 2015 4 сентября; 151: 124-130. doi: 10.1016/j.seppur.2015.07.015. Сентябрь Purif Technol. 2015. PMID: 26681914 Бесплатная статья ЧВК.
Энергетика проникновения воды через фуллереновую мембрану.
Изобе Х., Хомма Т., Накамура Э. Изобе Х. и др. Proc Natl Acad Sci U S A. 2007 Sep 18;104(38):14895-8. doi: 10.1073/pnas.
 0705010104. Epub 2007, 10 сентября.
Proc Natl Acad Sci U S A. 2007.
PMID: 17846427
Бесплатная статья ЧВК.
0705010104. Epub 2007, 10 сентября.
Proc Natl Acad Sci U S A. 2007.
PMID: 17846427
Бесплатная статья ЧВК.
Изучение межмолекулярных взаимодействий и температурно-концентрационной зависимости транспорта в электролитах EMI–TFSI/LiTFSI на основе ионных жидкостей
У вас не включен JavaScript. Пожалуйста, включите JavaScript чтобы получить доступ ко всем функциям сайта или получить доступ к нашему страница без JavaScript.
Выпуск 8, 2022 г.
Из журнала:
Новый химический журнал
Изучение межмолекулярных взаимодействий и температурно-концентрационной зависимости транспорта в электролитах EMI–TFSI/LiTFSI на основе ионных жидкостей†
Цитра Делиана Деви Сундари, или Аттар Лукман Иванся, кд Октия Флауэри, и Я сделал Аркана* и а также Перевозить Искандар * эфг
Принадлежности автора
* Соответствующие авторы
и Отделение неорганической и физической химии, Факультет математики и естественных наук, Технологический институт Бандунга, Бандунг 40132, Индонезия
Электронная почта: arcana@itb.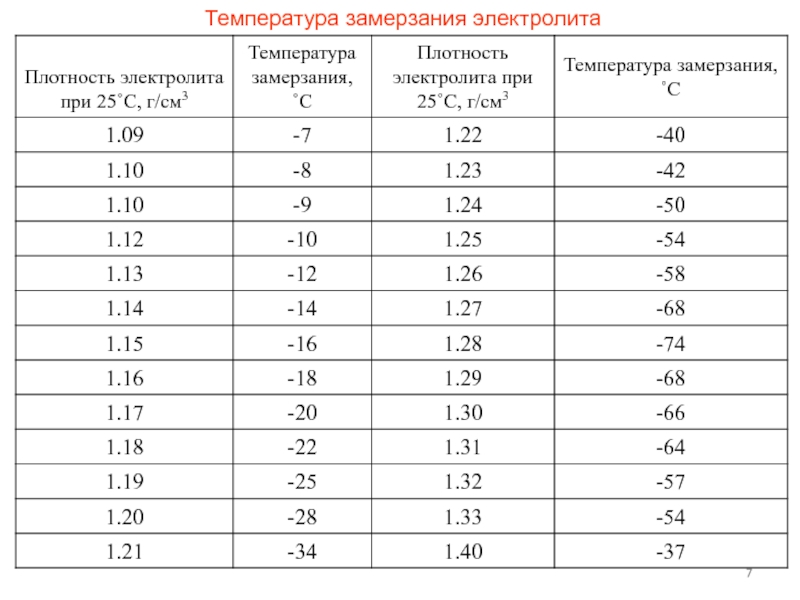 ac.id
ac.id
б Кафедра химического образования, UIN Sunan Gunung Djati Bandung, Бандунг 40292, Индонезия
с Магистерская программа в области вычислительной техники, Факультет математики и естественных наук, Технологический институт Бандунга, Бандунг 40132, Индонезия
д Отделение аналитической химии, кафедра химии, факультет математики и естественных наук, Технологический институт Бандунга, Бандунг 40132, Индонезия
и Исследовательский центр нанонауки и нанотехнологий (RCNN), Технологический институт Бандунга, Бандунг 40132, Индонезия
ф Кафедра физики, Факультет математики и естественных наук, Технологический институт Бандунга, Бандунг 40132, Индонезия
Электронная почта: паром@fi. itb.ac.id
itb.ac.id
г Национальный центр устойчивых транспортных технологий (NCSTT), Технологический институт Бандунга, Бандунг 40132, Индонезия
Аннотация
1-Этил-3-метилимидазолий-бис(трифторметилсульфонил)имид (EMI-TFSI) представляет собой один из типов ионной жидкости (ИЖ), который привлек большое внимание в связи с его применением в качестве электролита для литий-ионных аккумуляторов из-за его большого коэффициента диффузии, широкого диапазон температур жидкой формы и высокая термическая стабильность. Чтобы получить представление о характеристиках EMI-TFSI, межмолекулярные взаимодействия и зависимость переноса ионов от температуры и концентрации в электролитах EMI-TFSI/LiTFSI были исследованы с использованием теории функционала плотности (DFT) и молекулярной динамики (MD). Результаты расчета DFT показали, что сильные донорно-акцепторные взаимодействия между электронами неподеленной пары (НП) TFSI − и неподеленная вакантная (LV) орбиталь Li + приводят к более высокой энергии стабилизации системы EMI–TFSI/LiTFSI (88,47 ккал моль −1 ) по сравнению с чистой EMI-TFSI (48,52 ккал моль -1 ). Межмолекулярные взаимодействия, возникающие между ионами, состоят из нековалентных и слабых электростатических взаимодействий, которые стабилизируются сильным несвязанным притяжением и стерическими взаимодействиями. Свойства переноса ионов, рассчитанные с помощью моделирования МД, показали, что увеличение Li + концентрация ионов может уменьшить коэффициенты диффузии и ионную проводимость системы. Дальнейший анализ температурно-концентрационной зависимости транспорта электролита EMI-TFSI/LiTFSI показал, что оптимальное значение литий-ионной проводимости ( σ Li + ) может быть достигнуто при использовании умеренного Li + концентрация ионов ( x Li ) от 0,1 до 0,2, в зависимости от температуры.
Результаты расчета DFT показали, что сильные донорно-акцепторные взаимодействия между электронами неподеленной пары (НП) TFSI − и неподеленная вакантная (LV) орбиталь Li + приводят к более высокой энергии стабилизации системы EMI–TFSI/LiTFSI (88,47 ккал моль −1 ) по сравнению с чистой EMI-TFSI (48,52 ккал моль -1 ). Межмолекулярные взаимодействия, возникающие между ионами, состоят из нековалентных и слабых электростатических взаимодействий, которые стабилизируются сильным несвязанным притяжением и стерическими взаимодействиями. Свойства переноса ионов, рассчитанные с помощью моделирования МД, показали, что увеличение Li + концентрация ионов может уменьшить коэффициенты диффузии и ионную проводимость системы. Дальнейший анализ температурно-концентрационной зависимости транспорта электролита EMI-TFSI/LiTFSI показал, что оптимальное значение литий-ионной проводимости ( σ Li + ) может быть достигнуто при использовании умеренного Li + концентрация ионов ( x Li ) от 0,1 до 0,2, в зависимости от температуры. Кроме того, мы обнаружили, что наибольшая проводимость литий-иона ( σ LI + ) при 298 К составил 6,82 × 10 -5 S CM −1 9069 S CM −1 9069 S CM −1 9069 S –1 9069. 5.15 × 10 −4 S см −1 при 338 К.
Кроме того, мы обнаружили, что наибольшая проводимость литий-иона ( σ LI + ) при 298 К составил 6,82 × 10 -5 S CM −1 9069 S CM −1 9069 S CM −1 9069 S –1 9069. 5.15 × 10 −4 S см −1 при 338 К.
Варианты загрузки Пожалуйста, подождите…
Дополнительные файлы
- Дополнительная информация PDF (1244 КБ)
Информация о товаре
- ДОИ
- https://doi.
 org/10.1039/D1NJ05489A
org/10.1039/D1NJ05489A - Тип изделия
- Бумага
- Отправлено
- 17 ноя 2021
- Принято
- 24 января 2022 г.
- Впервые опубликовано
- 24 января 2022 г.
Скачать цитату
New J. Chem. , 2022 , 46 , 3966-3977
BibTexEndNoteMEDLINEProCiteReferenceManagerRefWorksRIS
Разрешения
Запросить разрешения
Социальная деятельность
Получение данных из CrossRef.
Загрузка может занять некоторое время.
Прожектор
Объявления
Стратегии проектирования низкотемпературных водных электролитов
Ссылки(80)
[1]
Xie, J.; Lu, YC. Ретроспектива литий-ионных аккумуляторов. Нат . Коммуна . 2020 , 11 , 2499.
DOI Google Scholar
[2]
Винтер, М.; Барнетт, Б.; Сюй, К. Перед ионно-литиевыми батареями. Химия . Ред. . 2018 , 118 , 11433-11456.
ДОИ Академия Google
[3]
Йошино А. Рождение литий-ионного аккумулятора. Анжю . Хим. ., Междунар. . Эд . 2012 , 51 , 5798-5800.
ДОИ Google Scholar
[4]
Данн Б. ; Камат, Х .; Тараскон, Дж. М. Аккумулирование электроэнергии для сети: выбор батареи. Наука 2011 , 334 , 928-935.
; Камат, Х .; Тараскон, Дж. М. Аккумулирование электроэнергии для сети: выбор батареи. Наука 2011 , 334 , 928-935.
ДОИ Академия Google
[5]
Ян З. Г.; Чжан, JL; Кинтнер-Мейер, MCW; Лу, XC; Чой, Д .; Леммон, JP; Лю, Дж. Электрохимическое накопление энергии для зеленой сети. Химия . Ред. . 2011 , 111 , 3577-3613.
ДОИ Google Scholar
[6]
Ким Х.; Хонг, Дж.; Парк, К.Ю.; Ким, Х .; Ким, SW; Канг, К. Литий-ионные перезаряжаемые аккумуляторы на водной основе. Химия . Ред. . 2014 , 114 , 11788-11827.
ДОИ Google Scholar
[7]
Чжао, Ю. В.; Чен, З .; Мо, Ф. Н.; Ван, Д. Х.; Го, Ю .; Лю, ZX; Ли, XL; Ли, В.; Лян, GJ; Zhi, C.Y. Водные перезаряжаемые металлоионные батареи, работающие при отрицательных температурах. Доп . Наука .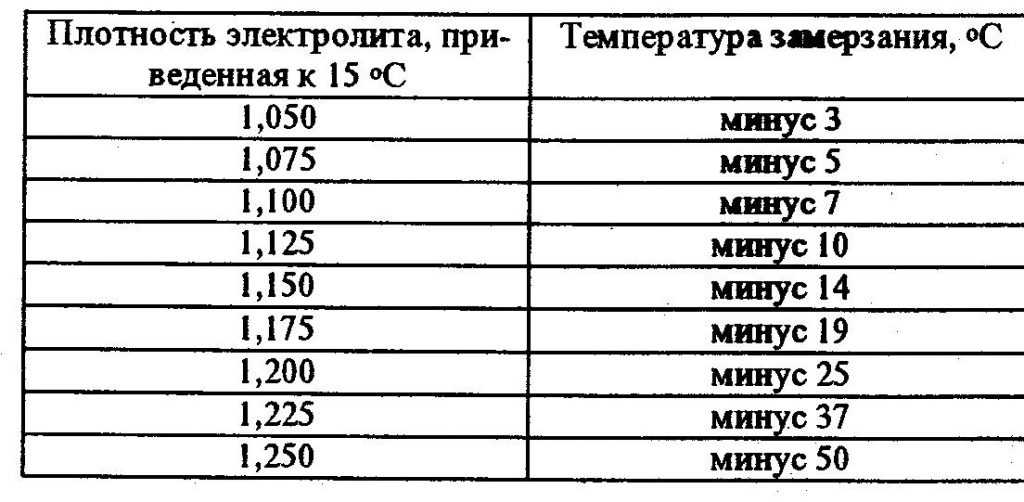 2021 , 8 , 2002590.
2021 , 8 , 2002590.
DOI Google Scholar
[8]
Nian, QS; Сан, Т.Дж.; Лю, С .; Du, HH; Рен, XD; Тао З.Л. Проблемы и возможности низкотемпературных аккумуляторов на водной основе. Химия . англ . Дж . 2021 , 423 , 130253.
DOI Google Scholar
[9]
Dong, X.L.; Ван, Ю.Г.; Xia, YY. Продвижение перезаряжаемых батарей, работающих при низкой температуре. Акк . Химия . Рез . 2021 , 54 , 3883-3894.
ДОИ Google Scholar
[10]
Ли, К.; Лю, Г.; Ченг, HR; Сан, QJ; Чжан, JL; Мин, Дж. Конструкция низкотемпературного электролита для литий-ионных аккумуляторов: перспективы и проблемы. Химия . -Евро . Дж . 2021 , 27 , 15842-15865.
ДОИ Google Scholar
[11]
Хаббл Д. ; Браун, Д.Э.; Чжао, Ю.З.; Фанг, К.; Лау, Дж.; Макклоски, Б.Д.; Лю Г. Разработка жидкого электролита для низкотемпературных литий-ионных аккумуляторов. Энергетика Окружающая среда . Наука . 2022 , 15 , 550-578.
; Браун, Д.Э.; Чжао, Ю.З.; Фанг, К.; Лау, Дж.; Макклоски, Б.Д.; Лю Г. Разработка жидкого электролита для низкотемпературных литий-ионных аккумуляторов. Энергетика Окружающая среда . Наука . 2022 , 15 , 550-578.
ДОИ Академия Google
[12]
Чжэн, Дж. К.; Хоу, Ю.Ю.; Дуань, Ю.Д.; Песня, XH; Вэй, Ю .; Лю, ТК; Ху, JT; Го, Х .; Чжо, ZQ; Лю, Л.Л. и др. Интерфейс Янус твердое тело-жидкость обеспечивает сверхвысокую скорость зарядки и разрядки современных литий-ионных аккумуляторов. Нано Летт . 2015 , 15 , 6102-6109.
ДОИ Google Scholar
[13]
Кунду, Д.; Ваджаргах, С.Х.; Ван, LW; Адамс, Б.; Прендергаст, Д.; Назар, Л.Ф. Водные и неводные Zn-ионные батареи: последствия штрафа за десольватацию на границе раздела. Энергетика Окружающая среда . Наука . 2018 , 11 , 881-892.
ДОИ Google Scholar
[14]
Рамануджапурам, А.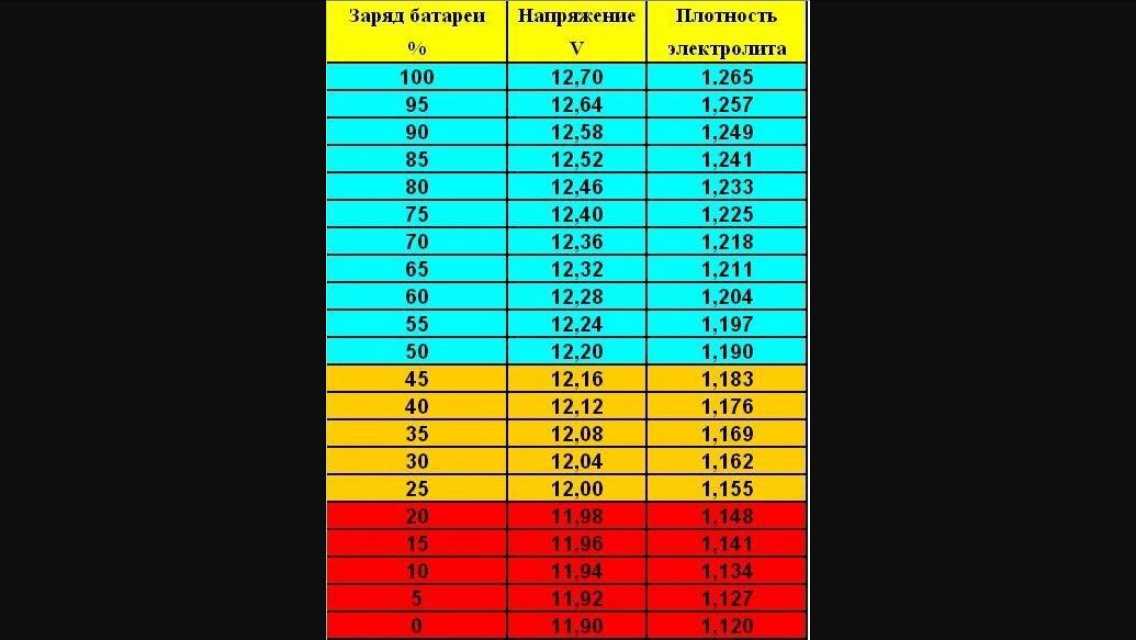 ; Юшин Г. Понимание исключительных характеристик катодов литий-ионных аккумуляторов в водных электролитах при отрицательных температурах. Доп . Энергетическая Материя . 2018 , 8 , 1802624.
; Юшин Г. Понимание исключительных характеристик катодов литий-ионных аккумуляторов в водных электролитах при отрицательных температурах. Доп . Энергетическая Материя . 2018 , 8 , 1802624.
DOI Академия Google
[15]
Дин М.С.; Сюй, К. Фазовая диаграмма, проводимость и стеклование бинарных электролитов LiTFSI-H 2 O. Дж . Физ . Химия . C 2018 , 122 , 16624-16629.
ДОИ Google Scholar
[16]
Monnin, C.; Дюбуа, М.; Папайконому, Н.; Симонин Дж. П. Термодинамика системы LiCl + H 2 O. Дж . Химия . англ . Данные 2002 , 47 , 1331-1336.
ДОИ Google Scholar
[17]
Corti, HR; Энджелл, Калифорния; Оффрет, Т .; Левин, Х .; Буэра, член парламента; Рид, Д.С.; Роос, Ю.Х.; Слейд, Л.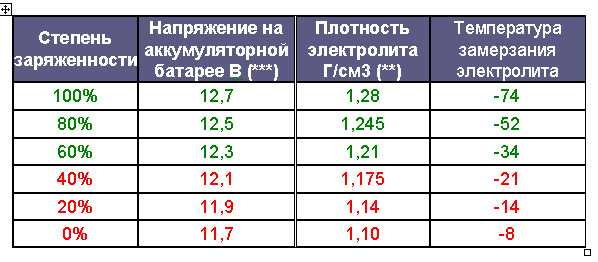 Эмпирические и теоретические модели равновесных и неравновесных температур перехода дополненных фазовых диаграмм в водных системах (технический отчет IUPAC). Чистое приложение . Химия . 2010 , 82 , 1065-1097.
Эмпирические и теоретические модели равновесных и неравновесных температур перехода дополненных фазовых диаграмм в водных системах (технический отчет IUPAC). Чистое приложение . Химия . 2010 , 82 , 1065-1097.
ДОИ Google Scholar
[18]
Эндрюс Ф. К. Коллигативные свойства простых решений. Наука 1976 , 194 , 567-571.
ДОИ Google Scholar
[19]
Шумахер, О.; Марвел, CJ; Келли, Миннесота; Кантуэлл, PR; Винчи, Р.П.; Рикман, JM; Рорер, Г.С.; Хармер, М. П. Диаграммы времени-температуры-преобразования (ТТТ) цвета лица: возможности и проблемы. Курс . Заключение . Твердотельный материал . Наука . 2016 , 20 , 316-323.
ДОИ Google Scholar
[20]
Wang, WH; Донг, К.; Шек, Ч. Х. Объемные металлические очки. Мать . Наука . англ . R Респ. . 2004 , 44 , 45-89.
Наука . англ . R Респ. . 2004 , 44 , 45-89.
ДОИ Google Scholar
[21]
Тернбулл, Д.; Фишер, Дж. К. Скорость зародышеобразования в конденсированных системах. Дж . Химия . Физ . 1949 , 17 , 71-73.
ДОИ Google Scholar
[22]
MacFarlane, D.R.; Кадияла, РК; Энджелл, К.А. Прямое наблюдение кривых трансформации время-температура для кристаллизации льда из растворов по гомогенному механизму. Дж . Физ . Химия . 1983 , 87 , 1094-1095.
ДОИ Академия Google
[23]
Чжу, К. Дж.; Ли, ZP; Солнце, ZQ; Лю, П.; Джин, Т .; Чен, XC; Ли, Х. Х.; Лу, ВБ; Цзяо, Л.Ф. Неорганический электролит для низкотемпературных водно-ионных натриевых батарей. Малый 2022 , 18 , 2107662.
DOI Google Scholar
[24]
Сюй, Дж. Дж.; Джи, Х .; Чжан, JX; Ян, CY; Ван, П.Ф.; Лю, С.Ф.; Людвиг, К.; Чен, Ф .; Кофинас, П.; Ван, К.С. Дизайн водного электролита для сверхстабильного 2,5 В LiMn 2 O 4 ||Li 4 Ti 5 O 12 ячеек. Нат . Энергия 2022 , 7 , 186-193.
Дж.; Джи, Х .; Чжан, JX; Ян, CY; Ван, П.Ф.; Лю, С.Ф.; Людвиг, К.; Чен, Ф .; Кофинас, П.; Ван, К.С. Дизайн водного электролита для сверхстабильного 2,5 В LiMn 2 O 4 ||Li 4 Ti 5 O 12 ячеек. Нат . Энергия 2022 , 7 , 186-193.
ДОИ Google Scholar
[25]
Мо, Ф. Н.; Лян, GJ; Мэн, QQ; Лю, ZX; Ли, Х.Ф.; Фан, Дж.; Zhi, CY Гибкая перезаряжаемая водная цинк-диоксид-марганцевая батарея, работающая при -20 ℃. Энергетика Окружающая среда . Наука . 2019 , 12 , 706-715.
ДОИ Google Scholar
[26]
Чжао Л.С.; Пан, LQ; Цао, ZX; Ван, К. Витрификация водных растворов хлорида натрия, вызванная ограничением свободы. Химия . Физ . Буква . 2016 , 647 , 170-174.
ДОИ Google Scholar
[27]
Jiang, L.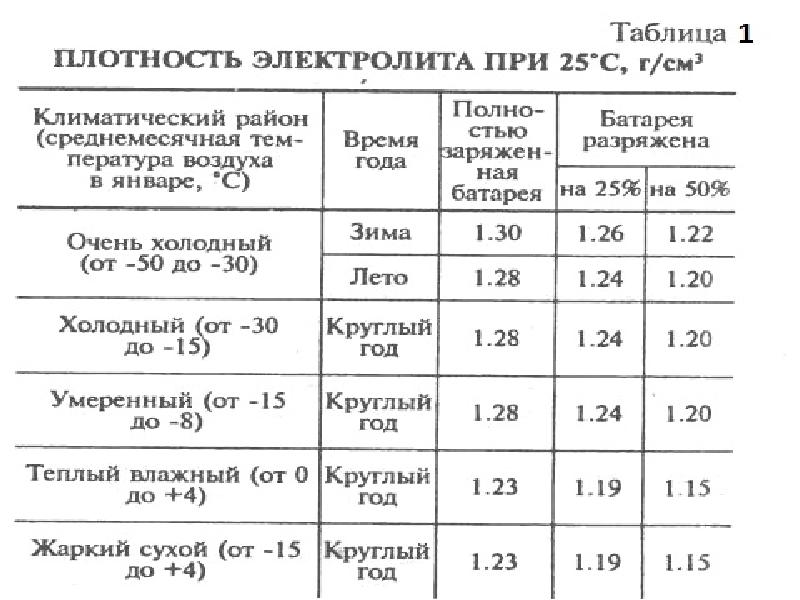 W.; Лу, YX; Чжао, CL; Лю, LL; Чжан, Дж. Н.; Чжан, QQ; Шен, X .; Чжао, JM; Ю, X. В.; Ли, Х. и др. Создание водных K-ионных батарей для хранения энергии. Нат . Энергетика 2019 , 4 , 495-503.
W.; Лу, YX; Чжао, CL; Лю, LL; Чжан, Дж. Н.; Чжан, QQ; Шен, X .; Чжао, JM; Ю, X. В.; Ли, Х. и др. Создание водных K-ионных батарей для хранения энергии. Нат . Энергетика 2019 , 4 , 495-503.
ДОИ Google Scholar
[28]
Ребер, Д.; Кюнель, Р. С.; Батталья, К. Подавление кристаллизации водно-солевых электролитов асимметричными анионами обеспечивает низкотемпературную работу высоковольтных водных батарей. Письмо о материалах ACS . 2019 , 1 , 44-51.
ДОИ Академия Google
[29]
Чжан, К.; Ма, Ю.Л.; Лу, Ю.; Ли, Л .; Ван, Ф .; Чжан, К .; Чен, Дж. Модулирующая структура электролита для сверхнизкотемпературных водных цинковых батарей. Нат . Коммуна . 2020 , 11 , 4463.
DOI Google Scholar
[30]
Nian, QS; Ван, JY; Лю, С .; Сан, Т.Дж.; Чжэн, С. Б.; Чжан, Ю .; Тао, ZL; Чен, Дж. Водные батареи, работающие при температуре -50 ℃. Анжю . Химия ., Интерн. . Эд . 2019 , 58 , 16994-16999.
Б.; Чжан, Ю .; Тао, ZL; Чен, Дж. Водные батареи, работающие при температуре -50 ℃. Анжю . Химия ., Интерн. . Эд . 2019 , 58 , 16994-16999.
ДОИ Google Scholar
[31]
Трон, А.; Чон, С .; Парк, Ю.Д.; Мун, Дж. Литий-ионный аккумулятор на водной основе из нано-LiFePO 4 с антифризом этиленгликоля для работы при низких температурах. ACS Устойчивая химия . англ . 2019 , 7 , 14531-14538.
ДОИ Академия Google
[32]
Цзян Х.; Шин, В .; Ма, Л.; Хонг, Джей Джей; Вэй, ZX; Лю, Ю.; Чжан, С.Ю.; Ву, XY; Сюй, Ю.К.; Guo, Q.B. и соавт. Высокопроизводительная водная протонная батарея, обеспечивающая мощность ниже -78 ℃ за счет незамерзшей фосфорной кислоты. Доп . Энергетическая Материя . 2020 , 10 , 2000968 .
ДОИ Google Scholar
[33]
Suo, LM; Хан, Ф. Д.; Фан, XL; Лю, HL; Сюй, К .; Wang, C.S. Электролиты «вода-в-соли» позволяют использовать экологичные и безопасные литий-ионные батареи для крупномасштабных приложений по хранению электроэнергии. Дж . Мать . Химия . А 2016 , 4 , 6639-6644.
Д.; Фан, XL; Лю, HL; Сюй, К .; Wang, C.S. Электролиты «вода-в-соли» позволяют использовать экологичные и безопасные литий-ионные батареи для крупномасштабных приложений по хранению электроэнергии. Дж . Мать . Химия . А 2016 , 4 , 6639-6644.
ДОИ Google Scholar
[34]
Виола В.; Эндрю, Т. Л. Водный эвтектический электролит для недорогого безопасного хранения энергии с диапазоном рабочих температур 150 ℃, от -70 до 80 ℃. Дж . Физ . Химия . С 2021 , 125 , 246-251.
ДОИ Академия Google
[35]
Чжан Л.Ю.; Ю, Г. Х. Технология гибридных электролитов позволяет создавать безопасные и широкотемпературные проточные окислительно-восстановительные батареи. Анжю . Хим. ., Междунар. . Эд . 2021 , 60 , 15028-15035.
ДОИ Google Scholar
[36]
Чжан, В. ; Ся, К. Х.; Ма, Ю.Л.; Лу, Ю.; Ли, Л .; Лян, Дж.; Чоу, С.Л.; Чен, Дж. Хаотропный анион и катод с быстрой кинетикой, позволяющие создавать низкотемпературные водные цинковые батареи. ACS Energy Письмо . 2021 , 6 , 2704-2712.
; Ся, К. Х.; Ма, Ю.Л.; Лу, Ю.; Ли, Л .; Лян, Дж.; Чоу, С.Л.; Чен, Дж. Хаотропный анион и катод с быстрой кинетикой, позволяющие создавать низкотемпературные водные цинковые батареи. ACS Energy Письмо . 2021 , 6 , 2704-2712.
ДОИ Google Scholar
[37]
Sun, YL; Ма, Х.Ю.; Чжан, XQ; Лю, Б.; Лю, Л.Ю.; Чжан, X .; Фэн, JZ; Чжан, QN; Дин, YX; Ян, Б.Дж. и соавт. Соленый ледяной электролит с превосходной ионной проводимостью по отношению к низкотемпературным водным гибридным конденсаторам с ионами цинка. Доп . Функция . Мать . 2021 , 31 , 2101277.
ДОИ Google Scholar
[38]
Guo, ZW; Хуанг, JH; Донг, XL; Ся, Ю.Ю.; Ян, Л .; Ван, З .; Ван, Ю. Г. Гидроксий-ионная батарея на основе органических / неорганических электродов. Нат . Коммуна . 2020 , 11 , 959.
DOI Google Scholar
[39]
Ян Л. ; Хуанг, JH; Го, ZW; Донг, XL; Ван, З .; Ван, Ю. Г. Твердотельная протонная батарея, работающая при сверхнизкой температуре. ACS Energy Письмо . 2020 , 5 , 685-691.
; Хуанг, JH; Го, ZW; Донг, XL; Ван, З .; Ван, Ю. Г. Твердотельная протонная батарея, работающая при сверхнизкой температуре. ACS Energy Письмо . 2020 , 5 , 685-691.
ДОИ Google Scholar
[40]
Чанг, Н. Н.; Ли, Т.Ю.; Ли, Р .; Ван, С.Н.; Инь, Ю.Б.; Чжан, HM; Li, XF. Водный гибридный электролит для низкотемпературных накопителей энергии на основе цинка. Энергетика Окружающая среда . Наука . 2020 , 13 , 3527-3535.
ДОИ Академия Google
[41]
Чжу, М.С.; Ван, XJ; Тан, HM; Ван, JW; Хао, В.; Лю, LX; Ли, Ю .; Чжан, К .; Шмидт, О. Г. Антифризный гидрогель с высокой обратимостью цинка для гибких и долговечных аккумуляторов на водной основе за счет совместных гидратированных катионов. Доп . Функция . Мать . 2020 , 30 , 18.
DOI Google Scholar
[42]
Yue, JM; Чжан, Дж. К.; Тонг, YX; Чен, М .; Лю, LL; Цзян, LW; Лв, Т. С.; Ху, Ю.С.; Ли, Х .; Huang, X.J. et al. Водная интерфаза, образованная CO 2 возвращает электролиты к солевому режиму. Нат . Химия . 2021 , 13 , 1061-1069.
К.; Тонг, YX; Чен, М .; Лю, LL; Цзян, LW; Лв, Т. С.; Ху, Ю.С.; Ли, Х .; Huang, X.J. et al. Водная интерфаза, образованная CO 2 возвращает электролиты к солевому режиму. Нат . Химия . 2021 , 13 , 1061-1069.
ДОИ Google Scholar
[43]
Sun, TJ; Юань, XM; Ван, К.; Чжэн, С. Б.; Ши, JQ; Чжан, В.; Кай, WS; Лян, Дж.; Тао З.Л. Сверхнизкотемпературная водная ионно-цинковая батарея. Дж . Мать . Химия . А 2021 , 9 , 7042-7047.
ДОИ Google Scholar
[44]
Sun, TJ; Du, HH; Чжэн, С. Б.; Ши, JQ; Тао, З. Л. Водная протонная батарея высокой мощности и плотности энергии, работающая при -90 ℃. Доп . Функция . Мать . 2021 , 31 , 2010127.
DOI Google Scholar
[45]
Zhu, Z. X.; Ван, WP; Инь, YC; Мэн, YH; Лю, ZC; Цзян, Т. Л.; Пэн, Q .; Сан, Дж. Ф.; Чен, В. Сверхбыстрая и сверхнизкотемпературная водородная газопротонная батарея. Дж . Ам . Химия . Сок . 2021 , 143 , 20302-20308.
Л.; Пэн, Q .; Сан, Дж. Ф.; Чен, В. Сверхбыстрая и сверхнизкотемпературная водородная газопротонная батарея. Дж . Ам . Химия . Сок . 2021 , 143 , 20302-20308.
ДОИ Google Scholar
[46]
Sun, TJ; Чжэн, С. Б.; Du, HH; Тао З.Л. Синергетический эффект катиона и аниона для низкотемпературной водной цинк-ионной батареи. Нано-Микро Летт . 2021 , 13 , 204.
ДОИ Google Scholar
[47]
Arrhenius, S. Über die Reaktionsgeschwindigkeit bei der Inversion von Rohrzucker durch Säuren. З . Физ . Химия . 1889 , 4U , 226-248.
ДОИ Google Scholar
[48]
Нюрнберг Р. Б. Численное сравнение обычных уравнений типа Аррениуса для моделирования переноса ионов в твердых телах. Ионик 2020 , 26 , 2405-2412.
ДОИ Google Scholar
[49]
Kohout, J. Модифицированное уравнение Аррениуса в материаловедении, химии и биологии. Молекулы 2021 , 26 , 7162.
DOI Google Scholar
[50]
France-Lanord, A.; Гроссман, Дж. К. Корреляции от спаривания ионов и уравнения Нернста-Эйнштейна. Физ . Ред. . Буква . 2019 , 122 , 136001.
DOI Google Scholar
[51]
He, X. F.; Чжу, Ю.З.; Эпштейн, А .; Мо, Ю. Ф. Статистические отклонения диффузионных свойств от ab initio моделирование молекулярной динамики. npj Вычисление . Мать . 2018 , 4 , 18.
DOI Google Scholar
[52]
Марколонго, А.; Марзари, Н. Ионные корреляции и нарушение соотношения Нернста-Эйнштейна в твердотельных электролитах. Физ . Ред. . Mate риалов 2017 , 1 , 025402.
Ред. . Mate риалов 2017 , 1 , 025402.
DOI Академия Google
[53]
Фулчер, Г. С. Анализ последних измерений вязкости стекол. —Ⅱ 1 . Дж . Ам . Керам . Сок . 1925 , 8 , 789-794.
ДОИ Google Scholar
[54]
Garca-Coln, LS; дель Кастильо, Л.Ф.; Гольдштейн, П. Теоретическая основа уравнения Фогеля-Фулхера-Таммана. Физ . Ред. . Б 1989 , 40 , 7040-7044.
ДОИ Google Scholar
[55]
Коэн, М. Х.; Тернбулл, Д. Молекулярный транспорт в жидкостях и стеклах. Дж . Химия . Физ . 1959 , 31 , 1164-1169.
ДОИ Google Scholar
[56]
Адам Г.; Гиббс, Дж. Х. О температурной зависимости кооперативных релаксационных свойств в стеклообразующих жидкостях. Дж . Химия . Физ . 1965 , 43 , 139-146.
Дж . Химия . Физ . 1965 , 43 , 139-146.
ДОИ Google Scholar
[57]
Энджелл, Калифорния. Модель свободного объема для транспорта в расплавленных солях: электрическая проводимость в стеклообразующих нитратных расплавах. Дж . Физ . Химия . 1964 , 68 , 1917-1929.
ДОИ Google Scholar
[58]
Энджелл, Калифорния; Брессель, Р. Д. Текучесть и проводимость водных растворов электролитов. Подход из стеклообразного состояния и высококонцентрированный предел. I. Растворы нитрата кальция. Дж . Физ . Химия . 1972 , 76 , 3244-3253.
ДОИ Google Scholar
[59]
Tropea, C.; Ярин, А. Л.; Foss, JF Springer Handbook of Experiment al Fluid Mechanics ; Springer: Берлин, 2007.
DOI. Google Scholar
[60]
Fuoss, RM. Обзор теории электролитической проводимости. Дж . Химический раствор . 1978 , 7 , 771-782.
Обзор теории электролитической проводимости. Дж . Химический раствор . 1978 , 7 , 771-782.
ДОИ Google Scholar
[61]
Чандра А.; Bagchi, B. Ионная проводимость в растворах электролитов. Дж . Химия . Физ . 1999 , 110 , 10024-10034.
ДОИ Google Scholar
[62]
Банерджи П.; Багчи, Б. Движение ионов в воде. Дж . Химия . Физ. . 2019 , 150 , 1.
DOI Google Scholar
[63]
Авни Ю.; Адар, Р. М.; Андельман, Д.; Орланд, Х. Электропроводность концентрированных электролитов. Физ . Ред. . Буква . 2022 , 128 , 098002.
DOI Google Scholar
[64]
Yim, CH; Абу-Лебде Ю. А. Связь между фазовой диаграммой, структурой и переносом ионов в жидких, водных растворах электролитов хлорида лития. Дж . Электрохим . Сок . 2018 , 165 , А547-А556.
Дж . Электрохим . Сок . 2018 , 165 , А547-А556.
ДОИ Google Scholar
[65]
Мияке Т.; Роланди, М. Механизмы Гроттусса: от транспорта протонов в протонных проволоках до биопротонных устройств. Дж . Физ . Конденс . Материя . 2016 , 28 , 023001.
DOI Академия Google
[66]
Он, Х. Ф.; Чжу, Ю.З.; Мо, Ю. Ф. Происхождение диффузии быстрых ионов в суперионных проводниках. Нат . Коммуна . 2017 , 8 , 15893.
DOI Google Scholar
[67]
Pau, PCF; Берг, Дж. О.; Макмиллан, В. Применение закона Стокса к ионам в водном растворе. Дж . Физ . Химия . 1990 , 94 , 2671-2679.
ДОИ Академия Google
[68]
Кестин, Дж. ; Соколов, М.; Wakeham, WA Вязкость жидкой воды в диапазоне от -8 ℃ до 150 ℃. Дж . Физ . Химия . Реф. . Данные 1978 , 7 , 941-948.
; Соколов, М.; Wakeham, WA Вязкость жидкой воды в диапазоне от -8 ℃ до 150 ℃. Дж . Физ . Химия . Реф. . Данные 1978 , 7 , 941-948.
ДОИ Google Scholar
[69]
Петиг Р.; Келл, Д. Б. Пассивные электрические свойства биологических систем: их значение в физиологии, биофизике и биотехнологии. Физ. . Мед . Биол . 1987 , 32 , 933.
ДОИ Google Scholar
[70]
Jiang, L.W.; Лю, LL; Юэ, JM; Чжан, QQ; Чжоу, AX; Бородин, О .; Суо, Л. М.; Ли, Х .; Чен, LQ; Сюй, К. и др. Высоковольтная водная натрий-ионная батарея с водно-солевым электролитом с инертным катионом. Доп . Мать . 2020 , 32 , 1
7.
DOI Академия Google
[71]
Ву, X.Y.; Ци, Ю. Т.; Хонг, Джей Джей; Ли, ZF; Эрнандес, А.С.; Ji, XL. Аммиачно-ионная батарея кресла-качалки: высокообратимая система накопления энергии на водной основе. Анжю . Хим. ., Междунар. . Эд . 2017 , 56 , 13026-13030.
Анжю . Хим. ., Междунар. . Эд . 2017 , 56 , 13026-13030.
ДОИ Google Scholar
[72]
Келли, С.П.; Крамер, CJ; Трухлар, Д. Г. Свободная энергия водной сольватации ионов и кластеров ион-вода на основе точного значения абсолютной свободной энергии водной сольватации протона. Дж . Физ . Химия . Б 2006 , 110 , 16066-16081.
ДОИ Google Scholar
[73]
Ву, X.Y.; Хонг, Джей Джей; Шин, В .; Ма, Л.; Лю, ТК; Би, Х. Х.; Юань, Ю. Ф.; Ци, Ю. Т.; Сурта, Т.В.; Huang, W.X. et al. Бездиффузионная топохимия Grotthuss для высокоскоростных и долговечных протонных батарей. Нат . Энергетика 2019 , 4 , 123-130.
ДОИ Google Scholar
[74]
Маркус Р. А. Химическая и электрохимическая теория переноса электрона. год . Ред. . Физ . Химия . 1964 , 15 , 155-196.
год . Ред. . Физ . Химия . 1964 , 15 , 155-196.
ДОИ Google Scholar
[75]
Таубе Х. Перенос электрона между комплексами металлов: ретроспектива. Наука 1984 , 226 , 1028-1036.
ДОИ Google Scholar
[76]
Барбара, П. Ф.; Мейер, Т.Дж.; Ратнер М.А. Современные проблемы исследования переноса электрона. Дж . Физ . Химия . 1996 , 100 , 13148-13168.
ДОИ Google Scholar
[77]
Хоу, С.; Джи, Х .; Гаскелл, К.; Ван, П.Ф.; Ван, Л.Н.; Сюй, JJ; Солнце, Р. М.; Бородин, О .; Ван, К.С. Реорганизация сольватационной оболочки позволяет использовать двухвалентные металлические батареи с быстрой кинетикой межфазного переноса заряда. Наука 2021 , 374 , 172-178.
ДОИ Google Scholar
[78]
Лян З. Дж.; Конг, Г. Т.; Ван, Ю.; Лу, Ю. К. Медиатор литий-воздушной батареи. В Металло-воздушные батареи : Основы и применение . Чжан, XB; Wiley-VCH Verlag GmbH & Co. KGaA: Weinheim, 2018; стр. 151-205. https://doi.org/10.1002/9783527807666.ch7
Дж.; Конг, Г. Т.; Ван, Ю.; Лу, Ю. К. Медиатор литий-воздушной батареи. В Металло-воздушные батареи : Основы и применение . Чжан, XB; Wiley-VCH Verlag GmbH & Co. KGaA: Weinheim, 2018; стр. 151-205. https://doi.org/10.1002/9783527807666.ch7
DOI Академия Google
[79]
Парк, Дж. Б.; Ли, С.Х.; Юнг, HG; Аурбах, Д.; Sun, Y.K. Медиаторы окислительно-восстановительного потенциала для Li-O 2 аккумуляторов: состояние и перспективы. Доп . Мать . 2018 , 30 , 1704162.
DOI Google Scholar
[80]
Лян З. Дж.; Лу, Ю. К. Критическая роль медиатора окислительно-восстановительного потенциала в подавлении нестабильности зарядки литий-кислородных аккумуляторов. Дж . Ам . Химия . Соц . 2016 , 138 , 7574-7583.
ДОИ Академия Google
Дата
%PDF-1. 5
%
1 0 объект
>
/Метаданные 2 0 R
/Страницы 3 0 Р
/StructTreeRoot 4 0 R
/Тип /Каталог
>>
эндообъект
5 0 объект
/ModDate (D:201310204+02’00’)
/Режиссер
/Название (Дата)
>>
эндообъект
2 0 объект
>
ручей
заявление/pdf
5
%
1 0 объект
>
/Метаданные 2 0 R
/Страницы 3 0 Р
/StructTreeRoot 4 0 R
/Тип /Каталог
>>
эндообъект
5 0 объект
/ModDate (D:201310204+02’00’)
/Режиссер
/Название (Дата)
>>
эндообъект
2 0 объект
>
ручей
заявление/pdf
 577R
IV:}L.xp#)~9Oϛ}?{P>=@?2N
конечный поток
эндообъект
92 0 объект
>
ручей
хЕ
0F💨KzӚZM!»4[A3Éf
dI\єe»$P`,$hhB
>yQ_~_|KM2`Ŭ;ZF7tq0`3X7\ymNZB-3t1
конечный поток
эндообъект
93 0 объект
>
эндообъект
94 0 объект
>
эндообъект
95 0 объект
>
эндообъект
96 0 объект
>
эндообъект
97 0 объект
>
ручей
577R
IV:}L.xp#)~9Oϛ}?{P>=@?2N
конечный поток
эндообъект
92 0 объект
>
ручей
хЕ
0F💨KzӚZM!»4[A3Éf
dI\єe»$P`,$hhB
>yQ_~_|KM2`Ŭ;ZF7tq0`3X7\ymNZB-3t1
конечный поток
эндообъект
93 0 объект
>
эндообъект
94 0 объект
>
эндообъект
95 0 объект
>
эндообъект
96 0 объект
>
эндообъект
97 0 объект
>
ручейCrossMark_default
%PDF-1.7 % 1 0 объект > эндообъект 2 0 объект > эндообъект 5 0 объект > эндообъект 36 0 объект > эндообъект 6 0 объект > эндообъект 7 0 объект > эндообъект 8 0 объект > эндообъект 90 объект > эндообъект 10 0 объект > эндообъект 11 0 объект > эндообъект 12 0 объект > эндообъект 13 0 объект > эндообъект 14 0 объект > эндообъект 15 0 объект > эндообъект 16 0 объект > эндообъект 17 0 объект > эндообъект 18 0 объект > эндообъект 19 0 объект > эндообъект 20 0 объект > эндообъект 21 0 объект > эндообъект 22 0 объект > эндообъект 37 0 объект > эндообъект 23 0 объект > эндообъект 38 0 объект > эндообъект 24 0 объект > эндообъект 39 0 объект > эндообъект 25 0 объект > эндообъект 40 0 объект > эндообъект 26 0 объект > эндообъект 41 0 объект > эндообъект 27 0 объект > эндообъект 42 0 объект > эндообъект 46 0 объект > эндообъект 48 0 объект > ручей приложение/постскриптум
 did:8782A7460403E211A8D2D3A49E85B0A8xmp.iid:8782A7460403E211A8D2D3A49E85B0A8uuid:666BF2511C74E111964B81A43A2628D2proof:pdfxmp.iid:4995B7CDC88AE1119CC5FDD0B5E64ED7xmp.did:4995B7CDC88AE1119CC5FDD0B5E64ED7uuid:666BF2511C74E111964B81A43A2628D2proof:pdf
did:8782A7460403E211A8D2D3A49E85B0A8xmp.iid:8782A7460403E211A8D2D3A49E85B0A8uuid:666BF2511C74E111964B81A43A2628D2proof:pdfxmp.iid:4995B7CDC88AE1119CC5FDD0B5E64ED7xmp.did:4995B7CDC88AE1119CC5FDD0B5E64ED7uuid:666BF2511C74E111964B81A43A2628D2proof:pdf


 12-1.14 г/см3. При значительной
сульфатации электродов батарею сдать
в ремонт.
12-1.14 г/см3. При значительной
сульфатации электродов батарею сдать
в ремонт.

 Сколько убрано жидкости, столько корректирующего раствора нужно добавлять
Сколько убрано жидкости, столько корректирующего раствора нужно добавлять 254 г/см3. Аналогично, если температура составляла 21оC, вычесть значение 1.246 г/см3. Четыре балла (0.004) от 1.250 г/см3.
254 г/см3. Аналогично, если температура составляла 21оC, вычесть значение 1.246 г/см3. Четыре балла (0.004) от 1.250 г/см3. 70, нет. 8, стр. 4421–4425, 1991.
70, нет. 8, стр. 4421–4425, 1991. Х. Хольц и С. А. Ашер, «Полимеризованные коллоидно-кристаллические гидрогелевые пленки как интеллектуальные химические сенсорные материалы», Природа , том. 389, нет. 6653, стр. 829–832, 1997.
Х. Хольц и С. А. Ашер, «Полимеризованные коллоидно-кристаллические гидрогелевые пленки как интеллектуальные химические сенсорные материалы», Природа , том. 389, нет. 6653, стр. 829–832, 1997. Сантос, Л. Войкувка, Дж. Палларес, Дж. Ферре-Борруль и Л. Ф. Марсал, «Наностолбы кобальта и никеля на алюминиевых подложках с помощью процесса электроосаждения на постоянном токе», Nanoscale Research Letters , vol. . 4, нет. 9, стр. 1021–1028, 2009.
Сантос, Л. Войкувка, Дж. Палларес, Дж. Ферре-Борруль и Л. Ф. Марсал, «Наностолбы кобальта и никеля на алюминиевых подложках с помощью процесса электроосаждения на постоянном токе», Nanoscale Research Letters , vol. . 4, нет. 9, стр. 1021–1028, 2009. 81, нет. 11, pp. 63–66, 1983.
81, нет. 11, pp. 63–66, 1983.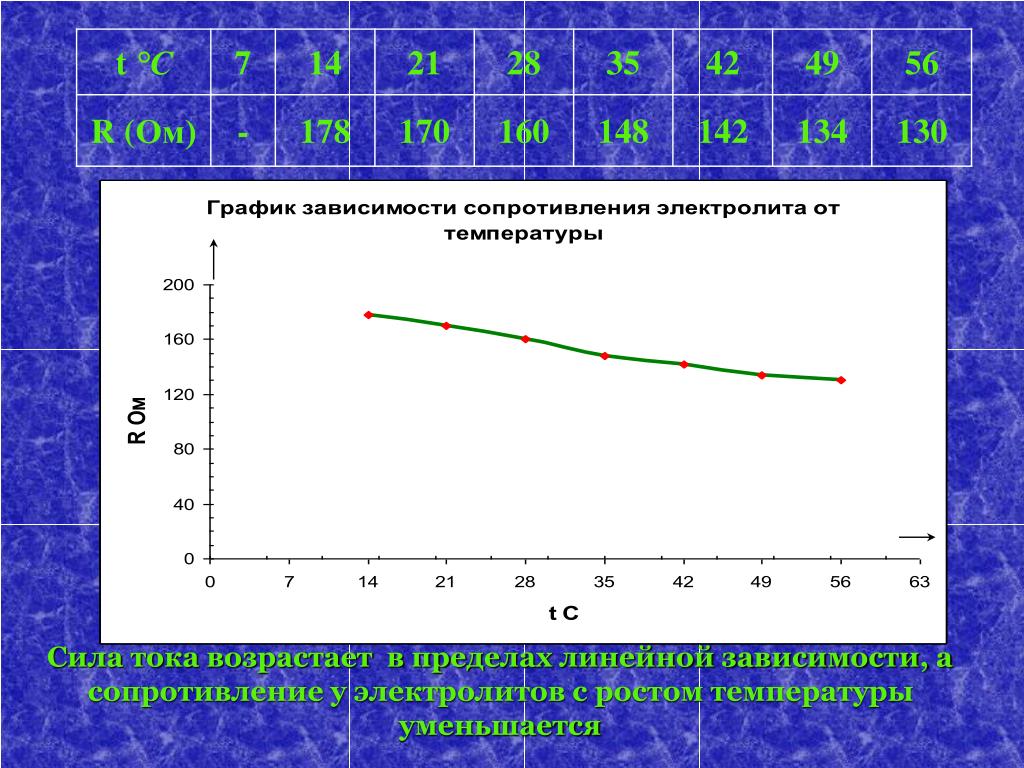 59, pp. 97–103, 1981.
59, pp. 97–103, 1981. 94, нет. 12, стр. 1081–1086, 2000.
94, нет. 12, стр. 1081–1086, 2000. 1016/j.jcis.2005.12.033
1016/j.jcis.2005.12.033 1016/j.jcis.2005.12.033
1016/j.jcis.2005.12.033
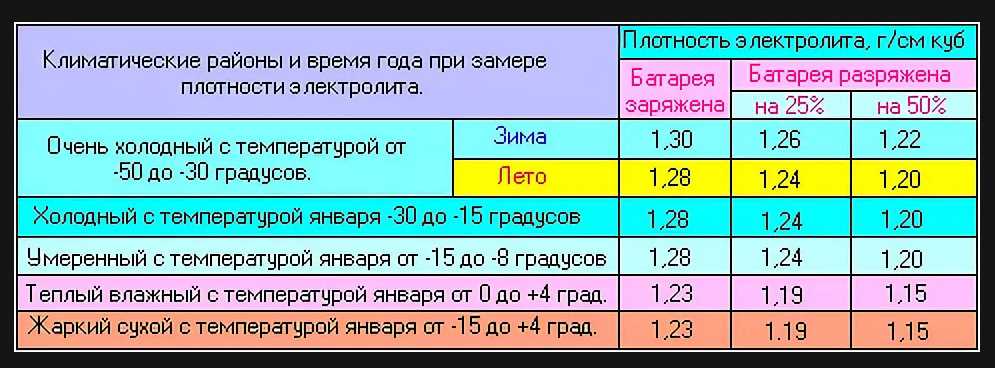 Р., Челлам С.
Шарма Р.Р. и соавт.
J Коллоидный интерфейс Sci. 2008 г., 15 декабря; 328(2):353-66. doi: 10.1016/j.jcis.2008.09.036. Epub 2008, 19 сентября.
J Коллоидный интерфейс Sci. 2008.
PMID: 18930248
Р., Челлам С.
Шарма Р.Р. и соавт.
J Коллоидный интерфейс Sci. 2008 г., 15 декабря; 328(2):353-66. doi: 10.1016/j.jcis.2008.09.036. Epub 2008, 19 сентября.
J Коллоидный интерфейс Sci. 2008.
PMID: 18930248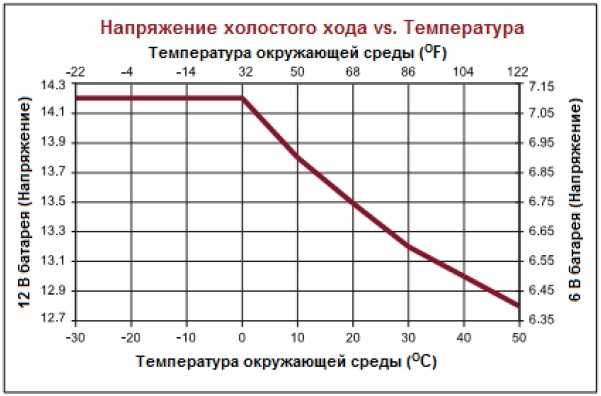 Epub 2016 14 марта.
Annu Rev Chem Biomol Eng. 2016.
PMID: 26979410
Обзор.
Epub 2016 14 марта.
Annu Rev Chem Biomol Eng. 2016.
PMID: 26979410
Обзор. 0705010104. Epub 2007, 10 сентября.
Proc Natl Acad Sci U S A. 2007.
PMID: 17846427
Бесплатная статья ЧВК.
0705010104. Epub 2007, 10 сентября.
Proc Natl Acad Sci U S A. 2007.
PMID: 17846427
Бесплатная статья ЧВК. org/10.1039/D1NJ05489A
org/10.1039/D1NJ05489A